Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Costarricense
On-line version ISSN 0001-6002Print version ISSN 0001-6012
Acta méd. costarric vol.54 n.2 San José Apr./Jun. 2012
Revisión
Nuevas perspectivas sobre la patogénesis del dengue
New Perspectives on Dengue Pathogenesis
Eugenia Corrales-Aguilar y Laya Hun-Opfer
*Dirección de correspondencia:
Resumen
El dengue es una enfermedad viral de gran importancia en la salud pública. Sin embargo, los mecanismos de patogénesis por el virus del dengue (DENV) no están bien definidos, ya que no existen modelos animales apropiados para estudiar el curso de la enfermedad. Únicamente se cuenta con datos de pacientes, los cuales son muy diversos y no permiten aún entender bien los fenómenos patológicos que ocurren en el transcurso de la infección. No obstante, varios factores parecen estar relacionados con la patogénesis de DENV: i) factores virales, tales como la virulencia y la transmisibilidad del virus, y ii) factores del hospedero, tales como la respuesta inmune, la naturaleza de su estado inmunológico y sus características genéticas.
En la presente revisión se exponen los factores que desempeñan un papel fundamental en la patogénesis del dengue, para así comprender mejor el curso de la enfermedad y permitir un más adecuado abordaje terapéutico de los pacientes. En vista de que la clasificación utilizada para definir los factores de riesgo durante una infección por dengue, ya no es congruente con estudios clínicos realizados, se plantea la nueva clasificación de la enfermedad dictada por la Organización Mundial de la Salud (OMS).
Descriptores: dengue, virus, patogénesis, dengue grave
Abstract
Dengue viral infections represent a major concern for public health. Yet, the mechanisms of dengue virus (DENV) pathogenesis are not understood very well yet, since there are no suitable animal models for studying the course of disease. The only source of knowledge is limited to clinical studies involving patients, which vary a lot and do not allow for the accurate understanding of the pathological events that occur during viral infection. Nevertheless, several factors seem to be related to DENV pathogenesis: i) viral factors, such as virulence and virus transmissibility and ii) host determinants like the immune response, immune status and genetic characteristics.
In this review we describe the factors that play an important role in dengue pathogenesis in order to have a better understanding of the disease and to allow for a more suitable therapeutic management of patients. Since the current disease classification used for determining risk factors during the course of a dengue infection is no longer congruent with the clinical studies performed, the use of the new dengue disease classification dictated by the World Health Organization (WHO) is suggested.
Keywords: dengue, virus, pathogenesis, severe dengue
El virus dengue (DENV) tiene una distribución mundial en trópicos y subtrópicos.1 Es endémico en muchos centros urbanos y su presencia aumenta por la urbanización de zonas rurales, lo que crea las condiciones ideales para la replicación del principal mosquito transmisor, el Aedes aegypti.2 Mundialmente, más de 50 millones de personas se infectan cada año y 2500 millones están en riesgo de infectarse.3 El DENV pertenece a la familia Flaviviridae y existen cuatro serotipos definidos (DENV-1, DENV-2, DENV-3 y DENV-4). La mayoría de las infecciones son subclínicas. La forma clínica más frecuente es el dengue clásico o fiebre del dengue, que es autolimitado. Las formas más graves se relacionan frecuentemente a una respuesta inmunopatológica heteróloga, o a otros factores del hospedero o virales.
Los mecanismos de patogénesis por DENV no están bien definidos, ya que no existen modelos animales apropiados para estudiar el curso de la enfermedad. Únicamente se tienen datos de pacientes, los cuales son muy diversos y no permiten entender bien los fenómenos patológicos que ocurren en el transcurso de la infección. No obstante, varios factores4 se relacionan con la patogénesis de DENV: 1) factores virales, tales como la virulencia y la transmisibilidad del virus, y 2) factores del hospedero, tales como la respuesta inmune, su condición inmunológica y sus características genéticas.
A mediados de los años 70, la Organización Mundial de la Salud propuso una clasificación de la gravedad de dengue con el fin de ayudar al diagnóstico, al abordaje de los pacientes y al monitoreo de la enfermedad.5 Se definieron entonces los conceptos:
1) Fiebre del dengue (FD) o dengue clásico: enfermedad benigna con fase aguda de 3-7 días con síntomas inespecíficos, como fiebre alta, cefalea, mialgias, artralgias, exantema máculo-papular y, en algunos casos, hemorragia moderada;
2) Dengue hemorrágico (FHD/SCD): enfermedad grave, con aumento en la permeabilidad vascular y hemoconcentración, con un aumento de hasta el 20% del valor normal del hematocrito y un recuento menor a 100 mil plaquetas/mm3. Fue clasificada en cuatro grados de gravedad: 1 y 2, sin síntomas de fallo circulatorio, y 3 y 4, caracterizados por fallo circulatorio y choque hipovolémico o síndrome de choque por dengue (SCD). El SCD puede ser fatal en un 5-15% de los casos.5 Esta definición ha sido ampliamente cuestionada, ya que en la mayoría de los países donde hay casos de dengue y dengue hemorrágico, los síntomas clínicos y hallazgos de laboratorio no concuerdan con los definidos por la OMS y además, los pacientes presentan variabilidad ante las infecciones por los diferentes serotipos.6
En la presente revisión se exponen los factores que podrían desempeñar un papel fundamental en la patogénesis del dengue. Además, se presenta enfáticamente la nueva clasificación clínica de la enfermedad de dengue dictada por la OMS. Esta ayudará a los profesionales en las áreas de la salud, a comprender mejor el curso de la enfermedad, lo que permitirá también un abordaje terapéutico adecuado de los pacientes, y menos muertes por las formas graves de la enfermedad.
Hipótesis actuales sobre la patogénesis del dengue
Inmunopotenciación mediada por anticuerpos (ADE)
Ensayos in vitro y estudios epidemiológicos relacionan una infección secundaria por un serotipo de DENV heterólogo (aquel distinto al de la primera infección) con enfermedad grave.7-11 En estudios realizados en Tailandia se observó que la incidencia de FHD/SSD se presenta mayormente en dos grupos de niños:8,12 el primero constituido por neonatos entre 6-9 meses de edad, infectados con un serotipo diferente al que había infectado a sus madres, y en quienes los anticuerpos maternos ya habían descendido a niveles subneutralizantes; y otro grupo compuesto por niños que habían estado previamente infectados con un serotipo de DENV y luego con uno diferente. Estas observaciones posibilitaron concluir que una infección subsecuente en personas preinmunizadas con un serotipo heterólogo, podría, por medio de los anticuerpos preexistentes, exacerbar, en lugar de mitigar la enfermedad. A este fenómeno se le denomina inmunopotenciación mediada por anticuerpos (ADE, antibody dependent enhancement, por sus siglas en inglés),8 basada en que en una infección primaria se generan anticuerpos neutralizantes contra el serotipo infectante, pero también, anticuerpos no neutralizantes que reaccionan contra serotipos heterólogos. Estos últimos anticuerpos maximizan una subsecuente infección con un serotipo heterólogo, al potenciar la entrada del virus mediante receptores Fc-γ en monocitos y macrófagos, logrando no solo un mayor número de células infectadas, sino un aumento en la replicación del virus en su célula blanco y, como consecuencia, un aumento en la producción de mediadores que incrementan la permeabilidad vascular.11,13-18
Otra hipótesis alterna o complementaria plantea que la entrada viral a la célula blanco por medio de los receptores Fc-γ inhibe la respuesta inmune antiviral mediante la producción de IL-6 e IL-10, y la inhibición transcripcional de la producción de IL-12, TNF-α e IFN-γ, y como consecuencia, se crea un ambiente ideal que fomenta la replicación viral.19,20 A pesar de los estudios clínicos relacionados con el fenómeno de ADE, la evidencia aún es circunstancial. Pruebas contrarias se han observado en otros brotes de dengue. En 1972 se produjo una epidemia por DENV-2 en una isla remota del Pacífico Sur, donde no existía evidencia de infección previa.21 Algunos infectados se ajustaron a la definición de FHD y se observaron 12 casos fatales; indudablemente, se trataba de una infección primaria en ausencia de anticuerpos preexistentes contra el virus, que inmunopotenciaran la infección. Observaciones semejantes se efectuaron durante una epidemia en Fiji en 1975, en donde se encontró que no había diferencias significativas en la incidencia de hemorragia y otros síntomas en infecciones primarias, versus infecciones secundarias.22 A raíz de estos datos, Rosen cuestiona la justificación de separar el dengue en dos entidades clínicas (benigna y grave), así como la validez de las definiciones de la OMS para FHD.23
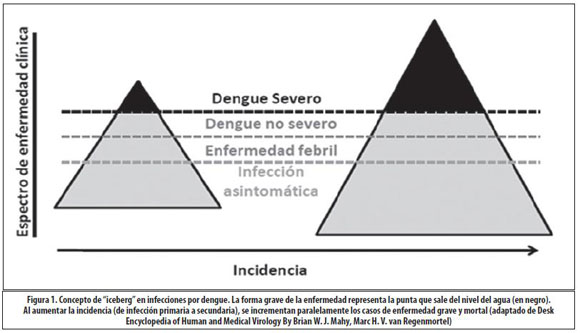
Se propone entonces que, al igual que en la mayoría de las infecciones, el DENV se comporta epidemiológicamente bajo el "concepto del iceberg",6 el cual plantea que puede presentarse desde una infección asintomática o enfermedad leve, en la mayoría de los casos, siendo esto la base del iceberg, hasta una enfermedad grave y en algunas ocasiones fatal, en un porcentaje mucho menor, siendo esto la punta del iceberg (Figura 1). De igual forma, se postula que la hemorragia y el síndrome de choque no necesariamente están ligados al mismo mecanismo patogénico.22 Otro estudio que rebate al fenómeno de ADE fue el realizado en Tahití,24 donde se examinaron los factores de riesgo para FHD, después de dos epidemias consecutivas por DENV-3 en 1989 y DENV-2 en 1996. El estudio se basó en el comportamiento de 401 niños hospitalizados por dengue, con edades variables. Diez de estos casos fueron fatales. Al utilizar la clasificación de la OMS y otros criterios clínicos y biológicos, se seleccionaron los 50 casos más graves. Diecisiete (34%) no cumplieron con los requisitos para FHD, porque no se detectó aumento en la permeabilidad vascular. De estos pacientes, 6 fallecieron por trastornos hepáticos (transaminasas elevadas más de 20 veces), trombocitopenia severa (menos de 20000 células/mm3), hemorragia severa y choque. El estudio demostró que muchos casos de infección con DENV no cumplen con la definición de la OMS para FHD, y que un porcentaje significativo de casos de FHD son causados por infecciones primarias.
Respuesta aberrante de linfocitos T
La reactivación de células T de memoria que reaccionan con serotipos heterólogos, pueden proveer inmunidad parcial. Sin embargo, también pueden ser la causa de inmunopatología.28 El hallazgo patológico de daño tisular, como resultado de citólisis o inflamación, inducido por un número elevado de células T efectoras, es posible en infecciones por DENV.29,30 Durante la fase aguda de una infección secundaria por un serotipo heterólogo, se activan preferiblemente clones CD8+ hiperreactivos, los cuales pueden producir una elevada concentración de citoquinas pro y anti-inflamatorias, como IFN-γ, TNF-α e IL-13 y niveles bajos de IL-10.31,32 Se mantiene una activación prolongada de células T CD8+ con una producción alta en los niveles de TNF-α, IL-6 y otros factores solubles que afectan la permeabilidad vascular (ver más adelante en tropismo y células endoteliales). Estas células T reaccionan de manera diferente contra serotipos heterólogos y contra los epítopos homólogos.33 Además, pierden su capacidad citolítica, lo que podría explicar el retraso en la eliminación del virus durante una infección secundaria. Pero, es posible que durante una infección heteróloga por DENV, solo se active una pequeña subpoblación de células T que serocruzan, y esto al combinarse con el hecho de que cada ser humano tiene un repertorio de receptores de células T específico, podría explicar la gran variabilidad en la presentación de la enfermedad posterior a una infección secundaria.4
Poco se sabe de la respuesta de las células T CD4+ durante una infección con DENV, y de las implicaciones de las coinfecciones con HIV. Se ha reportado que durante una infección aguda por dengue, la carga viral de HIV en un paciente infectado se ve disminuida.34 Esto obedece a que la expresión de NS5, una de las proteínas no estructurales del virus dengue, reduce la expresión de CD4 en la superficie de células T y, por ende, inhibe la infección y la replicación del HIV.35,36 La disminución de CD4 de la superficie de células T podría además afectar la función ayudadora o helper de estas células y, potencialmente, retrasar o evitar el desarrollo de una respuesta adaptativa efectiva. De igual forma, se podría atenuar la patogénesis causada por el HIV, disminuyendo la señal necesaria para la activación del receptor de células T e inhibiendo la proliferación celular.36 Además, durante una infección secuencial con diferentes serotipos de DENV, existe evidencia de alteración en la respuesta de citoquinas producidas por células CD4+ que serocruzan, lo que puede inducir altos niveles de citoquinas proinflamatorias,37 las cuales, conjuntamente con la respuesta de citoquinas de las células CD8+, pueden causar efectos adversos en la respuesta inmune.
Tropismo de DENV
Las células blanco y el tropismo de los DENV desempeñan un papel importante en el desenlace de la infección por dengue. No hay datos concluyentes sobre cuáles son los órganos blanco in vivo. Sin embargo, los datos in vitro y algunas autopsias sugieren que tres sistemas tienen un rol fundamental en la patogénesis de FHD/SSD:
a) Sistema inmune: la infección por DENV ocurre por la picadura de un mosquito a través de la epidermis y dermis. De esta manera, las células infectadas son las células inmaduras de Langerhans (células dendríticas epidermales) y los queratinocitos.38,39 Las células infectadas migran del sitio de la infección hacia los nódulos linfáticos, donde se reclutan los macrófagos y monocitos que se convierten en el blanco de la infección. El virus se disemina a través del sistema linfático. Como resultado de esta primera viremia, se obtiene una población de células de linaje mononuclear como monocitos, células dendríticas (CD) mieloides y macrófagos de hígado y bazo infectados.40-44 Además, durante las infecciones secundarias con DENV heterólogos, se observa una alta concentración de complejos del nuevo virus con inmunoglobulina G (IgG). Estos inmunocomplejos son fagocitados por células mononucleares. La mayoría de estas células muere por apoptosis,45,46 mientras que las CD cercanas son estimuladas y producen la mayoría de los mediadores relacionados con los procesos de respuesta inflamatoria44,45,47-49 y hemostática50-52 del hospedero. La cantidad de células infectadas y, por consiguiente, el nivel de viremia, podrían ser los determinantes en la relación de citoquinas proinflamatorias y antiinflamatorias, así como del nivel de quimoquinas y otros mediadores.41
b) Hígado: se han reportado casos de hepatitis con presentación de necrosis, esteatosis y cuerpos de Councilman (probablemente células apoptóticas) asociados al DENV.53,54 Además, la tendencia a la gravedad por DENV se ha vinculado con la elevación de enzimas hepáticas.55,56 Aunque el DENV ha sido detectado en una población significativa de hepatocitos y células Kupffer, no se evidencia inflamación en el hígado. Esto sugiere que la apoptosis y la necrosis observadas son directamente causadas por el virus y no por mediadores inflamatorios. La prevalencia de apoptosis es mucho mayor que la necrosis y esto podría explicar la poca inflamación observada en la zona. Sin embargo, el papel del daño hepático con respecto a las coagulopatías y a la gravedad de la enfermedad, debe ser aún bien establecido.
c) Células endoteliales (CE) que revisten los vasos capilares: la integridad del epitelio celular está regulada por muchos factores que además desempeñan un papel importante en la respuesta de la coagulación en casos de inflamación severa. El tropismo del DENV hacia las CE in vivo sigue siendo muy controversial. Algunos estudios preliminares de biopsias de piel indican que la microvasculatura localizada en la dermis es el sitio más afectado, aunque no se ha detectado antígeno de DENV en las CE que rodean la microvasculatura.57,58 Por el contrario, hay evidencia de antígeno de DENV en la vasculatura endotelial pulmonar,43 a pesar de que esto no necesariamente indique que hay replicación activa del virus. Al contrario de las células mononucleares, las CE no tienen receptores Fc-γ por lo que no se internalizaría complejos inmunes. Así, la presencia del virus en estas células solo se podría explicar por pinocitosis.43 In vitro se ha demostrado la replicación de los 4 serotipos DENV en CE, y la consecuencia de esta infección suele producir daño funcional más que morfológico.59,60 No hay evidencia de que la susceptibilidad al virus varíe entre los sistemas vasculares, pero se plantea que la respuesta de coagulación en una inflamación severa de CE en diferentes sitios del organismo, no es igual.61 Similarmente, el patrón de infección de DENV en las células de la microvasculatura es distinto, lo que sugiere que diferentes tejidos tienen varios patrones de activación.62 Está demostrado que el aumento de permeabilidad de la microvasculatura periférica ocurre tanto en pacientes con FHD como en SSD.63 Por lo tanto, las CE de sitios pulmonares y abdominales podrían reaccionar de una manera específica ante la infección por DENV,64 lo que explicaría el síndrome de derrame vascular característico de FHD/SSD. Estudios sugieren que el daño o disfunción vascular es fundamental en la patogénesis de estas formas graves de la infección con DENV.65-68 Se presenta apoptosis selectiva de las células endoteliales de la microvasculatura en tejidos pulmonares y abdominales, especialmente en casos fatales,69 lo que explicaría el intenso derrame vascular observado en pleura y cavidades peritoneales. También es interesante destacar que la proteína no estructural 1 (NS1) del DENV se une de manera preferencial a CE de pulmón e hígado.70 La unión del NS1 con su anticuerpo específico podría contribuir al derrame selectivo en pulmón.
La falta de un modelo animal que mimetice por completo la enfermedad grave del dengue, ha propiciado que la fisiopatología haya sido principalmente inferida por estudios in vitro, utilizando en su mayoría líneas celulares endoteliales, como las HUVEC.71 Estas células pueden ser infectadas por el virus dengue, pero su función de barrera transendotelial en cultivo, se encuentra comprometida, lo que las hace un modelo poco apropiado para estudiar la permeabilidad vascular inducida por el virus. Las células HMEC-1, derivadas de la microvasculatura dérmica humana, han sido usadas para este fin, ya que mantienen en cultivo sus características endoteliales y su función de barrera, por la estabilidad de los complejos proteicos que constituyen sus uniones estrechas ("tight junctions").72 En su infección por el virus dengue, se observó una pérdida de continuidad en la localización de la proteína de uniones estrechas llamada occludina, lo que coincide con el aumento de la permeabilidad a diversas moléculas de tamaños variables. Asimismo, un modulador significativo de la permeabilidad endotelial esla interacción del citoesqueleto de actina y los componentes de las uniones estrechas.73 En la infección por dengue, se observa una desorganización y fragmentación de las fibras de actina, lo que acrecentaría también la permeabilidad endotelial. Por otro lado, las citoquinas modulan la organización del citoesqueleto y de las proteínas que forman las uniones intercelulares. El dengue produce secreción de IL-8 en HMEC-1, la cual agonísticamente unida a otros factores, causa una reorganización del citoesqueleto. En resumen, el efecto directo del virus dengue sobre las uniones estrechas y el citoesqueleto, junto con la liberación de IL-8, inducen suficientes modificaciones estructurales que podrían ser importantes en la alteración de la permeabilidad endotelial72 y responsables de la extravasación plasmática.
Virulencia
Durante los años 70, Rosen y Gubler realizaron estudios epidemiológicos y entomológicos en el Pacífico Sur asiático, y describieron por primera vez diferencias en la virulencia del dengue.74,75 Ellos notaron que algunos brotes en esa región tenían menos casos o no tenían casos de FHD, por lo que los virus transmitidos fueron considerados de baja virulencia. Otros brotes observados tuvieron muchos casos de FHD después de una infección primaria, por lo que estos virus fueron considerados de alta virulencia. El desarrollo de los métodos de secuenciación de ADN copia de los ARNs virales y la generación de árboles filogenéticos, demostró que algunos grupos de variantes o genotipos se relacionan más frecuentemente con enfermedad más grave.76-80
Análisis de poblaciones de genotipos o poblaciones individuales no han logrado confirmar que aislamientos virales tomados de pacientes con formas severas de la enfermedad, sean diferentes a los tomados de pacientes con fiebre del dengue.88,89 Sin embargo, el genotipo IV de DENV-3 se ha asociado con formas moderadas de la enfermedad;90 ciertas cepas asociadas a formas graves han demostrado mayor infectividad en monocitos91 y, además, ciertas cepas de DENV-2 difieren en su capacidad de infectar diferentes tipos de células humanas.92
También se propuso que durante la epidemia de 1981 en Cuba, el virus circulante fue evolucionando a genotipos más virulentos responsables de enfermedad más grave al transmitirse entre los hospederos, y que por esta razón, la tasa de mortalidad fue aumentando al final de la epidemia.83 Una situación similar ocurrió en 1992 durante una epidemia por DENV en Australia,93 y de nuevo en Cuba, en 1997.14,0 Análisis de genomas de los genotipos de DENV han demostrado que estos podrían evolucionar durante una epidemia,95,96 pero se requiere más estudios para comprobar que en efecto algunos evolucionan a las formas más virulentas.
La secuencia de infección con los diferentes serotipos también se ha propuesto como un factor importante en la gravedad de la enfermedad por el virus dengue. Epidemias con una alta incidencia de FHD se han relacionado con una infección primaria por DENV-1, seguida de una infección por DENV-2 o DENV-3.97,98 Tales estudios también demostraron que a intervalos mayores entre la infección primaria y la secundaria, mayor riesgo de desarrollar enfermedad grave.
La edad también se ha postulado como un factor de riesgo en una infección secundaria con DENV heterólogos.15 Pero, se ha demostrado que el DENV en zonas geográficas distintas varía en su habilidad de infectar distintos tipos de células in vitro, o de causar enfermedad grave en humanos.18,92 A pesar de eso, la observación que FHD/SSD se presenta en un relativo bajo porcentaje en infecciones secundarias, y menos aún en infecciones primarias; aunque la infección sea con cepas virulentas, sugiere que los factores del hospedero son determinantes y cruciales en el desarrollo de enfermedad grave.
Activación del sistema de complemento
Uno de los componentes fundamentales de la respuesta inmune innata humoral es el sistema de complemento, el cual interactúa con el sistema homeostático para proveer una primera línea de defensa contra la infección de patógenos. En la infección con el DENV se ha reportado que durante el periodo de defervescencia (descenso de la fiebre), cuando aumenta la permeabilidad vascular, se detectan niveles elevados en plasma de los productos de la activación del complemento el C3a y el C5a, seguidos de una marcada hipocomplementemia en pacientes con FD y SSD.99,100 Por lo tanto, se postula que la activación del complemento tiene un papel fundamental en la patogénesis del dengue. Además, estudios de expresión génica en células mononucleares de sangre periférica, de pacientes con FD y FHD/SDD, también sugieren su relación con la gravedad de la enfermedad.101 Durante la replicación del ARN del DENV, se libera una de las proteínas no estructurales codificada por el virus: la NS1. Se postula que esta proteína no solo activa directamente el sistema de complemento,102 sino que también los complejos inmunes que se forman entre la proteína NS1 y los anticuerpos no homotípicos, cumplen la función de activar la vía clásica del complemento.103 La activación del complemento produce el complejo C5b-C9, que dispara reacciones celulares y estimula la producción de citoquinas proinflamatorias asociadas al desarrollo de FHD/SSD. Este complejo de ataque de membrana del complemento puede a su vez activar otros mecanismos locales y sistémicos implicados con la coagulación intravascular diseminada (CID).104
Autoinmunidad temporal
Se ha demostrado que durante una infección con el DENV se producen anticuerpos que pueden serocruzar con algunos antígenos propios del hospedero. Sin embargo, no está claro si este fenómeno ocurre solo durante una infección secundaria o también durante una primoinfección. Algunos anticuerpos que reconocen un epítope lineal en la proteína E viral de la envoltura, se pueden unir también al plasminógeno humano e inhibir la actividad de la plasmina.105-107 Anticuerpos anti-NS1 que serocruzan con CE pueden disparar la producción de oxido nítrico (NO) y, por ende, inducir apoptosis.108 Aunque se ha demostrado que el NO inhibe la replicación del DENV,109 su excesiva producción causa daño celular. Los anticuerpos anti- NS1 también pueden estimular la expresión de IL-6, IL-8 y la molécula intracelular de adhesión 1 (ICAM-1).110 Más estudios son necesarios para comprobar si la reacción cruzada entre anti- NS1 con células endoteliales, conlleva en efecto un aumento en la permeabilidad vascular, característico del SSD. Igual, se ha reportado que los anti-NS1 pueden serocruzar con plaquetas y causar una trombocitopenia temporal y hemorragia,111 lo que demuestra que estos anticuerpos antiplaquetarios son patogénicos.
Factores genéticos del hospedero
Modulación de la respuesta del interferón
El virus dengue es detectado por las células mediante los receptores Toll-like (TLR) y los receptores intracelulares, produciendo una respuesta mediada por INF-α e INF-γ.44,121 El IFN actúa sobre células infectadas y no infectadas estimulando la cascada de señalización JAK/STAT, lo que provoca la activación de genes específicos que llegan a establecer un estado antiviral.
Algunas proteínas no estructurales virales tienen capacidad de modular la respuesta del interferón122 contra el virus dengue. La importancia de este proceso radica en que tal modulación de la respuesta se traduce en niveles elevados de viremia o propagación exacerbada del virus, a pesar de que exista una respuesta inmune temprana apropiada.
Nuevos criterios para la clasificación de enfermedad por dengue
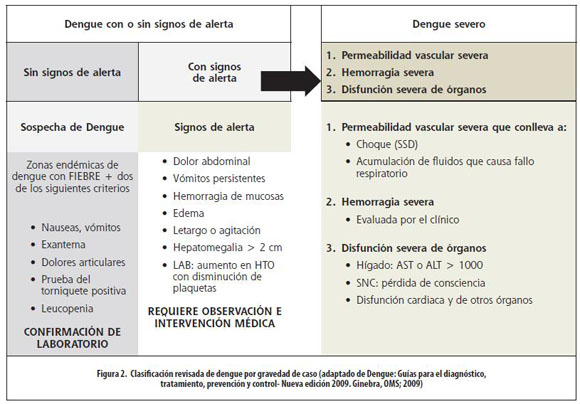
Independientemente de la clasificación de la enfermedad provocada por el virus dengue, el dengue grave se asocia a ciertas manifestaciones que incluyen hemorragia o trombocitopenia,123-126 alteraciones hepáticas,127,128 manifestaciones del SNC128,129 y síndrome de shock.123,124,126 Además, aunque el choque hipovolémico asociado a una aumento en la permeabilidad vascular es una manifestación obvia de enfermedad grave, este fenómeno puede ocurrir en ausencia de trombocitopenia o hemorragia.123,126 Muchos estudios indican que es muy difícil determinar clínicamente la fuga de plasma durante la fase aguda de la enfermedad, cuando los síntomas clínicos de efusión están ausentes y el valor del hematocrito se presenta en el rango normal.125 Como consecuencia y utilizando la clasificación previa de la OMS, los clínicos tienden a clasificar todos los casos graves como FHD. Esto conlleva a estimados confusos de la incidencia e incluso a conceptos erróneos sobre la patogénesis de la enfermedad. Por estas razones, se plantea que las definiciones previas de la OMS para FD y FHD son inadecuadas y desorientadoras.130,131 Se sugiere que un abordaje alternativo para la clasificación de casos podría ser "grave" vs "no grave", y que los casos graves deberían abarcar todo el rango de manifestaciones comprendiendo choque con o sin evidencia de efusión plasmática, manifestaciones de daño hepático, del SNC, hemorragia y trombocitopenia. Así, la definición de choque debido a pérdida de plasma sería simple y práctica para el diagnóstico y manejo del paciente, independiente de trombocitopenia y sangrado, y muy adecuado en países donde el dengue es endémico o epidémico.
Se han realizado nuevos estudios clínicos prospectivos multicéntricos, por parte de la OMS, con fines de redefinir las categorías de la enfermedad para estandarizar pautas clínicas por seguir.3,132
Por lo tanto, esta enfermedad se está clasificando con niveles de gravedad: dengue con o sin presencia de señales de alarma y dengue grave (Figura 2), con base en datos clínicos y de laboratorio. Se debe tener presente que incluso pacientes con dengue sin señales de alarma, pueden desarrollar cuadros graves. Esta clasificación en niveles de gravedad tiene un alto potencial para ayudar a los clínicos a tomar decisiones en cuanto a dónde y cuán intensamente debe ser observado y puesto en tratamiento un paciente, y ha demostrado ser más efectiva que la clasificación de DF/DHF/DSS para un rápido reconocimiento de enfermedad grave.132 Sin embargo, se requiere entrenamiento, diseminación de la información y más investigación en las manifestaciones de señales de alarma y en la definición de los casos clínicos en ausencia de resultados de laboratorio.
Implicaciones para la prevención y el control
Aunque se ha intentado controlar y prevenir el dengue con medidas de vigilancia de vectores, mejor manejo médico, mejor educación y mejor información, la principal forma de prevención sería una vacuna. Sin embargo, una vacuna segura y efectiva contra esta enfermedad, se vuelve difícil debido al papel importante que tiene la inmuno patógénesis. Un requisito indispensable de la vacuna sería inducir una protección prolongada contra los cuatro serotipos de dengue, ya que la inmunidad incompleta podría influir en el desarrollo de enfermedades graves en personas vacunadas. Otro punto preocupante es la falta de determinantes protectores claros contra la enfermedad y la ausencia de un modelo experimental robusto que mimetice la patogénesis observada en seres humanos. No obstante, una más adecuada definición de las causas de la patogenicidad del dengue asistiría en la formulación de candidatos efectivos para la vacuna y en el desarrollo de agentes antivirales.
Nota: las autoras del presente artículo no presentan conflictos de interés.
Referencias
1. Guzman MG, Kouri G. Dengue: an update. Lancet Infect Dis 2002; 2:33-42. [ Links ]
2. Gubler DJ, Rosen L. A simple technique for demonstrating transmission of dengue virus by mosquitoes without the use of vertebrate hosts. Am J Trop Med Hyg 1976;25:146-50. [ Links ]
3. Organización Mundial de la Salud (OMS), Programa Especial para Investigación y Capacitación en Enfermedades Tropicales (TDR). Dengue: guías para el diagnóstico, tratamiento, prevención y control- Nueva Edición 2009, vol. 1, 2009 ed. Geneva, Switzerland: WHO Library Cataloguing-in-Publication Data; 2009. [ Links ]
4. Martina BE, Koraka P, Osterhaus AD. Dengue virus pathogenesis: an integrated view. Clin Microbiol Rev 2009;22:564-81. [ Links ]
5. World Health Organization (WHO). Technical guidelines for diagnosis, treatment and control, vol. 1, 1997 ed. Geneva, Switzerland: WHO Library Cataloguing-in-Publication Data; 1997. [ Links ]
6. Murgue B. Severe dengue: questioning the paradigm. Microbes Infect. 2010;12:113-18. [ Links ]
7. Graham RR, Juffrie M, Tan R, Hayes CG, Laksono I, Ma'roef C et al. A prospective seroepidemiologic study on dengue in children four to nine years of age in Yogyakarta, Indonesia I. studies in 1995-1996. Am J Trop Med Hyg 1999;61:412-19. [ Links ]
8. Halstead SB. Observations related to pathogensis of dengue hemorrhagic fever. VI. Hypotheses and discussion. Yale J Biol Med 1970;42:350-62. [ Links ]
9. Kliks SC, Nimmanitya S, Nisalak A, Burke DS. Evidence that maternal dengue antibodies are important in the development of dengue hemorrhagic fever in infants. Am J Trop Med Hyg 1988;38:411-19. [ Links ]
10. Sakuntabhai A, Turbpaiboon C, Casademont I, Chuansumrit A, Lowhnoo T, Kajaste-Rudnitski A et al. A variant in the CD209 promoter is associated with severity of dengue disease. Nat Genet 2005;37:507-13. [ Links ]
11. Thomas L, Verlaeten O, Cabie A, Kaidomar S, Moravie V, Martial J et al.Influence of the dengue serotype, previous dengue infection, and plasma viral load on clinical presentation and outcome during a dengue-2 and dengue-4 co-epidemic. Am J Trop Med Hyg 2008;78:990-98. [ Links ]
12. Halstead SB, Nimmannitya S, Cohen SN. Observations related to pathogenesis of dengue hemorrhagic fever. IV. Relation of disease severity to antibody response and virus recovered. Yale J Biol Med 1970;42:311-28. [ Links ]
13. Burke DS, Kliks S. Antibody-dependent enhancement in dengue virus infections. J Infect Dis 2006;193:601-03. [ Links ]
14. Guzman MG, Kouri G, Valdes L, Bravo J, Alvarez M, Vazques S et al. Epidemiologic studies on Dengue in Santiago de Cuba, 1997. Am J Epidemiol 2000;152:793-99. [ Links ]
15. Guzman MG, Kouri G, Bravo J, Valdes L, Vazquez S, Halstead SB. Effect of age on outcome of secondary dengue 2 infections. Int J Infect Dis 2002;6:118-24. [ Links ]
16. Guzman MG, Kouri G. Dengue haemorrhagic fever integral hypothesis: confirming observations, 1987-2007. Trans R Soc Trop Med Hyg 2008;102:522-23. [ Links ]
17. Libraty DH, Endy TP, Houng HS, Green S, Kalayanarooj S, Suntayakorn S et al. Differing influences of virus burden and immune activation on disease severity in secondary dengue-3 virus infections. J Infect Dis 2002;185:1213-21. [ Links ]
18. Vaughn DW, Green S, Kalayanarooj S, Innis BL, Nimmannitya S, Suntayakorn S et al. Dengue viremia titer, antibody response pattern, and virus serotype correlate with disease severity. J Infect Dis 2000;181:2-9. [ Links ]
19. Lidbury BA, Mahalingam S. Specific ablation of antiviral gene expression in macrophages by antibody-dependent enhancement of Ross River virus infection. J Virol 2000;74:8376-81. [ Links ]
20. Mahalingam S, Lidbury BA. Suppression of lipopolysaccharide- induced antiviral transcription factor (STAT-1 and NF-kappa B) complexes by antibody-dependent enhancement of macrophage infection by Ross River virus. Proc Natl Acad Sci U.S.A 2002;99:13819-24. [ Links ]
21. Barnes WJ, Rosen L. Fatal hemorrhagic disease and shock associated with primary dengue infection on a Pacific island. Am J Trop Med Hyg 1974;23:495-506. [ Links ]
22. Kuberski T, Rosen L, Reed D, Mataika J. Clinical and laboratory observations on patients with primary and secondary dengue type 1 infections with hemorrhagic manifestations in Fiji. Am J Trop Med Hyg 1977;26:775-83. [ Links ]
23. Rosen L. Dengue in Greece in 1927 and 1928 and the pathogenesis of dengue hemorrhagic fever: new data and a different conclusion. Am J Trop Med Hyg 1986;35:642-53. [ Links ]
24. Murgue B, Roche C, Chungue E, Deparis X. Prospective study of the duration and magnitude of viraemia in children hospitalised during the 1996-1997 dengue-2 outbreak in French Polynesia. J Med Virol 2000;60:432-38. [ Links ]
25. Pierson TC, Diamond MS. Molecular mechanisms of antibody- mediated neutralisation of flavivirus infection. Expert Rev Mol Med 2008;10:e12. [ Links ]
26. Schmidt AC. Response to dengue fever--the good, the bad, and the ugly? N Engl J Med 2010;363:484-87. [ Links ]
27. Dejnirattisai W, Jumnainsong A, Onsirisakul N, Fitton P, Vasanawathana S, Limpitikul W et al. Cross-reacting antibodies enhance dengue virus infection in humans. Science 2010;328:745-48. [ Links ]
28. Selin LK, Cornberg M, Brehm MA, Kim SK, Calcagno C, Ghersi D et al. CD8 memory T cells: cross-reactivity and heterologous immunity. Semin Immunol 2004;16:335-47. [ Links ]
29. An J, Zhou DS, Zhang JL, Morida H, Wang JL, Yasui K. Dengue- specific CD8+ T cells have both protective and pathogenic roles in dengue virus infection. Immunol Lett 2004;95:167-74. [ Links ]
30. Mongkolsapaya J, Duangchinda T, Dejnirattisai W, Vasanawathana S, Avirutnan P, Jairungsri A et al. T cell responses in dengue hemorrhagic fever: are cross-reactive T cells suboptimal? J Immunol 2006;176:3821-29. [ Links ]
31. Dong T, Moran E, Vinh CN, Simmons C, Luhn K, Peng Y et al. High pro-inflammatory cytokine secretion and loss of high avidity cross-reactive cytotoxic T-cells during the course of secondary dengue virus infection. PLoS One 2007;2: e1192. [ Links ]
32. Imrie A, Meeks J, Gurary A, Sukhbataar M, Kitsutani P, Effler P et al. Differential functional avidity of dengue virus-specific T-cell clones for variant peptides representing heterologous and previously encountered serotypes. J Virol 2007;81:10081-91. [ Links ]
33. Mongkolsapaya J, Dejnirattisai W, Xu XN, Vasanawathana S, Tangthawornchaikul N, Chairunsri A et al. Original antigenic sin and apoptosis in the pathogenesis of dengue hemorrhagic fever. Nat Med 2003;9:921-27. [ Links ]
34. Watt G, Kantipong P, Jongsakul K. Decrease in human immunodeficiency virus type 1 load during acute dengue fever. Clin Infect Dis 2003; 36: 1067-69. [ Links ]
35. McLinden JH, Stapleton JT, Chang Q, Xiang J. Expression of the dengue virus type 2 NS5 protein in a CD4(+) T cell line inhibits HIV replication. J Infect Dis 2008;198:860-63. [ Links ]
36. Xiang J, McLinden JH, Rydze RA, Chang Q, Kaufman TM, Klinzman D et al. Viruses within the Flaviviridae Decrease CD4 Expression and Inhibit HIV Replication in Human CD4(+) Cells. J Immunol 2009;183:7860-69. [ Links ]
37. Mangada MM, Endy TP, Nisalak A, Chunsuttiwat S, Vaughn DW, Libraty DH et al. Dengue-specific T cell responses in peripheral blood mononuclear cells obtained prior to secondary dengue virus infections in Thai schoolchildren. J Infect Dis 2002;185:1697-703. [ Links ]
38. Limon-Flores AY, Perez-Tapia M, Estrada-Garcia I, Vaughan G, Escobar-Gutierrez A, Calderon-Amador J et al.Dengue virus inoculation to human skin explants: an effective approach to assess in situ the early infection and the effects on cutaneous dendritic cells. Int J Exp Pathol 2005; 86: 323-34. [ Links ]
39. Wu SJ, Grouard-Vogel G, Sun W, Mascola JR, Brachtel E, Putvatana R et al. Human skin Langerhans cells are targets of dengue virus infection. Nat Med 2000;6:816-20. [ Links ]
40. Blackley S, Kou Z, Chen H, Quinn M, Rose RC, Schlesinger JJ et al. Primary human splenic macrophages, but not T or B cells, are the principal target cells for dengue virus infection in vitro. J Virol 2007;81:13325-34. [ Links ]
41. Durbin AP, Vargas MJ, Wanionek K, Hammond SN, Gordon A, Rocha C et al. Phenotyping of peripheral blood mononuclear cells during acute dengue illness demonstrates infection and increased activation of monocytes in severe cases compared to classic dengue fever. Virology 2008; 376: 429-35. [ Links ]
42. Ho LJ, Wang JJ, Shaio MF, Kao CL, Chang DM, Han SW et al. Infection of human dendritic cells by dengue virus causes cell maturation and cytokine production. J Immunol 2001;166:1499-506. [ Links ]
43. Jessie K, Fong MY, Devi S, Lam SK, Wong KT. Localization of dengue virus in naturally infected human tissues, by immunohistochemistry and in situ hybridization. J Infect Dis 2004;189:1411-18. [ Links ]
44. Libraty DH, Pichyangkul S, Ajariyakhajorn C, Endy TP, Ennis FA. Human dendritic cells are activated by dengue virus infection: enhancement by gamma interferon and implications for disease pathogenesis. J Virol 2001;75:3501-08. [ Links ]
45. Espina LM, Valero NJ, Hernandez JM, Mosquera JA. Increased apoptosis and expression of tumor necrosis factor-alpha caused by infection of cultured human monocytes with dengue virus. Am J Trop Med Hyg 2003;68:48-53. [ Links ]
46. Palmer DR, Sun P, Celluzzi C, Bisbing J, Pang S, Sun W et al. Differential effects of dengue virus on infected and bystander dendritic cells. J Virol 2005;79:2432-39. [ Links ]
47. Bosch I, Xhaja K, Estevez L, Raines G, Melichar H, Warke RV et al. Increased production of interleukin-8 in primary human monocytes and in human epithelial and endothelial cell lines after dengue virus challenge. J Virol 2002;76:5588-97. [ Links ]
48. Chen YC, Wang SY. Activation of terminally differentiated human monocytes/macrophages by dengue virus: productive infection, hierarchical production of innate cytokines and chemokines, and the synergistic effect of lipopolysaccharide. J Virol 2002;76:9877-87. [ Links ]
49. Luplertlop N, Misse D, Bray D, Deleuze V, Gonzalez JP, Leardkamolkarn V et al. Dengue-virus-infected dendritic cells trigger vascular leakage through metalloproteinase overproduction. EMBO Rep 2006;7:1176-81. [ Links ]
50. Krishnamurti C, Alving B. Effect of dengue virus on procoagulant and fibrinolytic activities of monocytes. Rev Infect Dis 1989;11 Suppl 4: S843-S846. [ Links ]
51. Krishnamurti C, Wahl LM, Alving BM. Stimulation of plasminogen activator inhibitor activity in human monocytes infected with dengue virus. Am J Trop Med Hyg 1989;40:102-07. [ Links ]
52. Suharti C, van Gorp EC, Setiati TE, Dolmans WM, Djokomoeljanto RJ, Hack CE et al. The role of cytokines in activation of coagulation and fibrinolysis in dengue shock syndrome. Thromb Haemost 2002;87:42-46. [ Links ]
53. Fabre A, Couvelard A, Degott C, Lagorce-Pages C, Bruneel F, Bouvet E et al. Dengue virus induced hepatitis with chronic calcific changes. Gut 2001;49:864-65. [ Links ]
54. Wahid SF, Sanusi S, Zawawi MM, Ali RA. A comparison of the pattern of liver involvement in dengue hemorrhagic fever with classic dengue fever. Southeast Asian J Trop Med Public Health 2000;31:259-63. [ Links ]
55. de Souza LJ, Nogueira RM, Soares LC, Soares CE, Ribas BF, Alves FP et al. The impact of dengue on liver function as evaluated by aminotransferase levels. Braz J Infect Dis 2007;11:407-10. [ Links ]
56. Wichmann O, Gascon J, Schunk M, Puente S, Siikamaki H, Gjorup I et al. Severe dengue virus infection in travelers: risk factors and laboratory indicators. J Infect Dis 2007;195:1089-96. [ Links ]
57. Boonpucknavig S, Boonpucknavig V, Bhamarapravati N, Nimmannitya S. Immunofluorescence study of skin rash in patients with dengue hemorrhagic fever. Arch Pathol Lab Med 1979;103:463-66. [ Links ]
58. Sahaphong S, Riengrojpitak S, Bhamarapravati N, Chirachariyavej T. Electron microscopic study of the vascular endothelial cell in dengue hemorrhagic fever. Southeast Asian J Trop Med Public Health 1980;11:194-204. [ Links ]
59. Avirutnan P, Malasit P, Seliger B, Bhakdi S, Husmann M. Dengue virus infection of human endothelial cells leads to chemokine production, complement activation, and apoptosis. J Immunol 1998;161:6338-46. [ Links ]
60. Huang YH, Lei HY, Liu HS, Lin YS, Liu CC, Yeh TM. Dengue virus infects human endothelial cells and induces IL-6 and IL-8 production. Am J Trop Med Hyg 2000;63:71-75. [ Links ]
61. Rosenberg RD. Vascular-bed-specific hemostasis and hypercoagulable states: clinical utility of activation peptide assays in predicting thrombotic events in different clinical populations. Thromb Haemost 2001;86:41-50. [ Links ]
62. Peyrefitte CN, Pastorino B, Grau GE, Lou J, Tolou H, Couissinier- Paris P. Dengue virus infection of human microvascular endothelial cells from different vascular beds promotes both common and specific functional changes. J Med Virol 2006;78:229-42. [ Links ]
63. Bethell DB, Gamble J, Pham PL, Nguyen MD, Tran TH, Ha TH et al. Noninvasive measurement of microvascular leakage in patients with dengue hemorrhagic fever. Clin Infect Dis 2001;32:243-53. [ Links ]
64. Cardier JE, Marino E, Romano E, Taylor P, Liprandi F, Bosch N et al.Proinflammatory factors present in sera from patients with acute dengue infection induce activation and apoptosis of human microvascular endothelial cells: possible role of TNF-alpha in endothelial cell damage in dengue. Cytokine 2005;30:359-65. [ Links ]
65. Butthep P, Chunhakan S, Tangnararatchakit K, Yoksan S, Pattanapanyasat K, Chuansumrit A. Elevated soluble thrombomodulin in the febrile stage related to patients at risk for dengue shock syndrome. Pediatr Infect Dis J 2006;25:894-97. [ Links ]
66. Cardier JE, Rivas B, Romano E, Rothman AL, Perez-Perez C, Ochoa M et al. Evidence of vascular damage in dengue disease: demonstration of high levels of soluble cell adhesion molecules and circulating endothelial cells. Endothelium 2006;13:335-40. [ Links ]
67. Cardier JE, Balogh V, Perez-Silva C, Romano E, Rivas B, Bosch N et al. Relationship of thrombopoietin and interleukin-11 levels to thrombocytopenia associated with dengue disease. Cytokine 2006;34:155-60. [ Links ]
68. Murgue B, Cassar O, Deparis X. Plasma concentrations of sVCAM-1 and severity of dengue infections. J Med Virol 2001; 65:97-104. [ Links ]
69. Limonta D, Capo V, Torres G, Perez AB, Guzman MG. Apoptosis in tissues from fatal dengue shock syndrome. J Clin Virol 2007;40:50-54. [ Links ]
70. Avirutnan P, Zhang L, Punyadee N, Manuyakorn A, Puttikhunt C, Kasinrerk W et al. Secreted NS1 of dengue virus attaches to the surface of cells via interactions with heparan sulfate and chondroitin sulfate E. PLoS Pathog 2007;3:e183. [ Links ]
71. Bonner SM, OSullivan MA. Endothelial cell monolayers as a model system to investigate dengue shock syndrome. J Virol Methods 1998;71:159-67. [ Links ]
72. Talavera D, Castillo AM, Dominguez MC, Gutierrez AE, Meza I. IL8 release, tight junction and cytoskeleton dynamic reorganization conducive to permeability increase are induced by dengue virus infection of microvascular endothelial monolayers. J Gen Virol 2004;85:1801-13. [ Links ]
73. Blum MS, Toninelli E, Anderson JM, Balda MS, Zhou J, O'Donnell L et al. Cytoskeletal rearrangement mediates human microvascular endothelial tight junction modulation by cytokines. Am J Physiol 1997;273:286-94. [ Links ]
74. Gubler DJ, Reed D, Rosen L, Hitchcock JR, Jr. Epidemiologic, clinical, and virologic observations on dengue in the Kingdom of Tonga. Am J Trop Med Hyg 1978;27:581-89. [ Links ]
75. Rodriguez-Roche R, Sanchez L, Burgher Y, Rosario D, Alvarez M, Kouri G et al.Virus Role During Intraepidemic Increase in Dengue Disease Severity. Vector Borne Zoonotic Dis. 2011. [ Links ]
76. Chungue E, Cassar O, Drouet MT, Guzman MG, Laille M, Rosen L et al. Molecular epidemiology of dengue-1 and dengue-4 viruses. J Gen Virol 1995;76 ( Pt 7):1877-84. [ Links ]
77. Lanciotti RS, Gubler DJ, Trent DW. Molecular evolution and phylogeny of dengue-4 viruses. J Gen Virol 1997;78 ( Pt 9):2279- 84. [ Links ]
78. Messer WB, Gubler DJ, Harris E, Sivananthan K, de Silva AM. Emergence and global spread of a dengue serotype 3, subtype III virus. Emerg Infect Dis 2003;9:800-09. [ Links ]
79. Rico-Hesse R. Molecular evolution and distribution of dengue viruses type 1 and 2 in nature. Virology 1990;174:479-93. [ Links ]
80. Rico-Hesse R, Harrison LM, Salas RA, Tovar D, Nisalak A, Ramos C et al.Origins of dengue type 2 viruses associated with increased pathogenicity in the Americas. Virology 1997;230:244-51. [ Links ]
81. Holmes EC, Twiddy SS. The origin, emergence and evolutionary genetics of dengue virus. Infect Genet Evol 2003;3:19-28. [ Links ]
82. Watts DM, Porter KR, Putvatana P, Vasquez B, Calampa C, Hayes CG et al. Failure of secondary infection with American genotype dengue 2 to cause dengue haemorrhagic fever. Lancet 1999;354:1431-34. [ Links ]
83. Kouri GP, Guzman MG, Bravo JR, Triana C. Dengue haemorrhagic fever/dengue shock syndrome: lessons from the Cuban epidemic, 1981. Bull World Health Organ 1989;67:375-80. [ Links ]
84. Leitmeyer KC, Vaughn DW, Watts DM, Salas R, Villalobos I, de C et al. Dengue virus structural differences that correlate with pathogenesis. J Virol 1999;73:4738-47. [ Links ]
85. Pryor MJ, Carr JM, Hocking H, Davidson AD, Li P, Wright PJ. Replication of dengue virus type 2 in human monocyte-derived macrophages: Comparisons of isolates and recombinant viruses with substitutions at amino acid 390 in the envelope glycoprotein. Am J Trop Med Hyg 2001;65:427-34. [ Links ]
86. Proutski V, Gritsun TS, Gould EA, Holmes EC. Biological consequences of deletions within the 3 -untranslated region of flaviviruses may be due to rearrangements of RNA secondary structure. Virus Res 1999;64:107-23. [ Links ]
87. Armstrong PM, Rico-Hesse R. Efficiency of dengue serotype 2 virus strains to infect and disseminate in Aedes aegpti. Am J Trop Med Hyg 2003;68:539-44. [ Links ]
88. Rico-Hesse R. Microevolution and virulence of dengue viruses. Flaviviruses: Structure, Replication and Evolution 2003; 59: 315-41. [ Links ]
89. Uzcategui NY, Camacho D, Comach G, de Uzcategui RC, Holmes EC, Gould EA. Molecular epidemiology of dengue type 2 virus in Venezuela: evidence for in situ virus evolution and recombination. J Gen Virol 2001;82:2945-53. [ Links ]
90. Lanciotti RS, Lewis JG, Gubler DJ, Trent DW. Molecular evolution and epidemiology of dengue-3 viruses. J Gen Virol 1994;75:65-75. [ Links ]
91. Kliks S. Antibody-enhanced infection of monocytes as the pathogenetic mechanism for severe dengue illness. Aids Res Hum Retrovir 1990;6:993-98. [ Links ]
92. Diamond MS, Edgil D, Roberts TG, Lu B, Harris E. Infection of human cells by dengue virus is modulated by different cell types and viral strains. J Virol 2000;74:7814-23. [ Links ]
93. Streatfield R, Bielby G, Sinclair D. A primary dengue 2 epidemic with spontaneous haemorrhagic manifestations. Lancet 1993; 342: 560-61. [ Links ]
94. Guzman MG, Alvarez M, Rodriguez R, Rosario D, Vazquez S, Vald s L et al.Fatal dengue hemorrhagic fever in Cuba, 1997. Int J Infect Dis 1999;3:130-35. [ Links ]
95. Chen HL, Lin SR, Liu HF, King CC, Hsieh SC, Wang WK. Evolution of dengue virus type 2 during two consecutive outbreaks with an increase in severity in southern Taiwan in 2001-2002. Am J Trop Med Hyg 2008;79:495-505. [ Links ]
96. Rodriguez-Roche R, Alvarez M, Gritsun T, Halstead S, Kouri G, Gould EA et al. Virus evolution during a severe dengue epidemic in Cuba, 1997. Virology 2005;334:154-59. [ Links ]
97. Guzman MG, Kouri G. Dengue and dengue hemorrhagic fever in the Americas: lessons and challenges. J Clin Virol 2003;27:1-13. [ Links ]
98. Halstead SB. Dengue. Lancet 2007;370:1644-52. [ Links ]
99. Nishioka K. Serum complement level in dengue hemorrhagic fever. Allerg Immunol (Leipz.) 1974;20-21:385-92. [ Links ]
100. Shaio MF, Chang FY, Hou SC. Complement pathway activity in serum from patients with classical dengue fever. Trans R Soc Trop Med Hyg 1992;86:672-75. [ Links ]
101. Ubol S, Halstead SB. How innate immune mechanisms contribute to antibody-enhanced viral infections. Clin Vaccine Immunol 2010;17:1829-35. [ Links ]
102. Kurosu T, Chaichana P, Yamate M, Anantapreecha S, Ikuta K. Secreted complement regulatory protein clusterin interacts with dengue virus nonstructural protein 1. Biochem Biophys Res Commun 2007;362:1051-56. [ Links ]
103. Avirutnan P, Punyadee N, Noisakran S, Komoltri C, Thiemmeca S, Auethavornanan K et al. Vascular leakage in severe dengue virus infections: a potential role for the nonstructural viral protein NS1 and complement. J Infect Dis 2006;193:1078-88. [ Links ]
104. Markiewski MM, Nilsson B, Ekdahl KN, Mollnes TE, Lambris JD. Complement and coagulation: strangers or partners in crime? Trends Immunol 2007;28:184-92. [ Links ]
105. Falconar AK. The dengue virus nonstructural-1 protein (NS1) generates antibodies to common epitopes on human blood clotting, integrin/adhesin proteins and binds to human endothelial cells: potential implications in haemorrhagic fever pathogenesis. Arch Virol 1997; 142: 897-916. [ Links ]
106. Huang YH, Chang BI, Lei HY, Liu HS, Liu CC, Wu HL et al. Antibodies against dengue virus E protein peptide bind to human plasminogen and inhibit plasmin activity. Clin Exp Immunol 1997;110:35-40. [ Links ]
107. Markoff LJ, Innis BL, Houghten R, Henchal LS. Development of cross-reactive antibodies to plasminogen during the immune response to dengue virus infection. J Infect Dis 1991;164:294-301. [ Links ]
108. Lin CF, Lei HY, Shiau AL, Liu HS, Yeh TM, Chen SH et al. Endothelial cell apoptosis induced by antibodies against dengue virus nonstructural protein 1 via production of nitric oxide. J Immunol 2002;169:657-64. [ Links ]
109. Takhampunya R, Padmanabhan R, Ubol S. Antiviral action of nitric oxide on dengue virus type 2 replication. J Gen Virol 2006; 87: 3003-11. [ Links ]
110. Lin CF, Chiu SC, Hsiao YL, Wan SW, Lei HY, Shiau AL et al. Expression of cytokine, chemokine, and adhesion molecules during endothelial cell activation induced by antibodies against dengue virus nonstructural protein 1. J Immunol 2005;174:395-403. [ Links ]
111. Sun DS, King CC, Huang HS, Shih YL, Lee CC, Tsai WJ et al. Antiplatelet autoantibodies elicited by dengue virus non- structural protein 1 cause thrombocytopenia and mortality in mice. J Thromb Haemost 2007;5:2291-99. [ Links ]
112. LaFleur C, Granados J, Vargas-Alarcon G, Ruiz-Morales J, Villarreal-Garza C, Higuera L et al.HLA-DR antigen frequencies in Mexican patients with dengue virus infection: HLA-DR4 as a possible genetic resistance factor for dengue hemorrhagic fever. Hum Immunol 2002;63:1039-44. [ Links ]
113. Loke H, Bethell DB, Phuong CX, Dung M, Schneider J, White NJ et al. Strong HLA class I--restricted T cell responses in dengue hemorrhagic fever: a double-edged sword? J Infect Dis 2001;184:1369-73. [ Links ]
114. Polizel JR, Bueno D, Visentainer JE, Sell AM, Borelli SD, Tsuneto LT et al. Association of human leukocyte antigen DQ1 and dengue fever in a white Southern Brazilian population. Mem Inst Oswaldo Cruz 2004;99:559-62. [ Links ]
115. Stephens HA, Klaythong R, Sirikong M, Vaughn DW, Green S, Kalayanarooj S et al. HLA-A and -B allele associations with secondary dengue virus infections correlate with disease severity and the infecting viral serotype in ethnic Thais. Tissue Antigens 2002;60:309-18. [ Links ]
116. Zivna I, Green S, Vaughn DW, Kalayanarooj S, Stephens HA, Chandanayingyong D et al. T cell responses to an HLA-B*07- restricted epitope on the dengue NS3 protein correlate with disease severity. J Immunol 2002;168:5959-65. [ Links ]
117. Fernandez-Mestre MT, Gendzekhadze K, Rivas-Vetencourt P, Layrisse Z. TNF-alpha-308A allele, a possible severity risk factor of hemorrhagic manifestation in dengue fever patients. Tissue Antigens 2004;64:469-72. [ Links ]
118. Loke H, Bethell D, Phuong CX, Day N, White N, Farrar J et al. Susceptibility to dengue hemorrhagic fever in vietnam: evidence of an association with variation in the vitamin d receptor and Fc gamma receptor IIa genes. Am J Trop Med Hy. 2002;67:102-06. [ Links ]
119. Chao YC, Huang CS, Lee CN, Chang SY, King CC, Kao CL. Higher infection of dengue virus serotype 2 in human monocytes of patients with G6PD deficiency. PLoS One 2008;3:e1557. [ Links ]
120. Stephens HA. HLA and other gene associations with dengue disease severity. Curr Top Microbiol Immunol 2010;338:99-114. [ Links ]
121. Wang JP, Liu P, Latz E, Golenbock DT, Finberg RW, Libraty DH. Flavivirus activation of plasmacytoid dendritic cells delineates key elements of TLR7 signaling beyond endosomal recognition. J Immunol 2006;177:7114-21. [ Links ]
122. Munoz-Jordan JL. Subversion of interferon by dengue virus. Curr Top MicrobiolImmunol 2010; 338: 35-44. [ Links ]
123. Balmaseda A, Hammond SN, Perez MA, Cuadra R, Solano S, Rocha J et al.Short report: assessment of the World Health Organization scheme for classification of dengue severity in Nicaragua. Am J Trop Med Hyg 2005;73:1059-62. [ Links ]
124. Harris E, Videa E, Perez L, Sandoval E, Tellez Y, Perez ML et al.Clinical, epidemiologic, and virologic features of dengue in the 1998 epidemic in Nicaragua. Am J Trop Med Hyg 2000;63:5-11. [ Links ]
125. Murgue B, Deparis X, Chungue E, Cassar O, Roche C. Dengue: an evaluation of dengue severity in French Polynesia based on an analysis of 403 laboratory-confirmed cases. Trop Med Int Health 1999;4:765-73. [ Links ]
126. Phuong CX, Nhan NT, Kneen R, Thuy PT, van Thien C, Nga NT et al. Clinical diagnosis and assessment of severity of confirmed dengue infections in Vietnamese children: is the world health organization classification system helpful? Am J Trop Med Hyg 2004;70:172-79. [ Links ]
127. de Souza VA, Tateno AF, Oliveira RR, Domingues RB, Araujo ES, Kuster GW et al.Sensitivity and specificity of three ELISA-based assays for discriminating primary from secondary acute dengue virus infection. J Clin Virol 2007;39:230-33. [ Links ]
128. Domingues RB, Kuster GW, Onuki-Castro FL, Souza VA, Levi JE, Pannuti CS. Involvement of the central nervous system in patients with dengue virus infection. J Neurol Sci 2008; 67:36-40. [ Links ]
129. Solomon T, Dung NM, Vaughn DW, Kneen R, Thao LT, Raengsakulrach B et al. Neurological manifestations of dengue infection. Lancet 2000;355:1053-59. [ Links ]
130. Deen JL, Harris E, Wills B, Balmaseda A, Hammond SN, Rocha C et al. The WHO dengue classification and case definitions: time for a reassessment. Lancet 2006;368:170-73. [ Links ]
131. Setiati TE, Mairuhu AT, Koraka P, Supriatna M, Mac Gillavry MR, Brandjes DP et al. Dengue disease severity in Indonesian children: an evaluation of the World Health Organization classification system. BMC Infect Dis 2007;7:22. [ Links ]
132. Barniol J, Gaczkowski R, Barbato EV, da Cunha RV, Salgado D, Martinez E et al.Usefulness and applicability of the revised dengue case classification by disease: multi-centre study in 18 countries. BMC Infect Dis 2011;11:106. [ Links ]
*Correspondencia a: eugenia.corrales@ucr.ac.cr
Centro de Investigación en Enfermedades Tropicales (CIET), Facultad de Microbiología, Universidad de Costa Rica
Abreviaturas: ADE, inmunopotenciación mediada por anticuerpos; CD, células dendríticas; CE, células endoteliales; DENV, virus dengue; FD, fiebre del dengue; FHD, fiebre hemorrágica del dengue; HLA, human leukocyte antigen; IFN, interferón; IL, interleuquina; SNC, sistema nervioso central; SSD, síndrome de shock (choque) por dengue.
Fecha recibido: 20 de junio de 2011 Fecha aceptado: 03 de noviembre de 201











 text in
text in