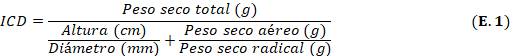1. Introducción
Probablemente, Swietenia mahagoni L. Jacq. es una de las especies maderables más valiosas del mundo, la más conocida y apreciable para ebanistería y toda clase de obra que requiera madera de alta calidad; que ha sido exportada a Europa y Estados Unidos por más de cuatro siglos. Pertenece a la familia Meliaceae y es conocida en Cuba con los nombres comunes de caoba, caoba antillana o caoba de Cuba (Betancourt, 1999).
Las investigaciones en Cuba sobre S. mahagoni se han enfocado en el estudio de sus características morfológico-funcionales, ecológicas y propagación in vitro (Ricardo, Puentes, y Torres, 2016; Barbón et al., 2013), pero muy pocas han tenido como objetivo el estudio de las relaciones simbióticas que establece con microorganismos del suelo, lo que mejora el crecimiento y calidad de la planta en vivero. Los resultados de estos estudios pueden contribuir a mejorar la productividad de las plantaciones forestales (Oros et al., 2015).
La efectividad de la micorriza, pues, depende de factores físicos y químicos (pH, fósforo y nitrógeno, entre otros) ofrecidos por el sustrato, que determinan qué tan favorable es la simbiosis entre plantas y hongos, y cuánto mejor será el desarrollo de las especies vegetales (Li et al., 2016).
Producir plantas de calidad en vivero contribuye a garantizar mayor porcentaje de supervivencia en las plantaciones forestales y en los programas de reforestación (Rueda et al., 2014). El desarrollo de protocolos y estrategias para la producción de plántulas con calidad, en menor tiempo y en condiciones asequible es muy importante. De esta manera, estudios que relacionan sustratos alternativos y la inoculación de las plántulas con hongos micorrízicos arbusculares, así como microorganismos que favorecen o estabelecimiento de las plántulas en las áreas degradadas (Feijen et al., 2018), son de grande valía. El efecto de la interacción sustrato-micorrízica puede contribuir a obtener plántulas con mejor calidad en vivero y alta supervivencia al trasplantar a campo. El presente estudio evalúa el efecto de dichos factores en el crecimiento y calidad de S. mahagoni en fase de vivero.
2. Metodología
Se utilizaron plántulas de S. mahagoni producida en vivero bajo umbráculo de malla verde con 50 % de sombra ubicado en Centro de Estudio de Tecnología Agroforestal (CETAF) perteneciente a la Universidad de Guantánamo, localizado en las coordenadas geográficas 20°12´21´´ de latitud norte y los 75°13´37´´ de longitud oeste a 87 m s.n.m. Respectivamente, según información del Instituto de Meteorología de Cuba (INSMET, 2019), el clima presenta una marcada estacionalidad seca de noviembre a marzo; y lluvias desde abril hasta junio y septiembre hasta octubre. Este sitio posee una precipitación y temperatura media anual de 1 028 mm y 25.9 °C.
Según la Norma Cubana NC: 71-04/87, las semillas de S. mahagoni se obtuvieron de la nave semillera de la Empresa Agroforestal Guantánamo, certificadas en el Instituto de Investigaciones Agroforestales de Baracoa.
El experimento siguió un diseño experimental completamente al azar, con arreglo factorial para evaluar los factores sustrato y microorganismos (2x4 respectivamente) (Cuadro 1). Se utilizaron 5 réplicas por cada uno de los 8 tratamientos, con 10 plántulas cada una (50 individuos por tratamiento).
Cuadro 1 Descripción de los tratamientos aplicados en el experimento.
| Tratamientos | Código | Cepas de HMA | Sustratos |
|---|---|---|---|
| 1 | M0/S1 | No | S1 |
| 2 | M0/S2 | No | S2 |
| 3 | M1/S1 | Glomus cubense | S1 |
| 4 | M1/S2 | Glomus cubense | S2 |
| 5 | M2/S1 | Rhizoglomus intraradices | S1 |
| 6 | M2/S2 | Rhizoglomus intraradices | S2 |
| 7 | M3/S1 | Funneliformis mosseae | S1 |
| 8 | M3/S2 | Funneliformis mosseae | S2 |
S1= Cascarilla de cacao + Fibra de coco + Aserrín de pino en proporción 6:2:2; S2= Cascarilla de cacao + Fibra de coco + Aserrín de pino compostados en proporción 2:6:2; HMA= Hongo Micorrízico Arbuscular.
La mezcla de compuestos orgánicos utilizado como sustrato (Cascarilla de cacao-Fibra de coco-Aserrín de pino compostados) para la producción de las plántulas de Caoba antillana fue escogida en función de los buenos resultados obtenidos por Falcón et al. (2019). La mezcla fue tamizada por una malla de 4 mm y esterilizada en autoclave a 121 ºC a 1 atm de presión por 120 minutos.
En el momento de la siembra en tubetes de 200 cm3, las semillas se inocularon por el método de recubrimiento (Fernández et al., 2001) con las cepas de inóculos micorrízicos certificados: INCAM-2: Funneliformis mosseae (Schüßler y Walker, 2011); INCAM 4: Glomus cubense (Rodríguez et al., 2011) e INCAM-11: Rhizoglomus intraradices (Schüßler y Walker, 2011) con una calidad mínima garantizada de 20 esporas g-1 de inoculante, producto no tóxico y libre de patógenos, procedentes del cepario del Instituto Nacional de Ciencias Agrícolas (INCA).
Las características químicas-físicas del sustrato y sus intervalos óptimos sugeridos por Abad et al., (2005) y Arévalo et al., (2016), se presentan en el Cuadro 2, los que se encuentran entre los valores óptimos, no así para el sustrato dos en el que el fosforo se encuentra por debajo del intervalo óptimo.
Cuadro 2 Caracterización química-física de los sustratos.
| Propiedades químicas | ||||||
|---|---|---|---|---|---|---|
| Sustrato | pH | MO (%) | N (%) | P (%) | K+ (%) | CE (dS.m-1) |
| S1 | 6.20 | 77.20 | 1.86 | 1.43 | 1.79 | 3.13 |
| S2 | 7.70 | 66.66 | 1.40 | 0.10 | 1.19 | 2.27 |
| Valores óptimos | 5.3-6.5 | >50 | >1.3 | >0.7 | >0.2 | <3.5 |
| Propiedades físicas | ||||||
| Sustrato | DA (g mL-1) | DR (g mL-1) | PT (%) | DMP (mm) | RH (%) | |
| S1 | 0.38 | 1.67 | 82.02 | 0.45 | 65.49 | |
| S2 | 0.31 | 1.68 | 76.16 | 0.35 | 70.76 | |
| Valores óptimos | 0.2-0.4 | 1.45-2.64 | 75-85 | - | >50 | |
2. 1 Caracterización de la planta en vivero
Al cabo de los 55 días de germinación, se comenzó la medición de los parámetros morfológicos; la altura se midió con una regla graduada en centímetros, desde la base del tallo hasta la yema apical y el diámetro se registró en milímetros en la base del tallo, con un pie de rey.
Al final del experimento (120 días), se evaluó el área foliar utilizando un medidor de área foliar Portable Area Meter Model LI-3000A (LI-COR®) y la biomasa seca total de la planta, para lo cual se colectaron todas las partes de las plantas, se empacaron en bolsas de papel y fueron llevadas a estufa (Binder®) a una temperatura constante de 60 ºC por 72 h. Luego se determinó el peso seco aéreo (PSA), radical (PSR) y total (PST). Con los datos obtenidos se calcularon los siguientes índices morfológicos obtenidos de Rueda et al., (2014):
Esbeltez (H/DCR): es el cociente de la altura en cm dividido por el diámetro en mm.
Relación parte aérea/parte radical (PSA/PSR): se estimó como el cociente entre el peso seco de la parte aérea y el peso seco de la raíz en gramos.
Índice de calidad de Dickson (ICD): el ICD se determinó mediante la Ecuación 1:
Calidad de la planta (CP): la CP se determinó mediante la Ecuación 2 citada por Panduro (2017):
Donde:
B= Individuos en condiciones buenas para plantas de tallo limpio sin defectos o enfermedades;
R= Individuos en condiciones regulares para plantas atacadas por enfermedades o con defectos y
M= Individuos en condiciones malas para plantas muertas.
La calidad de la planta se evalúa mediante el coeficiente de calidad según escala de valores citado por Panduro (2017), que se presenta en la Cuadro 3:
2.2 Análisis estadístico
A las variables evaluadas en cada uno de los tratamientos se les analizó la homocedasticidad y normalidad de los datos, utilizando, respectivamente, los criterios de Levene y Kolmogorov-Smirnov. Posteriormente, se sometieron a análisis de varianza (Anova) y las medias se compararon con la prueba de Duncan (p < 0.05). Al parámetro calidad de la planta se les realizó una prueba chi-cuadrado (X 2) mediante un análisis de contingencia (p < 0.05). Todos los análisis se realizaron con el programa estadístico SPSS ver. 23 para Windows.
3. Resultados
El Cuadro 4 presenta el análisis de varianza, este mostró efectos significativos (p≤ 0.001) para todos los parámetros e índices morfológicos evaluados. La interacción entre los factores sustratos y cepas de HMA utilizados fue altamente significativa (p≤ 0.001) en todos los parámetros evaluados.
Cuadro 4 Análisis de varianza para los parámetros e índices morfológicos de la planta S. mahagoni a los cuatro meses de cultivada.
| Cuadrados medios y significancia (P) | ||||||
|---|---|---|---|---|---|---|
| Factor de variación | G.L | Altura (cm) | Diámetro (mm) | Esbeltez | Índice de Dickson | Área foliar (cm2) |
| Sustrato (S) | 1 | 41.60*** | 3.05** | 0.05* | 0,004* | 5,99* |
| Cepas (HMA) | 3 | 131.87*** | 11.27** | 0.18* | 0.05*** | 67.49*** |
| S X HMA | 3 | 29.18*** | 2.70** | 0.19** | 0.01** | 3.09*** |
| Cuadrados medios y significancia (P) | ||||||
| Factor de variación | G.L | Peso seco aéreo (g) | Peso seco radical (g) | Colonización micorrízica (%) | Relación peso seco aéreo/peso seco radical | |
| Sustrato (S) | 1 | 0.01* | 0,02* | 143.93*** | 0.02* | |
| Cepas (HMA) | 3 | 0.19*** | 0.31*** | 11293.90*** | 0.49*** | |
| S X HMA | 3 | 0.01* | 0.02* | 27.319*** | 0.06* | |
*= P < 0.05; **= P < 0.01; ***= P < 0.001; G.L= Grado de libertad.
En los parámetros altura, diámetro del cuello de la raíz, esbeltez e índice de Dickson (Cuadro 5), se observó que las plántulas desarrolladas en el sustrato S2 inoculado con las cepas G. cubense y R. intraradices (M1/S2 y M2/S2) fueron las que alcanzaron los mayores valores, difiriendo estadísticamente con el resto de los tratamientos. Los tratamientos no inoculados (M0/S1 y M0/S2) fueron los que presentaron los menores valores. Esto puede estar relacionado con los beneficios proporcionados por la micorriza en el crecimiento de las plantas.
Cuadro 5 Comportamiento de parámetros de crecimiento e índices morfológicos de S. mahagoni a los cuatro meses de cultivada.
| Tratamientos | Altura (cm) | Diámetro del cuello de la raíz (mm) | Esbeltez (H/Dcr) | Índice de calidad de Dickson (ICD) | |
| 1 | M0/S1 | 19.34e | 3.97d | 4.89a | 0.16c |
| 2 | M0/S2 | 17.31f | 3.52d | 4.97a | 0.14c |
| 3 | M1/S1 | 26.29b | 6.25c | 4.23b | 0.26b |
| 4 | M1/S2 | 29.75a | 7.90a | 3.78d | 0.31a |
| 5 | M2/S1 | 24.61d | 6.38b | 3.86c | 0.27b |
| 6 | M2/S2 | 28.20b | 7.56a | 3.75d | 0.30a |
| 7 | M3/S1 | 24.18d | 6.20c | 3.90bc | 0.24b |
| 8 | M3/S2 | 25.10c | 6.67b | 3.76d | 0.25b |
| ES* | 0.465* | 0.169* | 0.067* | 0.006* | |
Medias con letras desiguales difieren estadísticamente según dócima de Duncan para p < 0.05. *Error estándar
Relacionado con el peso seco, colonización micorrízica y área foliar (Cuadro 6), se puede observar diferencia significativa entre tratamientos. Por eso, se ven favorecidas las plántulas desarrolladas en los sustratos micorrizados. No obstante, las plántulas desarrolladas en el sustrato S2 inoculado con las cepas G. cubense y R. intraradices (M1/S2 y M2/S2) alcanzaron los mayores valores, difiriendo estadísticamente con el resto de los tratamientos, en la relación peso seco aéreo/peso seco radical, colonización micorrízica y área foliar Cuadro 6. Efecto de los tratamientos en el peso seco, colonización micorrízica y el área foliar de la planta S. mahagoni a los cuatro meses de cultivada.
Cuadro 6 Efecto de los tratamientos en el peso seco, colonización micorrízica y el área foliar de la planta S. mahagoni a los cuatro meses de cultivada.
| Peso seco (g) | ||||||
|---|---|---|---|---|---|---|
| Tratamientos | Aéreo | Radical | Relación Peso seco aéreo/Peso seco radical (g) | Colonización micorrízica (%) | Área foliar (cm2) | |
| 1 | M0/S1 | 0.63d | 0.42e | 1.50a | - | 9.55c |
| 2 | M0/S2 | 0.58d | 0.35e | 1.67a | - | 9.15c |
| 3 | M1/S1 | 0.76b | 0.53d | 1.44b | 48.25b | 12.45b |
| 4 | M1/S2 | 0.84a | 0.68a | 1.26d | 52.45a | 13.85a |
| 5 | M2/S1 | 0.76b | 0.62bc | 1.31c | 46.31c | 12.85b |
| 6 | M2/S2 | 0.81ab | 0.65ab | 1.26d | 51.35a | 13.78a |
| 7 | M3/S1 | 0.75b | 0.57cd | 1.35b | 40.75c | 12.10b |
| 8 | M3/S2 | 0.74bc | 0.56cd | 1.30c | 42.25c | 12.35b |
| ES* | 0.011* | 0.015* | 0.024* | 0.026* | 0.035* | |
Medias con letras desiguales difieren estadísticamente según dócima de Duncan para p < 0.05. *Error estándar.
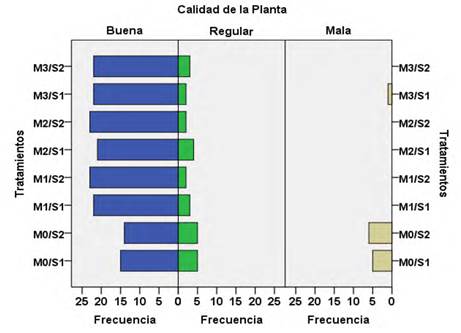
En la mayoría de los tratamientos, la calidad de la planta (Figura 1) resultó buena, excepto en M0/S1 y M0/S2 donde se aprecian plántulas con características de inferior calidad en todos los parámetros evaluados, que las clasifica como mala. A través del coeficiente de contingencia de 0.799, se corrobora interacción entre los factores (sustratos x microorganismos) con diferencias significativas en la calidad de las plantas (p < 0,05), como efecto de los tratamientos investigados, por lo que hay evidencia de que la inoculación del sustrato con hongos micorrizógenos incide favorablemente en la calidad de la planta.
Con respecto al valor del coeficiente de calidad citado por Panduro (2017), las plántulas son categorizadas de excelente en el sustrato S2 inoculado con las cepas G. cubense y R. intraradices (M1/S2 y M2/S2) y buena en el restante de los tratamientos donde el sustrato fue inoculado, no así para los tratamientos no inoculado (M0/S1 y M0/S2) las que son evaluadas como regular (Cuadro 7).
Cuadro 7 Efecto de los sustratos y microorganismos en la calidad de la planta de S. mahagoni a los cuatro meses de cultivada.
| Calificación de la calidad de la planta (CP) | |||
| Tratamientos | Coeficiente | Interpretación | |
| 1 | M0/S1 | 1.60 | Regular |
| 2 | M0/S2 | 1.68 | Regular |
| 3 | M1/S1 | 1.12 | Buena |
| 4 | M1/S2 | 1.08 | Excelente |
| 5 | M2/S1 | 1.16 | Buena |
| 6 | M2/S2 | 1.08 | Excelente |
| 7 | M3/S1 | 1.16 | Buena |
| 8 | M3/S2 | 1.12 | Buena |
4. Discusión
Los resultados del presente estudio muestran que la inoculación con Hongos Micorrízicos Arbusculares tiene un efecto positivo en el crecimiento y calidad de la planta de S. mahagoni en condiciones de vivero. Con la inoculación de las cepas Glomus cubense y Rhizoglomus intraradices se evidencia mayor crecimiento, esto provoca un efecto sinérgico cuando el sustrato fue inoculado con las distintas cepas micorrízicas, fundamentalmente en los tratamientos donde se utiliza el sustrato S2 (M1/S2, M2/S2 y M3/S2). Esto permitió que las plántulas de caoba antillana crecieran en promedio 7.7 cm más en comparación con los tratamientos donde no se aplicó micorriza.
Este comportamiento pudiera estar relacionado con la disminución del contenido de fósforo disponible en el sustrato S2. Al respecto, para Rodríguez (2010) la actividad y el beneficio de la simbiosis es más visible en suelos deficientes en fósforo. En esta condición, plantas de Swietenia macrophylla inoculadas con hongos micorrízicos arbusculares (HMA) presentaron mayores tasas de crecimiento. La aplicación de fósforo influye considerablemente sobre el desarrollo de las micorrizas. Se ha reportado que pequeñas aplicaciones a los suelos, tanto inoculados como esterilizados, incrementaron el porcentaje de colonización, sin embargo, se reporta un efecto contrario con altas adiciones de este elemento (Bustamante y Rojas, 2017). Esta situación podría explicar el comportamiento de las cepas estudiadas en este experimento, pues el sustrato uno (S1) se caracterizó por valores superiores de fósforo disponible.
Por otra parte, el mayor porcentaje de fibra de coco (60 %) en el sustrato S2, favoreció el crecimiento, lo que coincide con Klein (2015), quien describe un buen desarrollo de las plantas cuando es utilizada la fibra de coco como componente en el sustrato. Los resultados favorables pueden explicarse a partir del análisis físico-químico del S2, donde se observa una baja DA y DMP pequeña. Lo que hace que el sustrato retenga alta cantidad de agua, ya que una cantidad adecuada de agua disponible es esencial para mantener la productividad de las plantas. La presencia de micorrizas puede influir de manera importante para regular la disponibilidad de agua e incrementar la biomasa, sobre todo en la parte radicular (Gómez et al., 2013).
En cuanto al índice de esbeltez (H/Drc), un valor inferior a 6 se considera adecuado para plantas latifoliadas (Rueda et al., 2014). En el presente estudio los valores fueron inferiores para todos los tratamientos, donde se alcanzaron los mejores índices de H/Drc, en los tratamientos donde el sustrato fue inoculado con las cepas micorrízicas. Fundamentalmente en los tratamientos (M1/S2, M2/S2 y M3/S2), de donde se infiere que serán plantas que podrían presentar una mayor resistencia mecánica a los fuertes vientos, asociado a una mejor calidad, plantas más esbeltas y con tallos vigorosos (Santin et al., 2018).
Al analizar los valores de ICD se pudo apreciar que los sustratos inoculados presentaron índices adecuados (0.24 y 0.31) para definir una planta de buena calidad. Dickson et al., (1960), consideran que cuanto más alto es el valor ICD, mejor es la calidad de la planta. En este sentido, los mayores valores fueron obtenidos en el sustrato S2 inoculado con las cepas G. cubense y R. intraradices (M1/S2 y M2/S2), que registraron índices adecuados (0.30 y 0.31) para definir una planta de buena calidad. Cabe destacar que en la mayoría de los trabajos donde se evalúa la calidad de las plantas en vivero, se trabaja bajo programas de fertirriego, donde las plantas están por periodos prolongados (8-12 meses) expuestas a condiciones ideales. Para el presente estudio se trabajó con la aplicación de micorriza arbuscular sin ningún apoyo de fertilizantes, solamente riego con agua a capacidad de campo. Por ello, los resultados de crecimiento de las plántulas de S. mahagoni obtenidos con los tratamientos M1/S2 y M2/S2, resultan promisorios y deberían conducir a disminuir la aplicación de fertilizantes comerciales en viveros forestales, para dar paso a la utilización de inóculos biológicos como biofertilizantes.
El crecimiento también fue favorecido, en biomasa aérea y radical, lo que representaría una mayor productividad. El efecto benéfico, además, se observó en la relación Peso seco aéreo/Peso seco radical, parámetro muy importante para el establecimiento de las plantas en campo. A menor valor de esta relación se ve favorecida la capacidad de absorción de agua. Esto es una condición favorable para la plantación en sitios marginales (Rueda et al., 2014), como las de la región de estudio. El mismo autor asevera que mientras menor valor se obtenga en esta relación para especies tropicales, existirá más vigor en la planta. En general, recomienda que, en sitios con precipitación escasa, el cociente no debe superar el valor de 2.5. En este sentido, los mejores valores fueron obtenidos en el sustrato S2 inoculado con las cepas G. cubense y R. intraradices (M1/S2 y M2/S2). El uso de hongos endomicorrizógenos en especies del género Swietenia cultivadas en vivero y destinadas a repoblaciones, se ha reportado en Swietenia macrophylla con resultados satisfactorios (Bango et al., 2013), así como en Swietenia mahagoni (Falcón et al., 2013) y en Swietenia humillis (Acosta, 2019).
Según lo revisado por Feijen et al. (2018), en las plantas con micotrófia facultativa se ve favorecida la colonización radical en condiciones de baja disponibilidad de nutrientes. Para diferentes estudios plantas que crecen en bajas condiciones de fósforo incrementan exudación de aminoácidos, estos reducen los azúcares y ácidos carboxílicos (Jones, Hodge y Kuzyakov, 2004), lo que favorece a la micorrización. Por esta razón, los mayores porcentajes de micorrización en el sustrato S2 inoculados con G. cubense y R. intraradices respectivamente con valores de 52.45 y 51.55 %,. Estos grados de micorrización fueron significativamente superiores a los alcanzados con F. mosseae en ambos sustratos (40.75 y 42.25 %). En todos los sustratos inoculados se presentaron porcentajes de micorrización entre 40.75 y 52.45 %. Estos resultados muestran la especificidad infectiva que establecen los HMA en las plantas, dependiendo de las características de cada sustrato (Feijin et al., 2018).
Los valores más altos asociados al área foliar se encontraron en los tratamientos M1/S2 y M2/S2, estadísticamente significativos al hacer su comparación con los tratamientos sin inoculación micorrízica. La mayor área foliar y biomasa se determinó con la utilización de las cepas micorrízicas G. cubense y R. intraradices. Lo cual indica que la especie caoba antillana, en la etapa de vivero, responde a la adición de estas cepas. Donde además se obtuvo mejores resultados cuando se usó el sustrato dos (S2). El uso de HMA presenta un efecto positivo en el crecimiento de las plantas, debido a los beneficios de esta simbiosis micorrízica, la que está relacionada con la nutrición vegetal (Smith y Smith, 2011). Por su parte, el sustrato dos, al presentar mayor porcentaje de fibra de coco (60 %), aporta nutrientes como calcio, nitrógeno y potasio. Lo que contribuye a mejorar la composición base de este sustrato, además de lograr una nutrición más balanceada (Falcón et al., 2019). Arévalo, Oberpaur y Méndez (2016), indican que la fibra de coco presenta ventajas de estabilidad física, porosidad total elevada (64.1 a 98.3 %), baja densidad aparente, (0.03 a 0.9 g cm-3) y una adecuada aireación (24.2 a 89.4 %).
La inoculación con HMA en el sustrato produce mejor calidad de plántula de S. mahagoni. La simbiosis planta-hongo se caracteriza por la presencia de estructuras fúngicas dentro y fuera de las raíces, que se extienden por el suelo como una red interconectada que funciona de interface entre el suelo y la planta. Con lo que aumenta la superficie de contacto de las raíces en el suelo y mejora la absorción de agua y nutrientes (Li et al., 2016).
Según resultados antes expuestos, los tratamientos M1/S2 y M2/S 2 pueden utilizarse indistintamente. Esta opción posibilita la obtención de plántulas de mayor calidad, lo que valida la aptitud de estas combinaciones para ser utilizada en la producción de caoba antillana en condiciones similares a la del experimento. De igual manera, se reafirmó que F. mosseae como una segunda opción mostró valores por debajo de las otras cepas utilizadas en ambos tipos de sustratos, independientemente de su fertilidad. Bustamante y Rojas (2017), consignaron resultados semejantes con la inoculación de micorriza arbuscular en Theobroma cacao L.
El estímulo en el crecimiento, atribuible a la inoculación con hongos endomicorrízicos, ha sido reportado para algunas especies de la familia Meliaceae. Bango et al., (2013), registraron aumento en la altura, peso seco de raíz y diámetro de plantas de Swietenia macrophylla inoculadas con cepas micorrízicas del género Glomus. A su vez, Oros et al., (2015) demostraron que Cedrela odorata incrementó la biomasa aérea y radical cuando se inoculó con Rhizophagus intraradices. De igual forma Falcón et al., (2013) y Falcón et al., (2018), registraron mayor crecimiento y supervivencia en plántulas de Swietenia mahagoni L. Jacq., inoculadas con Rhizophagus intraradices y Glomus cubense, respectivamente, en comparación con las plantas sin inocular.
El sinergismo registrado debido a la inoculación de hongos endomicorrízicos y sustratos orgánicos, también se ha reportado previamente. Por ejemplo, Souza et al., (2009) reportaron el incremento de biomasa en la raíz de Schinus terebinthifolius en sustrato orgánico y esporas de las especies Gigaspora margarita y Glomus clarum. Acosta (2019) demostró que la inoculación con las cepas Glomus sp. y Acaulospora sp. en sustrato de origen industrial, incrementó el crecimiento y la colonización endomicorrízica de árboles de Swietenia humilis.
La respuesta de una plántula a una práctica cultural determinada es muy compleja y para el caso de los tratamientos evaluados, la sola adición de los dos sustratos pudo dar lugar a múltiples condiciones. A partir de las variables evaluadas, se observó cómo la especie caoba antillana mostró una tendencia, la cual indica que hay una respuesta diferenciada hacia las cepas de HMA y el tipo de sustrato aplicado.
Tanto los resultados del presente trabajo como los reportados en la bibliografía permiten afirmar que los biofertilizantes de tipo HMA representan un potencial para disminuir las limitantes en la producción de especies forestales a nivel de vivero. Que se refleja en un mayor desarrollo radical, mayor tasa de crecimiento, mejor adaptación a condiciones de estrés hídrico y nutricional en campo (Ramírez et al., 2018). Por otra parte, con base en HMA, el uso de biofertilizantes podría reducir los tiempos de vivero y para el productor forestal se convierten en mayor competitividad y sostenibilidad, con reducción de costos de producción y mejora en los ingresos.
5. Conclusiones
La interacción del sustrato S2 conformado por 60 % de fibra de coco + 20 % de cascarilla de cacao + 20 % de aserrín de pino y las cepas micorrízicas Glomus cubense, Rhizoglomus intraradices y Funneliformis mosseae, son las más beneficiosas para la estimulación del crecimiento de la planta S. mahagoni cultivada vivero. Las cepas micorrízicas G. cubense y R. intraradices, ambas inoculadas en el sustrato S2, favorecieron la calidad de la planta S. mahagoni. La inoculación de sustratos orgánicos con Hongos Micorrízicos Arbusculares como biofertilizantes, demuestran ser alternativas viables para utilizar en la producción de plantas forestales de S. mahagoni.
6. Ética y conflicto de intereses
Las personas autoras declaran que han cumplido totalmente con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la producción del manuscrito; que no hay conflictos de intereses de ningún tipo; que la entidad participante se menciona completa y claramente en la sección de agradecimientos; y que están totalmente de acuerdo con la versión final editada del artículo.












 uBio
uBio