Introducción
Los hongos se han utilizado como nutracéuticos, medicamento y fuente de alimento a lo largo de la historia de la humanidad (Bakratsas et al., 2021). En la industria alimentaria, los hongos son reconocidos por sus diversas cualidades, ya sea como alimentos (setas) o como mediadores en los procesos biotecnológicos para la obtención de alimentos (Karim, 2020). Con respecto a sus características nutricionales, los hongos comestibles contienen un alto contenido de fibra alimentaria y proteínas, además de ser bajos en grasas (Campi et al., 2023). El creciente interés sobre el consumo de alimentos seguros y saludables ha impulsado la búsqueda de fuentes de compuestos bioactivos naturales que ofrezcan beneficios para la salud, además de sus valores nutritivos (Das et al., 2021).
Las setas son valoradas como delicatesen por sus propiedades organolépticas asociadas al sabor “UMAMI”, un sabor intenso y agradable codiciado en el área gourmet y característico del reino Fungi (Sun et al., 2020). Los hongos también son considerados alimentos funcionales por producir compuestos bioactivos y terapéuticos beneficiosos para la salud (Kim y Kim, 1999; Gao y Zhou, 2002; Dimopoulou et al., 2022). El aprovechamiento de setas precisa de una producción continua y la adecuada estandarización de procesos para el cultivo extensivo. En el 2021, el tamaño del mercado mundial de hongos se valoró en USD 50 300 millones y se espera una tasa de crecimiento anual del 9,7 % entre el 2022 y el 2030 (Mushroom Market Size & Share, s. f.). Entre las especies más cultivadas en Latinoamérica se citan al Agaricus bisporus (J. E. Lange) Imbach y varias especies de género Pleurotus, seguida de Lentinula edodes (Berk.) Pegler (Martínez-Carrera, 2000). Los estudios sobre la domesticación del hongo Favolus rugulosus son fundamentales para adquirir conocimientos sobre el sistema de producción, dado a su potencial aplicación en la industria de alimentos.
El género Favolus comprende especies con distribución neotropical y pantropical (Tianara et al., 2020; Palacio et al., 2021). Las especies Favolus tenuiculus P. Beauv, F. alveolaris (Bosc) Fr., y F. brasiliensis (Fr.) Fr. han sido citadas como comestibles en México (Ruán-Soto et al., 2006; Jiménez et al., 2013; del Moral Cervantes, 2015), y en Brasil se han citado las especies F. brunneolus Berk y Curt, F. brasiliensis, F. tessellatus Mont., F. yanomami Palacio y Menolli, F. radiatifibrillosus Palacio y R. M. Silveira y F. rugulosus Palacio y R. M. Silveira como comestibles y se ha registrado el uso alimenticio de estas especies por la tribu Yanomami (Prance, 1984; Palacio et al., 2021). En Paraguay se ha documentado la especie Favolus brasiliensis (citado como F. tenuiculus) para los Departamentos Central y Paraguarí (Campi et al., 2018; Campi et al., 2021; Palacio et al., 2021). Las diferencias morfológicas entre las especies de Favolus citadas como comestibles son sutiles y muchas veces resultan insuficientes para la determinación taxonómica. Por lo tanto, la integración de herramientas como los análisis morfológicos, filogenéticos moleculares y ecológicos son indispensables para la correcta identificación de especies de este género.
Estudios sobre la domesticación de hongos del género Favolus han iniciado, esto es fundamental para adquirir conocimientos sobre el sistema de producción para estandarizar los procesos, dado a su potencial aplicación en la industria de alimentos. Favolus rugulosus está catalogado como comestible y recientemente se ha evaluado la factibilidad de domesticación y cultivo en distintos sustratos (Sanchez-Ocampo et al., 2022). Sin embargo, no se han realizado estudios sobre sus características químicas y nutricionales. El objetivo de este trabajo fue la domesticación y evaluación de la producción en dos sustratos disponibles en el mercado local, así como realizar el primer análisis proximal nutricional, químico y biológico de los basidiomas.
Materiales y Métodos
Colecta y aislado de cepa
Se colectaron basidiomas frescos de Favolus rugulosus en el Campus Universitario de la Universidad Nacional de Asunción, ubicado en la ciudad de San Lorenzo, Departamento Central (25°33’58.1”S y 57°51’93.8”W). La muestra analizada fue depositada en el Herbario de la Facultad de Ciencias Exactas y Naturales (FACEN) de la Universidad Nacional de Asunción con código de entrada a herbario FACEN 005252. A partir del contexto del basidioma fresco se aisló un fragmento en agar malta para obtener la cepa, siguiendo los lineamientos de Mata y Salmones (2021). La cepa fue depositada en el cepario de la FACEN UNA (FC59).
Identificación
Análisis morfológicos
La identificación taxonómica se realizó siguiendo los lineamientos de Palacio et al. (2021). Se realizaron cortes a mano alzada utilizando un estereoscopio y se montaron en KOH 3 % más floxina 1 % y reactivo de Melzer. Las mediciones se realizaron en reactivo de Melzer según lineamientos de Palacio et al. (2021).
Análisis moleculares
La extracción de ADN se realizó a partir del basidioma seco según el protocolo de Doyle (1991), con modificaciones de Góes-Neto et al. (2005). La región ITS (ITS1, 5.8S y ITS2) fue amplificada con los cebadores ITS1F/ITS4B (White et al., 1990; Gardes y Bruns, 1993; Hopple y Vilgalys, 1999), con los parámetros propuestos por Robledo et al. (2020). Los productos de amplificación fueron purificados y secuenciados en Macrogen.
Para estimar la estrategia de partición y el modelo de evolución de nucleótidos de mejor ajuste, se utilizó la herramienta ModelFinder (Kalyaanamoorthy et al., 2017) implementado en el software IQ-Tree (Nguyen et al., 2015) para el conjunto de datos de tres bloques (nc28S rDNA; ITS1; 5.8S; ITS2). Los modelos fueron restringidos a aquellos implementados en MrBayes 3.2 (Ronquist et al., 2012). Se realizaron análisis filogenéticos de inferencia bayesiana (BI) y máxima verosimilitud (ML) al conjunto de datos concatenados utilizando el esquema de partición y los modelos evolutivos definidos por ModelFinder. La Inferencia Bayesiana se realizó de acuerdo con los planteamientos de Costa-Rezende et al. (2020). Los análisis de máxima verosimilitud se llevaron a cabo con IQ-TREE. El análisis MrBayes 3.1.2 se realizó en el portal científico CIPRES (Miller et al., 2012).
Características de cultivo en placa
Se describió las características macro y micromorfológicas del cultivo en placa. Se evaluó la velocidad de crecimiento mediante cultivo en placa. Se inoculó los discos de 5 mm de diámetro en tres medios de cultivo diferentes, APD (Agar Papa Dextrosa), AM (Agar Malta) y Sabouraud, cada uno por cuadruplicado. El crecimiento micelial se midió en milímetros por día (mm día-1) con un escalímetro de Vernier. La densidad del micelio se determinó según las claves de identificación de la densidad del micelio en medios de cultivo de Mata y Salmones (2021).
Producción de basidiomas bajo condiciones controladas
Se evaluó la producción de basidiomas en dos sustratos: aserrín de Eucaliptus spp (E), paja de Megathyrsus maximus (Jacq.) B. K. Simon & S. W. L. Jacobs (P) y la combinación de ambas (EP) en proporción 1:1. Se ajustó el pH del sustrato a seis con carbonato de calcio al 1 %, se hidrató con agua destilada al 50 % del peso total y se sometió a tratamiento térmico de 121 °C por 20 min. Las pruebas se realizaron por cuadruplicado.
Las condiciones de fructificación se mantuvieron dentro de los siguientes parámetros: humedad 80 %, temperatura entre de 30 a 38 °C y ciclos de luz de 12 horas para simular el día y la noche. Los cálculos de rendimiento y eficiencia biológica se determinaron de la siguiente manera, siguiendo a Ruegger et al. (2001): rendimiento: R= ((Peso fresco de basidiomas/Peso fresco de sustrato) x 100); eficiencia biológica: EB % = ((Peso fresco de basidiomas/Peso de sustrato seco) x 100).
Preparación de extractos
Las extracciones con disolventes por gradiente de polaridad se realizaron con la técnica de Heleno et al. (2011) con modificaciones según Campi et al. (2023). Se pesaron diez gramos de basidioma cultivado, previamente liofilizado y molido. Se maceraron los diez gramos de muestra en (3 x 150 mL) metanol: agua 80:20, esta mezcla se sometió a sonicación (Digital Ultrasonic Cleaner) durante dos horas. Luego se filtró con un filtro de fibra de vidrio de 1 mm. La solución final filtrada se evaporó a 60 °C a presión reducida (RC Ingennery-RE 200A) para eliminar el metanol. La fase acuosa se sometió a una extracción líquido-líquido con éter de petróleo (3x100 mL), n-hexano (3x100 mL), cloroformo (3 x 100 mL) y acetato de etilo (3x100 mL). Las fases orgánicas y el resto acuoso se evaporaron a 40 °C hasta sequedad y, posteriormente, se redisolvieron en metanol para los análisis.
Cuantificación de fenoles totales
La concentración de compuestos fenólicos totales en los extractos se determinó mediante el método de Folin-Ciocalteu, según los lineamientos de Campi et al. (2023), utilizando ácido gálico (Sigma-Aldrich®) como patrón. El contenido total de los compuestos fenólicos se calculó como mg g-1 equivalentes de ácido gálico (GAE). Todas las pruebas se realizaron por triplicado.
Determinación de la actividad antirradicalaria DPPH•
La actividad antirradicalaria DPPH• se determinó mediante el método de absorbancia de radicales DPPH•, según Campi et al. (2023) en un espectrofotómetro (GENESYS 140 Vis de Thermo Scientific). Las pruebas se realizaron por triplicado. Los resultados se expresaron como la media del análisis realizado por triplicado en miligramos de equivalentes de ácido ascórbico por g de extracto crudo ± desviación estándar (DE). El porcentaje de actividad (A) se calculó como:
A= 100 (AbsDPPH• - AbsSol)/AbsDPPH• Donde AbsDPPH• y AbsSol son las absorbancias de DPPH• en solución y DPPH• con extracto respectivamente, medidas a 517 nm.
Perfil nutricional
El contenido de humedad (Estufa para secado, San Jor Modelo SL30SDR), cenizas (Mufla, Haereaus M110) y grasas (extractor soxhlet y Randall, Boeco) se analizó siguiendo los estándares de la norma mexicana (NMX-F-089-S,1978; NMX-F-083, 1986; NMX-F-066-S, 1978) con modificaciones para determinación de grasas, utilizando hexano (Supelco) como solvente de extracción. El contenido de proteína (N x 4.38) (Breene, 1990; Chang y Miles, 2004) (digestor y destilador de Kjeldhal Velp Modelo DK42) y fibra alimentaria (Baño María, Nexus; Mufla, Haereaus M110; Digestor, Velp Modelo DK42; Estufa, Thermo Serie Heratherm; Balanza analítica Radwag AS220; Enzimas, Sigma-Aldrich®) se analizó siguiendo estándares de la AOAC 2000 (Association of Official Analytical Chemists; N.° 960.52; N.° 985.29), respectivamente.
El contenido de carbohidratos se calculó de acuerdo con los lineamientos de Fernandes et al. (2012), con modificaciones usando ácido sulfúrico (Merck) 98 %, ácido perclórico (Cicarelli) 50 % v/v, reactivo antrona (9,10 dihidro, 9 oxoantraceno) (Fluka Analytical) y glucosa (Merck) como estándar de referencia; el contenido de carbohidratos totales se calculó como mg g-1 de equivalente de glucosa. El valor energético se estimó siguiendo los estándares del Reglamento Técnico Mercosur 46/03.
Perfil de ácidos grasos
El perfil de ácido grasos y porcentaje de abundancia se determinó según estándares de la AOAC 1969, N.° 969.33 en un cromatógrafo de gases (Shimadzu Modelo 2010 Plus).
Análisis estadístico
Los resultados se expresaron como la media aritmética ± desviación estándar, cada muestra se realizó por triplicado en experimentos independientes. Se utilizó la prueba t-Student para todos los ensayos con una p <0,05. El análisis estadístico se realizó con el programa PAST (Hammer, 2001).
Resultados y discusión
Identificación taxonómica
Análisis morfológicos
Las características morfológicas de las muestras analizadas coinciden con las descritas por Palacio et al. (2021) para la especie, Favolus rugulosus se distingue morfológicamente por la superficie del píleo pubescente con pelos cortos (hasta 100 μm) y finos; basidiosporas; pileipellis plagiotricodermal caracterizada por la disposición radial de las hifas basales e hifas terminales proyectadas en fascículos.
Análisis filogenético
La topología de los árboles obtenidos por inferencia bayesiana (IB) y máxima verosimilitud (ML) resultaron similares. Se presenta la topología del análisis de ML junto con los valores de soporte encontrados para ambos análisis ML/IB. El género Favolus fue recuperado como un clado monofilético (77/1). El nuevo espécimen secuenciado se agrupó con dos especímenes de Favolus rugulosus, incluido espécimen holotipo de F. rugulosus MP191 (Figura 1).
Características de cultivo
Micelio con crecimiento radial en medio sólido, denso, algodonoso y blanquecino cuando joven, tornándose coriáceo y castaño en el centro cuando maduro. Hifas aéreas de dos tipos: (i) generativas con septos simples, hialinas, pared delgada, congófilas, 1.7-3.2 μm diám.; (ii) fibuladas de 3.2-5.3 μm diám., ambas sin ramificaciones ni clamidiosporas. Hifas sumergidas de dos tipos, (i) septadas simples, 2.1-4.8 μm diám y (ii) fibuladas de 2-4 μm diám.
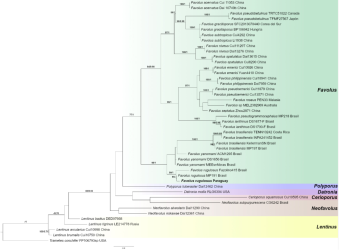
Fuente: propia de la investigación
Figura 1 Árbol consenso de máxima verosimilitud basado en secuencias de ITS. Los valores de soporte de IB y ML mayores a 70 y 0.7 respectivamente se muestran encima de las ramas
En cuanto a la velocidad del crecimiento micelial fue mayor en AM (25.1 mm día-1), APD (24.5 mm día-1) y Sabouraud (22.4 mm día-1). La velocidad de crecimiento reportada por Sanchez-Ocampo et al. (2022) para APD incubados a 23 °C fue tres veces menor a las observadas para AM y APD en este estudio. Por otra parte, para la especie Favolus brasi liensis se reportó una velocidad mayor a 30°C (Omarini et al., 2009), lo cual sugiere que la temperatura de incubación es un factor importante para la velocidad de crecimiento.
Producción de basidiomas bajo condiciones controladas
El sustrato que presentó la mayor velocidad de colonización fue el de paja (P), seguido de eucalipto/paja (EP) y, finalmente, eucalipto (E) (Tabla 1). Las bolsas se perforaron a los 35 días de ser inoculadas, la aparición de los primeros primordios se dio entre los 15 y 20 días después de la perforación de las bolsas (Figura 2). El sustrato de mayor rendimiento (R) y eficiencia biológica (EB) fue EP (26.3 % y 52.5 %), respectivamente; seguido de E (1.6 % y 3.2 %) y, finalmente, P (1.0 % y 2.0 %). Con respecto al cultivo de Favolus rugulosus, Sanchez-Ocampo et al. (2022) reportaron 30.3 % de EB en un sustrato de madera mixta suplementada. Sin embargo, para el cálculo de la EB tomaron en cuenta solo la primera oleada. Por otra parte, Omarini et al. (2009) obtuvieron 82.3 % de EB para la especie F.
Tabla 1 Rendimiento (%), eficiencia biológica (%), oleadas y tiempo de colonización de Favolus rugulosus en las distintas proporciones de sustratos empleados
| Sustratos | Rendimiento (%) | Eficiencia biológica(%) | Cantidad de oleadas | Tiempo de colonización (días) |
| P | 1.0 ± 1.3ª | 2.0 ± 2.6ª | 1 | 30 |
| E | 1.6 ± 0.6a | 3.2 ± 1.2ª | 3 | 90 |
| EP | 26.3 ± 7.8b | 52.5 ± 15.7b | 7 | 45 |
Letras iguales indican que no existen diferencias significativas (p < 0.05).
Nota: elaboración propia.

Fuente: elaboración propia.
Figura 2: A) y B) Basidiomas de Favolus rugulosus en cultivo. C) Textura coriácea en superficie de cultivo
brasiliensis, la cual fue mayor a la obtenida para F. rugulosus en este trabajo (52.5 %). Esta diferencia podría deberse a la suplementación del sustrato o las condiciones de fructificación implementadas.
En cuanto a la cantidad de oleadas de fructificación, la mayor fue de 7 para EP, se guido de 3 para E y 1 para P; el intervalo de fructificación a 28 °C entre oleadas fue de 7 días aproximadamente. Por su parte, Sánchez-Ocampo et al. (2022) observaron intervalos de tiempo de hasta 20 días entre oleadas en sustratos distintos a 23 °C. Esto sugiere que la temperatura influye en los intervalos de fructificación acortándolos a 28 °C.
Los sustratos ensayados mostraron un cambio en la textura y coloración antes de la fructificación. El sustrato recientemente colonizado evidenció una coloración por completo blanca y blanda que, con el transcurso del tiempo, se tornó marrón y coriácea en la parte superior, esta característica también fue observada previamente en Favolus rugulosus y en otras especies como F. brasiliensis, Lentinula edodes (Berk.) Pegler y Ganoderma australe Fr Pat., (1889), en donde Omarini et al. (2009 mencionan que quizás esta tex
tura actúa como barrera protectora contra la pérdida de humedad y ataque contra insectos
Perfil químico
Las concentraciones más altas de compuestos fenólicos totales y actividad antirradicalaria DPPH• se observaron en la fracción de Acetato de etilo (Tabla 2).
Se observó una relación directa entre el incremento de la polaridad de la fracción y el aumento de la concentración de feno les y actividad antirradicalaria DPPH•. Este
Tabla 2 Valores de fenoles totales y actividad antirradicalaria DPPH• de las fracciones del basidioma de Favolus rugulosus
| Fracción | Fenoles totales (mg GAE g-1) | Actividad Antirradicalaria (mg AAE g-1) | Actividad Antirradicalaria DPPH• (%) |
|---|---|---|---|
| Éter de Petróleo | 2.5 ± 0.4ª | 2.5 ± 0.0a | 2.0 ± 0.0a |
| Hexano | 9.0 ± 0.7b | 0.8 ± 0.1ª | 1.0 ± 0.1a |
| Cloroformo | 11.7 ± 1.9b | 7.8 ± 0.5ª | 4.5 ± 0.5a |
| Acetato de Etilo | 35.6 ± 2.6c | 13.6 ± 1.3b | 7.0 ± 1.3b |
GAE: Equivalentes de Ácido Gálico. AAE: Equivalentes de Ácido Ascórbico. Letras iguales indican que no existen diferencias significativas (p < 0.05).
Nota: elaboración propia.
comportamiento ya ha sido documentado en estudios previos con extractos de basidiomicetos (Zheng et al., 2011). Además, es importante destacar que, la selección del solvente de extracción influye en la selectividad compuestos de interés (Campi et al., 2023).
No se encontraron referencias sobre el contenido fenólico ni la actividad antirradicalaria DPPH• de especies del género Favolus. Sin embargo, Hussein et al. (2015) re portaron contenido fenólico total de 4.31 ± 0.03 mg GAE g-1, para Polyporus tenuiculus (un sinónimo de Favolus brasiliensis). Por otra parte, se han reportado contenidos fenó licos de 2.5-47.3 mg GAE g-1 para especies de Polyporus, un género cercano (Orhan Üstun, 2011), mientras que para el extracto etanólico de Lentinus lindquistii (Singer) B. E. Lechner & Albertó, una especie de otro género cercano (Figura 1), se han reporta do 15 mg GAE g-1 de contenido fenólico y 9.5 mg AAE g-1 de la actividad antirradica laria DPPH• (Campi et al., 2019). Respecto a la actividad antirradicalaria DPPH• no se ha encontrado registros bibliográficos para especies del género Favolus; sin embargo, Hussein et al. (2015) documentan actividad antioxidante de 90.71 % para Polyporus teuiculus. Ahora bien, para especies del género Polyporus se reportó actividad antioxidante de hasta 76 % para polisacáridos deumbellatus (Pers.) Fr. y 91 % para extracto GAE: Equivalentes de Ácido Gálico. AAE: Equivalentes de Ácido Ascórbico. Letras iguales indican que no metanólico de P. squamosus (Huds.) Fr. (Elmastas et al., 2007; He et al., 2016); no obstante, para L. lindquistii 6.6 % de actividad en su extracto etanólico (Campi et al., 2019).
Composición proximal
El género Favolus está catalogado como comestible (Palacio et al., 2021); sin embargo, no se han encontrado evidencias bibliográficas referentes al valor nutricional de especies cultivadas de este género. Los resultados obtenidos en este estudio sobre el análisis proximal demuestran que F. rugulosus es un alimento con alto contenido de proteínas (20.0 %), fibra alimentaria (25.2 %) y bajo en grasas (5.7 %) (Tabla 3), valores consistentes con lo reportado para los hongos comestibles silvestres y cultivados (Rampinelli et al., 2010).
Tabla 3 Composición proximal en base seca de basidiomas cultivados de Favolus rugulosus obtenidos del sustrato de mayor rendimiento y eficiencia biológica (EP)
| Hongo cultivado seco | Composición (%) |
|---|---|
| Humedad | 91.1 ± 0.4 |
| Proteína | 20.0 ± 0.0 |
| Grasas totales | 5.7 ± 0.5 |
| Fibra alimentaria | 25.2 ± 0.0 |
| Hidratos de carbono | 14.5 ± 0.1 |
| Cenizas | 1.9 ± 0.7 |
| Valor energético | 189.3 kcal |
Nota: elaboración propia.
Los hongos cultivados son de importancia nutricional porque contienen entre 19 y 35 % de proteínas ricas en aminoácidos esenciales como la lisina y leucina (Chang y Buswell, 1996; Wani et al., 2010). Favolus rugulosus presente 20.0 % de proteínas, valor similar a los reportados por Silva Neto et al. (2021) para basidiomas silvestres de F. brasiliensis (27.0 %). En cuanto a la fibra alimentaria, el consumo habitual estimula el desarrollo de la flora intestinal, mejora el tránsito digestivo y reduce los niveles de glucosa y colesterol en sangre (Dhingra et al., 2012); por ende, los alimentos ricos en fibra alimentaria son recomendados en la dieta humana.
Favolus rugulosus contiene 25.2 % de fibra alimentaria coincidente con el valor diario de referencia (25 g) establecido por el reglamento del Mercosur (2003). Especies cultivadas de Pleurotus demuestran un rango entre 1.7 y 22.4 % de fibra cruda (Nieto y Chegwin, 2010; Rampinelli et al., 2010; Cano-Estrada y Romero, 2016). En la mayoría de los casos, las referencias bibliográficas sobre el valor proximal de los hongos informan sobre el contenido de fibra cruda. Sin embargo, este método analítico utilizado es inapropiado para el reporte del contenido de fibras para alimentos de consumo humano, pues subestima el contenido de fibra alimentaria (García et al., 2008; Campi et al., 2023). Con respecto al contenido lipídico en hongos, las concentraciones oscilan entre 0.1 y 16.3 % y están representadas por ácidos grasos esenciales, esteroles y triterpenos de valor nutraceútico (Nieto y Chegwin, 2008; Sande et al., 2019). Favolus rugulosus contiene 5.7 % de lípidos, valor superior (1.3 %) a los obtenidos por Silva Neto et al. (2021) para basidiomas silvestres de F. brasiliensis. En lo referente a los carbohidratos presentes en los hongos, uno de los tres nutrientes principales de los alimentos, F. rugulosus contiene 14.5 % de esta biomolécula. Finalmente, la calidad de un alimento está relacionada con la cantidad de nutrientes que componen el aporte energético y la fuente de donde provienen (Burgess y Glasauer, 2006). Favolus rugulosus es un alimento con 222.7 kcal/100g, energía que proviene principalmente de las proteínas y carbohidratos.
Perfil de ácidos grasos
Con respecto al perfil lipídico de Favolus rugulosus, el análisis revela la presencia de ácidos grasos saturados (SFA) de 14 a 19 unidades de carbono, ácidos grasos monoinsaturados (MUFA) y ácidos grasos poliinsaturados (PUFA). El 16.4 % de la composición lipídica de F. rugulosus corresponde a los ácidos grasos esenciales docosahexanoico (ω-3), linoleico (ω-6) y oleico (ω-9) (Tabla 4). El ácido graso oleico (ω-9) reduce los niveles de colesterol en sangre (Puiggros et al., 2002); el ácido linoleico (ω-6) es fundamental para el desarrollo del sistema visual y nervioso (Matencio et al., 2012; Sande et al., 2019) y el ácido docosahexanoico (ω-3) se considera indispensable para el desarrollo y mantenimiento del cerebro, por ello su consumo es recomendado en embarazadas (von Schacky, 2021). Los ácidos palmítico (16:0), oleico (18:1) y linoleico (18:2) se encuentran con frecuencia en las especies comestibles Agaricus bisporus (J. E. Lange) Imbach, Pluteus atricapillus (Batsch) Fayod, Lentinula edodes (Berk.) Pegler, Flammulina velutipes (Curtis) Singer y Ramaria aurea (Schaeff.) Quél. (Pedneault et al., 2006; Kalač, 2013; Pereira et al., 2012). Con respecto al ω-3, su presencia es poco frecuente en los hongos, en el 2013 Nakalembe y Kabasa reportan por primera vez la existencia de ácido docosahexanoico (DHA) en las especies
Tabla 4 Perfil de ácidos grasos y porcentaje de abundancia expresados como ésteres metílicos en extracto de hexano obtenidos de basidiomas cultivados de Favolus rugulosus identificados en GC-MS
| % Abundancia | Ester metílico | Contenido mg/100g | |
|---|---|---|---|
| 42 | Ácido palmítico, éster metílico | (C16:0) | 51.9 |
| 16.2 | Ácido esteárico, éster metílico | (C18:0) | 20.0 |
| 15.9 | Ácido elaídico, éster metílico | (18:1 trans-9) | 19.7 |
| 13.6 | Ácido oleico, éster metílico (ω-9) | (18:1 -9) | 16.9 |
| 2.7 | Ácido linoleico, éster metílico (ω-6) | (18:2 -6) | 3.4 |
| 2.6 | Ácido láurico, éster metílico | (C12:0) | 3.2 |
| 1.9 | 18-nonadecanoato de metilo | (C19:0) | 2.3 |
| 1.6 | Ácido trans-13-octadecenoico, éster metílico | (C18:1) | 2.0 |
| 1.4 | 15-metoxyhexadecanoato de metilo | (C16:1) | 1.7 |
| 0.7 | Ácido pentadecanóico, éster metílico | (C15:0) | 0.8 |
| 0.6 | Ácido margárico, éster metílico | (C17:0) | 0.8 |
| 0.5 | Ácido mirístico, éster metílico | (C14:0) | 0.6 |
| 0.2 | 7,12-octadecadienoato de metilo | (C18:2) | 0.3 |
| 0.1 | Ácido docosahexanoico, éster metílico (ω-3) | (C22:6 -3) | 0.2 |
Nota: elaboración propia.
Termitomyces globulus R. Heim & Gooss.Font. y T. microcarpus (Berk. & Broome) R. Heim; además también se encuentra la existencia de este ácido graso para Fomes fomentarius (L.) Fr. y Tricholoma terreum (Schaeff.) P. Kumm. (Yilmaz et al., 2013 Abugri et al., 2016). Los hongos son fuente de ácidos grasos esenciales y su presencia en conjunto con ácidos grasos no esenciales podría indicar que son apropiados para uso como nutracéuticos y farmacéuticos (Sande et al., 2019; Adedokun et al., 2022; Azeem et al., 2023).
Conclusión
Los resultados de este estudio indican el potencial nutricional de Favolus rugulosus de producción indoor. Con respecto al cultivo, la mezcla de aserrín de eucalipto y paja presentó los mayores rendimientos, eficiencia biológica y cantidad de oleadas. En relación con el análisis proximal, F. rugulosus cultivado demostró un alto contenido de proteínas, fibra alimentaria y bajo contenido de grasas, además de poseer ácidos grasos esenciales, entre ellos la presencia de ácido docosahexanoico (DHA), fundamentales en la fisiología y nutrición.
El neotrópico posee hongos comestibles no convencionales nativos con potencial de producción indoor e interés nutricional y nutracéutico que requieren de investigación para brindar nuevas alternativas a la industria de alimentos, por lo cual es importante continuar el estudio de la especie al introducir bioprocesos altamente controlados para optimizar el tiempo y rendimiento de la producción de hongos. Se sugiere ampliar el estudio de perfil de aminoácidos y toxicológicos para extender el conocimiento de las especies de hongos comestibles















