Introducción
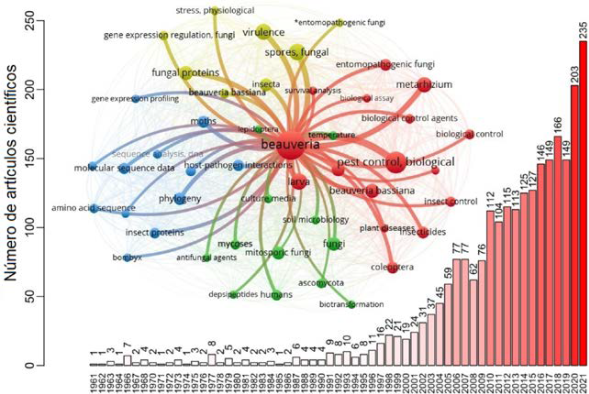
El uso inadecuado de insecticidas químicos ha generado plagas más resistentes, al tiempo que ha aumentado los efectos de la contaminación ambiental (Naqqash et al., 2016). Actualmente, hay una tendencia a utilizar insecticidas diamidas y nicotínicos (Umetsu y Shirai, 2020), lo cual podría afectar de forma negativa a las especies de abejas, invertebrados acuáticos y otros organismos no objetivo (Borsuah et al., 2020). Además, algunos insumos químicos han disminuido su eficacia; por ejemplo, los lepidópteros presentan resistencia a las diamidas (Richardson et al., 2020). Debido a esto, desde hace varios años se está en la búsqueda de alternativas sostenibles de control, como los hongos entomopatógenos (Furuie et al., 2022; Zeina et al., 2022; Zhang et al., 2020). Entre los productos más comunes a base de hongos se encuentran: Beauveria bassiana (33.9 %), Metarhizium anisopliae (33.9 %), Isaria fumosorosea (5.8 %), B. brongniartii (4.1 %) y otros (22.3 %), esto de un total de 171 productos contabilizados (Faria y Wraight, 2007). En cuanto a investigaciones, hay un total de 2 445 artículos que coinciden con el término “Beauveria” en la búsqueda realizada en PubMed.gov (figura 1). Se destacan avances científicos en las décadas de 1960 a 1990, pero no fue hasta el periodo 2000-2021 que el número de documentos comenzó a aumentar significativamente, abarcando el 92 % de todas las referencias bibliográficas. En este análisis, la palabra clave más común es “control biológico de plagas”, lo cual demuestra el notable interés y la gran cantidad de estudios de este género en lo relacionado a su potencial entomopatógeno para fines agrícolas. Sin embargo, hay aspectos menos explorados que podrían mejorar el uso de estos hongos, como su supervivencia en condiciones adversas y su potencial como biofertilizantes.
El calentamiento global en regiones de clima tropical podría entorpecer las estrategias de control biológico basadas en B. bassiana, pues factores como las altas temperaturas y la baja humedad pueden limitar su rendimiento (Vidal y Fargues, 2007). Por ejemplo, la germinación óptima de las conidias de este hongo varía entre 25 y 30 °C (Mwamburi et al., 2015), sin embargo, las cepas expuestas a temperaturas de ~30 °C
Fuente: propia de la investigación
Figura 1 Número de artículos científicos relacionados con Beauveria spp. en PubMed.gov, 1961-2021 (n= 2 445), con el descriptor de búsqueda “Beauveria”(Título/Resumen). Análisis de clúster de las 50 palabras más relevantes, por medio de la distancia de Kullback-Leibler para comparar la distribución de las coocurrencias de palabras con la distribución general de palabras. El análisis cienciométrico se realizó con el software VOSviewer, versión 1.6.16.
pueden mostrar un crecimiento reducido y por encima de los 34 °C pueden resultar letales (Abdulhai et al., 2010; Hiromori et al., 2004). Es un hecho que estas altas temperaturas son fácilmente alcanzables en un clima tropical, por lo que las cepas termotolerantes y aisladas de insectos muertos infectados en climas tropicales secos podrían ser una opción. La mejora genética de este hongo también podría ser una estrategia (Ortiz-Urquiza et al., 2015; Xie et al., 2010), no obstante, este enfoque está limitado por los términos regulatorios relacionados con el uso de organismos modificados genéticamente, cuyos posibles efectos ambientales aún son inciertos (Koenraadt y Takken, 2011).
B. bassiana es conocida por su potencial en el manejo de plagas, pero su potencial como promotor del crecimiento en plantas ha sido menos explorado (Sinno et al., 2021). Entre los posibles beneficios de la asociación planta-hongo se encuentran: i) mejoras en la respuesta de las plantas a los cambios ambientales, al presensibilizar el metabolismo celular de las plantas, lo cual les permite enfrentar y sobrevivir al estrés ambiental de manera más eficiente (Sturz y Nowak, 2000), ii) propiciar el intercambio de compuestos que permiten el correcto funcionamiento metabólico entre la planta y el hongo (Mishra et al., 2018), y iii) aumento de la disponibilidad de nutrientes, mejora de la calidad del suelo, producción de antibióticos y sustancias que aumentan el crecimiento de las plantas (Ciccillo et al., 2002; Lodewyckx et al., 2002). Al establecer una asociación endófita, se ha registrado un incremento significativo en el crecimiento de las plantas, además, estas asociaciones mantienen las plagas dentro de límites manejables (Barra-Bucarei et al., 2019). Por ejemplo, Pachoute et al. (2021) registraron aumentos significativos en la biomasa de las plantas de caupí (Vigna unguiculata), explicados por un aumento en las tasas de asimilación de CO2, la conductancia estomática y el contenido total de clorofila. Mantzoukas et al. (2021) demostraron no solo la colonización exitosa del endófito B. bassiana, sino también un notable efecto en el crecimiento de las raíces de la vid (Vitis vinifera) sin dañar la planta y Russo et al. (2019) informaron que las plantas de maíz inoculadas con B. bassiana presentaron un aumento en la altura, el número de hojas, el peso del grano, el rendimiento y el porcentaje de germinación de las semillas en comparación con las plantas de control.
En todos estos estudios, se determinó que la reducción significativa en las plagas y la capacidad del hongo para colonizar plantas contribuyen al conocimiento existente sobre su actividad entomopatógena y resalta su impacto beneficioso en el crecimiento y rendimiento de los cultivos. El objetivo de esta investigación fue evaluar in vitro el desarrollo de estructuras infectivas de cinco cepas de Beauveria spp. aisladas de insectos parasitados recolectados en diferentes regiones de clima tropical en Costa Rica y su efecto en el crecimiento de plántulas de tomate (Solanum lycopersicum, cultivar ‘Gladiator’) en condiciones de alta temperatura.
Metodología
Cepas de Beauveria spp.
Se utilizaron las cepas de Beauveria spp.: INTA-H26, INTA-H30, INTA-H31, INTA-H49 e INTA-H50 (en lo sucesivo: H-26, H-30, H-31, H-49 y H-50), del Banco de Microorganismos del Laboratorio de Fitoprotección del Instituto Nacional de Innovación y Transferencia en Tecnología
Tabla 1 Especies hospederas y ubicación geográfica de los sitios de aislamiento de las cepas de Beauveria spp. utilizadas en esta investigación.
| Nombre científico | Código | Hospedero | Latitud | Longitud | Lugar de colecta (provincia) | Año de colecta |
|---|---|---|---|---|---|---|
| Beauveria spp. | INTA-H26 | Diaphorina citri | 10.8368 | -84.6202 | Alajuela | 2013 |
| Beauveria spp. | INTA-H30 | Hypothenemus hampei | 9.9753 | -84.1399 | Heredia | 2013 |
| Beauveria spp. | INTA-H31 | Hypothenemus hampei | 9.9833 | -84.1833 | Heredia | 2013 |
| Beauveria spp. | INTA-H49 | Bemisia tabaci | 11.0333 | -84.7166 | Alajuela | 2017 |
| Beauveria spp. | INTA-H50 | Aulacorthum solani | 10.0939 | -84.4238 | Alajuela | 2012 |
Nota: fuente propia de la investigación.
Agropecuaria (INTA), aisladas a partir de insectos muertos parasitados recolectados de diferentes regiones de Costa Rica (tabla 1), con temperaturas que oscilan entre 19 °C min. y 35 °C máx. y ~70 % de humedad relativa. Las cepas se almacenaron en discos de papel filtro (0.5 cm de diámetro) en aceite a -20 °C.
Identificación taxonómica
La caracterización molecular se llevó a cabo en el Laboratorio de Biología Molecular del INTA. La extracción de ADN se realizó con 20 mg de micelio con 15 días de incubación en medio de cultivo agar papa dextrosa (PDA), según el procedimiento descrito por Hoyos-Carvajal et al. (2008). Se maceró el micelio en 500 μL del buffer de extracción (Tris-HCl 200 mM pH 7.2, EDTA 50 mM, SDS 3 %, NaCl 1 M y Mercaptoetanol 0.2 %), la mezcla resultante se incubó a 60 °C durante 30 min y se agitó cada 10 min con un agitador vortex. Posteriormente, se añadió 500 μL de cloroformo: alcohol isoamílico (24:1) y se mezcló hasta formar una masa blanca. Luego, se centrifugó a 8 154 g durante 15 min y al sobrenadante se le añadió 0.54 veces el volumen de isopropanol. Se centrifugó a 4 313 g durante 5 min, se descartó el sobrenadante, se dejó secar el sedimento y luego se resuspendió en 300 μL de buffer Tris-EDTA. Se añadió acetato de sodio pH 5.2 (0.3 M) y dos veces el volumen de etanol absoluto y luego se centrifugó a 2 426 g durante 10 min. Se descartó el sobrenadante y se lavó el precipitado con 200 μL de etanol al 70 %, se dejó reposar por 1 h y se centrifugó a 4 313 g durante 10 min. Finalmente, el precipitado se dejó secar y se resuspendió en 100 μL de buffer Tris-EDTA, el cual se incubó a 37 °C durante 10 min. La integridad del ADN se determinó mediante un espectrofotómetro (Thermo Scientific®).
La identificación molecular de las cepas se realizó con la amplificación de dos regiones: 1) la del gen de factor de elongación-1 alfa (EF1-α) por la técnica PCR Touchdown, los cebadores utilizados fueron 983F (10 µM) 5’-GCYCCYGGHCAYCGTGAYTTYAT-3’ y 2218R 5’-ATGACACCRACRGCRACRGTYTG-3’ (Rehner y Buckley, 2005) y 2) la región intergénica nuclear del locus B (Bloc) mediante PCR de punto final, con los cebadores B5.1F (10 µM) 5’-CGACCCGGCCAACTACTTTGA-3’ y B3.1R 5’-GTCTTCCAGTACCACTAC-GCC-3’ (Rehner et al., 2006). Los reactivos para la PCR fueron: 2X DreamTaq polimerasa Master Mix (Thermo Scientific®, K1071) y 10 ng µL-1 ADN de volumen final 25-50 µL. Las condiciones de amplificación para el gen EF1-α y la región intergénica Bloc se detallan en la tabla 2. Los productos de PCR obtenidos se visualizaron en gel de agarosa al 1 %. Las secuencias se obtuvieron por el
Tabla 2 Perfil de termociclado para la PCR del gen EF1-α y la región intergénica Bloc.
| Gen EF1-α | |||
|---|---|---|---|
| Paso | Temperatura (°C) | Tiempo | Repeticiones |
| Desnaturalización inicial | 94 | 4 min | 1 X |
| Desnaturalización | 94 | 30 s | Touchdown |
| Hibridación | 66-58 disminución 1 ºC por ciclo | 30 s | 8 X |
| Extensión | 72 | 1 min | |
| Desnaturalización | 94 | 30 s | 36X |
| Hibridación | 56 | 30 s | |
| Extensión | 72 | 1 min | |
| Terminación | 72 | 30 min | 1 X |
| Región intergénica Bloc | |||
| Paso | Temperatura (°C) | Tiempo | Repeticiones |
| Desnaturalización inicial | 94 | 2 min | 1 X |
| Desnaturalización | 94 | 30 s | 40 X |
| Hibridación | 56 | 30 s | |
| Extensión | 72 | 2 min | |
| Terminación | 72 | 15 min | 1 X |
Nota: fuente propia de la investigación.
método de Sanger y las secuencias Bloc y EF1-α se analizaron por separado. Luego se estudió en el software MEGA X (versión 11) de acuerdo con los criterios de verosimilitud bayesiana. Los árboles filogenéticos se realizaron por el método estadístico de árboles de Máxima Verosimilitud, con 1 000 réplicas.
Las secuencias de EF1-α se reportaron en NCBI con los números de acceso H-26: ON755274, H-30: ON755275, H-31: ON755276, H-49: ON755277 y H-50: ON755278; y las secuencias de Bloc con números de acceso H-26: ON734097, H-30: ON734098, H-31: ON734099, H-49: ON734100 y H-50: ON734101.
Producción de conidios, crecimiento del micelio y germinación
La producción de conidios y el crecimiento del micelio se registró bajo dos condiciones con variables de temperatura y humedad relativa (tabla 3). La primera simula
Tabla 3 Condiciones de temperatura y humedad relativa utilizadas para probar el desarrollo de hongos y plántulas de tomate
| Condición: alta temperatura | |||
|---|---|---|---|
| Hora | Temperatura (°C) | Humedad relativa (%) | Luz |
| 02:00 | 22 | 70 | No |
| 04:00 | 21 | 70 | No |
| 06:00 | 21 | 50 | Sí |
| 08:00 | 26 | 50 | Sí |
| 10:00 | 31 | 50 | Sí |
| 12:00 | 34 | 50 | Sí |
| 14:00 | 35 | 50 | Sií |
| 16:00 | 33 | 50 | Sí |
| Condición: alta temperatura | |||
| Hora | Temperatura (°C) | Humedad relativa (%) | Luz |
| 18:00 | 29 | 50 | No |
| 20:00 | 27 | 50 | No |
| 22:00 | 25 | 50 | No |
| 24:00:00 | 24 | 70 | No |
| Condición: óptimo | |||
| Hora | Temperatura (°C) | Humedad relativa (%) | Luz |
| 00:00-12:00 | 26 | 90 | Sí |
| 12:00-24:00 | 26 | 90 | No |
Nota: fuente propia de la investigación.
la temperatura promedio del clima tropical, específicamente de la zona de Nicoya de Costa Rica (en adelante, alta temperatura) y la segunda corresponde a las condiciones óptimas para el crecimiento de B. bassiana (en adelante, óptimo), ambas condiciones fueron preestablecidas en una cámara ambiental MLR-352H (Panasonic®).
Para cuantificar la producción de conidios, cada cepa se inoculó por esparcido y quintuplicado en agar PDA a partir de cultivos monospóricos y se incubaron por 15 días en cada una de las condiciones de cultivo. Luego del periodo de incubación a cada placa se le agregó aproximadamente 9 mL de agua destilada estéril con Tween 80 (0.1 %) para permitir una suspensión del mayor número de conidios. La suspensión resultante se homogeneizó en un mezclador vortex, se diluyó (10-2 conidios mL-1) y se contaron los conidios en un hemocitómetro. Para la medición de la tasa de crecimiento de micelio, fragmentos del borde de colonias (5×5 mm) de un cultivo monospórico de 8 días de incubación, se inocularon por quintuplicado en el centro de la placa Petri (100 ×15 mm) con PDA y se incubaron en cada una de las condiciones de cultivo. El diámetro de la colonia de cada réplica se registró en mm cada 2 días, hasta cubrir toda la placa, con un periodo máximo de 25 días de incubación (Costa et al., 2021; Gerónimo-Torres et al., 2016). La germinación de conidios se evaluó inoculando 3 µL de suspensión de 10-2 conidios en medio PDA y se incubó por 24 h en condiciones óptimas y alta temperatura, se consideró germinada cuando el tubo germinativo tenía el doble del tamaño del conidio.
Efecto de B. bassiana en el crecimiento de plántulas de tomate
Se utilizaron plántulas de tomate (Solanum lycopersicum, cultivar ‘Gladiador’) de un mes desde la siembra. Las semillas se germinaron a 32 °C y luego se cultivaron en invernadero a 28 °C y 45 % de humedad relativa. Para aplicar los tratamientos, las plántulas se sembraron en macetas de 100 mL en un sustrato de tierra con abono orgánico. Para el tratamiento con Beauveria spp., se le aplicó a cada plántula (n= 53), por el método de drench, 10 mL de una suspensión de 106 conidios mL-1 en Tween 20 (0.1 %) de la cepa que mostró la mejor respuesta en la producción de conidios y en el crecimiento del micelio y se incubaron por 21 días en las condiciones de alta temperatura (tabla 3) en la cámara ambiental MLR-352H (Panasonic®). A la semana de incubación se realizó una segunda aplicación por aspersión foliar de 10 mL por plántula de la suspensión de conidios para procurar una distribución homogénea del hongo. Para el tratamiento control (n= 50), se siguió el mismo procedimiento aplicando agua destilada estéril y Tween 20 (0.1 %). La viabilidad de los conidios se determinó inoculando 3 µL de la suspensión en PDA e incubando a 25 °C por 24 h.
Después del periodo de incubación, se registró el desarrollo de las plántulas bajo los siguientes parámetros: número de hojas (NH), altura (A, cm), diámetro del tallo (D, mm), índice de esbeltez (IE, cm mm-1), masa seca de la raíz (MSR, g), masa seca aérea (MSA, g), masa seca total (MST, g), relación de masa de raíz (RMR: relación de MSR a MST, %), relación de masa aérea (RMA: relación de MSA a MST, %), relación de raíz a superficie (RRS: MSRrelación a MSA, g g-1) y tasa de crecimiento relativa (TCR, g g-1 día-1). El TCR se calculó con la siguiente fórmula:
TCR = (ln(MST 2 ) - ln(MST 1 ))/(t 2 - t 1 ) (ecuación 1),
donde MST1 y MST2 fueron MST inicial y final, respectivamente, y (t2 - t1) fue el tiempo de crecimiento. El MST inicial se midió 30 días después de la siembra, antes de aplicar el tratamiento a la plántula. Finalmente, se midió la masa foliar por área (MFA, kg m-2) y el contenido relativo de agua de la hoja (CRA, %) de tres discos de hoja por plántula (n= 10).
Análisis de datos
La producción de conidios de las cinco cepas de Beauveria spp. en condiciones óptimas y de alta temperatura se evaluó mediante Kruskal-Wallis y la prueba de diferencia mínima significativa (LSD). El crecimiento del área de micelio (MA) en condiciones óptimas y de alta temperatura se evaluó mediante el análisis de covarianza (ANCOVA), por el siguiente modelo:
μ ij = (μ+α i ) + (β + γ i ) ∙ x ij + ε ij (ecuación 2),
donde μij es MA para una muestra j de condición i, xij es el tiempo (covariable) para una muestra j de condición i, μ es el intercepto y β es la pendiente de la relación entre MA y el tiempo para la condición óptima; αi y γi son las diferencias en la intersección y la pendiente, respectivamente, entre las condiciones óptimas y de alta temperatura (i = 2), y εij es el error para la muestra j de la condición j. Se realizó una extrapolación para estimar el área de micelio a los 25 días para las cepas H-26 y H-31, pues presentaron un crecimiento que cubrió toda la placa, pero no fue posible medir su crecimiento final. Finalmente, el efecto de la cepa aplicada en las plántulas de tomate en condiciones de alta temperatura y control se evaluó mediante una prueba t-student o de Wilcoxon. Todos los análisis estadísticos se realizaron con el lenguaje de programación R, versión 3.6.1 (Equipo RCore, 2021) con un nivel de significación de α = 0.05.
Análisis y resultados
Identificación taxonómica
Todas las cepas fueron identificadas como Beauveria bassiana de linaje neotropical, excepto la cepa H-49 cuyo linaje es sudamericano (figura 2; relaciones de linaje según región intergénica Bloc en material suplementario).
Producción de conidios, crecimiento del micelio y germinación
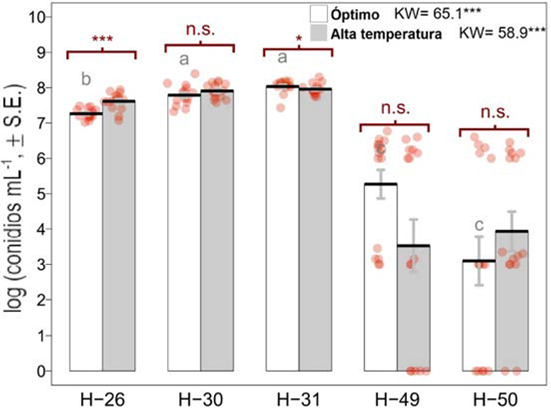
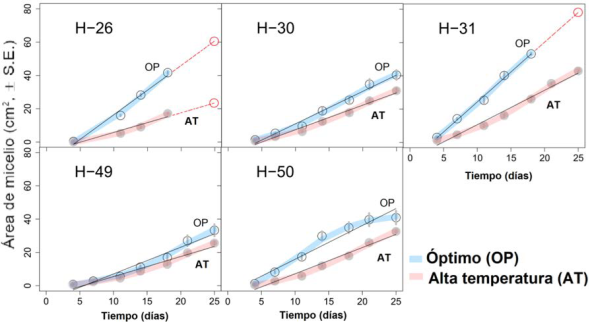
Las cepas H-30 y H-31 presentaron la mayor producción de conidios en ambas condiciones (óptima y alta temperatura, P<0.05; figura 3). Las cepas con los rendimientos más bajos en términos de producción de conidios fueron H-49 y H-50. En cuanto al desarrollo de micelio, todas las cepas en condiciones óptimas tuvieron la mayor tasa de crecimiento (P<0.01 análisis estadístico en material suplementario; figura 4), donde H-31 mostró la mayor tasa de crecimiento en ambas condiciones, con valores de 78.5 y 42.5 cm2 a los 25 días de incubación para condición óptima y alta temperatura, respectivamente. En cuanto a la germinación, para todas las cepas fue de 100 % luego de 8 h después de la inoculación.
Fuente: propia de la investigación
Figura 3 Comparación de la producción de conidios de 5 cepas de Beauveria bassiana (H-26, H-30, H-31, H-49 y H-50) bajo dos condiciones de temperatura: óptima y alta temperatura. Las letras iguales indican que no hay diferencia estadísticamente significativa entre las cepas para cada tratamiento (P>0.05, prueba de diferencia mínima significativa (LSD). El corchete indica la comparación entre condiciones de crecimiento para cada cepa mediante la prueba de Wilcoxon (α= 0.05). KW: Prueba de KruskalWallis; d.f.= 4, 70; *: P<0.05; ***: P<0.001, n. s.: no significativo; S. E.: error estándar.
Fuente: propia de la investigación.
Figura 4 Crecimiento del área de micelio por tiempo de incubación para cinco cepas de Beauveria bassiana (H-26, H-30, H-31, H-49 y H-50) en dos condiciones de crecimiento: óptimo y alta temperatura. La línea negra sólida muestra el ajuste del modelo de regresión lineal del área de crecimiento del micelio (R2>0.98). La línea roja punteada presenta el estimado para el mejor ajuste del modelo a 25 días para H-26 y H31. S. E.: error estándar.
Se ha documentado que B. bassiana puede crecer adecuadamente en temperaturas entre 25 y 30 °C; sin embargo, se ha reportado que conforme aumenta la temperatura, el rendimiento disminuye hasta el punto de detener el crecimiento a 35 °C (Alali et al., 2019). En el presente estudio las cepas probadas mostraron una mayor tolerancia al sobrevivir 7 h al día a temperaturas entre 31 y 35 °C durante 25 días, destacando a H-31 como la mejor cepa en cuanto a producción de conidios y crecimiento de micelio. Otros estudios han demostrado la supervivencia de B. bassiana hasta 45°C en una prueba de 2 h, y mortalidad a 46°C para una prueba de 6 h (Fernández et al., 2008). Al momento de causar la infección en insectos, las vías de propagación de los hongos son conidios, blastosporas y el micelio, esto debido a que estas estructuras aumentan la probabilidad de contacto (Wang et al., 2020). Se conoce que en condiciones de campo la exposición a altas temperaturas es uno de los factores de estrés más determinantes que podrían afectar negativamente la germinación y el crecimiento de estos biocontroladores (Fernández y Bittencourt, 2008), por lo que los resultados del presente estudio sobre el desarrollo de estas estructuras, demuestran que es viable obtener cepas autóctonas de B. bassiana con cualidades termo tolerantes para ser utilizadas en el control biológico de algunas plagas bajo altas temperaturas. Esto es útil para incentivar la aplicación en cultivos de zonas de clima tropical y también en escenarios de calentamiento global. Incluso, la temperatura fuera del óptimo podría estimular la producción de conidios, tal fue el comportamiento observado en las cepas H-26, H-30 y H-50.
Efecto de B. bassiana en el crecimiento de plántulas de tomate
De acuerdo con los resultados de producción de conidios y crecimiento de micelio en altas temperaturas, se utilizó la cepa H-31 para evaluar cambios en el desarrollo de plántulas de S. lycopersicum. A pesar de que no se presentaron cambios significativos en el desarrollo foliar (número y área), altura, diámetro y raíz y brote+hoja (tabla 4), se observaron cambios leves pero significativos en la partición de la raíz y la superficie (RMR, RMA y RRS), lo cual representa un ajuste marginal de +0.8 % entre el tratamiento H-31 y el control. Se destaca que el tratamiento donde se aplicó el hongo no mostró cambios físicos negativos visibles en las plántulas (coloración o deformación de hojas, brotes y raíces).
Raya-Díaz et al. (2017) encontraron que a mayor tiempo de exposición de este hongo (93 días después de la siembra), se obtuvo un incremento en la longitud total de las raíces al hacer las aplicaciones de hongo sobre semillas, sustrato y hojas en comparación con el control. Por su parte, Mantzoukas et al. (2021) también demostraron un aumento en el crecimiento de las raíces sin dañar la planta de ninguna manera y Kuzhuppillymyal-Prabhakarankutty et al. (2020) reportaron una mayor tolerancia a la sequía en el maíz con hasta un 63 % de recuperación del vigor 24 h después del riego tras 10 días de sequía. En el contexto de esta investigación, se plantea la hipótesis de que si se extiende el tiempo de exposición al hongo se obtendrán mayores efectos en el crecimiento de órganos como las raíces, con posibles beneficios como una mayor absorción de agua (resistencia a la sequía) y nutrientes (Tall y Meyling, 2018). Además, se podrían esperar efectos notables al conferir a las plantas resistencia a ciertas plagas en condiciones de campo (Russo et al., 2019).
Tabla 4 Efecto de la cepa de Beauveria bassiana H-31 en las características morfológicas de plántulas de Solanum lycopersicum (cultivar ‘Gladiator’; 21 días después de la inoculación)
| Variable (Abreviatura, unidad) | Control ( n = 50) | H-31 (n = 53) | t-student ( t ) oWilcoxon ( W ) | P |
|---|---|---|---|---|
| Número de hojas (NH) | 8.1 ± 0.22 | 8.6 ± 0.12 | 1070 W | n. s. |
| Masa foliar por área (MFA, kg m -2 ) § | 27.7 ± 0.64 | 26.9 ± 0.56 | 0.93 t | n. s. |
| Contenido relativo de agua de la hoja (CRA, %) § | 89.7 ± 0.2 | 90.4 ± 0.2 | -0.97 t | n. s. |
| Altura (A, cm) | 24.38 ± 0.53 | 25.48 ± 0.45 | -1.58 t | n. s. |
| Diámetro del tallo (D, mm) | 4.10 ± 0.05 | 4.07 ± 0.06 | 1283 W | n. s. |
| Índice de esbeltez (IE, cm mm -1 ) | 5.98 ± 0.14 | 6.30 ± 0.13 | -1.70 t | n. s. |
| Masa seca de la raíz (MSR, g) | 0.044 ± 0.002 | 0.044 ± 0.002 | -2.77 t | n. s. |
| Masa seca aérea (MSA, g) | 0.525 ± 0.016 | 0.564 ± 0.019 | -1.56 t | n. s. |
| Masa seca total (MST, g) | 0.561 ± 0.017 | 0.607 ± 0.020 | -1.75 t | n. s. |
| Relación de masa de raíz (RMR, %) | 6.4 ± 0.2 | 7.2 ± 0.3 | 882 W | * |
| Relación de masa aérea (RMA, %) | 93.6 ± 0.2 | 92.8 ± 0.3 | 1418 W | * |
| Relación raíz a superficie (RRS, g g -1 ) | 0.069 ± 0.003 | 0.078 ± 0.003 | 882 W | * |
| Tasa de crecimiento relativa (TCR, g g -1 dia -1 ) | 0.030 ± 0.001 | 0.033 ± 0.002 | -1.55 t | n. s. |
Media ± S. E.; *: P<0.05; n. s.: no significativo (P>0.05); tres discos de hoja por plántula n = 10.
Nota: fuente propia de la investigación.
En cuanto al efecto endófito de este hongo, se sabe que se ha logrado una colonización exitosa cuando se aplica la cepa a la semilla (43.34 % después de 60 días en Corchorus olitorius; Biswas et al. (2011)) y a la radícula (100 % después de 60 días en Theobroma cacao, Posada y Vega (2005)). Sin embargo, en algunos casos este hongo puede establecerse como endófito, pero sin persistir en el tiempo; la asociación podría ser incluso cepa-específica (Brownbridge et al., 2012). Para este estudio se plantea la hipótesis de que al inocular B. bassiana en plántulas de tomate no se evidenció una interacción significativa debido a que: i) requiere una etapa de inoculación más temprana en algunos momentos de desarrollo de la planta, es decir, radícula o semilla; ii) su establecimiento cesa poco tiempo después, o iii) la interacción del endófito es específica de la cepa.
Conclusiones
Se reporta por primera vez en Costa Rica un aislamiento de linaje sudamericano de B. bassiana, (cepa H-49), lo cual apoya la hipótesis de Castro et al. (2021) que la amplia diversidad y distribución de la especie en el mundo hace probable la existencia de estos linajes en el país y que estudios adicionales podrían incrementar estos reportes. Se destaca el potencial de crecimiento y producción de conidias de la cepa H-31 bajo condiciones de estrés de temperatura. Además, aunque la cepa H-31 no evidenció efectos estimulantes en el desarrollo de plántulas de tomate, tampoco ocasionó efectos negativos. Por lo anterior, la cepa H-31 podría ser aplicada de forma segura para el control de plagas a las concentraciones utilizadas en este estudio; en zonas de clima tropical y en escenarios de calentamiento global.
Los métodos más sostenibles para el manejo de plagas y los promotores del crecimiento a base de hongos no siempre son fácilmente aceptados por agricultores, por lo que es necesario realizar ensayos adicionales en invernadero y campo en seguimiento a este estudio. También es recomendable medir la patogenicidad de la cepa H-31 en los insectos que afectan al tomate y evaluar el efecto de la radiación ultravioleta en la germinación y producción de conidias. Finalmente, aunque no se encontraron cepas con potencial endófito en este estudio, es importante promover la bioprospección de microorganismos con esta y otras características benéficas, ya que los efectos protectores ante enfermedades y plagas podrían mejorar el desarrollo e impactar la productividad de la planta.
















