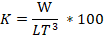INTRODUCCIÓN
El pargo manchado Lutjanus guttatus (Steindachner, 1869) es considerado uno de los principales candidatos para el desarrollo de la piscicultura marina comercial en la costa pacífica tropical y subtropical de América Latina, gracias a que se distribuye desde el Golfo de California hasta Perú y a que cuenta con un mercado de exportación hacia EE.UU (Chacón-Guzmán, Carvajal-Oses, Herrera-Ulloa & Pauletto, 2019a; Chacón-Guzmán, Carvajal-Oses, Toledo-Agüero & Flores-Gatica, 2020; Fischer et al.,1995; Herrera-Ulloa, Chacón-Guzmán, Zúñiga-Calero, Fajardo-Espinoza & Jiménez-Montealegre, 2009).
Los estudios para determinar su biotecnología de cultivo se han desarrollado especialmente en Costa Rica y México, aunque otros países como Colombia y Panamá también han realizado investigaciones con el fin de mejorar su producción en cautiverio (Abdo-de-la-Parra, Rodríguez-Ibarra, Rodríguez-Montes de Oca, Velasco-Blanco e Ibarra-Castro, 2015). Los primeros estudios con juveniles salvajes demostraron su factibilidad de crecimiento y sobrevivencia en jaulas flotantes a finales de la década de los noventa (Gutiérrez-Vargas & Durán-Delgado, 1998). Las investigaciones realizadas tanto con desoves inducidos con hormonas como espontáneos han permitido estudiar aspectos reproductivos de la especie (Abdo-de-la-Parra et al., 2015; Álvarez-Lajonchére et al., 2012; Ibarra-Castro & Duncan, 2007).
El escalamiento productivo que condujo al establecimiento de la base tecnológica de producción del pargo manchado L. guttatus en Costa Rica fue desarrollado a partir del año 2002 por el Parque Marino del Pacífico (PMP). Las producciones de juveniles iniciaron entre 2005 y 2006 con 45 000 mil juveniles en total, los que permitieron implementar la primera granja de cultivo comercial en jaulas flotantes de pequeña escala manejada por pescadores artesanales. En 2007 se liberaron 71 000 juveniles en el Refugio de Vida Silvestre Isla San Lucas y a partir del 2008 se iniciaron los procesos de venta de juveniles (117 000 individuos) y transferencia de la tecnología base a la primera empresa privada de gran escala, quienes en los siguientes años construyeron su propio centro de producción de juveniles y realizaron exitosamente sus primeras exportaciones a los Estados Unidos ( Chacón-Guzmán et al., 2019b, 2020; Herrera-Ulloa et al., 2009; Herrera-Ulloa, Chacón-Guzmán, Zúñiga-Calero, Fajardo-Espinoza & Jiménez-Montealegre, 2010; Velarde et al., 2012). En 2018, Costa Rica registró una producción de pargo de 600 toneladas métricas (Instituto Costarricense de Pesca y Acuicultura & Secretaría Ejecutiva de Planificación Sectorial Agropecuaria, 2019). El escalamiento productivo desarrollado tanto en Costa Rica como en México ha permitido implementar las investigaciones hacia la mejora de los procesos de cultivo en jaulas flotantes (Castillo-Vargasmachuca, Ponce-Pelafox, Rodríguez-Domínguez & Aragón-Noriega, 2016; Hernández et al., 2014; Hernández et al., 2016; Martínez-Cordero, Sánchez-Zazueta & Hernández, 2017; Mazón-Suástegui et al., 2016; Peña, Hernández, Ibarra-Castro & Álvarez-González, 2017).
Sin embargo, la fase larvaria del cultivo de peces ha representado un cuello de botella tecnológico para las especies que se han deseado cultivar (Tovar-Ramírez et al., 2017). Por ello, es necesario mejorar continuamente las metodologías de producción de peces marinos tales como reproducción, nutrición, bioseguridad y el manejo general de los cultivos larvales.
El PMP como centro para la investigación y desarrollo de biotecnologías de cultivo de especies marinas de Costa Rica ha mejorado a través de los años los procedimientos de producción de juveniles. En este contexto, este trabajo tuvo como objetivo evaluar la producción de juveniles de tres cultivos larvales de L. guttatus obtenidos de desoves naturales de reproductores F2.
METODOLOGÍA
La investigación se realizó en el Laboratorio de Acuicultura y Biotecnología Marina del Parque Marino del Pacifico (PMP), Puntarenas, Costa Rica.
Desove, incubación y siembra
Tres desoves se obtuvieron de forma natural y espontánea de tres familias de reproductores F2; n = 8 c/u; 1,45±0,21; 1,33±0,12; y 1,28±0,10 kg (peso promedio ± D.E.). Los reproductores se seleccionaron de la granja de cultivo de la Asociación de Acuicultores de Paquera (ASAP), ubicada en el Golfo de Nicoya (9°48′N 84°48′O), los peces se marcaron por medio de sistemas de identificación de radiofrecuencia y fueron aclimatados en salas bajo techo con luz tenue y natural (fotoperiodo natural ≈ 12 horas luz/oscuridad). Luego de tres meses de aclimatación iniciaron los desoves naturales en tanques circulares de fibra de vidrio de 20 m3, provistos de un sistema de recirculación (doble UV-65 watts, fraccionador de espuma RK2, filtro biológico y filtro mecánico) con un recambio de 8,6 volúmenes/día y una reposición diaria del 5 % con agua nueva filtrada a 5µm e irradiada (UV-128 watts). Los reproductores se alimentaron entre las 3:00 y 5:00 p.m., cinco días a la semana con calamar (Illex argentinus 40 %), sardina (Opisthonema libertate 40 %) y camarón (Protrachynemme precipua 20 %). La relación macho hembra en cada tanque fue 1:1.
Los desoves se presentaron entre las 03:00 y 05:00 a.m. Los huevos boyantes fertilizados fueron desviados a través de un tubo lateral y superficial a un tanque cosechador de 150 l con un tamiz central de drenaje de 500 µm, 9 horas después fueron colectados y contados cada uno en una probeta de vidrio graduada de 1 l. Los huevos se contaron por el método de desplazamiento volumétrico, luego de introducirlos se esperaron cinco minutos para que los huevos flotantes se separaran de los no flotantes. Para determinar cuántos huevos flotantes había por ml se contabilizaron cinco muestras de un ml. El total de huevos, flotantes y no flotantes, se determinó multiplicando la cantidad de huevos de cada ml por el total de ml obtenidos en la columna de la probeta.
De la columna de huevos flotantes se tomaron tres muestras (n=30) y se revisaron en el microscopio, para determinar el diámetro del huevo y su gota de aceite, así como, el porcentaje de viabilidad, definida en base a los criterios establecidos por Silva & Castelló (2005).
Los huevos fueron incubados a una densidad promedio de 520 huevos ml-1 en tanques cónicos de 250 l con agua de mar filtrada a cinco µm e irradiada (UV-128 watts). El recambio de agua durante la incubación fue de 9 l min-1, con aireación moderada. Las incubadoras contaron con un tamiz central de drenaje de 150 µm.
Entre las 17 y 19 h después del desove (hdd) los huevos eclosionaron, a una temperatura entre 27, 8 y 28,0 °C. Una hora después se detuvo el recambio y la aireación y se procedió a mover el agua circularmente hasta formar un efecto vortex, los restos de corion y huevos no eclosionados se concentraron en el centro inferior del tanque de donde fueron extraídos por sifón.
Para determinar el porcentaje de eclosión, se tomaron cinco muestras de un litro con un beaker graduado, el contenido se vació sobre una malla de 100 µm y se procedió a contar las larvas eclosionadas. La siembra de las larvas se realizó por gravedad utilizando un tubo de una pulgada de diámetro. Los tanques de cultivo larval con un volumen total de 7 m3 se ubicaron bajo una malla sombra (sarán) con una penetración de luz del 20 %, contaron con un fraccionador de espuma de superficie y cinco piedras difusoras para proveer la aireación. La altura de la columna del agua fue de 0,90 m y el volumen del agua se mantuvo constante en 5 m3, el recambio por flujo continuo aumentó paulatinamente con los días de cultivo (Figura 1).
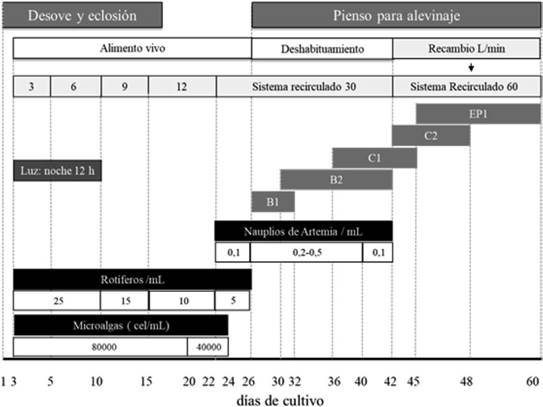
Figura 1 Alimentación, recambio de agua y luz artificial (día 3 al 10) aplicada en el proceso de producción de juveniles de L. gutattus en el Parque Marino del Pacífico. Donde B1 (250-260 µm), B2 (360-650 µm), C1 (580-840 µm), C2(840-1410 µm) Y EP1 (1,7 mm) corresponde a tamaños del alimento formulado.
Levante larval
Se utilizó una densidad de cultivo similar para los tres tanques, la cual correspondió a 90 mil larvas aproximadamente. La alimentación se basó en la aplicación de microalgas marinas Nannochloropsis oculata, rotíferos Brachionus plicatilis, nauplios de Artemia sp. y alimento formulado (Figura 1).
Las microalgas fueron producidas por medio de un fotobiorreactor tubular helicoidal (Uribe & Rangel, 2004), utilizando el medio nutritivo f/2 de (Guillard, 1975). Los medios de cultivo se mantuvieron a una salinidad de 31 PSU y fueron producidos en el cepario del laboratorio del PMP en el cual la temperatura se mantuvo en 27±1 °C. Para facilitar el almacenaje en cámaras de refrigeración a 5 °C, las microalgas fueron inducidas a la floculación por medio del protocolo de Rojo-Cebreros et al. (2016) y cuando fueron requeridas para su utilización, el alga floculada se vertió en envases con cinco litros de agua de mar y se procedió a la desfloculación por medio de la aplicación de dióxido de carbono durante 5 minutos a un flujo de 5 l min-1.
Los rotíferos fueron producidos con un sistema intensivo basado en el protocolo de Carvajal-Oses, Campos-Rodríguez & Herrera-Ulloa (2016). Los cultivos se mantuvieron a 31 PSU y a una temperatura promedio de 29,50+0,20 °C. El enriquecimiento se realizó 12 horas antes de realizar la alimentación a las larvas y se basó en la fórmula utilizada por Benetti et al. (2008). Para entregar la cantidad necesaria de enriquecimiento a los rotíferos se utilizó la fórmula de Suantika, Dhert, Nurhudah & Sorgeloos (2000):
CHS=0,027D 0, 415 V Donde: CHS= total de alimento (gramos) D= densidad de rotíferos ml-1 V= volumen
Los rotíferos se cosecharon en una malla de 50 µm, se lavaron con abundante agua de mar filtrada a 5µm e irradiada (UV-128 watts) y finalmente se mantuvieron en una hielera con temperatura aproximada de 10 oC para su posterior utilización como alimento.
La artemia se enriqueció durante 12 h en tanques cónicos de fibra de vidrio de 500 l. Al igual que con los rotíferos, para el enriquecimiento se utilizó el producto comercial DHA-Selco® de INVE Aquacuture, Bélgica. La dieta de enriquecimiento estuvo basada en la receta de Benetti et al. (2008); y fue entregada a la artemia a una tasa de 0,3 g / 106 artemia. La artemia fue cosechada en una malla de 150 μm y lavada durante 30 a 45 minutos con agua de mar filtrada a 5 µm e irradiada. La artemia cosechada se almacenó en hieleras a una temperatura de 10 °C para su posterior entrega a las larvas.
La primera alimentación de las larvas al momento de la apertura de su boca, basada en microalgas y rotíferos, se ofreció a las 58 horas después del desove (hdd), antes de la pigmentación de los ojos. Durante el cultivo, entre 6:00-7:00 a.m. y 2:00-3:00 p.m., se aplicaron 5 litros de Nanochloropsis sp. 25x107 cel ml-1, junto con las microalgas se adicionaron, rotíferos Brachionus plicat ilis, disminuyendo progresivamente de 20 a 5 rotíferos ml-1 a lo largo del periodo, nauplios de artemia entre una y seis veces por día y entre 0,1 y 0,5 nauplios ml-1. Para el deshabituamiento alimenticio se aplicó pienso en distintos calibres (≤360 µm, 360-650 µm, 580-840 µm, 840-1,410 µm y 1,5 mm). Se aplicó entre 20 y 30 minutos antes de cada alimentación con nauplios de artemia (Figura 1).
Día por medio (un día sí y un día no) y durante el primer periodo de cultivo (26 días) se midió la longitud total (Lt) de las larvas (n=15), inicialmente con un microscopio con lente micrómetro con escala de menor división de 25 micras y luego con una regla de 10 cm graduada en mm. A partir del día 29 y hasta el 60, además de obtener su Lt, las larvas se pesaron por medio de una balanza digital con una precisión de ±0,01 g. Se determinaron los siguientes índices de crecimiento:
Tasa de crecimiento absoluto en peso:
Tasa específica de crecimiento en peso:
Tasa de crecimiento absoluto en longitud:
Tasa específica de crecimiento en longitud:
Donde, Pf= peso total promedio final (g). Pi= peso promedio inicial (g). Lf= longitud total promedio final (mm). Li= longitud promedio inicial (mm). T = número de días del período. Ln = Logaritmo natural.
Con el peso final W y la longitud total final Lt se determinó el factor de condición (K), según Froese (2006):
La sobrevivencia fue monitoreada en cinco diferentes etapas a partir del inicio del cultivo larval: a) a los tres días posteriores a la siembra; b) a los ocho días (fin de periodo de mayor mortalidad), c) a los 26 días (inicio del deshabituamiento alimenticio d) 42 días (final del deshabituamiento alimenticio) y e) a los 60 días (cosecha para traslado a las granjas de cultivo). Se bajó el nivel de agua de los tanques a 1000 l, se aplicó 5 ml de aceite de clavo de olor diluido (2-methoxy-4-2-(2-propenyl)-phenol) para generar un efecto tranquilizante en las larvas y se procedió por medio de redes de mano (cachadores) a concentrarlas y contarlas en grupos de 100 ejemplares.
A los 17 días se inició la fase de separación de larvas para evitar el canibalismo. Del día 17 al 26 las larvas más grandes se capturaron con redes de mano y se trasladaron individualmente por medio de beakers de 2 litros de volumen a un tanque de 1,5 m3. En el día 27 todos los tanques se separaron en tres tallas (Small, Medium y Large). A partir de este momento los levantes larvales se unieron por talla en tres tanques de 10 m3 provistos con un sistema de recirculación (UV-65 watts, fraccionador de espuma, filtro biológico y filtro mecánico). Las larvas previamente separadas en el tanque de 1,5 m3 fueron adicionadas al tanque con larvas L.
La cosecha de los juveniles de cada tanque se realizó a los 60 días. Los juveniles se anestesiaron con 15 ppm de aceite de esencia de clavo de olor, se contaron uno a uno y se trasladaron en tanques transportadores de 500 l con 8 mg l-1 de oxígeno para el transporte hasta una granja de cultivo ubicada a 8,6 millas náuticas en el Golfo de Nicoya. Durante el conteo de cada tanque se tomó una muestra al azar de 300 juveniles, se anestesiaron con 20 ppm de aceite de clavo, se pesaron para determinar el peso promedio y se observaron detenidamente para determinar malformaciones físicas, el resultado se extrapoló a la población total.
Durante todo el periodo de producción se monitoreó el oxígeno disuelto (mg l-1), la salinidad (PSU) y la temperatura (ºC).
Se analizó la normalidad y homocestacidad de los datos obtenidos. Se aplicó un análisis de varianza de una vía ANDEVA para determinar diferencias estadísticamente significativas entre las variables analizadas y se efectuaron con el programa Info Stat versión 2011 (Di-Rienzo et al., 2011). El crecimiento (mm) hasta el día 26, así como la Lt (mm) del día 26 al 60 de las larvas de cada cultivo fueron graficados en función del tiempo mediante hoja de cálculo Excel®.
Desoves espontáneos naturales e incubación
Con una salinidad de 30 PSU, temperatura de 28,9 °C y oxígeno disuelto de 6,1 mg l-1, se obtuvo un total de 514 000 huevos provenientes de tres familias de reproductores F2.
No se presentaron diferencias significativas (p≥0,05) entre la viabilidad y diámetro de los huevos de los tres desoves, ni entre los porcentajes de eclosión (Tabla 1).
Tabla 1: Características de los desoves y huevos, densidad de siembra y talla inicial de las larvas de L. guttatus
| Familia 1 | Familia 2 | Familia 3 | Promedio general | p | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| % | % | % | % | |||||||
| Desove | 198 000 | 145 000 | 171 000 | |||||||
| Huevos viables | 181 000 | 91,4 | 134 000 | 92,4 | 156 000 | 91,2 | 91,7 | ≥0,05 | ||
| Huevos malos | 17 000 | 8,6 | 11 000 | 7,6 | 15 000 | 8,8 | 8,3 | |||
| Huevos incubados | 100 000 | 100 000 | 100 000 | |||||||
| Eclosión | 89 000 | 89 | 89 500 | 89,5 | 93 100 | 93,1 | 90,5 | ≥0,05 | ||
| Diámetro del huevo (µm) | 756,3±10,1 | 752±7,5 | 752±7,5 | ≥0,05 | ||||||
| Densidad de siembra (larvas l-1) | 17,8 | 17,9 | 18,62 | |||||||
| Lt post eclosión (mm) | 2,25±0,04 | 2,25±0,03 | 2,25±0,04 | |||||||
Nota: Fuente propia de la investigación.
Cultivo larval
Los parámetros físico químicos promedio obtenidos en el periodo de larvicultura y alevinaje fueron 6,67±0,71 mg l-1 de oxígeno disuelto, 28,23±0,88 ºC de temperatura y 27,8±3,1 PSU de salinidad.
La densidad de siembra fue similar entre los tres cultivos larvales, varió en 0,82 larvas l-1 (rango entre 17,8 y 18,62), mientras que el promedio de la longitud total inicial de la larva fue de 2,25 mm sin diferencias significativas (p≥0,05) entre los tres cultivos larvales (Tabla 1).
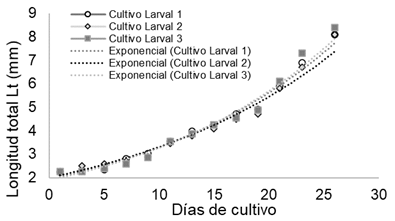
El crecimiento fue exponencial y presentó un comportamiento similar entre los tres cultivos larvales en la primera etapa del cultivo (26 días) (Figura 2). A los 26 días en promedio las larvas alcanzaron solamente 8,2±0,17 mm de longitud total. La TCA (Lt) promedio alcanzado en este periodo fue de 0,23 mm d-1 y la TCE (para Lt) de 4,97 % d-1. No se presentaron diferencias significativas (p>0,05 %) entre el crecimiento (Lt) de los tres cultivos en los primeros 26 días.
Nota: Fuente propia de la investigación.
Figura 2 Crecimiento en longitud (mm) de larvas de Lutjanus guttatus hasta los 26 días del cultivo posteclosión.
En el crecimiento de cada grupo de larvas, luego de su separación por tallas, al final del periodo se observó una leve tendencia a incrementar la diferencia de longitudes entre tallas separadas pasando de 8,61 mm a los 29 días a 15,10 mm a los 60 días (Figura 3).
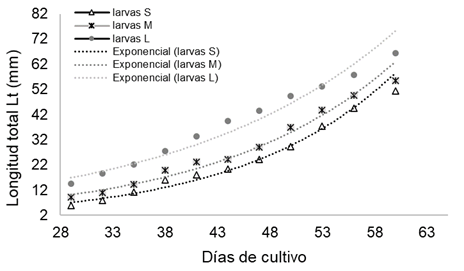
Nota: Fuente propia de la investigación.
Figura 3 Crecimiento individual y promedio de las tres tallas (S, M, L) obtenidas de la separación de los cultivos larvales de L. guttatus hasta la cosecha.
El crecimiento promedio de las larvas durante el periodo de estudio fue exponencial (Figura 4). En promedio las larvas alcanzaron a los 60 días 57,8±7,82 mm de longitud total. La TCA (para Lt) promedio de todo el periodo fue de 0,93 mm d-1 y la TCE de 5,41 % d-1. El factor de condición K promedio obtenido al final del periodo de cultivo fue de 1,089.
La TCA en peso (g) obtenida de cada grupo de larvas separadas por talla entre los 29 y 60 días fue: talla (S)= 0,05 g día-1; talla (M) = 0,07 g día-1; talla (L) = 0,08 g día-1. La TCE: talla (S)= 17,3 % d-1; talla (M)= 14,5 % d-1; talla (L)= 12,0 % d-1. La TCA y TCE en peso promedio fue de 0,06 g día-1 y 16,9 % d-1.
La sobrevivencia fue monitoreada en dos etapas (Tabla 2), en la primera etapa (26 días) se da el mayor porcentaje de mortalidad promedio 88,1 %. En la segunda etapa (27-60 días) luego de la separación de tallas y cultivo en sistemas de recirculación (RAS), la mortalidad bajó en comparación con la primera fase del cultivo, con una mortalidad de 3,5 %.
Tabla 2: Sobrevivencia monitoreada en el cultivo larval de L. guttatus antes y después de la separación por tallas
| Día | Familia 1 | Familia 2 | Familia 3 | |||||
| % | Número de larvas | % | Número de larvas | % | Número de larvas | Número larvas total | %Número larvas total | |
| 3* | 100 | 89 000 | 100 | 89 500 | 100 | 93 100 | 271 600 | 100 |
| 8 | 29 | 25 810 | 25 | 22 375 | 14 | 13 034 | 61 219 | 22,5 |
| 26 | 17 | 15 130 | 12 | 10 740 | 7 | 6 517 | 32 387 | 11,9 |
| Día | Tanque 4 (larvas S) | Tanque 5 (larvas M) | Tanque 6 (larvas L) | %Número larvas total | ||||
| % | Número de larvas | % | Número de larvas | % | Número de larvas | Número larvas total | %Número larvas total | |
| 26 | 100 | 10 040** | 100 | 14 574** | 100 | 7 773** | 32 387 | 11,9 |
| 42 | 74 | 7 430 | 79 | 11 513 | 93 | 7 229 | 26 171 | 9,6 |
| 60 | 71 | 7 128 | 75 | 8 635 | 91 | 7 073 | 22 837 | 8,4 |
*Día de la siembra
** Porcentaje de larvas separadas por talla a los 26 días (31 % S, 45 %, M y 24 % L).
Nota: Fuente propia de la investigación.
En la cosecha se determinó alta variabilidad de tallas; 31,2 % de las larvas fueron pequeñas (S) ≤1,4 g; 37,8 % presentaron una talla media (M) entre ≥1,5 g y ≤2 g y el 31 % presentaron una talla grande (L) ≥2,1 g.
A los 60 días se presentó un 6,3 % de juveniles con algún tipo de deformidad observable como deformación del opérculo, mandíbula, lordosis y escoliosis (Tabla 3). La talla con mayor porcentaje de deformidad promedio fue la talla S con 8 % y la de menor porcentaje la talla L con 5,3 %.
Tabla 3: Porcentajes por tipo de deformidad obtenidos de las muestras de cosecha de los juveniles de L. guttatus cultivados en el PMP
| S | M | L | |||||||
|---|---|---|---|---|---|---|---|---|---|
| N | 7128 | 8635 | 7073 | ||||||
| n | 300 | % | 300 | % | 300 | % | # Promedio | % Promedio | |
| Opérculo | 18 | 6 | 16 | 5,3 | 14 | 4,7 | 16 | 5,3 | |
| Lordosis | 1 | 0,3 | 0 | 0 | 0 | 0 | 0,3 | 0,1 | |
| Escoliosis | 2 | 0,7 | 0 | 0 | 1 | 0,3 | 1 | 0,3 | |
| Boca | 3 | 1 | 1 | 0,3 | 1 | 0,3 | 1,7 | 0,6 | |
| Total | 24 | 8 | 17 | 5,7 | 16 | 5,3 | 19 | 6,3 | |
Nota: Fuente propia de la investigación.
DISCUSION
La temperatura, salinidad y el oxígeno disuelto se mantuvieron estables y semejantes a las encontradas en la parte externa del Golfo de Nicoya (García-Rojas, Vega-Bolaños, & Quesada-Phillips, 2017). Estos datos difieren a los reportadas por Álvarez-Lajonchére et al. (2012) para la producción larval de la misma especie; temperatura 26 ± 1,0 °C; salinidad 35 ± 1,0 g l-1; oxígeno disuelto 5,1 ± 0,6 mg l-1. En este trabajo las variables físico químicas fueron propicias para lograr desoves de buena calidad, según los estándares descritos por Silva & Castelló (2005) y adecuadas para los cultivos larvales y producción de juveniles.
Los reproductores de L. guttatus F2 alcanzaron puestas naturales luego de tres meses de su traslado de la granja a las instalaciones del PMP, un tiempo menor en comparación con los 12-13 meses descritos por Ibarra-Castro, García-Aguilar, Abdo de la Parra & Rodríguez-Ibarra (2012) para alcanzar la madurez sexual con adultos salvajes de la misma especie. Los reproductores F2 seleccionados de granjas de cultivo se adaptan fácilmente a las condiciones de reproducción en cautiverio, lo cual contribuye a que el proceso de producción de huevos sea eficiente en términos de tiempo y economía.
La relación sexual fue efectiva para obtener puestas de buena calidad, a pesar de que para estos estudios generalmente se utiliza una relación sexual macho hembra de 2:1 (Abdo-de la Parra et al., 2015). La relación sexual 1:1 ha sido empleada en el PMP con el objetivo de lograr una mayor disponibilidad de ovocitos maduros por tanque en los periodos de alta demanda de juveniles para el cultivo en granjas marinas.
Valores altos en viabilidad y eclosión de los huevos, como los obtenidos en este trabajo, han sido considerados por Bromage et al. (1992) como factores de buena calidad del huevo. Gutiérrez-Sigeros, Ibarra- Castro & Álvarez-Lajonchére (2018), con Ocyurus chrysurus, obtuvieron adecuados desarrollos larvales con 87,3 % de huevos flotantes de los cuales el 90 % eran transparentes con embriones vivos.
El diámetro del huevo, la longitud inicial de la larva y el porcentaje de eclosión se encontraron dentro del rango de valores normales reportados para la especie por varias investigaciones (rango del diámetro del huevo 650 a 900 μm; longitud total entre 2,1 y 2,7 mm; eclosión ≥80 %), mientras que el porcentaje de fecundación estuvo por encima del rango del 90 % (Abdo-de-la-Parra et al., 2015).
En condiciones normales y con buena calidad de huevos se esperan eclosiones superiores al 80 % (Silva & Castelló, 2005). El promedio de eclosión superó este valor por 10,5 %. Respecto a otras especies del mismo género fue superior al reportado por Papanikos, Phelps, Ferry & Maus (2003) para Lutjanus campechanus (83,6±9,5 %) y por Hamamoto et al. (1992) para el Lutjanus stellatus (80 %) y para la misma especie superior a reportados por (Herrera-Ulloa et al., 2009) (85 %) y similar al reportado por (Álvarez-Lajonchère et al., 2012) (90,2±2,1 %). La ausencia de diferencias estadísticamente significativas en viabilidad, diámetro de los huevos y porcentaje de eclosión demostró que las condiciones de cultivo y alimentación de reproductores fueron similares y propicias para los tres desoves y su respectiva incubación, lo que permitió continuar con la fase de cultivo larval.
La densidad de siembra empleada en el cultivo larval (17,8-18.62 larvas/l-1) se mantuvo dentro del rango descrito por Abdo-de-la-Parra et al. (2010) como un rango de densidad que no afecta negativamente el crecimiento y la sobrevivencia larval de la especie.
La ausencia de diferencias significativas (p≥0,05) entre los valores de crecimiento en los primeros 26 días demostró homogeneidad en las condiciones de cultivo y crecimiento en las larvas provenientes de los tres desoves.
Las talla promedio obtenida a los 26 días (8,2 mm) fue inferior a la reportada por Boza-Abarca, Calvo-Vargas, Solís-Ortíz & Komen (2008) a los 25 días (10,23 mm), pero similar a las descrita por Álvarez-Lajonchére et al. (2012) a los 25 días (8 mm). En este trabajo, el crecimiento larval se incrementó luego de la aplicación de los nauplios de artemia y en especial con la separación de tallas desde los 26 hasta los 60 días para alcanzar una talla levemente superior de 57,8 mm a la reportada para la misma especie por Álvarez-Lajonchére et al. (2012) (55 mm). A la misma conclusión llegaron García-Ortega et al. (2005), quienes también reportaron un aumento en el crecimiento de las larvas a partir de la alimentación con nauplios de artemia.
En comparación con otras investigaciones de la misma especie, durante los primeros 26 días, se presentaron leves diferencias en los valores de crecimiento. La TCA (0,23 mm día-1), fue superior a la obtenida por Álvarez-Lajonchére et al. (2012) a los 25 días (0,22 mm día-1) e inferior a la reportada por Boza-Abarca et al. (2008) (0,243 mm día-1). El peso final promedio alcanzado a los 60 días (1,90±0,90 g), aunque inferior al reportado por Álvarez-Lajonchére et al. (2012) (2,24±0,04 g), se considera adecuado para iniciar el traslado a las granjas de cultivo. En comparación con otras especies de pargo, el crecimiento en la etapa larval en esta especie tiende a ser inferior (Emata, Eullaran & Bagarinao, 1994; Ogle & Lotz, 2011). El factor de condición fue inferior al reportado por Álvarez-Lajonchére et al. (2012) aunque se encuentra dentro del intervalo de los datos reportados para peces marinos (Moretti, Fernández-Criado & Guidastri, 1999).
Un alto porcentaje de larvas durante los días 3-4 ddd no presentaron alimento en su sistema digestivo, lo que es considerado como principal causante del 77,5 % de mortalidad medido a los ocho días de cultivo larval. En Colombia se registró 85 % de mortalidad a los cinco días después de la eclosión y se asumió la pérdida por la misma situación (Sierra-de-la-Rosa, 2007). Una probable causa es que la boca del L. guttatus es muy pequeña para su presa (0,105±0,010 mm, n=100) (Boza-Abarca et al., 2008), ya que los rotíferos adultos de B. plicatilis cultivados en el PMP presentaron tallas promedio de 163,17±31,85 mm de longitud y 127,88±32,46 mm de ancho. Para minimizar el problema se optó por un sistema de cultivo de agua verde en los primeros días (Liao, Su & Chang, 2001; Naas, Naes & Harboe, 1992; Palmer, Burque, Palmer & Burke, 2007). Este sistema permitió la reproducción de los rotíferos en el tanque de cultivo larval y, por ende, mayor disponibilidad de juveniles de rotíferos con tallas aproximadas a los 75 µm, lo que aumenta el porcentaje de captura e ingestión de las larvas.
Una de las principales causas de mortalidad, después del día 20, en este tipo de larvas se debe al canibalismo (Hecht & Piennar, 1993; Ibarra-Castro, Gutiérrez-Sigeros, Álvarez-Lajonchére, Durryty-Lagunes & Sánchez-Zamora, 2015). Se infiere que el segundo periodo de mortalidad monitoreado a los 26 días del cultivo larval (25 %) pudo estar relacionado en un alto porcentaje al canibalismo, el cual fue evidente a partir del día 14 y acentuado a partir del día 25; por lo que se optó por la separación de tallas a los 26 días. La separación de tallas al día 26 podría ser un factor que, además de influir en el crecimiento de las larvas de L. guttatus, contribuye en la disminución del canibalismo.
La diferenciación natural de tallas y la aplicación de una ración de alimento por debajo de la adecuada permiten el aumento en la frecuencia de ataques de canibalismo (Baras & Jobling, 2002; Qin & Fast, 1996), por ello, es necesaria la observación constante del cultivo larval de L. guttatus a partir del día 14-15 días, para identificar el inicio del canibalismo, así como un monitoreo constante del alimento sobrante en el tanque y el consumido por las larvas. En consecuencia con los sugerido por Rosenlund, Stoss & Talbot (1997), se recomienda el suministro temprano del alimento artificial junto con el alimento vivo, por lo que es importante conocer cómo se desarrolla su sistema digestivo.
La variabilidad de tallas obtenida en la cosecha (sesenta días) fue similar a otras especies de peces marinos (Hecht & Piennar, 1993; Moretti et al., 1999), y se considera al canibalismo un factor causal en la diferencias de tallas (Hecht & Piennar, 1993).
Ambos aspectos explican la diferencia de tallas en esta especie. Silva & Oliva (2010) reportaron que en el lenguado chileno Paralichthys adspersus, a los 60 días, un 67 % de individuos alcanza tallas cercanas a los 15 mm y un 33 % a los 20 mm., mientras que Ibarra-Castro et al. (2015) reportaron diferencias mayores al 50 % en la corvina Cynoscion nebulosus. La separación por tallas efectuada a partir de los 26 días, aunque no forma parte del objetivo principal del trabajo, contribuyó en la fase final de cosecha y entrega de los peces a la granja; ya que permitió cosechar solo el tanque con la talla adecuada, así como, llevar el control de la cantidad disponible para entrega.
La mayoría de las deformaciones esqueléticas genéticas en peces aparecen en las etapas de larvas y juveniles; son de considerable interés, debido a que reducen la sobrevivencia larvaria y el crecimiento de los peces en los laboratorios, y en las granjas de engorde los peces deformes deben ser descartados o vendidos a un menor precio (Gisbert, Fernández & Estévez, 2008). El 6,43 % de las deformidades esqueléticas observadas se consideran bajas en comparación con otros peces marinos (entre 15 y 50 %) (Boglione et al., 2001); sin embargo, es posible que aumente, si se aplican metodologías de doble tinción para análisis esqueléticos que permiten transparentar los tejidos de las larvas y evidenciar malformaciones óseas en cráneo, columna y complejo caudal, entre otros (Gisbert, Alcaraz, Tovar-Ramírez & Álvarez-González, 2014).
La principal deformidad presentada correspondió a una formación incompleta del opérculo (5,3 % del total de la población), que fue considerada por Moretti et al. (1999) como la menos perjudicial, e indica que una incidencia menor al 10 % es aceptable. Esta deformidad se atribuye entre otros aspectos a deficiencias de vitamina C (Planas & Cunha, 1999); no obstante, Gisbert et al. (2008) explican que es difícil determinar, en muchos casos, el origen de una malformación y que puede deberse a muchos factores.
En comparación con trabajos similares la sobrevivencia final promedio de los tres desoves 8,4 % a los 60 días, fue inferior la descrita por Álvarez-Lajonchére et al. (2012) en la misma cantidad de días de cultivo (12,1±1,1 %) y superior a la reportada por Boza-Abarca et al. (2008) (1,5 % - 171 días) y Sierrra-de-la-Rosa (2007) (1,8 % - 44 dpe). El 8,4 % de sobrevivencia se considera adecuado para la producción preindustrial (piloto) de la especie.
CONCLUSIÓN
Costa Rica, con sus investigaciones en instituciones como el Parque Marino del Pacífico, ha logrado mejorar la biotecnología de producción de la especie. Se ha conseguido la reproducción de ejemplares adultos F2, se han aplicado metodologías que combinan sistemas de flujo abierto y recirculado (RAS), nuevas tecnologías de producción de alimento vivo como la implementación de los fotobirreactores y estrategias de manejo de los alevines por tallas.
Aunque este trabajo haya demostrado la factibilidad técnica de mejorar la producción de juveniles de esta especie; aún se requiere de mejoras en aspectos puntuales como nutrición de larvas en los primeros días de cultivo y mayor control microbiológico. Los resultados en sobrevivencia se consideran positivos.