Introducción
Los cultivos de piña y palma aceitera forman parte de los sectores de producción más grandes en lo que a territorio de cultivo respecta en Costa Rica. El sector piñero costarricense está catalogado como el productor de la mejor piña fresca a nivel mundial, la cual es el tercer producto de exportación en el país. El territorio destinado al cultivo de piña aumentó de 43 000 a 45 000 hectáreas del 2016 al 2018 (Mora et al., 2020).
Los residuos del cultivo piñero se han contabilizado en cerca de 8,2 millones de toneladas anuales, una cantidad importante de biomasa que actualmente genera grandes problemáticas de plagas (Picado, 2018). Por su parte, el territorio de siembra del raquis de palma africana incrementó desde el año 2016 al 2018 de 72 456 a 76 910 hectáreas de cultivo, que representaron alrededor de 1 087 800 toneladas para el 2018(Mora et al., 2020). Estudios han determinado que una vez seco, el 35% es celulosa (López et al., 2009; Irías & Lutz, 2014). Y para el raquis de palma africana, el contenido holocelulósico ronda el 51% (Galiwango et al., 2018). La celulosa es el biopolímero más abundante de la biosfera y es fuente de carbono renovable, con varias aplicaciones comerciales; sintetizada en su mayor parte por las plantas por medio de fotosíntesis (Dopico-Ramírez et al., 2012). En la actualidad, hay varios procesos utilizados para extraer la celulosa, por ejemplo, los procesos alcalinos, de bisulfito y sulfato (kraft), en combinación con tratamientos térmicos y mecánicos que, dependiendo de la combinación utilizada, dan como resultado diferentes resistencias de fibra de la pulpa (Shaghaleh et al., 2018). La obtención de nanocelulosa a partir de celulosa es una de las tecnologías que ha tomado gran relevancia en la actualidad, debido a su gran cantidad de aplicaciones y a la diversidad de nanocelulosa que es posible obtener.
Las fibras elementales o mícelas, se forman por 40 y 100 cadenas de celulosa. Dichas cadenas se acoplan para formar las llamadas fibras elementales o nanofibrillas, las cuales de igual manera se ensamblan unas con otras hasta formar cadenas más largas de celulosa denominadas microfibrillas de celulosa. Las nanofibras pueden tener de 20 a 50nm de diámetro y varios micrómetros de longitud (Lavoine et al., 2012). Las microfibrillas, por su parte, se empaquetan de manera unidireccional y forman así las fibras de celulosa de la pared celular vegetal (Siqueira et al., 2010), con un ancho de 5 a 20µm y una longitud de 0,5 hasta varios milímetros (Kalia et al., 2014). Existen métodos de ruptura de fibras de celulosa en sus micelas elementales, tal como como el ultrasonido, el cual puede llegar a producir nanocelulosas con dimensiones muy variadas de 10 nm a 100 nm de espesor y longitudes de las fibras en la escala de los micrómetros (Jiang & Hsieh, 2013). Es por ello que la presente investigación propone una forma de aprovechar los residuos agroindustriales en la producción de celulosa, empleando sistemas de bajo requerimiento energético y de insumos, que posteriormente pueda dar paso a la obtención de nanofibras de celulosa por métodos mecánico.
Materiales y métodos
Caracterización química
La determinación de la composición química de cada una de las biomasas utilizadas se efectuó con base en la norma TAPPI: T280 pm-99, así como en los reportes técnicos: NREL/TP-510-42620, NREL/TP-510-42618.
Preparación de nanocelulosa
Degradación básica de las fibras
En la degradación de las biomasas, efectuamos un diseño factorial 22 para cada una de las biomasas por separado, en el cual los factores: concentración de hidróxido de sodio (NaOH) y tiempo de degradación se estudiaron en los niveles de 2% y 5% (concentración en m/V) para el NaOH, mientras que para el tiempo los niveles bajos y altos respectivamente 30 y 60. Para dicho diseño se analizó el porcentaje de lignina removida como variable de respuesta.
Para la degradación utilizamos 1g de biomasa, la cual se secó hasta que su contenido de humedad fuera menor al 10%m/m y posteriormente fue molida, y tamizada con una malla de 0,5mm de diámetro de poro y se colocó en un Erlenmeyer de 150mL con 50mL de disolución de NaOH. La introdujimos en una autoclave a 136kPa. La biomasa degradada se filtró por gravedad y se lavó con agua hasta pH neutro. La celulosa extraída se dejó reposando en 50mL de hipoclorito de sodio al 4%m/V durante 15 minutos, tras los cuales se filtró la celulosa y se repitió el lavado con hipoclorito. Luego, se filtró y se efectuaron lavados con agua hasta eliminar el exceso de cloro.
Degradación ácida de las fibras
Utilizamos 1g de biomasa con previa degradación básica y colocamos en un Erlenmeyer de 150mL con 50mL de disolución de ácido acético (HOAc) 10%V/V. La introdujimos en una autoclave a 136 kPa por 60 minutos. La biomasa degradada se filtró por gravedad y se lavó con agua hasta pH neutro.
Ruptura de las fibras de celulosa
La celulosa obtenida se dispersó en agua aproximadamente al 2,5%m/m y se sometió a ruptura en un ultrasónico de alta potencia a una frecuencia de 60Hz, una amplitud de 60% y un período de 15 minutos en el ultrasónico de alta potencia QSonica modelo Q700 del Centro de Investigación en Biotecnología del Instituto Tecnológico de Costa Rica. Para ello tomamos fibras de cada biomasa con dos tipos de degradación: A) Fibras con tratamiento básico según lo establecido en el diseño estadístico, B) Fibras con tratamiento básico según lo establecido en el diseño estadístico y un posterior tratamiento ácido.
Caracterización microscópica y espectroscópica
Microscopía óptica
Para observar el tamaño de las fibras de celulosa utilizamos un microscopio ZEISS, Axiolab 5.
Microscopía por fluorescencia
Para observar la presencia de lignina y celulosa en las fibras, utilizamos un microscopio ZEISS, Axiolab 5 y se tiñeron las fibras con el reactivo fluorescent brightener 28F3543, para promover la fluorescencia de la celulosa, mientras que la lignina se observó por autofluorescencia; tanto la Microscopía óptica como por fluorescencia realizamos en el Laboratorio de Ingeniería Química de Universidad de Costa Rica en la Sede Caribe.
Microscopía electrónica de trasmisión (MET)
Para determinar el tamaño de las fibras de nanocelulosa uilizamos un Microscopio Electrónico de Transmisión HITACHI HT 7700 del Centro de Investigación en Estructuras Microscópicas (CIEMic) de la Universidad de Costa.
Espectroscopia Infrarroja (FTIR)
Para obtener las bandas de los grupos funcionales asociados a los componentes de la fibra, así como ausencia y presencia de lignina utilizamos un equipo Perkin Elmer modelo Frontier FT-IR-ATR, realizamos 32 escaneos por muestra de 4000cm-1 a 450cm-1 en el Centro de Investigación en Ciencia e Ingeniería de Materiales (CICIMA) de la Universidad de Costa Rica.
Resultados
La composición porcentual de los diferentes polímeros, extractivos y cenizas presentes en las fibras vegetales no solo muestran a los residuos como potenciales materias primas, sino que brindan información relacionada con el primer paso de degradación: hay una relación directa entre las condiciones de degradación, la concentración de reactivos y la cantidad de lignina que se desea retirar de las fibras (Tabla 1).
Para ambas biomasas el contenido de holocelulosa constituye más de la mitad del material (Tabla 1); el porcentaje varía de forma importante entre biomasas. Por su parte, el raquis de palma africana contiene 17,9% de celulosa en su composición másica y cerca del doble de hemicelulosa.
Según el análisis de varianza, tanto el tiempo de reacción, como la interacción entre la concentración de NaOH (factor “A”) y el tiempo de degradación (factor “B”) interfieren de forma significativa en la remoción de lignina de las fibras de piña. En el diagrama de Pareto, tanto la interacción como el factor “B” sobrepasan el límite de significancia (Fig. 1).
Tabla 1 Composición química del rastrojo de piña
| Componente | Rastrojo de piña (%) | Raquis de palma africana (%) |
| Extractivos | 12,1 ± 0,4 | 10,9 ± 0,9 |
| Celulosa | 35,8 ± 0,5 | 17,9 ± 0,1 |
| Hemicelulosa | 18,6 ± 0,6 | 36,6 ± 0,8 |
| Lignina | 20,0 ± 0,3 | 30,8 ± 0,4 |
| Cenizas | 0,7 ± 0,3 | 0,44 ± 0,02 |
Para el nivel alto del factor "Tiempo", la remoción de lignina se ve favorecida con el nivel alto del factor “Cn NaOH”. (Fig. 2).
Para el sistema de degradación de la fibra de raquis de palma africana ambos factores exceden el límite de significancia, al igual que la interacción (Fig. 3).
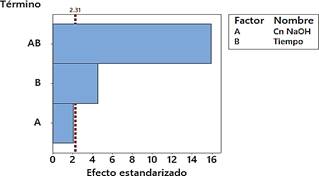
Fig. 1 Diagrama de Pareto de efectos estandarizados, en respuesta al porcentaje de remoción de lignina extraída del rastrojo de piña (α= 0,05).
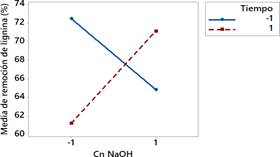
Fig. 2 Interacciones entre los factores, en respuesta al porcentaje de remoción de lignina del rastrojo de piña.
El mayor porcentaje de remoción de lignina se da en el nivel bajo de ambos factores (Fig. 4): de las cuatro combinaciones de factores, las condiciones más bajas de tiempo y concentración de NaOH presentan la mayor eliminación de lignina.

Fig. 4 Interacciones entre los factores, en respuesta al porcentaje de remoción de lignina del raquis de palma africana
Las condiciones de degradación de la fibra de raquis de palma africana se fijan en 30 minutos de degradación de las fibras, con una concentración de NaOH del 2% m/V. Los parámetros de presión y temperatura se mantienen en las condiciones de degradación establecidas, así como la proporción de biomasa y volumen de disolución de NaOH del diseño estadístico.
Aunque hay remoción de lignina, el microscopio de luz indica que las medias del diámetro de las fibras, antes de la ruptura con aparato ultrasónico de alta potencia, eran de 7,7µm (piña) y 7,6µm (palma, Fig. 5).
Las fibras de rastrojo de piña y raquis de palma africana sin tratamiento, respectivamente (Fig. 6 A, C). La exposición de las fibras de celulosa (regiones azules) es mínima para las biomasas sin tratamiento.
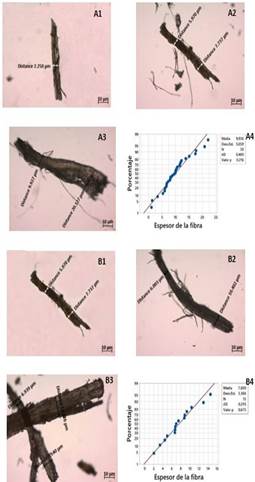
Fig. 5 Fibras de A) Rastrojo de piña, B) Raquis de palma africana, (1 fibras sin tratamiento, y 2 fibras tras tratamiento básico y 3 tras al tratamiento ácido)
Tras tratamiento alcalino, hay remoción de lignina y mayor exposición de las fibras de celulosa(Figura 6 B,D).
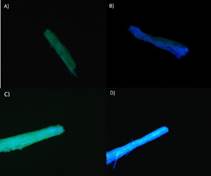
Fig. 6 Microscopía de fluorescencia de fibras de rastrojo de piña: A) sin tratamiento, B) post tratamiento. Y fibras de raquis de palma africana C) sin tratamiento, D) post tratamiento.
El pico alrededor de los 3300cm-1 es un estiramiento asociado con la vibración del enlace de hidrógeno de los grupos hidroxilo en holocelulosa, así como el pico a 1000cm-1 característico del enlace simple C-O, vibración de estiramiento que pertenece a los polisacáridos en la celulosa: en rojo los espectros de las biomasas sin tratamiento, en verde b fibras con tratamiento básico (Figuras 7 y 8).
Por otra parte, en el intervalo entre los 2000cm-1 a los 1200cm-1, es típico encontrar bandas características de holocelulosa y lignina, que disminuyen su intensidad de forma significativa, o desaparecen por completo en los espectros que representan las fibras con tratamiento. Lo anterior evidencia la disminución de la presencia de lignina en las fibras (Figuras 7 y 8).
Las líneas azules indicadoras de holocelulosa se intensifican en los espectros de las fibras pretratadas (Tabla 2).
Tabla 2 Resumen de las principales bandas observadas en FTIR, antes y después de la degradación, así como lo reportado por otras investigaciones
| Rastrojo de Piña | Raquis de Palma africana | Otras investigaciones | ||
| Longitud de onda (cm-1) | Asignación de las bandas | Referencia | ||
| 3330 | 3330 | 3330 | Grupos OH en holocelulosa | (Amroune et al., 2014) |
| 2920 | 2923 | 2923 | Enlace C-H en holocelulosa | (Amroune et al., 2014) |
| 2852 | 2852 | 2852 | Grupo CH2 en holocelulosa | (Amroune et al., 2014) |
| 1732 | 1740 | 1736 | Presencia de lignina | (Ahmed et al., 2014) |
| 1645 | 1643 | 1640 | Enlaces O-H del agua absorbida | (Xiong et al., 2017) |
| 1593 | 1593 | 1593 | Estructura aromática de la lignina | (Liu et al., 2009) |
| 1515 | 1508 | 1510 | Enlace C=C en lignina | (Saravanakumar et al., 2013) |
| 1460 | 1460 | 1460 | Enlace C=O en lignina | (Amroune et al., 2014) |
| 1428 | 1426 | 1423 | Grupo CH2 en celulosa | (Maache et al., 2017) |
| 1370 | 1371 | 1367 | Enlaces C-H en holocelulosa | (Bezazi et al., 2014) |
| 1316 | 1316 | 1319 | Grupo CH2 en celulosa | (Saravanakumar et al., 2013) |
| 1238 | 1240 | 1240 | Enlaces C-O en lignina | (Ahmed et al., 2014) |
| 1168 | 1160 | 1162 | Enlaces C-O-C en holocelulosa | (Saravanakumar et al., 2013) |
| 1030 | 1030 | 1030 | Enlace C-O en celulosa | (Saravanakumar et al., 2013) (Bezazi et al., 2014) |
Los diámetros de nanofibras de rastrojo de piña son de 40-78nm y de raquis de palma africana de 11-20nm. Estos rangos son característicos de las nanocelulosas de tipo fibrilar (Figuras 9 y 10).
Ambos tipos de fibras tienen longitudes que van desde nanómetros hasta unos pocos micrómetros, característica de las nanofibras de celulosa. Aunque en ambos casos hay nanofibrillas de celulosa, las del rastrojo de piña se componen de fibras largas que se entrelazan, formando algunas fibras más gruesas (Figura 9 y Figura 10).
Discusión
El rastrojo de piña, contiene un 35,8% de material celulósico que representa el 65,8% de la holocelulosa. Los análisis realizados por otros investigadores apuntan a que, por lo general, cerca del 64,5% del material holocelulósico en el rastrojo de piña es celulosa (Sharma, 1981), un porcentaje similar al que se obtuvo en la muestra estudiada. Este porcentaje de celulosa en la muestra también es respaldado por otras investigaciones, que reportan valores típicos de 27,6% (Maneeintr et al., 2018) y hasta 32,2% (Irías & Lutz, 2014) en el rastrojo de piña. Por otra parte, Bourrillón en su investigación señala que el contenido varía drásticamente dependiendo de la procedencia de la hoja de la piña, un 59,0% para las hojas de la corona de la piña y 25,8% en el caso del rastrojo de la planta (López-Herrera et al., 2014).
Por su parte, el raquis de palma africana analizado contiene 17,9% de celulosa en su composición másica y cerca del doble de hemicelulosa. Otros autores reportan valores de celulosa en el raquis de palma africana en cerca de 32,0% (Galiwango et al., 2018; 2019). La proporción entre los constituyentes de holocelulosa puede variar en gran magnitud dependiendo de la función de la biomasa y las condiciones en las que se desarrolle. El raquis de palma africana es característico por ser un material que necesita rigidez y resistencia para poder soportar el peso de los frutos, razón por la cual es lógico que posea un elevado contenido de hemicelulosa, ya que a esta se le atribuye la función de dar rigidez fijando y enlazando las diversas cadenas de celulosa y lignina que se encuentran en la biomasa (Scheller & Ulvskov, 2010; Rodriguez-Gacio et al., 2012). Otras investigaciones respaldan los valores elevados de hemicelulosa en las fibras de raquis de palma africana con valores mayores al 29,8% (Bendahou et al., 2007; Khiari et al., 2010a).
Por otro lado, la lignina, uno de los tres principales componentes de las fibras vegetales, constituye el 20,0% del rastrojo de piña y 30,8% para el raquis de palma africana. La variación de las proporciones de lignina entre ambas fuentes de biomasa es de esperar debido a que la lignina es uno de los polímeros de la fibra que ayuda a dar rigidez a las fibras, por lo que es lógico un valor elevado de este componente en el raquis de palma africana (Sun et al., 2000). Los valores obtenidos de lignina suelen ser típicos en dichas fibras según lo que se reporta en otras investigaciones (Khiari et al., 2010b; Irías & Lutz, 2014; Maneeintr et al., 2018). Además, las proporciones de lignina, a pesar de no ser el principal producto de interés, son de suma importancia debido a que es el componente que se desea extraer y eliminar de las fibras vegetales.
Las condiciones de degradación tanto básicas como ácidas, de las materias primas, inicialmente se basaron en el método de explosión como el expuesto por Cherian et al., (2010) o el de Luzi et al., (2016), al igual que con la sonicación con referentes como Csiszar et al., (2016). Posteriormente se realizaron experimentaciones en donde se comprobó el método de degradación y reducción a nanocelulosa en diferentes materias primas como banano (Jirón et al., 2020), raquis de palma y bagazo de caña (Vargas & Rodríguez, 2021; Jirón-García et al., 2022; Jirón & Rodríguez, 2022).
Teniendo en cuenta que se desea obtener un sistema de degradación de las fibras a bajas condiciones energéticas, se estableció el estudio de la remoción de lignina de las fibras bajo un diseño factorial 22, que permitiera observar el efecto de la concentración de reactivo y el tiempo de degradación, así como el de la interacción de las mismas. Los niveles seleccionados para el estudio estadístico, se establecieron con base en las investigaciones realizadas por (Alawar et al., 2009) (Jirón et al., 2020).
La red de fibras nanométricas de rastrojo de piña obtenidas posterior a la ruptura mecánica se asemeja al comportamiento de las fibras obtenidas en otras investigaciones de nanocelulosa fibrilar a partir de la hoja de la piña, en donde el espesor de las fibras es de alrededor de 30 nm (Ravindran et al., 2010; Rigg-Aguilar et al., 2020).
Asimismo, nanocelulosa fibrilar de raquis de palma se ha obtenido con diámetros de alrededor de 20nm (Jirón-García et al., 2022) o nanoceluosa cristalina de palma africana con diámetros también cercanos a los 23nm determinados por la misma técnica de determinación de tamaño (Ichwan et al., 2023). Otras investigaciones han caracterizado las nanofibras de celulosa obtenidas a partir del raquis de palma africana mediante microscopía de fuerza atómica, en donde también reportan cómo la nanocelulosa se separa en largas fibras individuales, tal y como las que se obtuvieron en esta investigación, con espesores entre 1 a 3,5nm (Fahma et al., 2010, 2017).
Es importante destacar que, debido a las bajas concentraciones en las hidrólisis, se comprueba que se tiene una mezcla entre nano y micro celulosa, dicha mezcla eventualmente puede separase por diversos métodos como diálisis (Zheng et al., 2019) dependiendo de la aplicación. Para efectos de este artículo dicha separación no se realizó.
Las principales conclusiones del estudio se enfocan en la obtención de celulosa utilizando hidrólisis alcalina con NaOH en concentraciones relativamente bajas (30 minutos y 2% NaOH), la cual fue caracterizada y se demostró que contenía bajos porcentajes de lignina residual por medio y solo se da un aumento de 2% en el índice de cristalinidad de la celulosa obtenida a partir del rastrojo de piña. Además, se obtuvo nanocelulosa fibrilar por medio de la ruptura mecánica de pulpa de celulosa, la cual tuvo tamaños de diámetro entre 20,4-10,8nm para las nanofibras de raquis de palma africana mientras que las de rastrojo de piña son comparables a los 30nm.
Ética, conflicto de intereses y declaración de financiamiento
Los autores declaran haber cumplido con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en el manuscrito; que no hay conflictos de interés de ningún tipo, y que todas las fuentes financieras se detallan plena y claramente en la sección de agradecimientos. Asimismo, están de acuerdo con la versión editada final del documento. El respectivo documento legal firmado se encuentra en los archivos de la revista.
La contribución de los autores es como se detalla a continuación: J.V.M.: investigador, análisis de datos y redacción del artículo. K.R.M.: investigador, análisis de datos y redacción del artículo. E.J.G: investigador, redacción del artículo. C.B.S. investigador, análisis de datos y redacción del artículo.












 uBio
uBio 







