Los bosques montañosos menos fragmentados de Costa Rica (C.R.) se ubican entre 1 400 y 3 200msnm (Tobler et al., 2006), en la Cordillera de Talamanca, cuya mayor extensión la ocupa el Parque Internacional de La Amistad (PILA) (SINAC, 2019), donde existen ecosistemas aptos para la conservación a largo plazo (Kappelle, 2004; Avalos, 2007). Algunas investigaciones (Carbonell & Torrealba, 2007; González et al., 2008; Altrichter & Carbonell, 2013; Mejía, 2014; Chaverri et al., 2016;) han registrado 189 especies de mamíferos silvestres: 23 endémicas de Talamanca, 21 en peligro de extinción y 44 con poblaciones reducidas o amenazadas (Rodríguez et al., 2014).
Los mamíferos silvestres se movilizan entre las Áreas Silvestres Protegidas (ASP) y su entorno (Arias et al., 2008; Céspedes et al., 2008). El Corredor Biológico el Quetzal Tres Colinas (CBQTC) es una estrategia para conservar la biodiversidad fuera de los límites del ASP (Florian et al., 2010; Salom et al., 2010; Villate et al., 2010; Villate y Canet, 2010). La mayor riqueza de especies se da en elevaciones medias y disminuye conforme aumenta la altura (Jaime et al., 2016). Aunque los ecosistemas del PILA (SINAC, 2019) y del CBQTC (Calvo, 2009; Martínez, 2013) albergan especies con poblaciones reducidas o en peligro de extinción (Kappelle, 2004; SINAC, 2019), existe un vacío de información de los mamíferos de las montañas altas (Kappelle, 2004), pues la mayoría de las investigaciones se han realizado en elevaciones medias y bajas (SINAC, 2017).
La riqueza y abundancia de los mamíferos silvestres varía espacial y temporalmente (Walker et al., 2000; Lira & Briones, 2012), por lo que las especies que existen en el CBQTC y el PILA cambian con respecto a los pisos altitudinales (Ramos et al., 2007), zonas de vida (Williams et al., 2002), estructura y fragmentación del hábitat (Norris et al., 2010). La actividad circadiana de los mamíferos varía con respecto al estrés térmico (Owen, 1998; Oliveira et al., 2010), el día, la noche o el crepúsculo (Van Schaik & Griffiths, 1996; Kirk, 2006; Bennie et al., 2014), la disponibilidad de alimento (McDonough et al., 1997), el riesgo de depredación (Downes, 2001; Mech & Cluff, 2011; Russo et al., 2011; Suselbeek et al., 2014), el brillo de la luna (Lizcano & Cavelier, 2000; Norris et al., 2010; Harmsen et al., 2011; Penteriani et al., 2013), la estación seca o la lluviosa (Santos et al., 2010) y los cambios antropogénicos (Kitchen et al., 2000).
Se requiere generar mayor conocimiento de los mamíferos silvestres (Rodríguez et al., 2002), pues su patrón de actividad, interacción entre especies y ocupación son claves para la conservación (Berger-Tal et al., 2011) y son indicadores de la salud de los ecosistemas, pues sufren variaciones cuando se altera su hábitat (Sanderson & Trolle, 2005), lo cual afecta la riqueza, grupos funcionales y dominancia (Ahumada et al., 2011). Las actividades humanas en el PILA y el CBQTC afectan el comportamiento de especies o comunidades (Wright et al., 2010) de mamíferos tropicales que utilizan los senderos antrópicos y sus patrones de actividad pueden variar con la actividad humana (Blake et al., 2017), aunque la tendencia de los mamíferos a caminar sobre un sendero es muy variable (Harmsen et al., 2009). Un estudio similar a éste (Ahumada et al., 2013), desarrollado en C.R. en un gradiente altitudinal de 3000 metros, detectó 26 especies varias de ellas con algún riesgo de conservación. Estas investigaciones aportan al conocimiento biológico y fortalecen la gestión de las ASP (Rodríguez et al., 2002) pues son una base para la toma de decisiones de manejo (Vásquez & Matallana, 2016).
En esta investigación, utilizamos los datos registrados por cámaras trampas para evaluar la riqueza, abundancia relativa, patrones de actividad, distribución espacial y temporal de los mamíferos silvestres medianos y grandes en el CBQTC y el PILA, en un gradiente altitudinal de 2 569m, en la Cordillera de Talamanca, Costa Rica.
MATERIALES Y MÉTODOS
Área de estudio: Realizamos una investigación en un gradiente altitudinal desde 980msnm en el CBQTC hasta 3 503msnm en el PILA, en el Sur de Costa Rica. El CBQTC tiene una extensión de 1 800,8ha en donde existen paisajes alterados, áreas en regeneración y parches boscosos que brindan conectividad funcional (93,3%), estructural (70%) y cobertura forestal (62,5%) (Calvo, 2009) aptas para la conservación de mamíferos. El sendero Tres Colinas-Cerro Kamuk recorre bosques nubosos (Kappelle & Brown, 2001), turberas y páramos (Kappelle & Horn, 2005) que forman parte del PILA (Fig. 1), el cual es el ASP terrestre más extensa de C.R. (199 147ha) (SINAC, 2019) cubierta de bosque tropical inalterado (Palminteri et al., 1999). El endemismo y biodiversidad característicos del PILA, le han conferido tres denominaciones internacionales: Reserva de la Biósfera, Sitio de Patrimonio Mundial y Sitio Ramsar (SINAC, 2012).
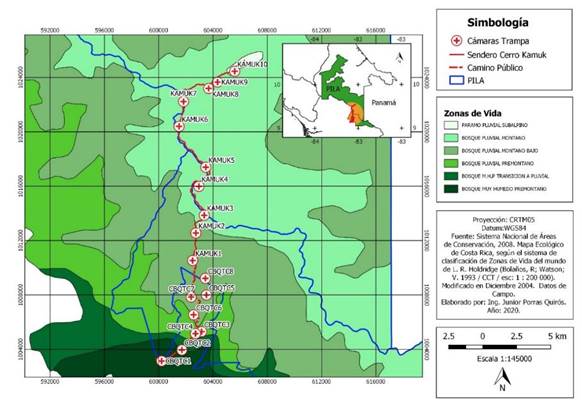
Fig. 1 Ubicación de las estaciones de fototrampeo en el Corredor Biológico el Quetzal Tres Colinas y en el Parque Internacional de La Amistad, Costa Rica
Población de estudio: De las 249 especies de mamíferos silvestres registrados en Costa Rica (Rodríguez et al., 2014), seleccionamos las que se desplazan en el suelo (no voladores ni arborícolas), cuyo tamaño corporal en individuos adultos va de mediano a grande. Determinamos las tallas medianas (peso: >101g <10kg) y grandes (peso >10kg) con base en Sánchez et al. (2019) y Arita y Figueroa (1999). Incluimos todos los registros de seres humanos (Homo sapiens) y los mamíferos domésticos: caballos (Equus caballus), vacas (Bos taurus) y perros (Canis familiaris).
Cámaras trampa: Utilizamos el ''fototrampeo''debido a sus ventajas sobre otras técnicas de investigación de mamíferos (Zúñiga & Jiménez, 2010; Janecka et al., 2011; O'Connell et al., 2011; Vila et al., 2016; Hurtado et al., 2018) y seguimos el procedimiento y ajustes para C.R. realizados por Hurtado y Soto (2017). Utilizamos 18 cámaras trampa (Bushnell Trophy Cam Essential E3 Brown) colocadas dentro de una caja de acero con candado de seguridad y atadas a un árbol robusto mediante un cable antirrobo Masterlock Python (Mooring et al., 2020). El flash infrarrojo de las cámaras evitó el destello blanco que podría asustar a los animales en condiciones de poca luz (Séquin et al., 2003; Gibeau & McTavish, 2009; Meek et al., 2014; Meek et al., 2016; Srbek et al., 2018). Instalamos las cámaras a 50cm sobre el suelo, orientadas en el mismo sentido del paso de animales para aumentar el tiempo dentro del campo de visión de cada cámara (Mooring et al., 2020). Ajustamos el sensor infrarrojo en modo normal y las programamos para activarse automáticamente cada vez que detectaron calor corporal y movimiento, en intervalos de cada tres segundos, tomando tres fotografías continuas (en calidad 4K), que se almacenaron en tarjetas SD rotuladas con el número de cada cámara trampa. Cada dos meses recolectamos las tarjetas, revizamos el nivel de carga de las baterías, la configuración de cada cámara y ajustamos la hora y fecha correctas para conocer el patrón de actividad de las especies a través de los metadatos Exchangeable Image File Format (EXIF) de fecha y hora (Griffiths & Van Schaik, 1993; Gómez et al., 2005) grabados en cada fotografía.
Estaciones de olor: Colocamos un atrayente olfativo (Moreno, 2000; Polisar et al. 2014) a dos metros frente a cada cámara trampa. El atrayente consistió en un trozo (5cm) de esponja comercial impregnada con colonia para hombre (Obsession de Calvin Klein CK) colocada dentro de 6 cm de tubo de vinilo transparente, el cual atamos al extremo de un tubo de PVC incrustado verticalmente en el suelo (Mooring et al., 2020). Aunque el atrayente olfativo mantuvo su efecto por más de tres meses (Maxwell, 2018), durante nuestras giras colocamos más perfume rociando cuatro veces sobre la esponja (Mooring et al., 2020). Esto aumentó la calidad de las fotografías y ayudó en la identificación de especies y de individuos (Weaver et al., 2005; Barea et al., 2007; Thorn et al., 2009; Randel & Peace, 2010; Maffei et al., 2011; García, 2012; Braczkowski & Watson, 2013; Noss et al., 2013). La estación de olor atrajo sólo los mamíferos que ya estaban cerca (Maxwell, 2018) pues el olor se detecta a máximo 20 metros (Jinn, 2019) y no afectó la cantidad de fotografías, distancias de movimiento, inmigración o emigración, actividad temporal ni abundancia (Gerber et al., 2012; Braczkowski et al., 2016).
Diseño de muestreo: Para reflejar los ecosistemas del PILA y el CBQTC, combinamos el muestreo sistemático y selectivo (Hurtado & Soto, 2017). Cada estación de fototrampeo se instaló considerando que entre ellas existiera una distancia mínima de 2 km (Rovero & Marshall, 2009; Parsons et al., 2017) y que hubiera al menos dos estaciones por zona de vida, así como rastros de mamíferos silvestres (Karanth et al., 2006) y árboles grandes en donde colocar las cámaras trampa. Utilizamos el programa Quantum Giz 2,8 (QGIS, 2020) y el Atlas Digital de C.R. (Ortiz, 2014) para trazar una cuadrícula de 1x1km sobre el sitio de estudio. Instalamos estaciones de fototrampeo en el borde de senderos, caminos, servidumbres y carriles. Tramitamos el permiso de investigación R-SINAC-PNI-ACLAP-016-2021 y en el CBQTC obtuvimos la autorización de los propietarios. Las estaciones de fototrampeo permanecieron en un mismo sitio el cual georreferenciamos mediante un GPS Garmin 64s (Apéndice digital, Tabla 1). Prolongamos el tiempo de muestreo durante las 24 horas desde el 12 de julio del 2018 al 18 de abril del 2021 (1 012 días), lo cual brindó un esfuerzo de muestreo de 15 335 días cámaras trampa, pues el tiempo necesario para investigar mediante fototrampeo es inversamente proporcional al número de cámaras instaladas (Hurtado et al., 2018).
Análisis de datos: Almacenamos las fotografías en una computadora y las revisamos para detectar la presencia de mamíferos e identificarlos taxonómicamente. Hicimos una carpeta para cada cámara trampa, dentro de las cuales creamos subcarpetas por especie y dentro de éstas hicimos subcarpetas con el número de individuos observados en cada fotografía. El programa Renamer (Kozlov, 2018) nos permitió renombrar cada fotografía con sus metadatos EXIF (año-mes-día, hora-minuto-segundo). Renamer generó un archivo de texto (.txt) que analizamos mediante CameraSweet (Sanderson & Harris, 2013) y obtuvimos resultados de riqueza, abundancia relativa, patrones de actividad circadiana y esfuerzo de muestreo. Analizamos sólo los eventos independientes separados por al menos 30 minutos de cualquier otro registro fotográfico de la misma especie y en la misma cámara trampa (Ridout & Linkie, 2009; Si et al., 2014; Van Berkel, 2014; Anile & Devillard, 2016; Sollmann, 2018). Exportamos la base de datos creada por CameraSweet y la guardamos como un archivo de Excel (.csv) que analizamos mediante guiones escritos en el lenguaje de programación R (R Core Team, 2019). Seleccionamos el programa con base en Young et al. (2018).
Riqueza de especies: Identificamos todas las especies de mamíferos y sus gremios tróficos con base en Mora (2000), Carrillo et al. (2002) y Wainwright (2007) y los clasificamos como herbívoros, insectívoros, frugívoros, carnívoros y omnívoros (Ceballos y Navarro, 1991). Mediante el programa R (R Core Team, 2019) y su función ''Specaccum''del paquete ''Vegan'', construimos una curva de acumulación de especies. Utilizamos los días acumulados de las cámaras trampa siguiendo el método aleatorio: cada día que las cámaras estuvieron activas se incluyeron en la curva en orden aleatorio (Oksanen et al., 2019). Este orden fue aleatorizado 1000 veces y se calcularon intervalos de confianza del 95% (Rovero et al., 2014).
Consultamos el estado de conservación de cada especie según la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza (UICN, 2020), la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora (CITES) y la lista oficial de especies en peligro de extinción y con poblaciones reducidas y amenazadas del Ministerio de Ambiente y Energía (MINAE) (SINAC, 2017). Asignamos un valor a cada especie de acuerdo con su clasificación: en peligro (5), vulnerable (4), casi amenazado (3), preocupación menor (2) y datos insuficientes (1) (UICN, 2012); Apéndices CITES I (3), II (2) y III (1) (PNUMA-CMCM, 2014); especies con Poblaciones Reducidas (1) y especies en peligro de extinción (2) (MINAE). Sumamos los tres valores (CITES, UICN y MINAE) y categorizamos las especies de acuerdo a su estado de conservación.
Abundancia relativa: La cual calculamos mediante el Índice de Abundancia Relativa (IAR) como la frecuencia con que las cámaras trampa registraron cada especie en todo el sitio y en cada piso altitudinal y zona de vida. Calculamos el IAR mediante la fórmula ((número de observaciones independientes) / (número de días que la cámara estuvo activa)) * 1000 (Rovero & Marshall, 2009; Lira & Briones, 2011; Monroy et al., 2011; Cortés & Briones, 2014; Lira et al., 2014). Utilizamos el IAR debido a su efectividad (Maffei et al., 2002; Azuara, 2005; Jenks et al., 2011; Hernández et al., 2015) y porque la información para calcular la densidad de los mamíferos neotropicales (Negroes et al., 2010; Morgan et al., 2018) es costosa y difícil de obtener (Lira & Briones, 2012).
Uso del espacio: Mediante el fototrampeo detectamos diversidad y patrones de actividad (Cuellar et al., 2006; Soria & Monroy, 2015) en cuatro pisos altitudinales y seis zonas de vida (Holdridge, 1987): Bosque Muy húmedo Premontano (BmH-P), Bosque Muy húmedo Premontano Transición a Pluvial (BmHP-TP), Bosque Pluvial Premontano (BP-P), Bosque Pluvial Montano Bajo (BP-MB), Bosque Pluvial Montano (BP-M) y Bosque Pluvial Subalpino(BP-S). Distribuimos las estaciones de fototrampeo de la siguiente forma: seis estaciones en el piso altitudinal Premontano (dos en cada zona de vida), cuatro en el Montano Bajo, seis en el Montano y dos estaciones en el piso Subaplino. Analizamos el uso del espacio de las especies por modalidad de conservación mediante la instalación de diez estaciones en el PILA y ocho en el CBQTC (Apéndice digital, TABLA 1).
Patrones de actividad: Determinamos los patrones de actividad circadiana y actividad lunar durante la estación seca y la lluviosa, considerando que las actividades de los mamíferos se asocian con los períodos de luz (día), oscuridad (noche) (Bennie et al., 2014) y estados intermedios (crepusculares o catemerales) (Van Schaik & Griffiths, 1996; Kirk, 2006). Consideramos especies nocturnas aquellas que detectamos una hora después de la puesta del sol y una hora antes de la salida del sol del día siguiente; las especies registradas entre la salida y la puesta del sol las clasificamos como diurnas. Si el evento ocurrió una hora antes del amanecer o una hora después del atardecer la consideramos una especie crepuscular. Consideramos especies catemerales las que estuvieron activas durante el día, la noche y el crepúsculo (O'Brien et al., 2003).
El momento del amanecer y atardecer en el trópico varía durante el año (Nouvellet et al., 2012) por lo cual analizamos los patrones de actividad circadiana utilizando la hora del sol mediante la función "sunTime" de "Overlap", que funciona con el tiempo en radianes (06:00 horas=p/2 y 18:00 horas=3p/2) (Meredith & Ridout, 2018a, 2018b). Caracterizamos el patrón de actividad lunar de las especies nocturnas utilizando la función "getMoonIllumination" del paquete "suncalc" (Agafonkin & Thieurmel, 2018), para cada evento obtuvimos la fase lunar con valores de 0 (luna nueva) 0,25 (cuarto creciente), 0,5 (luna llena) y 0,75 (cuarto menguante), los cuales multiplicamos por 2π y escalamos linealmente en radianes para cada ciclo lunar.
Comparamos la actividad de los mamíferos durante la estación seca (noviembre a abril) y la estación lluviosa (mayo a noviembre) (Kappelle, 1996). El Sendero Tres Colinas-Cerro Kamuk estuvo abierto a la visitación turística del 1 de noviembre al 30 de abril de cada año (estación seca) y contó con un estudio de capacidad de carga (Brenes et al., 2004) que reguló el ingreso diario a máximo nueve personas (SINAC, 2019). Mediante la bitácora para el registro de visitantes del SINAC-ACLAP-PILA calculamos la cantidad de turistas que ingresaron durante la época seca 2019-2021.
Para determinar si la presencia de humanos y mamíferos domésticos alteró el patrón de actividad (P) de las especies silvestres, analizamos la actividad circadiana y el coeficiente de superposición (𝚫) entre todas las especies. Estimamos el 𝚫 con valores que van desde 0 (sin superposición) a 1 (superposición completa) (Ridout & Linkie, 2009) lo cual pudo indicar competencia o depredación (Carver et al., 2011; Linkie & Ridout, 2011; Carter et al., 2012; Kamler et al., 2012; Ramesh et al., 2012; Ross et al., 2013). Realizamos tres pruebas complementarias al 𝚫 pues las estadísticas asociadas con los datos cíclicos no están tan desarrolladas como las estadísticas tradicionales. La primera prueba complementaria fue ''Watson's Two Sample U2 Test with Ties''(Zar, 1999) y los valores de nivel de significancia (P) calculados a través de una aproximación de ''Chi-cuadrado''de la distribución de U2 (Tiku, 1965). La segunda prueba fue ''Wr uniform scores statistic'', con valores P calculados de acuerdo con Fisher (1993). La tercera prueba fue ''Fisher's Exact Test''(Upton, 1992) con valores de P calculados usando 1 000 réplicas de Monte Carlo.
Para determinar el valor de patrón de actividad en cada especie, ajustamos de forma no paramétrica como funciones de densidad del núcleo con el paquete ''Overlap''y utilizando los parámetros de ancho de banda predeterminados (Meredith & Ridout, 2018a, 2018b); siguiendo el supuesto de que todas las especies tienen la misma probabilidad de ser detectadas en cualquier período de su actividad (Linkie & Ridout, 2011). Para no sobreestimar el patrón de actividad y el 𝚫 utilizamos un tamaño mínimo de 20 eventos independientes (n) (Lynam et al., 2013; Rowcliffe et al., 2014; Tan et al., 2018).
RESULTADOS
Riqueza y estado de conservación: Con un esfuerzo de muestreo de 15 335 días cámara trampa proveniente de 18 estaciones de fototrampeo, obtuvimos 36 667 registros en los que detectamos 27 especies silvestres de mamíferos medianos y grandes, de las cuales 25 las registramos en el CBQTC y 24 en el PILA. El orden mejor representado fue Carnívora, con cinco familias y 12 especies, seguido por Rodentia con cuatro familias y cinco especies. Detectamos ocho especies carnívoras, siete herbívoras, siete omnívoras, tres frugívoras y dos insectívoras, de las cuales, la mayor abundancia relativa la detectamos en Sciurus granatensis, Tapirus bairdii, Sylvilagus dicei y Mazama temama (herbívoras) y Cuniculus paca (frugívora). De acuerdo con la lista roja de la UICN, registramos dos especies en peligro, cuatro vulnerables, dos casi amenazadas, 18 con preocupación menor y una con datos insuficientes. Ocho especies están en el Apéndice I y II en el Apéndice II de CITES. Nueve especies están en peligro de extinción y cinco tienen poblaciones reducidas según la lista del MINAE (Apéndice digital, Tabla 2). En los primeros 19 días de muestreo detectamos trece especies y requerimos 991 días más para detectar las demás (Apéndice digital, Tabla 3). A través del programa R (R Core Team, 2019), generamos la curva de acumulación de especies (Fig. 2), la cual tiende a ajustarse a la asíntota. La zona de color gris representa un intervalo de confianza del 95%.
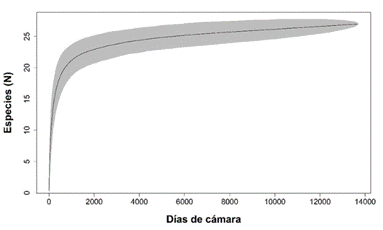
Fig. 2 Curva de acumulación de las especies detectadas en el Corredor Biológico el Quetzal Tres Colinas y el Parque Internacional de La Amistad, Costa Rica
Abundancia relativa: Para todo el sitio, las especies más abundantes fueron S. granatensis (IAR=133,41; n=1838), T. bairdii (IAR=53,42; N=736), S. dicei (IAR=25,91; N=357), M. temama (IAR=20,90; N=288), C. paca (IAR=20,32; N=280), P. onca (IAR=11,40; N=157), P. concolor (IAR=10,67; N=147) y D. marsupialis (IAR=9,15; N=126). Las especies menos abundantes fueron C. latrans (IAR=0,87; N=12), M. frenata (IAR=0,65; N=9), H. yagouaroundi (IAR=0,36; N=5), T. pecari (IAR=0,36; N=5), A. geoffroyi, C. imitator y M. alfari (IAR=0,07; N=1) (Tabla 1).
En la zona de vida BmH-P, las especies más abundantes fueron D. novemcinctus (IAR=74,21), P. oposum (IAR=47,8) y S. granatensis (IAR=41,51); las menos abundantes fueron S. dicei, H. yagouaroundi y C. imitator (IAR=1,26). En el BmHP-TP, las especies más abundantes fueron S. granatensis (IAR=98,56), M. temama (IAR=41,07) y N. narica (IAR=22,59); las menos abundantes fueron T. pecari (IAR=2,05), D. punctata (IAR=1,03) y C. latrans (IAR=1,03). En el BP-P las especies más abundantes fueron S. granatensis (IAR=219,40), T. bairdii (IAR=62,56) y C. paca (IAR=54,40); las menos abundantes fueron H. yagouaroundi, L. tigrinus y L. pardalis (IAR=0,91) (Tabla 1).
En el BP-MB las especies más abundantes fueron S. granatensis (IAR=277,40), C. paca (IAR=65,20) y S. dicei (IAR=50,50); las especies menos abundantes fueron L. pardalis (IAR=0,64), A. geoffroyi (IAR=0,32) y M. frenata (IAR=0,32). En el BP-M las especies más abundantes fueron S. granatensis (IAR=77,03) y T. bairdii (IAR=67,13); y las menos abundantes fueron D. marsupialis (IAR=0,13) y T. pecari (IAR=0,13). En el BP-S las especies más abundantes fueron T. bairdii (IAR=56,58), S. granatensis (IAR=40,12) y M. temama (IAR=13,37); y las menos abundantes fueron N. narica (IAR=1,03), P. tajacu (IAR=1,03) y M. alfari (IAR=0,51) (Tabla 1).
TABLA 1 Riqueza y abundancia relativa de los mamíferos silvestres medianos y grandes detectados en el Corredor Biológico el Quetzal Tres Colinas y el Parque Internacional de La Amistad, Costa Rica
| Especie | n* | **IAR total del sitio | IAR BmH-P | IAR BmHP-TP | IAR BP-P | IAR BP-MB | IAR BP-M | IAR BP-S |
|---|---|---|---|---|---|---|---|---|
| Sciurus granatensis | 1838 | 133,41 | 41,51 | 98,56 | 219,40 | 277,40 | 77,03 | 40,12 |
| Tapirus bairdii | 736 | 53,42 | 13,84 | 16,43 | 62,56 | 37,71 | 67,13 | 56,58 |
| Sylvilagus dicei | 357 | 25,91 | 1,26 | 5,13 | 50,50 | 24,82 | 8,74 | |
| Mazama temama | 288 | 20,90 | 3,77 | 41,07 | 31,73 | 13,74 | 24,18 | 13,37 |
| Cuniculus paca | 280 | 20,32 | 8,81 | 6,16 | 54,40 | 65,20 | 0,39 | |
| Panthera onca | 157 | 11,40 | 3,08 | 3,63 | 27,80 | 8,10 | 3,09 | |
| Puma concolor | 147 | 10,67 | 11,29 | 2,72 | 11,51 | 12,47 | 2,06 | |
| Didelphis marsupialis | 126 | 9,15 | 5,03 | 4,11 | 21,76 | 29,72 | 0,13 | |
| Pecari tajacu | 101 | 7,33 | 13,35 | 31,73 | 9,27 | 3,09 | 1,03 | |
| Dasypus novemcinctus | 98 | 7,11 | 74,21 | 13,35 | 4,53 | 4,15 | 4,12 | |
| Nasua narica | 97 | 7,04 | 11,32 | 22,59 | 19,04 | 9,27 | 2,40 | 1,03 |
| Leopardus tigrinus | 81 | 5,88 | 0,91 | 4,15 | 2,57 | 6,17 | ||
| Philander opossum | 74 | 5,37 | 47,80 | 16,43 | 18,13 | |||
| Conepatus semistriatus | 47 | 3,41 | 3,77 | 3,08 | 9,07 | 6,39 | 1,41 | |
| Eira barbara | 40 | 2,90 | 2,52 | 10,27 | 5,44 | 2,88 | 1,67 | |
| Coendou mexicanus | 39 | 2,83 | 12,46 | |||||
| Leopardus wiedii | 35 | 2,54 | 3,77 | 8,21 | 7,25 | 3,84 | 3,09 | |
| Leopardus pardalis | 31 | 2,25 | 0,91 | 0,64 | 11,32 | 6,17 | ||
| Bassariscus sumichrasti | 23 | 1,67 | 0,96 | 2,57 | ||||
| Dasyprocta punctata | 21 | 1,52 | 13,84 | 1,03 | 5,44 | 0,96 | ||
| Canis latrans | 12 | 0,87 | 1,03 | 2,88 | 0,26 | |||
| Mustela frenata | 9 | 0,65 | 3,63 | 0,32 | 0,51 | |||
| Herpailurus yagouaroundi | 5 | 0,36 | 1,26 | 0,91 | 0,96 | |||
| Tayassu pecari | 5 | 0,36 | 2,05 | 1,81 | 0,13 | |||
| Ateles geoffroyi | 1 | 0,07 | 0,32 | |||||
| Cebus capucinus | 1 | 0,07 | 1,26 | |||||
| Microsciurus alfari | 1 | 0,07 | 0,51 |
*n: número de eventos independientes **IAR: Índice de Abundancia Relativa. BmH-P: Bosque Muy húmedo Premontano. BmHP-TP: Bosque Muy húmedo Premontano Transición a Pluvial. BP-P: Bosque Pluvial Premontano BP-MB: Bosque Pluvial Montano Bajo. BP-M: Bosque Pluvial Montano. BP-S: Bosque Pluvial Subaplino
Uso del espacio: Detectamos la mayor riqueza (23 especies) en el BP-MB y la menor riqueza (12 especies) en el BP-S. Las especies con mayor distribución por zona de vida y piso altitudinal fueron S. granatensis, T. bairdii, M. temama y N. narica. Las especies con la distribución más restringida fueron C. imitator, C. mexicanus, A. geoffroyi y M. alfari (TABLA 1). Detectamos individuos manchados y melánicos de P. onca y L. tigrinus. Los jaguares melánicos los detectamos en siete zonas de vida ubicadas en el CBQTC (BmHP-TP, BP-MB) y en el PILA (BP-M, BP-S). La coloración melánica de L. tigrinus la detectamos en tres estaciones ubicadas en el PILA (BP-MB, BP-M, BP-S). El PILA y el CBQTC comparten 22 especies en común; dos especies se registraron solo en PILA (C. mexicanus y M. alfari) y tres especies se registraron únicamente en CBQTC (A. geoffroyi, C. imitator, P. opossum). Registramos cinco eventos independientes de Tayassu pecari, en las zonas de vida BmHP-TP, BP-P y BP-M.
Patrones de actividad: Detectamos seis especies diurnas (M. frenata, E. barbara, A. geoffroyi, C. imitator, S. granatensis, M. alfari), siete nocturnas y crepusculares (D. marsupialis, C. paca, B. sumichrasti, C. mexicanus, C. semistriatus, P. oposum, T. pecari) y 14 catemerales (P. tajacu, T. bairdi, S. dicei, N. narica, M. temama, L. pardalis, L. tigrinus, L. wiedii, P. concolor, P. onca, H. yagouaroundi, D. novemcinctus, D. punctata, C. latrans). De las especies que mostraron actividad nocturna, seis (B. sumichrasti, C. mexicanus, C. semistriatus, S. dicei, M. temama y C. latrans) mostraron filia lunar, ocho (C. paca, P. tajacu, L. pardalis, L. tigrinus, H. yagouaroundi, D. novemcinctus, N. narica, D. punctata) mostraron fobia lunar y seis especies (D. marsupialis, P. oposum, T. bairdi, L. wiedii, P. concolor y P. onca) no mostraron afinidad al brillo lunar. Analizamos el IAR, el 𝚫 y las pruebas estadísticas (U2 de Watson, Wr y Fisher) de las especies con n>20 con respecto a la presencia de personas y mamíferos domésticos (Apéndice digital, TABLA 4). La mayor similitud en la actividad circadiana de las especies silvestres ocurrió con las vacas y la mayor diferencia con los caballos. Dos especies (E. barbara y D. punctata) mostraron la mayor similitud de actividad circadiana con C. familiaris (Apéndice digital, Fig. 4 a la 23).
Los resultados sugieren que el patrón de actividad de cada especie no mostró diferencia significativa entre la estación seca y la lluviosa (Apéndice digital, TABLA 5). La cantidad de eventos independientes fue significativamente diferente para 12 especies (C. mexicanus, C. semistriatus, D. marsupialis, P. opossum, D. novemcinctus, P. concolor, L. pardalis, L. tigrinus, P. onca, P. tajacu, N. narica, D. punctata) y no fue significativamente diferente para 7 especies (B. sumichrasti, S. dicei, L. wiedii, M. temama, T. bairdii, S. granatensis, E. barbara). Durante la estación seca (2019-2021) ingresaron 301 turistas al Sendero Tres Colinas-Cerro Kamuk y 214 finqueros y turistas al CBQTC. Debido a la emergencia sanitaria ocasionada por el COVID-19, el PILA permaneció cerrado a la visitación desde el 23 de marzo del 2020; los visitantes ingresaron a partir del 1 de diciembre del 2020 con un aforo del 50% (Apéndice digital, TABLA 6).
DISCUSIÓN
Riqueza y estado de conservación: Mediante el fototrampeo detectamos 27 especies silvestres; de acuerdo con Silveira et al. (2003), esto representa cerca del 70% de la riqueza de nuestra población y sitio de estudio. Podríamos detectar otras especies si prolongamos el tiempo de muestreo y aumentamos la cantidad de cámaras trampa (Karanth et al., 2004a; Ahumada et al., 2011) instaladas en el borde de pasos antrópicos (Piedra & Maffei, 2000; Karanth et al., 2004b; Blake et al., 2017; Tan et al., 2018), ya que por diversos factores (Karanth et al., 2004a; Arroita & Monfort, 2015) la detección de mamíferos silvestres varía temporal y espacialmente (O'Connell et al., 2011).
Todas las especies detectadas están en las listas de la UICN, CITES o MINAE, lo cual refleja la importancia de conservación del sitio. Herpailurus yagouaroundi, M. frenata, C. latrans, L. pardalis y L. wiedii muestran un bajo número de detecciones debido a que, por su naturaleza, son raras y elusivas (Tobler et al., 2008). La presencia de carnívoros como C. latrans y seis especies de felinos silvestres, indican un buen estado de conservación de los ecosistemas del PILA y del CBQTC, pues son sensibles a la modificación de la cobertura vegetal (Dirzo et al., 2014) y requieren espacios amplios (Holden & Neang, 2009; Cueva et al., 2010). Dichos ecosistemas son aptos para la conservación de especies a largo plazo (Kappelle, 2004; Avalos, 2007), algunas de las cuales (A. geoffroyi, H. yagouaroundi, L. pardalis, L. tigrinus, L. wiedii, P. concolor, P. onca, T. bairdii, C. paca y T. pecari) tienen poblaciones amenazadas o están en peligro de extinción (Rodríguez et al., 2002).
Abundancia relativa: Tapirus bairdii obtuvo el más alto valor de conservación y fue la segunda especie más abundante (IAR=53,42), similar a lo detectado por Brenes (2018). Sylvilagus dicei fue la tercera especie más abundante (IAR=25,91); al ser una especie endémica de Talamanca (Wainwright, 2007), depende por completo de un área específica y es mucho más vulnerable a los cambios en la composición vegetal (Kappelle, 2008). Los constantes registros (IAR=3,09) de P. onca melánico en el BP-S a 3142 msnm es novedoso, pues dicha especie es rara en elevaciones superiores a 2000 msnm (González et al., 2008). Los múltiples registros melánicos de P. onca y L. tigrinus siguieron el mismo patrón de actividad descrito por Mooring et al. (2020).
Uso del espacio: Hay una considerable similitud de especies en el PILA que también están en el CBQTC, sin embargo, la diversidad de especies disminuye conforme aumenta la elevación de los pisos altitudinales (Ramos et al., 2007) desde el CBQTC hasta el PILA. Obtuvimos la mayor riqueza en los pisos altitudinales Premontano y Montano Bajo (CBQTC), lo cual indica un buen estado de conservación con diversos grupos funcionales y sin dominancia de pocas especies (Ahumada et al., 2011). Tanto por zona de vida como por piso altitudinal, las especies con la distribución más amplia fueron T. bairdii, M. temama, N. narica y S. granatensis. Las especies con la distribución más restringida fueron B. sumichrasti, A. geoffroyi, C. imitator, C. mexicanus y M. alfari. A excepción de S. granatensis, se evidenció que el tamaño corporal grande está relacionado con un amplio rango de hogar y densidad (Bakker et al., 2000; Trejo et al., 2010; Ahumada et al., 2011) y se debe considerar su interacción constante con el ecosistema (Maciel et al., 2015). Dos de las elevaciones donde registramos T. pecari coinciden con la distribución descrita por Carrillo et al. (2002) y Wainwright (2007). Sin embargo, detectamos esta especie a 2768 msnm lo cual es poco usual.
Patrones de actividad: El tamaño corporal de P. tajacu, T. bairdi, S. dicei, N. narica, M. temama, L. pardalis, L. tigrinus, L. wiedii, P. concolor, P. onca, H. yagouaroundi, D. novemcinctus, D. punctata, C. latrans les permite alimentarse durante el día y la noche a diferencia de las especies que se sólo se alimentan durante el día (M. frenata, E. barbara, A. geoffroyi, C. imitator, M. alfari) o la noche (D. marsupialis, C. paca, B. sumichrasti, C. mexicanus, C. semistriatus, P. oposum)(Emmons et al., 1983). Detectamos varias presas potenciales (Botts et al., 2020a) entre ellas seis especies unguladas, que indican una población saludable de depredadores grandes pues éstos seleccionan presas igualmente grandes (Tan et al., 2018). Se detectaron especies diurnas, nocturnas-crepusculares y catemerales, pero ninguna fue estrictamente crepuscular (Van Schaik y Griffiths, 1996; Kirk, 2006; Bennie et al., 2014). Estos patrones de actividad obedecen a la morfología y fisiología del sistema visual (Kirk, 2004), a aspectos ecológicos (Di Bitetti et al., 2009), al rol de presas y depredadores (Emmons et al., 1983; Prugh y Golden, 2014; Suselbeek et al., 2014), a la alimentación (Downes, 2001) y al estrés térmico (Owen, 1998).
Algunas especies no mostraron afinidad al brillo lunar (Norris et al., 2010; Penteriani et al., 2013), otras especies mostraron filia (Lizcano & Cavelier, 2000) o fobia (Harmsen et al., 2011); sin embargo, estos patrones de actividad varían incluso entre individuos de la misma especie (Coelho et al., 2008; Oliveira et al., 2010; Harmsen et al., 2011; Michalski & Norris, 2011). En noches con luna llena C. paca, P. tajacu, D. novemcinctus, N. narica y D. punctata no forrajearon para evitar depredadores (Kotler et al., 2010), mientras que L. pardalis, L. tigrinus y H. yagouaroundi evitaron competir con otros predadores mayores (Botts et al., 2020b). Durante la estación seca, L. pardalis mostró mayor actividad en la tarde, quizá aprovechando las horas del día sin lluvia para buscar alimento, aunque Moreno et al. (2012) determinaron que esta especie fue mayormente nocturna (63,2%). Pecari tajacu y M. temama disminuyeron su actividad en el medio día, posiblemente para evitar el estrés térmico (Owen, 1998; Oliveira et al., 2010).
La regeneración natural, los parches boscosos y el abandono de tierras ha favorecido el turismo ecológico y la conservación de los mamíferos (Rodríguez et al., 2002). Éstos desempeñan un importante papel en la estructuración y regeneración de los ecosistemas (Escribano et al., 2015). Recomendamos continuar restaurando la conectividad biológica a través de estrategias como el CBQTC, el cual ha disminuido la deforestación provocada por la agricultura, ganadería e incendios forestales (Martínez, 2013). Concluimos que la semejanza de 22 especies entre el CBQTC y el PILA obedece a la continuidad y gran área boscosa del ASP, lo cual favorece la permanencia y el tránsito de mamíferos silvestres (Sridhari et al., 2008) en el CBQTC y de ahí a otras áreas adyacentes, donde son vulnerables a la cacería y entran en conflicto con los seres humanos (Arias et al., 2008; Céspedes et al., 2008; Cartín & Carrillo, 2017). Recomendamos enfocar acciones de protección a especies como T. pecari, la cual se está movilizando a tierras más altas probablemente por la presión que enfrenta fuera del ASP (Sáenz & Carrillo, 2002).
Para todas las especies silvestres, la mayor similitud en el 𝚫 de su actividad circadiana se observó con B. taurus; la mayor diferencia ocurrió con E. caballus, sin embargo, debido a su pequeña muestra (n=12) este resultado debe interpretarse de manera conservadora. De acuerdo con el 𝚫, la mayor probabilidad de encuentros físicos ocurriría entre los mamíferos silvestres y B. taurus. El mayor valor de superposición (0,90) ocurrió entre N. narica y H. sapiens, por lo cual es posible que los visitantes puedan observarlos. Existe un gran riesgo de zoonosis entre los mamíferos domésticos y humanos hacia los mamíferos silvestres y viceversa (Acha & Szyfres, 2001; Monsalve et al., 2009), por lo cual recomendamos tomar las medidas pertinentes para impedir el paso de mamíferos domésticos hacia el PILA.
Aunque hubo variación en la cantidad de eventos independientes entre las estaciones seca y lluviosa (Santos et al., 2010), el patrón de actividad no fue significativamente diferente. Las estadísticas indican que la riqueza y abundancia de mamíferos silvestres no parece ser afectada por la presencia de humanos y mamíferos domésticos. Concluimos que las regulaciones a la visitación turística (Brenes et al., 2004; SINAC, 2019) han sido una herramienta técnica adecuada para conservar las especies silvestres y recomendamos que éstas se mantengan. Esta investigación es una línea base previo al desarrollo turístico del Sendero Tres Colinas-Cerro Kamuk. Recomendamos continuar con el fototrampeo a largo plazo, para medir el impacto del turismo en los mamíferos silvestres antes, durante y después de la construcción de infraestructura turística.












 uBio
uBio 



