Introducción
En la industria lechera, el semen congelado-descongelado se utiliza principalmente en inseminación artificial (IA) (Chicaiza-Cabezas et al., 2023), lo que favorece la mejora genética del ganado lechero (Koch et al., 2022). La variabilidad en la calidad del semen congelado-descongelado tiene una base genética (Selvaraju et al., 2018). Sin embargo, también existen factores moleculares, como la presencia de proteínas específicas asociadas con la criotolerancia, que podrían influir en la capacidad de congelación del semen (Gomes et al., 2020). Además, los factores ambientales, entre ellos la temperatura y el tiempo de descongelación, pueden afectar la eficiencia del proceso y la calidad del semen después de la descongelación (Yánez-Ortiz et al., 2022).
La fertilidad de los toros utilizados en inseminación artificial debe considerar la calidad inicial de los eyaculados mediante la determinación de las características óptimas en los espermatozoides (Yániz et al., 2015). Los eyaculados se pueden considerar como conjuntos heterogéneos que se distribuyen mediante subpoblaciones espermáticas y que pueden explicar los cambios en la fertilidad de los machos (Martínez-Pastor, 2022; Valverde, Castro-Morales, et al., 2019). Esto remarca la idea de que hay variación individual entre machos respecto de la fertilidad (Valverde et al., 2016) y es necesario evaluar con mayor exactitud y precisión la calidad seminal de los reproductores.
Se ha demostrado que la validación de protocolos óptimos de descongelación del semen criopreservado (Solís et al., 2024) puede mejorar los parámetros de movilidad de los espermatozoides y la preservación de la integridad celular (Layek et al., 2016). Estos protocolos deben incluir la valoración de la calidad espermática mediante métodos objetivos de análisis (Gallagher et al., 2018; Mortimer & De Jonge, 2018; Soler, Valverde, et al., 2017; Yániz, Silvestre, et al., 2018), lo cual se logra mediante la evaluación in vitro de la movilidad espermática con sistemas computacionales de análisis espermático (Computer-Assisted Semen Analysis, CASA) (Bompart et al., 2019; Gacem et al., 2020).
La caracterización de los eyaculados mediante subpoblaciones espermáticas en función de variables cinemáticas es posible debido a la tecnología CASA. Esto ha posibilitado caracterizar subpoblaciones espermáticas en diversas especies como bovinos de leche (Valverde et al., 2016), bovinos de carne (Araya-Zúñiga et al., 2024), ovinos (Barbas et al., 2018), caprinos (Vázquez et al., 2015), verracos (Valverde, Madrigal, et al., 2019), caballos (Gacem et al., 2021), burros (Gacem et al., 2020), conejos (Quintero-Moreno et al., 2007) y llamas (Cucho et al., 2021). La información que se obtiene de estos análisis permite describir funcionalmente los gametos masculinos y considera la variación intrínseca de los eyaculados (Barquero, Roldan, et al., 2021; Barquero, Soler, et al., 2021; Holt & Satake, 2018). También se han realizado análisis de subpoblaciones espermáticas en otras especies de animales como perros (Soler, Alambiaga, et al., 2017; Valverde, Arnau, et al., 2019), zorros (Soler, Contell, et al., 2017), venados (Cucho et al., 2022), salmones (Caldeira et al., 2018; 2019), cocodrilos (Valverde et al., 2021), caimanes (Valverde, Madrigal-Valverde, et al., 2019), aves (García-Herreros, 2016) y humanos (García-Molina et al., 2022; 2023).
El análisis de subpoblaciones espermáticas ha permitido comprender mejor el funcionamiento del eyaculado en las especies y explicar el fenómeno de la fertilidad (Valverde et al., 2021). Desde un punto de vista biológico, la distribución de subpoblaciones en el eyaculado ha servido de base para plantear la hipótesis del mecanismo de selección espermática que ha favorecido el éxito de las especies con el paso de los años (Martínez-Pastor, 2022).
La evaluación de la temperatura y el tiempo de descongelación del semen puede proporcionar información adicional para evaluar los efectos del proceso mediante pruebas de resistencia térmica (TRT) (Solís et al., 2024). La TRT busca simular las condiciones del tracto reproductivo femenino (Schulze et al., 2019). Las muestras de esperma son heterogéneas (Valverde et al., 2016), lo que implica que en un mismo eyaculado coexisten espermatozoides con diferentes patrones cinemáticos y de movilidad (García-Molina et al., 2020; Valverde, Castro-Morales, et al., 2019; Víquez et al., 2021).
Actualmente, el eyaculado se puede considerar como un conglomerado de subpoblaciones de espermatozoides bien definido, cuyo significado biológico se está entendiendo mejor en diversas especies (Barquero, Roldan, et al., 2021; Víquez et al., 2020). Esto ha conllevado a mejorar la caracterización de las subpoblaciones para explicar con mayor precisión la fertilidad potencial de un eyaculado (Ibanescu et al., 2020). Por lo tanto, el objetivo del presente estudio fue evaluar la variación en la estructura subpoblacional cinemática del semen congelado-descongelado en razas Jersey y Holstein usando un sistema CASA-mot.
Materiales y métodos
Aprobación ética
Este estudio fue aprobado de conformidad con los principios éticos, por el Comité del Centro de Investigación y Desarrollo en Agricultura Sostenible para el Trópico Húmedo del Instituto Tecnológico de Costa Rica (CIDASTH-ITCR), según la Sección 08/2023, artículo 5.0, DAGSC-075-2023 y CIE-206-2023.
Período de estudio y ubicación
La investigación se realizó de abril a noviembre de 2023 en el Laboratorio de Reproducción Animal (AndroTEC), ubicado en el Campus Tecnológico Local San Carlos del Instituto Tecnológico de Costa Rica, en Santa Clara, Florencia, San Carlos, Alajuela, Costa Rica (CRTM05; X: 444296 Y: 1146016). El sitio se encuentra a una altitud de 70 m s. n. m., y en condiciones climatológicas de trópico húmedo.
Dosis de semen, procedimientos de descongelación y diseño del estudio
En este trabajo se utilizaron 72 dosis de semen congelado-descongelado provenientes de ocho toros de dos razas (Holstein, n = 4; Jersey, n = 4). Para los análisis, se emplearon nueve dosis de semen por toro, envasadas en pajillas de 0,25 mL de volumen y almacenadas en un tanque criogénico MVE® XC 20 Signature (MVE Biological Solutions, Ball Ground, Georgia, EE. UU.). Cada dosis se descongeló en un baño de agua de laboratorio termorregulado (Digisystem Laboratory Instruments Inc., New Taipei City, Taiwán) a 37 °C durante 30 s. Después de la descongelación, el contenido de cada pajilla se diluyó 1:10 (vol:vol) con el diluyente comercial OptiXcell® (IMV, L’Aigle, Francia) en tubos Eppendorf® (Sigma-Aldrich, St. Louis, Misuri, EE. UU.).
Evaluación del semen
El análisis se realizó mediante el sistema CASA-mot ISAS®v1 (Sistema Integrado de Análisis de Semen, Proiser I+D, Paterna, España), equipado con una cámara de video (Proiser 782M, Proiser I+D) que capturaba imágenes a 50 fotogramas por segundo (fps) y una resolución final de 768 × 576 píxeles. La cámara se conectó a un microscopio UB203 (UOP/Proiser R+D) con un ocular de 1× y un objetivo de contraste de fase negativa de 10× (AN 0,25). El microscopio contaba con una platina térmica integrada, fijada a 37,0 ± 0,5 °C. Se colocaron submuestras de 3 µL de semen descongelado en una cámara de recuento Spermtrack® (Proiser I+D, Paterna, España) precalentada a 37 °C. Para cada muestra evaluada se realizaron dos réplicas. Se capturaron al menos siete campos microscópicos, con un total mínimo de 600 espermatozoides, registrando su movilidad y cinética. Para los análisis, se utilizaron los porcentajes de movilidad total (TM) y movilidad progresiva (PM), junto con velocidad rectilínea (VSL, μm s-1), velocidad curvilínea (VCL, μm s-1), velocidad de trayectoria promedio (VAP, μm s-1), frecuencia de cruce (BCF, Hz), desplazamiento lateral de la cabeza (ALH, μm), linealidad (LIN=VSL/VCL·100), rectitud (STR=VSL/VAP·100) y oscilación (WOB=VAP/VCL·100).
Análisis estadístico
Los supuestos de normalidad y homocedasticidad se evaluaron mediante las pruebas de Shapiro-Wilk y Levene. Además, la normalidad de los parámetros espermáticos se estimó mediante la prueba probabilística normal. Una vez probadas las hipótesis de distribución normal y homogeneidad de varianzas, se ejecutó un análisis de variancia (ANDEVA) de medias repetidas. El efecto de la raza sobre las características cinemáticas del esperma bovino se analizó mediante ANDEVA de medidas repetidas. Se utilizaron modelos generales lineales y mixtos para evaluar las variables cinemáticas y de movilidad del esperma bovino. Se efectuaron pruebas de comparación múltiple mediante el método de mínimos cuadrados, con una corrección de Bonferroni y un nivel de significación estadística de P < 0,05.
Se creó un subconjunto de datos a partir de las ocho variables cinemáticas y se realizaron procedimientos multivariados para identificar grupos a partir de este subconjunto de datos cinemáticos de espermatozoides. Todos los valores de las variables cinemáticas fueron estandarizados para evitar cualquier efecto de escala. Se ejecutó un análisis de factores principales (PFA, por sus siglas en inglés) sobre estos datos para derivar una pequeña cantidad de combinaciones lineales que aún conservaban la mayor cantidad de información posible de las variables originales. Las comunalidades previas para este análisis se estimaron a partir del coeficiente máximo de correlación absoluta entre cada variable y cualquier otra. El número de factores principales (FP) a extraer se determinó a partir del criterio de Kaiser, es decir, se seleccionaron solo aquellos con un valor propio >1. También se obtuvo la estadística KMO (Kaiser, Meyer, Olkin) como medida de la adecuación del conjunto de datos para la extracción de factores. Como método de rotación, se utilizó el método Varimax con normalización de Kaiser.
Se exploraron las correlaciones entre factores y variables cinemáticas originales para comprender mejor el significado de los factores extraídos. Además, se efectuó un análisis para clasificar los espermatozoides en un número reducido de grupos, según las puntuaciones obtenidas del análisis factorial. Esto se logró en dos fases con la combinación de procedimientos de agrupamiento jerárquico y no jerárquico. En primer lugar, las puntuaciones de los factores para todos los eyaculados se agruparon jerárquicamente utilizando el método de varianza mínima de Ward. En segundo lugar, el número óptimo de conglomerados obtenido en el análisis anterior se utilizó como número objetivo de conglomerados en un análisis de conglomerados de K-medias no jerárquico.
Se aplicó un ANDEVA para evaluar las diferencias estadísticas entre grupos para todas las variables cinemáticas. El umbral de significación se definió como P < 0,05. También se llevó a cabo una comparación por pares entre las medias de los grupos mediante la prueba de Tukey-Kramer. Los resultados se presentaron como media ± desviación estándar de la media. Todos los datos se analizaron utilizando el programa estadístico IBM SPSS, versión 23.0, para Windows (SPSS Inc., Chicago, Illinois, EE. UU.).
Resultados
Los toros Jersey presentaron valores mayores de espermatozoides móviles totales, móviles progresivos y espermatozoides con movimiento categorizado como rápido que los toros Holstein (P < 0,05; Cuadro 1). Los porcentajes de las variables de movilidad espermática categorizadas con movimiento medio y lento no fueron significativamente diferentes entre las dos razas. No hubo diferencias entre los porcentajes de morfoanomalías espermáticas entre razas.
Cuadro 1 Variables de movilidad espermática (media ± EEM) en dosis seminales congeladas-descongeladas de ganado lechero. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
| Variable (%) | Raza | |
| Jersey | Holstein | |
| Movilidad total | 67,88 ± 3,66b | 55,51 ± 3,50a |
| Movilidad progresiva | 46,54 ± 2,46b | 38,07 ± 2,36a |
| Movilidad progresiva (% del total de móviles) | 69,27 ± 1,55a | 70,66 ± 1,49a |
| Espermatozoides rápidos* | 65,66 ± 3,65b | 52,89 ± 3,49a |
| Espermatozoides medios | 1,97 ± 0,18a | 2,24 ± 0,17a |
| Espermatozoides lentos | 0,26 ± 0,09a | 0,38 ± 0,08a |
| Morfología normal | 85,75 ± 2,10a | 90,00 ± 2,14a |
| Morfología anormal | 14,25 ± 2,11a | 10,00 ± 2,15a |
EEM = error estándar de la media. * Espermatozoides con movimiento categorizado como rápido (>45 μm·s-1). a, b Superíndices con distinta letra en una misma fila indican diferencias entre razas. P < 0,05. / SEM = standard error of the mean. * Spermatozoa with movement categorized as rapid (>45 μm·s-¹). a, b Superscripts with different letters in the same row indicate differences between breeds. P < 0.05.
El análisis de factores principales indicó un valor estadístico KMO (Kaiser, Meyer, Olkin) de 0,61, y las estimaciones finales de comunalidad estuvieron por encima de 0,90 para todas las variables cinemáticas, excepto BCF (0,05). Según el criterio de Kaiser, de estos datos se extrajeron dos FP significativos que representaron el 87,50 % de la varianza total. El primer FP, definido como trayectoria lineal (FP1), fue responsable del 45,40 % de la varianza y se asoció principalmente con las variables cinemáticas LIN, WOB, STR y VSL, con la mayor correlación para LIN (0,985). El segundo FP, definido como velocidad (FP2), estuvo fuertemente asociado con las variables VCL, ALH, VAP y VSL, con la mayor correlación para VCL (0,983) (Cuadro 2).
Cuadro 2 Valores propios (correlaciones) entre variables de cinética espermática en semen criopreservado de ganado lechero (solución rotada) y factores principales (FP1, FP2)*. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
| Variable | FP1 (Lineal) | FP2 (Velocidad) |
| LIN | 0,98 | |
| WOB | 0,84 | |
| STR | 0,79 | |
| VSL | 0,72 | 0,66 |
| VCL | 0,98 | |
| ALH | 0,92 | |
| VAP | 0,79 | |
| BCF | - | |
| Var. exp. (%) | 45,40 | 42,10 |
Var. exp. = varianza explicada en cada factor principal (FP). Varianza total explicada = 87,50 %. * Expresa las variables más importantes en cada FP. Solo autovalores >0,6 se presentan. VCL = velocidad curvilínea (µm·s-1); VSL = velocidad rectilínea (µm·s-1); VAP = velocidad promedio (µm·s-1); LIN = índice de linealidad (%); STR = índice de rectitud (%); WOB = índice de oscilación (%); ALH = amplitud del desplazamiento lateral de la cabeza (µm); BCF = frecuencia de entrecruzamiento (Hz). / Var. exp. = variance explained by each principal component (PC). Total variance explained = 87.50 %. * Indicates the most important variables in each PC. Only eigenvalues >0.6 are presented. VCL = curvilinear velocity (µm·s-1); VSL = straight line velocity (µm·s-1); VAP = average path velocity (µm·s-1); LIN = linearity of forward progression (%); STR = straightness (%); WOB = wobble (%); ALH = amplitude of lateral head displacement (µm); BCF = beat-cross frequency (Hz).
El semen bovino congelado-descongelado se agrupó en tres grupos de acuerdo con la varianza mínima jerárquica de Ward, seguido de procedimientos de agrupamiento de k-medias no jerárquicos (Cuadro 3). Los parámetros cinemáticos caracterizaron el movimiento de los espermatozoides como subpoblación 2 (SP2), que fueron los espermatozoides con mayor VCL y VSL (229,65 ± 0,57 µm s-1; 104,18 ± 0,41 µm s-1, respectivamente). Estos eyaculados presentan espermatozoides con mayor BCF y ALH (15,70 ± 0,08 Hz; 5,35 ± 0,01 µm, respectivamente).
Cuadro 3 Variables cinemáticas (media ± EEM) de tres subpoblaciones (SPs) espermáticas en dosis seminales congeladas-descongeladas de ganado lechero. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
| Variable | SP1 | SP2 | SP3 |
| VCL | 106,64 ± 0,50a | 229,65 ± 0,57c | 127,59 ± 0,56b |
| VSL | 26,29 ± 0,37a | 104,18 ± 0,41c | 84,52 ± 0,41b |
| VAP | 48,33 ± 0,34a | 121,08 ± 0,38c | 89,37 ± 0,37b |
| LIN | 24,94 ± 0,16a | 45,52 ± 0,18b | 65,72 ± 0,17c |
| STR | 54,69 ± 0,22a | 84,05 ± 0,25b | 91,55 ± 0,25c |
| WOB | 45,80 ± 0,13a | 53,06 ± 0,15b | 70,24 ± 0,14c |
| ALH | 3,14 ± 0,01b | 5,35 ± 0,01c | 2,72 ± 0,01a |
| BCF | 9,17 ± 0,07a | 15,70 ± 0,08c | 15,38 ± 0,08b |
EEM = error estándar de la media. SP1 = lentos, no progresivos y movimiento no ondulatorio; SP2 = rápidos, velocidad alta y progresiva; SP3 = velocidad media, progresivos y movimiento ondulatorio. Número de dosis seminales = 72. VCL = velocidad curvilínea (µm·s-1); VSL = velocidad rectilínea (µm·s-1); VAP = velocidad promedio (µm·s-1); LIN = índice de linealidad (%); STR = índice de rectitud (%); WOB = índice de oscilación (%); ALH = amplitud del desplazamiento lateral de la cabeza (µm); BCF = frecuencia de entrecruzamiento (Hz). a-c Letras distintas indican diferencias entre subpoblaciones espermáticas. P < 0,05. / SEM = standard error of the mean. SP1 = slow, non-progressive, and non-wavy motion; SP2 = fast, high velocity, and progressive; SP3 = medium velocity, progressive, and wave motion. Number of semen doses = 72. VCL = curvilinear velocity (µm·s-1); VSL = straight-line velocity (µm·s-1); VAP = average path velocity (µm·s-1); LIN = linearity index (%); STR = straightness index (%); WOB = wobble index (%); ALH = amplitude of lateral head displacement (µm); BCF = beat-cross frequency (Hz). a-c Different letters indicate significant differences between sperm subpopulations. P < 0.05.
La subpoblación 3 (SP3) incluyó espermatozoides caracterizados por VSL alto (84,52 ± 0,41 µm s-1) y los valores más altos de LIN y STR (65,72 ± 0,17 %; 91,55 ± 0,25 %, respectivamente). La subpoblación 1 (SP1) presentó espermatozoides menos lineales, como lo indican los menores VSL y VAP (26,29 ± 0,37 µm s-1; 48,33 ± 0,34 µm s-1, respectivamente). Los espermatozoides de esta subpoblación también mostraron la menor progresividad, con los valores más bajos de LIN y STR (24,94 ± 0,16 %; 54,69 ± 0,22 %, respectivamente) (Cuadro 3).
Se hallaron diferencias (P < 0,05) entre las subpoblaciones espermáticas (SP1, SP2 y SP3) para las razas Jersey y Holstein. En la raza Jersey, la SP2 presentó los valores más altos en VCL (244,54 ± 0,76 µm-1), mientras que la SP1 tuvo los valores más bajos en esta variable. En la raza Holstein, se observó un patrón similar. El grupo SP2 mostró los valores más altos en VCL (201,00 ± 0,80 µm s-1) (Figura 1).
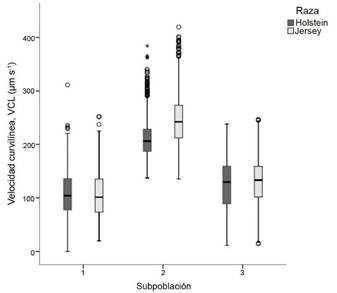
Figura 1 Diagrama de cajas para valores medios de velocidad curvilínea (VCL, µm s-1) en subpoblaciones espermáticas de semen congelado-descongelado de ganado lechero. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
Al analizar los índices de linealidad y progresividad celular, se encontró que la SP3 mostró valores más altos (P < 0,05) en LIN (67,52 ± 0,24 %) en la raza Jersey. En la raza Holstein, se halló un patrón similar con valores de LIN (63,07 ± 0,26 %) más altos en la SP3. Los valores más bajos en ambas razas se observaron en la SP1 (Figura 2).
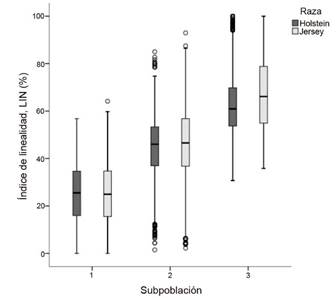
Figura 2 Diagrama de cajas para valores medios de índice de linealidad en subpoblaciones espermáticas de semen congelado-descongelado de ganado lechero. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
Los valores de ondulación espermática mayores (P < 0,05) en la raza Jersey se presentaron en la SP2, con una frecuencia de entrecruzamiento, BCF (15,93 ± 0,11 Hz), mientras que en la SP1 se encontraron los valores más bajos en esta variable. En la raza Holstein, se observó un patrón similar. La SP2 mostró los valores más altos (P < 0,05) en BCF (15,40 ± 0,12 Hz), mientras que SP1 tuvo los valores más bajos (Figura 3).
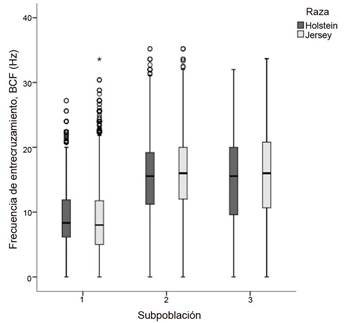
Figura 3 Diagrama de cajas para valores medios de frecuencia de entrecruzamiento en subpoblaciones espermáticas de semen congelado-descongelado de ganado lechero. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
Se hallaron diferencias (P < 0,05) entre las subpoblaciones espermáticas (SP1, SP2 y SP3) para las razas Jersey y Holstein. En la raza Jersey, la SP2 presentó los valores más altos en VSL (112,36 ± 0,60 µm s-1) y VAP (130,32 ± 0,53 µm s-1), mientras que la SP1 mostró los valores más bajos en estas mismas variables. En la raza Holstein, se observó un patrón similar. En el grupo SP2 se encontraron los valores más altos en VSL (93,49 ± 0,53 µm s-1) y VAP (109,00 ± 0,51 µm s-1) (Cuadro 4).
Cuadro 4 Variables cinemáticas (media ± EEM) en subpoblaciones espermáticas (SP) de semen criopreservado de ganado lechero. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
| Variable | Jersey | Holstein | ||||
| SP1 | SP2 | SP3 | SP1 | SP2 | SP3 | |
| VSL | 25,84 ± 0,57a | 112,36 ± 0,60c | 89,18 ± 0,57b | 26,71 ± 0,43a | 93,49 ± 0,53c | 77,70 ± 0,54b |
| VAP | 48,18 ± 0,51a | 130,32 ± 0,53c | 94,53 ± 0,51b | 48,49 ± 0,41a | 109,00 ± 0,51c | 81,80 ± 0,52b |
| STR | 53,62 ± 0,32a | 83,81 ± 0,33b | 91,25 ± 0,32c | 55,69 ± 0,32a | 84,37 ± 0,40b | 92,00 ± 0,40c |
| WOB | 46,32 ± 0,20a | 53,85 ± 0,21b | 72,35 ± 0,20c | 45,33 ± 0,17a | 52,02 ± 0,21b | 67,14 ± 0,22c |
| ALH | 3,07 ± 0,02b | 5,52 ± 0,02c | 2,67 ± 0,02a | 3,21 ± 0,02b | 5,13 ± 0,02c | 2,79 ± 0,02a |
EEM = error estándar de la media. SP1 = lentos, no progresivos y movimiento no ondulatorio; SP2 = rápidos, velocidad alta y progresiva; SP3 = velocidad media, progresivos y movimiento ondulatorio. Número de dosis seminales = 72. VCL = velocidad curvilínea (µm·s-1); VSL = velocidad rectilínea (µm·s-1); VAP = velocidad promedio (µm·s-1); LIN = índice de linealidad (%); STR = índice de rectitud (%); WOB = índice de oscilación (%); ALH = amplitud del desplazamiento lateral de la cabeza (µm); BCF = frecuencia de entrecruzamiento (Hz). a-c Letras distintas indican diferencias entre subpoblaciones espermáticas. P < 0,05. / SEM = standard error of the mean. SP1 = slow, non-progressive, and non-wavy motion; SP2 = fast, high velocity, and progressive; SP3 = medium velocity, progressive, and wave motion. Number of semen doses = 72. VCL = curvilinear velocity (µm·s-1); VSL = straight-line velocity (µm·s-1); VAP = average path velocity (µm·s-1); LIN = linearity index (%); STR = straightness index (%); WOB = wobble index (%); ALH = amplitude of lateral head displacement (µm); BCF = beat-cross frequency (Hz). a-c Different letters indicate significant differences between sperm subpopulations. P < 0.05.
Al analizar los índices de linealidad y progresividad celular se encontró que en la raza Jersey, la SP3 mostró valores más altos (P < 0,05) en STR (91,25 ± 0,32 %) y WOB (72,35 ± 0,20 %). La raza Holstein presentó un patrón similar con valores de STR (92,00 ± 0,40 %) y WOB (67,14 ± 0,22 %) más altos en la SP3. La ALH en la raza Jersey fue mayor (P < 0,05) en la SP2 (5,52 ± 0,02 µm) en comparación con las otras subpoblaciones, mientras que en la raza Holstein se observó un patrón similar. La SP2 exhibió los valores más altos (P < 0,05) en ALH (5,13 ± 0,02 µm) respecto a las demás subpoblaciones (Cuadro 4).
Las trayectorias promedio para las variables de velocidad de cada subpoblación y cada raza se observan en la Figura 4. En general, los patrones de velocidad de las células espermáticas por subpoblación y raza son similares para los grupos SP1 y SP2. En el caso de la SP3, difiere debido a que trayectoria de la raza Holstein muestra una tendencia a ser un movimiento más lineal respecto a la presentada por la raza Jersey.
Discusión
Las dosis de semen criopreservado de razas lecheras presentaron variaciones en los patrones de movilidad y cinemáticos de los espermatozoides asociadas con los procesos de descongelación. Esto podría deberse a la variación individual dentro de la misma especie con respecto a la calidad seminal posdescongelación (Morrell et al., 2018) y los protocolos de congelación y descongelación utilizados (Botta et al., 2019). Los resultados obtenidos difieren de lo descrito en otros trabajos, donde se evaluó la movilidad progresiva en razas lecheras y se reportaron valores mayores en la raza Holstein (Hoflack et al., 2006).
Algunos estudios han asociado las tasas de preñez en bovino con las subpoblaciones espermáticas de grupos de animales previamente definidos como de alta y baja fertilidad (Hidalgo et al., 2021). Toros de alta fertilidad han mostrado mayor porcentaje de espermatozoides con movilidad total y progresiva elevada porque presentan células con velocidad rápida. En investigaciones previas con ganado lechero se han registrado valores altos de movilidad, progresividad, velocidad rápida y mayor amplitud del desplazamiento lateral de la cabeza del espermatozoide (ALH), lo cual se ha correlacionado con una mayor criotolerancia y alta fertilidad (Kathiravan et al., 2011). Las variables cinemáticas de los espermatozoides han demostrado variar según las razas y pueden estar afectadas por factores extrínsecos (Víquez et al., 2020).
La tecnología CASA permite evaluar variables avanzadas de cinética espermática y contabilizar el registro individual de cada célula mediante una tasa de fotogramas (Barquero, Víquez, et al., 2021; Bompart et al., 2018; 2019). Esto posibilita una mayor confiabilidad en las estimaciones de las trayectorias medidas en el sistema (Van der Horst, 2020). Para mayor practicidad, el sistema puede promediar los valores cinemáticos para generar informes, lo cual puede causar pérdida de información relevante bajo la premisa de la uniformidad del eyaculado (Martínez-Pastor et al., 2011; Ramón & Martínez-Pastor, 2018).
En diversas investigaciones en especies animales como porcinos (Valverde, Madrigal, et al., 2019), bovinos (Araya-Zúñiga et al., 2024; Pichardo-Matamoros et al., 2023; Solís et al., 2024), equinos (Gacem et al., 2021), perros (Valverde, Arnau, et al., 2019), camélidos (Cucho et al., 2021), aves (García-Herreros, 2016), peces (Caldeira et al., 2018) y cocodrilos (Valverde et al., 2021) se ha reconocido la heterogeneidad del eyaculado y se ha asociado a variabilidad en la fertilidad de los machos, como en el presente estudio. Este trabajo aplicó el análisis de subpoblaciones espermáticas para cuantificar la calidad seminal posdescongelación en semen criopreservado de ganado lechero, al utilizar toda la información disponible de los sistemas CASA.
La caracterización de las variables cinemáticas se realizó mediante tres conjuntos o subpoblaciones espermáticas con patrones de natación similares en trabajos previos (Hidalgo et al., 2021; Ibanescu et al., 2020; Ibănescu et al., 2018). El estudio demostró que los toros Jersey poseen mejores patrones de espermatozoides móviles y progresivamente móviles que los de Holstein, lo cual indica que los toros Jersey tienen mejores datos de fertilidad potencial. Los resultados de las subpoblaciones espermáticas mostraron que los mejores valores de movilidad se presentaron en la SP2, al igual que en la raza Holstein, aunque la distribución del número de células asociado con cada subpoblación fue diferente.
Varios autores han afirmado que los valores cinemáticos están relacionados con datos de la tasa de preñez y el índice de fertilidad (Winters et al., 2018). La subpoblación espermática predominante fue la SP2, compuesta por espermatozoides con cinética rápida y ondulatoria. Esta subpoblación muestra características distintivas de espermatozoides hiperactivados y valores intermedios de progresividad, superados solamente por los valores de linealidad e índice de rectitud en la SP3. La cinética de las células hiperactivadas se caracteriza por un patrón de natación robusto, no lineal, con una gran amplitud y un batido flagelar asimétrico, que permite a los espermatozoides penetrar la zona pelúcida (Kathiravan et al., 2011).
Algunos trabajos han reportado que patrones de hiperactivación del semen se han presentado en toros con mayor fertilidad en inseminación artificial (Gallego et al., 2014; Shojaei et al., 2012). También se ha señalado una correlación positiva entre la proporción de espermatozoides con movimientos rápidos y no lineales y las tasas de no retorno al estro de las vacas (Ibanescu et al., 2020). Investigaciones en otras especies, como equinos (Quintero-Moreno et al., 2003) y ovinos (Yániz et al., 2015), han sugerido que la subpoblación espermática que contiene espermatozoides rápidos y lineales se relaciona con mayores tasas de fertilidad; sin embargo, estos estudios se realizaron con semen fresco y en condiciones experimentales distintas a las del presente trabajo.
Diversas investigaciones han determinado subpoblaciones espermáticas en ganado lechero. No obstante, los algoritmos utilizados para describir estos conjuntos celulares en el eyaculado no siempre tienen relevancia biológica (Víquez et al., 2020). Esto conlleva la necesidad de validar los resultados desde el pragmatismo biológico de su significado, además de emplear el método de agrupamiento estadístico apropiado para determinar las subpoblaciones de espermatozoides en muestras seminales. Estos hallazgos constituyen una herramienta que incorpora el volumen de datos aportado por los sistemas CASA (Valverde et al., 2020) y el análisis multivariado de datos para describir animales con mayor proporción de gametos con patrones de natación en subpoblaciones espermáticas con mayor velocidad y linealidad, para proporcionar información adicional sobre la fertilidad de los machos (Barquero, Roldan, et al., 2021).
En el presente trabajo, se caracterizó el semen congelado-descongelado de toros de razas Holstein y Jersey con base en variables como la velocidad y la progresividad espermática. Esto permitió describir tanto eyaculados rápidos y progresivos como lentos y no progresivos. El estudio describió las dosis congeladas-descongeladas en términos de subpoblaciones espermáticas para la caracterización de la fertilidad de los machos de acuerdo con la calidad seminal. Otras investigaciones también han descrito subpoblaciones de espermatozoides (Valverde et al., 2016; Yániz, Palacín, et al., 2018).
La fertilidad es multifactorial, y el semen solo influye en el resultado final. En cambio, la vaca tiene múltiples factores que influyen. Entre los principales factores que afectan tanto la fertilidad de las hembras como de los machos se encuentran el clima (Stefanska et al., 2024), el estado nutricional (Butler, 2014) y la actividad endocrina (Sitko et al., 2024). Adicionalmente, los factores externos en los procesos de poscongelación, como la temperatura y el tiempo en que se descongelan las células, podrían condicionar las características celulares y limitar su funcionalidad.
Conclusiones
El análisis de factores principales mostró que dos factores explican el 87,50 % de la varianza total en las variables cinemáticas del semen congelado-descongelado y permitió su clasificación en tres subpoblaciones de espermatozoides. Se encontraron diferencias en la distribución y los patrones de natación de las subpoblaciones identificadas en ambas razas lecheras. Estos hallazgos sugieren que, aunque existieron diferencias en la movilidad y cinética espermática entre los toros Jersey y Holstein, ambos grupos presentaron subpoblaciones espermáticas con características distintivas que podrían influir en su fertilidad y rendimiento reproductivo.
















