Introducción
Los insectos de la familia Cerambycidae son conocidos comúnmente como escarabajos longicornios debido a que sus antenas son más largas que el resto de su cuerpo (Martínez, 2000), a excepción de las subfamilias Parandrinae y Prioninae. La mayoría de las especies durante su fase larval son barrenadoras de madera y pueden provocar el deterioro de árboles frutales y maderables; los adultos presentan una alimentación variada desde árboles caídos o enfermos, madera en descomposición, hojas, savia y polen (Morales-Morales et al., 2012).
El rol ecológico de estos escarabajos en el ecosistema va más allá de la degradación de materia orgánica. Calderón-Cortés et al. (2011) demostraron que dentro de las interacciones no tróficas son considerados impulsores o ingenieros ecológicos relevantes de la diversidad, debido a que modifican directa o indirectamente los hábitats y aumentan la disponibilidad de recursos para otros organismos (Lemes et al., 2015; Novais et al., 2017). Un aspecto importante para algunas especies de cerambícidos es que su presencia puede estar determinada por diversos factores como: la composición taxonómica de árboles, la cubierta del dosel y los árboles en descomposición (Fahri et al., 2016), es así, que tanto su distribución y abundancia puede verse alterada debido al cambio en el uso de suelo, la tala y la extracción de madera de los bosques (Kouadio et al., 2009; Ponpinij et al., 2011).
Uno de los ecosistemas más importantes por su alta productividad son los bosques de manglar (Gerónimo-Torres et al., 2015), su funcionamiento y papel ecológico radica en las funciones que desempeña en las líneas costeras, proporcionando hábitat, refugio y alimentación para diversas especies (Lewis, 2005). Dentro de las investigaciones realizadas de diversidad y relaciones ecológicas de la entomofauna en el ecosistema manglar podemos encontrar estudios de lepidópteros de la familia Geometridae (Gara et al., 2001), dípteros de la familia Culicidae (Berti et al., 2010), himenópteros de la familia Formicidae (Castaño-Meneses, 2012; Pinto-Mendez, 2011) y de coleópteros de la familia Coccinellidae (Cornejo & González, 2014), Bostrichidae (Gerónimo-Torres et al., 2021a) y Curculionidae de las subfamilias Scolytinae y Platypodinae (Gerónimo-Torres et al., 2015; Gerónimo-Torres et al., 2021a). Sin embargo, no se han realizado estudios enfocados a evaluar la diversidad y dinámica de la comunidad de Cerambycidae, solo se conocen algunas especies asociadas a este ecosistema producto de investigaciones de diversidad entomológica, como lo registrado por Sayes et al. (2019), quienes reportan la presencia de Heterachthes sablensis Blatchley 1920, Callipogon barbatum (Fabricius 1781) y Eliphidion sp. Audinet-Serville 1834 en manglares de El Salvador. Por lo anterior, el objetivo del presente estudio fue determinar la diversidad y fluctuación anual de la comunidad de cerambícidos, así como la distribución vertical de la riqueza de especies asociadas al borde e interior de un manglar en el estado de Tabasco, México.
Materiales y métodos
El bosque de manglar estudiado se localiza en el ejido Chiltepec (18°25’28” N & 93° 09’57” W) del municipio de Paraíso, Tabasco, México. El suelo es principalmente arenoso y profundo de mediana fertilidad denominados arenosoles. El clima es cálido húmedo con una estación seca a finales de invierno y primavera, con lluvias en verano y principios de otoño, la temperatura media anual es de 26.5 °C, con una precipitación pluvial media anual de 1 760 mm (Instituto Nacional de Estadística y Geografía (INEGI), 2017). En el borde del manglar se encuentra una alta abundancia de Langucularia racemosa (L.) Gaertn., con la presencia de especies de las familias Burseraceae, Fabaceae, Arecaceae y Anacardiaceae, mientras hacia el interior del manglar se encuentran especies como Rhizophora mangle L., Avicennia germinans L. y L. racemosa, con una altura promedio de 12 m y un área basal de 1.3 m2/0.1 ha (Gerónimo-Torres et al., 2021a).
El muestreo de los insectos se realizó de agosto 2016 a julio 2017. La metodología utilizada fue de acuerdo con la descrita por Álvarez-Ramón et al. (2022), donde se seleccionaron tres puntos de muestreo en el borde del manglar y tres puntos en el interior, cada punto de muestreo tanto en el borde como en el interior estuvieron separados a 50 m y separados 200 m los puntos del interior respecto a los del borde. En cada punto de muestreo se instalaron tres trampas de intercepción cebadas con alcohol etílico al 70 % a tres diferentes alturas: 1.5, 6 y 12 m. La recolecta de los insectos atraídos en cada una de las trampas se realizó cada 15 días por un año. Los especímenes recolectados fueron conservados en frasco con alcohol etílico al 70 % para su posterior identificación en el laboratorio.
Identificación de ejemplares: La identificación taxonómica de los especímenes se realizó con el uso de claves taxonómicas y descripciones de especies (Maes et al., 2010a; Maes et al., 2010b; Maes et al., 2010c; Maes et al., 2010d; Maes et al., 2010e; Monné et al., 2020; Monné & Bezark, 2012; Toledo, 1997; Toledo & Hovore, 2005; Turnbow & Thomas, 2002; Verdugo, 2004) y comparados con los especímenes de la Colección de Insectos de la Universidad de Tabasco (CIUT) del Centro de Investigación para la Conservación y Aprovechamiento de Recursos Tropicales (CICART) de la División Académica de Ciencias Biológicas de la Universidad Juárez Autónoma de Tabasco.
Análisis de datos: La diversidad de cerambícidos en el borde e interior del manglar se determinó a través del índice de diversidad verdadera de orden 1 (1D), en la cual todas las especies son consideradas en el valor de diversidad, ponderadas proporcionalmente según su abundancia en la comunidad (Moreno et al., 2011). La equidad de las comunidades del borde e interior se determinó con el índice de Pielou (J'). La similitud de las comunidades del borde e interior, como entre los estratos se calculó con el índice de Sorensen (ls). La completitud del muestreo o cobertura de muestra se evaluó utilizando el estimador de riqueza no paramétrico Chao 1 (Moreno, 2001). La distintividad taxonómica entre las comunidades del borde e interior se analizó con el programa Past versión 3.14 (Hammer et al., 2001), donde se corrieron las métricas asociadas al análisis de jerarquías taxonómicas con los siguientes niveles taxonómicos: familia, subfamilia, tribu, género y especie (Álvarez-Ramón et al., 2022), los índices calculados fueron: a) índice de diversidad taxonómica (Δ), el cual a través de una clasificación linneana del conjunto de especies involucradas y sus abundancias mide la distancia taxonómica entre dos individuos elegidos al azar; b) índice de distintividad taxonómica (Δ*), el cual elimina parcialmente la dependencia de la abundancia y se encarga de medir la distancia taxonómica esperada entre dos individuos elegidos al azar de diferentes especies; y c) índice de distintividad taxonómica promedio (Δ+), en el cual no se considera el esfuerzo de muestreo y mide el promedio de las distancias taxonómicas entre especies (Gerónimo-Torres et al., 2022; Pérez-Hernández, 2019). Posteriormente, se analizó la fluctuación de la comunidad de los insectos recolectados mensualmente y se compararon con la precipitación, temperatura y humedad promedio del área de estudio obtenidas de la estación meteorológica de la Comisión Nacional del Agua (CONAGUA) (18°25’24” N & 093°09’20” W).
Resultados
Composición: Se recolectaron un total de 382 especímenes de tres subfamilias, pertenecientes 16 tribus de 25 géneros y 36 especies; Laminae fue la subfamilia con mayor diversidad, con 24 especies distribuidas en 14 géneros, seguida de Cerambycinae con 11 especies de diez géneros, y Prioninae con una especie. El género con mayor riqueza fue Leptostylus LeConte, 1852 con siete especies, seguido de Esthlogena Thomson, 1864 con cuatro. Se identificó a Obrium albifasciatum Bates 1872, Dendrobias mandibularis mandibularis Dupont in Audinet-Serville 1834, Mallodon dasystomus dasystomus (Say, 1824) y Adetus bacillarius Bates 1885 como nuevos registros para el estado de Tabasco (Fig. 1). En el borde del manglar se capturó la mayor riqueza de cerambícidos, donde se recolectaron 175 especímenes de dos subfamilias pertenecientes a 31 especies de 22 géneros; Lamiinae fue la subfamilia con mayor diversidad con 127 individuos de 22 especies, distribuidas en 14 géneros y para Cerambycinae se recolectaron 48 individuos de nueve especies, distribuidas en ocho géneros. El género con mayor riqueza fue Leptostylus con cinco especies, seguida de Esthlogena con cuatro. En el interior, se capturaron 207 especímenes de tres subfamilias pertenecientes a 21 especies de 16 géneros; Lamiinae fue la subfamilia con mayor diversidad con 171 individuos de 13 especies, distribuidas en ocho géneros y para Cerambycinae se recolectaron 36 individuos de siete especies, distribuidas en siete géneros. El género con mayor riqueza fue Leptostylus con cuatro especies. La especie más abundante para el borde e interior fue Ataxia sp., con 43 y 115 individuos respectivamente (Tabla 1).
Tabla 1 Riqueza y abundancia de cerambícidos capturados en el borde e interior de la selva. / Table 1. Richness and abundance of cerambycids captured on the edge and interior of the forest.
| Manglar de Chiltepec | Borde | Interior | |||||
| 1.5 m | 6 m | 12 m | 1.5 m | 6 m | 12 m | ||
| Cerambycinae | |||||||
| Achryson quadrimaculatum (Fabricius 1793) | 1 | 0 | 1 | 1 | 0 | 0 | |
| Gnaphalodes trachyderoides Thomson 1861 | 0 | 0 | 0 | 0 | 2 | 0 | |
| Chlorida cincta Guérin-Méneville 1844 | 0 | 0 | 0 | 1 | 0 | 1 | |
| Placosternus guttatus Chevrolat 1860 | 0 | 2 | 0 | 1 | 2 | 1 | |
| Placosternus crinicornis Chevrolat 1860 | 0 | 3 | 0 | 0 | 0 | 0 | |
| Neoclytus cacicusChevrolat 1860 | 2 | 3 | 2 | 5 | 5 | 9 | |
| Elaphidion sp. | 1 | 0 | 0 | 3 | 0 | 0 | |
| Methia sp. | 2 | 5 | 3 | 0 | 0 | 0 | |
| Compsibidion vanum (Thomson 1867) | 6 | 5 | 8 | 0 | 1 | 4 | |
| Obrium albifasciatum Bates 1872* | 0 | 2 | 1 | 0 | 0 | 0 | |
| Dendrobias mandibularis mandibularis Dupont in Audinet-Serville 1834* | 0 | 1 | 0 | 0 | 0 | 0 | |
| Lamiinae | |||||||
| Carphina arcifera Bates 1872 | 0 | 1 | 0 | 0 | 0 | 0 | |
| Lagocheirus binumeratus Thomson 1860 | 1 | 1 | 0 | 0 | 0 | 0 | |
| Leptostylus gibbulosus Bates 1874 | 1 | 4 | 4 | 1 | 0 | 2 | |
| Leptostylus hilaris Bates 1872 | 13 | 5 | 0 | 9 | 6 | 0 | |
| Leptostylus sp.1 | 0 | 2 | 0 | 0 | 0 | 0 | |
| Leptostylus sp. 2 | 0 | 0 | 1 | 0 | 0 | 0 | |
| Leptostylus sp. 3 | 0 | 1 | 0 | 0 | 0 | 0 | |
| Leptostylus sp. 4 | 0 | 0 | 0 | 0 | 2 | 0 | |
| Leptostylus sp. 5 | 0 | 0 | 0 | 0 | 0 | 1 | |
| Lepturginus obscurellus Gilmour 1959 | 1 | 3 | 6 | 1 | 2 | 0 | |
| Atrypanius haldemani (LeConte, 1952) | 2 | 2 | 2 | 1 | 2 | 1 | |
| Urgleptes ozophagus Chemsak & Feller 1988 | 1 | 6 | 5 | 4 | 7 | 1 | |
| Urgleptes sp. | 0 | 1 | 0 | 0 | 0 | 1 | |
| Aegomorphus circumflexus (Jacquelin du Val, 1857) | 2 | 0 | 0 | 0 | 0 | 0 | |
| Oreodera sp. | 1 | 0 | 0 | 1 | 1 | 0 | |
| Adetus bacillarius Bates 1885* | 1 | 1 | 4 | 1 | 2 | 5 | |
| Colobothea hebraica Bates 1865 | 1 | 1 | 0 | 0 | 0 | 0 | |
| Eupogonius sp. | 1 | 0 | 0 | 0 | 0 | 0 | |
| Cacostola sp. | 0 | 1 | 0 | 0 | 0 | 0 | |
| Esthlogena (Esthlogena) albisetosa Bates 1880 | 0 | 1 | 3 | 0 | 3 | 0 | |
| Esthlogena sp. 1 | 1 | 0 | 0 | 0 | 0 | 0 | |
| Esthlogena sp. 2 | 1 | 0 | 0 | 0 | 0 | 0 | |
| Esthlogena sp. 3 | 0 | 2 | 0 | 0 | 1 | 0 | |
| Ataxia sp. | 11 | 21 | 11 | 33 | 33 | 49 | |
| Prioninae | |||||||
| Mallodon dasystomus dasystomus (Say, 1824)* | 0 | 0 | 0 | 1 | 0 | 0 | |
| Total de especímenes | 50 | 74 | 51 | 63 | 69 | 75 | |
| Total de especies | 19 | 23 | 13 | 14 | 14 | 11 |
Nuevos registros para Tabasco* / New records for Tabasco*

Fig. 1 Nuevos registros para Tabasco. A. Obrium albifasciatum Bates 1872. B. Dendrobias mandibularis mandibularis Dupont in Audinet-Serville 1834. C. Mallodon dasystomus dasystomus (Say, 1824). D. Adetus bacillarius Bates 1885. / Fig. 1. New records for Tabasco. A. Obrium albifasciatum Bates 1872. B. Dendrobias mandibularis mandibularis Dupont in Audinet-Serville 1834. C. Mallodon dasystomus dasystomus (Say, 1824). D. Adetus bacillarius Bates 1885.
Diversidad: El índice de diversidad verdadera de orden 1 (1D), determinó que la mayor diversidad se obtuvo en el borde con 15.91 especies efectivas y la menor en el interior con 6.35, siendo el borde 2.51 más diverso que el interior. El índice de Pielou (J') mostró que existe una mayor equidad en el número de individuos de las poblaciones de cerambícidos del borde, en comparación con las poblaciones del interior con 0.79 y 0.58, respectivamente. El índice de Sorensen (ls) determinó que las comunidades presentaron una similitud del 61 %, al compartir una riqueza de 16 especies. El estimador Chao 1 calculó una riqueza esperada de 40.2 para el borde y 27.18 para el interior, lo que indica una cobertura de la muestra de 79.60 % y 84.62 %, respectivamente (Tabla 2).
Tabla 2 Diversidad y estructura de las comunidades de cerambícidos en manglar, Chiltepec, Tabasco. / Table 2. Diversity and structure of cerambycid communities in mangrove, Chiltepec, Tabasco.
| Sitio | Riqueza | Orden 1 | Equidad (J') | Similitud (ls) | Chao 1 | Cobertura |
| Borde | 31 | 15.91 | 0.79 | 0.61 | 40.20 | 79.60 |
| Interior | 21 | 6.35 | 0.58 | 0.61 | 27.18 | 84.62 |
Distintividad taxonómica: El análisis de distintividad mostró que la mayor diversidad taxonómica (Δ) se encontró en el borde del manglar y la menor en el interior, con 2.952 y 2.256 respectivamente. Sin embargo, tanto el índice de distintividad taxonómica (Δ*) como el índice de distintividad taxonómica promedio (Δ+) determinaron mayores valores de diversidad en el interior de este ecosistema (Tabla 3).
Tabla 3 Análisis de jerarquías taxonómicas de las comunidades de cerambícidos. / Table 3. Analysis of taxonomic hierarchies of cerambycid communities.
| Sitio | Δ | Δ* | Δ+ |
| Borde | 2.952 | 3.272 | 3.239 |
| Interior | 2.256 | 3.350 | 3.333 |
Fluctuación de las comunidades: La fluctuación de las comunidades de cerambícidos en el borde e interior del manglar presentó notables diferencias durante el año de muestreo. En el borde, la mayor abundancia de estos insectos se registró en el mes de febrero, con un ligero repunte en agosto. En el interior, este incremento se presentó en junio, julio y agosto. Al contrastar dichas fluctuaciones con las variables ambientales, se pudo observar que la máxima abundancia de cerambícidos en el borde coincide con el valor más bajo de precipitación, mientras que en el interior la abundancia aumenta durante y después de los máximos niveles de precipitación (Fig. 2).
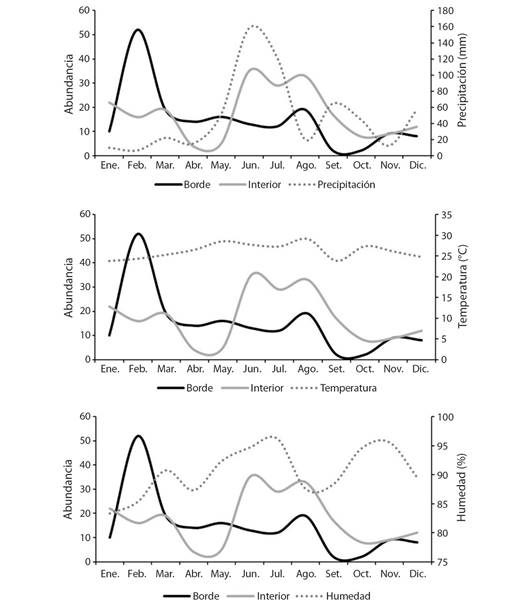
Fig. 2 Fluctuación anual de cerambícidos y variables ambientales. / Fig. 2. Annual fluctuation of cerambycids and environmental variables.
Distribución vertical: La distribución vertical de la riqueza de especies en los tres estratos evaluados difirió entre el borde e interior del manglar. En el borde, la mayor riqueza se registró a los 6 m de altura y la menor a los 12 m. En el interior, los mayores valores de riqueza se registraron a 1.5 m y 6 m, y la menor a 12 m. En las diferentes alturas evaluadas se registraron especies que no fueron capturadas en los estratos restantes: en el borde, cinco se recolectaron a 1.5 m, ocho a 6 m y una a los 12 m; en el interior, tres se recolectaron a 1.5 m, cuatro a 6 m y dos a los 12 m. El índice de Sorensen (ls) mostró que las trampas colocadas a 1.5 m y 12 m de altura en el borde presentaron una similitud del 62 % en sus capturas, así mismo, en el interior, las trampas colocadas a 1.5 m mostraron una similitud de captura del 64 % con las trampas colocadas a 6 y 12 m de altura (Tabla 4).
Tabla 4 Contraste entre riqueza de especies por altura evaluadas de acuerdo con el índice de Pielou (J'). / Table 4. Comparison between species richness by height evaluated according to the Pielou index (J').
| Sitio | Borde 1.5 m | Borde 6 m | Borde 12 m | Interior 1.5 m | Interior 6 m | Interior 12 m |
| Borde 1.5 m | - | 0.57 | 0.62 | 0.66 | 0.54 | 0.46 |
| Borde 6 m | 12 | - | 0.61 | 0.48 | 0.43 | 0.41 |
| Borde 12 m | 10 | 11 | - | 0.51 | 0.59 | 0.58 |
| Interior 1.5 m | 11 | 9 | 7 | - | 0.64 | 0.64 |
| Interior 6 m | 9 | 8 | 8 | 9 | - | 0.50 |
| Interior 12 m | 7 | 7 | 7 | 8 | 7 | - |
Discusión
Los datos obtenidos muestran un incremento en la riqueza de especies de cerambícidos para el estado de Tabasco, la cual asciende a 51 especies, tomando en cuenta las 12 especies registradas por Noguera (2014), más las 35 reportadas por Álvarez-Ramón et al. (2022) y los cuatro nuevos registros identificados hasta nivel de especie en el presente estudio.
Las subfamilias más diversas en el manglar estudiado fueron Lamiinae seguida de Cerambycinae, resultado que concuerda con las proporciones de especies de cerambícidos conocidas en el mundo, pertenecientes a las dos familias antes mencionadas, donde se reportan aproximadamente 21 000 especies para Lamiinae y alrededor de 11 000 para Cerambycinae (Nearns et al., 2020). Datos similares han sido registrados en otros ecosistemas de México, como lo documentado por Gutiérrez et al. (2014) en un bosque mesófilo de montaña, por Luna-León et al. (2015) en un bosque tropical caducifolio y por Álvarez-Ramón et al. (2022) en una selva alta perennifolia. No obstante, difiere a lo registrado por Morales-Morales et al. (2012) asociados a cercos vivos de Jatropha curcas L. en Chiapas, a lo descrito por Noguera et al. (2012) en un bosque tropical caducifolio y a lo encontrado en Pérez-Flores & Toledo-Hernández (2020) en una zona desértica, con una dominancia de Cerambycinae. Dichas diferencias pueden estar relacionadas al método de captura, ya que las trampas cebadas con alcohol etílico pudieron atraer especies que se alimentan de exudados de árboles fermentados como terpenos y polifenoles (Álvarez-Ramón et al., 2022), hojas, tallos y hongos (Álvarez et al., 2015; MacKay et al., 2014), los cuales son más atractivos para especies de la subfamilia Laminae.
El género que presentó el mayor número de especies fue Leptostylus, tal como Álvarez-Ramón et al. (2022) para la selva alta perennifolia de Tabasco, México. Las diferencias entre la riqueza y abundancia de cerambícidos capturados en el borde e interior del manglar, son similares a lo registrado por Álvarez-Ramón et al. (2022), quienes atribuyen el mayor número de individuos y de especies, al enriquecimiento estructural de la vegetación en los bordes de los ecosistemas. Ataxia sp. fue la especie que registró el mayor número de individuos tanto en el borde como en el interior, con el 24.57 y 55.56 % respectivamente, dato que difiere a los registrado por Álvarez-Ramón et al. (2022), quienes registran a Leptostylus gibbulosus Bates, 1874 como la especie más abundante en el borde y a Compsibidion vanum (Thomson, 1867) en el interior. Dichas diferencias pueden estar mediadas por la diversidad de especies vegetales presentes en los ecosistemas, en un hábitat más homogéneo como el manglar en comparación con uno heterogéneo como la selva, se puede encontrar la dominancia de un número reducido de especies que pueden estar explotando un recurso alimenticio abundante.
El análisis de diversidad mostró un mayor valor asociado al borde del manglar, resultado similar a los registrados en la selva por Álvarez-Ramón et al. (2022), sin embargo, con una notable discrepancia en el grado de las diferencias, ya que en nuestro estudio el borde fue 2.51 más diverso que el interior, contrastando con las diferencias obtenidas en la selva de 1.26 entre el borde e interior. La reducción en la diversidad asociada al interior del manglar puede deberse a los requerimientos ecológicos que necesitan algunas especies, ya que pueden estar fuertemente asociadas a su planta hospedera, lo que limitaría la coexistencia de un mayor número de especies en el interior de este ecosistema. Los valores registrados de equidad en función de la abundancia de las especies podrían indicar que hay una mejor repartición de microhábitats en el borde, caso opuesto a lo observado en el interior donde al reducirse la variedad de vegetación, disminuye la cantidad de alimento que puede ser explotada por un menor número de especies.
Las coberturas de las muestras para el borde e interior del manglar fueron superiores a lo obtenido por Álvarez-Ramón et al. (2022) en el borde e interior de la selva alta perennifolia, quienes registraron el 66 % de las especies, así como, lo reportado por Toledo et al. (2002) y Noguera et al. (2009) en los bosques secos de Chiapas y Sonora, con el 53 y 68 % respectivamente. Lo anterior, puede deberse a la composición y estructura del ecosistema estudiado, ya que un manglar es menos diverso en la variedad vegetal, y por lo tanto puede alberca un número menor de especies de cerambícidos. Sin embargo, para poder conocer la riqueza real del sitio, se recomendaría aumentar el esfuerzo del muestreo; aumentando el número de trampas, incrementando el tiempo de recolecta, utilizar otras técnicas de capturas complementarias e incluso rediseñar los métodos de colectas para conocer mejor la riqueza especifica.
Los índices de distintividad taxonómica (Δ*) y de distintividad taxonómica promedio (Δ+) mostraron mayores valores en el interior, datos similares a lo registrado por Álvarez-Ramón et al. (2022). Sin embargo, el índice de diversidad taxonómica muestra que hay una mayor diversidad taxonómica (Δ) en el borde del manglar, lo que difiere con los autores antes mencionados. Estas diferencias podrían ser el reflejo de la especialización de las especies asociadas a los sitios de estudio, ya que, al registrarse una mayor variedad vegetal en el borde del manglar, como son especies de las familias Burseraceae, Fabaceae, Arecaceae y Anacardiaceae, la riqueza de tribus y géneros aumenta, lo que acrecienta las distancias taxonómicas de la comunidad de insectos. No obstante, al igual que Álvarez-Ramón et al. (2022), las diferencias implican una baja separación filogenética entre las especies de ambas comunidades, producto de la cercanía del borde y el interior del manglar.
La mayor abundancia de cerambícidos en el borde del manglar difiere con lo documentado por Noguera et al. (2007), Noguera et al. (2009), Noguera et al. (2012), y Toledo et al. (2002), quienes registraron al mes de febrero como el de menor abundancia, sin embargo, es importante mencionar que en dichos estudios se utilizaron diversos métodos de colecta. No obstante, nuestros resultados son similares a lo reportado por Álvarez-Ramón et al. (2022), quienes mencionan que la mayor abundancia de estos insectos en el borde de la selva se presenta en dicho mes, sin embargo, también indican repuntes importantes en la abundancia en los meses de mayo y agosto. En el interior del manglar, los meses con mayor abundancia de cerambícidos fueron junio, julio y agosto, lo que difiere a lo descrito por Álvarez-Ramón et al. (2022) en el interior de la selva, quienes ubican a febrero como el más abundante, pero concuerda con los datos de Ordóñez-Reséndiz & Martínez-Ramos (2017) en la Sierra de Taxco, Guerrero, quienes colocan al mes de agosto entre los que presentan el mayor número de recolectas. Al contrastar nuestros resultados con las variables ambientales, podemos observar que la mayor abundancia de insectos se presentó cuando se registraron los menores niveles de precipitación, tal como lo describe Álvarez-Ramón et al. (2022), pero difiere a lo reportado por Noguera et al. (2007), Noguera et al. (2009), Noguera et al. (2012), y Toledo et al. (2002) quienes obtuvieron las mayores abundancias al principio y durante la temporada de lluvia. Por su parte, en el interior del manglar se registró la mayor abundancia en los meses que se registraron los mayores niveles de precipitación, lo cual coincide con lo descrito por Noguera et al. (2007), Noguera et al. (2009) y Noguera et al. (2012). Noguera et al. (2012) mencionan que la distribución de la abundancia a través del tiempo de muestreo puede estar relacionado a la disponibilidad de alimento en los ecosistemas, ya que las larvas de la mayoría de las especies de cerambícidos barrenan en mayor medida ramas o árboles muertos, lo cual se encuentra disponible en mayor número al final de la época de secas y principios de la época de lluvias; dichos momentos estarían relacionados con la actividad reproductiva de estos insectos, ya que la sincronización de su desarrollo larval estaría en función de la mayor disponibilidad de recursos, a excepción de aquellas especies que aparentemente se reproducen durante todo el año.
La distribución de las especies en las alturas evaluadas, muestran una estratificación y repartición del espacio vertical, con marcadas diferencias entre el borde e interior del manglar. En este sentido, Vodka et al. (2009) reportaron que la mayor riqueza de cerambícidos se encontró asociada al sotobosque en un bosque templado, resultados similares a los descritos por Gerónimo-Torres et al. (2021a) y Gerónimo-Torres et al. (2021b) para subfamilias Scolytinae y Platypodinae y la familia Bostrichidae en selvas y manglares de Tabasco, México. Sin embargo, en el presente estudio la mayor riqueza de especies en el borde fue registrada a 6 m de altura, resultado que se puede atribuir a la protección proporcionada contra el viento y la radiación solar por árboles de mayor talla. Los estudios relacionados con la distribución vertical de este grupo de insectos podrían proporcionar mayores índices de capturas, permitiendo colectar especies que se encuentren asociadas a un estrato en particular, lo que proporcionaría información necesaria sobre su biología y ecología.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


