Introducción
Los efectos de cambios ambientales en entornos marinos han sido documentados ampliamente, abarcando desde las limitaciones en la reproducción, alimentación y blanqueamiento de corales (Ateweberhan & McClanahan, 2010; Strychar & Sammarco, 2009) hasta impactos en la alimentación de especies de interés comercial (Duffy et al., 2017). El dorado (Coryphaena hippurus) es una especie altamente migratoria presente en ambientes tropicales y subtropicales (Farrell et al., 2014), prefiriendo zonas con temperaturas entre 21 y 30 °C (Zúñiga-Flores et al., 2008) y marcados cambios en la termoclina (Furukawa et al., 2014). Es un depredador que se asocia con otros pelágicos migratorios como los atunes (Martínez-Ortiz et al., 2015), razón por la cual hace parte de la captura incidental de dichas pesquerías en todo el mundo (Inter-American Tropical Tuna Commission (IATTC), 2005). Aunque la tendencia poblacional del dorado es “Estable” (Collette et al., 2011) y para el 2011 se consideraba como una pesquería en crecimiento (Whoriskey et al., 2011), actualmente el mercado de C. hippurus ocupa renglones importantes en la economía de países como Perú, país considerado el principal comercializador de esta especie con más del 50 % de la producción mundial (Amorós et al., 2017). En Perú se diseñó un mecanismo de seguimiento y evaluación productiva del dorado, el cual busca identificar amenazas a las poblaciones de esta especie con el fin de amortiguar impactos negativos en sus hábitats (Quinteros-Malpartida & Ñiquen-Carranza, 2016). Adicionalmente, se han recomendado vedas espaciotemporales que permiten disminuir las capturas en estadios juveniles, además de delimitar áreas protegidas enfocadas a su preservación (Dapp et al., 2013). Si bien estas medidas de conservación pueden ser acertadas, también deberían considerarse los posibles cambios en su distribución a partir de los diferentes escenarios de cambio climático propuestos por el Panel Intergubernamental de Cambio Climático-IPCC (sigla en inglés). En promedio, la temperatura de los océanos se ha incrementado 0.31 °C para el Océano Pacífico entre 1950 y 2009 (IPCC, 2014a), fenómeno que afectaría la distribución de especies pelágicas, además de disminuir la disponibilidad del recurso pesquero, con consecuencias directas en los costos de las faenas y comercialización de los productos (Cheung et al., 2012a). Los objetivos de este trabajo fueron: a) Modelar la distribución e idoneidad de hábitat actual para el dorado en el Pacífico Oriental Tropical y b) Proyectar los modelos de distribución con respecto al escenario de cambio climático más extremo planteado por el IPCC.
Materiales y métodos
Registros de presencia: Para modelar la distribución potencial de una especie altamente migratoria como el dorado, es indispensable que los datos cubran todos los entornos posibles para la especie (Soberón, 2007). Se crea un conjunto de presencias de dorado a partir de dos fuentes de información: 1) el Programa de Observadores Pesqueros de Colombia (POPC) ejecutado por la Autoridad Nacional de Acuicultura y Pesca de Colombia (AUNAP) y 2) los registros disponibles en la Infraestructura Mundial de Información en Biodiversidad-GBIF (sigla en inglés). Con lo anterior se busca cumplir el supuesto de tener registros de dorado en todos los lugares colonizables para esta especie. Se revisan 166 registros del POPC reportados para el Pacifico Oriental Tropical-POT entre el 2009 y 2015, extrayendo los registros de individuos de dorado capturados incidentalmente. Simultáneamente se emplea el Database Manager del ModestR® (García-Roselló et al., 2014) para acceder a los datos del GBIF y realizar un control de calidad a las ocurrencias del C. hippurus, excluyéndose registros no válidos o fuera del entorno marino. Además, se aplica un filtro temporal para seleccionar solo aquellos correspondientes a la misma ventana de tiempo de la información del POPC, lo anterior por ausencia de registros en años previos al 2009 y no tener acceso a información posterior al 2015. Para unificar los dos conjuntos preliminares de datos (POPC y GBIF), se tabuló la información en hojas de cálculo siguiendo la metodología de Isaza et al. (2020), incluyéndose coordenadas y fecha de captura, bandera de la embarcación e individuos totales capturados, generándose finalmente un conjunto de datos unificado, exportado en formato csv (Comma-Separated Values).
Variables predictoras y generación de la capa ambiental: Las variables ambientales en la ubicación correcta y lo suficientemente precisas son las idóneas para determinar un nicho de especie lo más cercano posible a sus necesidades ecofisiológicas (Guisan et al., 2017). Los predictores ambientales seleccionados son la temperatura superficial del mar, salinidad y velocidad de las corrientes marinas superficiales. Como fuente de información ambiental se selecciona la base de datos de Bio-ORACLE (Assis et al., 2018), la cual es específica para análisis de distribución de especies marinas (Tyberghein et al., 2012) y ofrece capas ambientales en condiciones actuales (2000-2014), a futuro cercano (2040-2050) y futuro lejano (2090-2100). Se consideran las Trayectorias de Concentración Representativas-RCP (sigla en inglés), presentadas en el Informe de Evaluación No. 5-AR5 (sigla en inglés) del IPCC, trayectorias que se agrupan en cuatro categorías: RCP 2.6, RCP 4.5, RCP 6 y RCP 8.5, representando así parte del balance global de energía (Forzamiento Radiativo-FR en vatios/m2), proyectados entre los años 2011-2050 y 2011-2100 (IPCC, 2014b). Para este estudio se seleccionó el escenario de cambio climático más drástico: el RCP 8.5 (Hayhoe et al., 2017), el cual se caracteriza por el máximo aumento en la temperatura ambiental debido a una mayor retención de energía y una mayor emisión de CO2 - equivalente (> 1 000 ppm al año 2010) (van Vuuren et al., 2011). Finalmente, y con el propósito de evaluar la contribución de cada variable ambiental al modelo, se aplica la prueba de Jackknife (Shcheglovitova & Anderson, 2013).
Heterogeneidad ambiental y filtro de registros de presencia: Debido a que se desea analizar los posibles cambios en la distribución potencial actual y futura del dorado a partir de registros de presencia provenientes de faenas atuneras y no de cruceros de prospección pesquera que garanticen la independencia de los registros, es posible que exista un sesgo espacial en los registros. Para reducir dicho sesgo y una posible autocorrelación de la información que pueda conducir a una sobreestimación de los modelos (Veloz, 2009), se calcula la heterogeneidad ambiental (Vetter et al., 2018) a partir de los datos de presencia del dorado usando la herramienta SDM Toolbox 2.0 (Brown et al., 2017). Se selecciona la cantidad máxima de categorías de clasificación disponibles (natural jenks), siguiendo con el análisis de componentes principales para la estimación y medición de la heterogeneidad ambiental. A partir del resultado anterior se filtran las ocurrencias del dorado y se genera el conjunto final de datos a emplear para modelar la distribución potencial en condiciones actuales y futuras (Brown, 2011).
Modelos de distribución de especies y cambio climático: Para modelar la distribución potencial del dorado en condiciones actuales se utilizan diez algoritmos con el fin de identificar el de mejor desempeño: BIOCLIM (Booth et al., 2014), Análisis Flexible Discriminante-FDA (Hastie et al., 1994), Modelos Lineales Generalizados-GLM y Modelos Aditivos Generalizados-GAM (Venables & Dichmont, 2004), Splines de Regresión Adaptativa-MARS (Friedman, 1991), Análisis de Árboles de Clasificación-CTA (Breiman et al., 1984), Árboles de Regresión Potenciados-BRT (Elith et al., 2008), Modelo Potenciado Generalizado-GBM (Ridgeway, 2007), Redes Neuronales Artificiales-ANN (Ripley, 1994) y Máxima Entropía-MaxEnt (Phillips et al., 2006). A excepción de BIOCLIM, los demás algoritmos hacen parte del paquete de R BIOdiversity MODelling-BIOMOD2, el cual actúa como una plataforma para generación y análisis de diferentes modelos de distribución de especies, permitiendo la evaluación simultánea de distintos algoritmos (Thuiller et al., 2009). BIOCLIM (Booth et al., 2014), hace parte del paquete de funciones de R Species Distribution Modeling-DISMO y se caracteriza por no necesitar información de ausencias para su correcto funcionamiento (Hijmans et al., 2017). A diferencia de BIOCLIM, los demás algoritmos empleados sí necesitan registros de ausencias o la generación de pseudoausencias (PA) para obtener resultados confiables. Por tal razón y con el propósito de asegurar un óptimo desempeño de los modelos se siguen las recomendaciones de Barbet-Massin et al. (2012) y de Merow et al. (2013) con respecto a las estrategias de generación de PA (Tabla 1).
Tabla 1 Estrategias de generación de PA y configuración de algoritmos. / Table 1. PA generation strategies and algorithm configuration.
| Enfoque ambiental envolvente o de sobre | Enfoque basado en regresiones | Enfoque basado en aprendizaje automático y árboles de clasificación | |
| Algoritmo | Bioclim | GLM, GAM, MARS, FDA | CTA, BRT, GBM, ANN |
| Estrategia de PA | -- | Aleatorio | Basado en condiciones ambientales (Surface Range Envelope -SRE) |
| Relación Ausencia-Presencia | -- | Aquella que garantice mayor número de PA (≥ 10 000) | 1:1 |
| Número de validaciones cruzadas | -- | 10 | 10 |
| Prevalencia | -- | Igual ponderación para presencias y ausencias |
El estadístico seleccionado para evaluar el desempeño es el Área Bajo la Curva-AUC (Swets, 1988), el cual es ampliamente utilizado en los análisis de distribución de especies marinas (França & Cabral, 2016), ofreciendo resultados confiables de fácil interpretación. Varía entre 0 y 1 y cuyos valores por encima de 0.9 sugieren excelentes desempeños, entre 0.7 y 0.9 indican buenas predicciones y los valores entre 0.5 y 0.7 se asocian con una predicción cuestionable. Por último, valores inferiores a 0.5 plantean la idea de que una clasificación aleatoria es mejor que el modelo generado (Hosmer & Lemeshow, 2000). Para correr los modelos de distribución se empleó el Laboratorio Virtual de Cambio Climático y Biodiversidad-BCCVL integrado a la plataforma EcoCommons (EcoCommons Australia, 2022; Hallgren et al., 2016).
Resultados
Heterogeneidad ambiental y análisis de componentes principales: El análisis de componentes principales aplicado a la capa ambiental indicó que el mayor porcentaje de la varianza explicada acumulada correspondió al 96.72 %, asociándose con el primer componente principal, siendo la temperatura superficial del agua la variable que aporta en mayor medida, seguido de la salinidad y la velocidad de las corrientes. Aunque la temperatura estaría aportando la mayor información a la capa ambiental, la baja correlación calculada para las variables (< 0.45) permitió incluir las tres variables en el proceso de filtrado de ocurrencia de las especies (Tabla 2).
Tabla 2 Análisis de componentes principales de la capa ambiental marina. / Table 2. Principal component analysis of the marine environmental layer.
| Componente | Autovalores | Varianza explicada (%) | Varianza acumulada (%) |
| 1 | 88.18 | 96.72 | 96.72 |
| 2 | 2.98 | 3.27 | 99.99 |
| 3 | 0.005 | 0.005 | 100 |
| Predictor | Autovectores | ||
| Componente 1 | Componente 2 | Componente 3 | |
| TSM | 0.995 | -0.096 | -0.002 |
| Salinidad | 0.095 | 0.995 | -0.001 |
| Velocidad de las corrientes | 0.002 | 0.001 | 1.000 |
| Matriz de correlación entre los predictores ambientales | |||
| TSM | Salinidad | Velocidad de las corrientes | |
| TSM | 1 | 0.448 | 0.299 |
| Salinidad | 0.448 | 1 | 0.163 |
| Velocidad de las corrientes | 0.229 | 0.163 | 1 |
Filtro de ocurrencias a partir de la heterogeneidad ambiental: La información descargada del GBIF registrada entre 2009 y 2015 incluyó 3 638 ocurrencias de dorado, pero con pocas presencias de la especie en el POT. En los registros del POPC se identificaron 655 capturas de la especie, distribuidas en un territorio comprendido entre 108°-77° W & 8°-09°S. Al unir las ocurrencias reportadas en el GBIF y el POPC, se tuvo un primer conjunto de datos compuesto por 4 293 registros, el cual fue filtrado según los resultados del análisis de heterogeneidad ambiental. El subconjunto de datos filtrados se redujo en un 78.68 %, quedando finalmente un total de 915 presencias. A pesar de la significativa reducción en la cantidad de datos, el filtro de presencias a partir de la heterogeneidad ambiental asegura que los datos estén distribuidos en todos los ambientes colonizables por esta especie, excluyendo registros redundantes desde una perspectiva ambiental.
Evaluación de los modelos de distribución potencial del dorado: Los valores de AUC para todos los modelos generados bajo condiciones actuales, estuvieron entre 0.88 (modelo GLM) y 1.0 (modelo GBM). Los valores alcanzados sugieren que todos los algoritmos tuvieron excelentes desempeños y las distribuciones potenciales estimadas tienen buenos ajustes (Fig. 1).
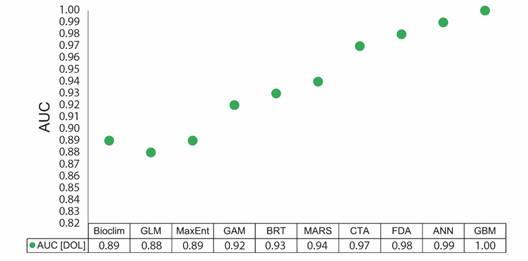
Fig. 1 AUC para los diferentes modelos de distribución potencial para el C. hippurus en condiciones actuales. / Fig. 1. AUC for the different potential distribution models for C. hippurus under current conditions.
El índice de idoneidad de hábitat generado con BIOCLIM (AUC: 0.89) y compuesto por las tres variables seleccionadas se caracterizó por tener temperaturas entre 12.35 y 29.33 °C, salinidades de 29.59 a 37.21 ppt y velocidad de corrientes desde 0 hasta 1.19 m/s. Debido al funcionamiento del BIOCLIM, se consideró el percentil 50 de cada variable como el indicador de mayor probabilidad para encontrar la especie en la ubicación desconocida (Booth et al., 2014; Thuiller et al., 2012). Para el dorado, el modelo sugiere entonces mayor probabilidad de presencia en sitios con temperatura del agua cercana a 27 °C, salinidad de 35 ppt y velocidad de corrientes cercanas a 0.2 m/s. El resultado de la prueba de Jackknife indicó que la contribución de cada variable al modelo fue similar, con aporte de la temperatura superficial del agua de 89.5 %, de la salinidad 88.6 % y la velocidad de las corrientes 90.3 %.
Modelo de distribución potencial y variaciones debidas al cambio climático: Aunque los modelos se generaron a partir de ocurrencias distribuidas mundialmente, para este estudio se hizo énfasis en la distribución potencial del dorado en el POT, zona que presenta características oceanográficas que favorecen la diversidad biológica (Cortés, 2012), afloramientos (D’Croz y O’Dea, 2007) y soportan importantes pesquerías industriales y caladeros de pesca (Isaza-Toro et al., 2020). Los mapas de distribución potencial generados en condiciones actuales mostraron que la zona de mayor idoneidad ambiental (entre 0.65 y 0.80) corresponde a una región transfronteriza Colombia-Ecuador que se extiende desde 82° W hasta aguas internacionales. Lo anterior contrasta con el área comprendida entre la línea ecuatorial y los 10°, en la cual las condiciones ambientales no serían las más adecuadas para la presencia del dorado (Fig. 2).
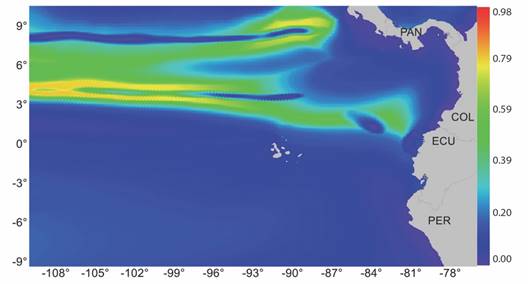
Fig. 2 Mapa de idoneidad hábitat para el dorado en condiciones ambientales actuales (2000-2014), resaltando la máxima idoneidad de hábitat (0.94) en aguas internacionales al norte de la línea ecuatorial. / Fig. 2. Habitat suitability map for dorado under current environmental conditions (2000-2014), highlighting the maximum habitat suitability (0.94) in international waters north of the equator.
A futuro cercano (2040-2050) y según el RCP 8.5, el modelo sugirió una reubicación y contracción de la zona de idoneidad de hábitat, aunque las condiciones favorables para la presencia y permanencia de la especie se mantienen (índice de idoneidad de hábitat de 0.90), estas quedaron restringidas a un área comprendida entre 82° W & 92° W sobre la línea ecuatorial. El modelo también propuso una nueva región donde las condiciones ambientales podrían favorecer la presencia del dorado (6°-10° S, desde 96° W hacia aguas internacionales), aunque con un índice de idoneidad bajo (0.42) (Fig. 3A). Para el 2100, el modelo de distribución del dorado reveló que esta nueva región podría alcanzar los valores máximos de idoneidad de hábitat (0.80), además de expandir el área potencialmente colonizable hacia el sur de la línea ecuatorial, desde 82° W hacia aguas internacionales (Fig. 3B).
Discusión
Modelar de la distribución potencial y el nicho ecológico de especies pelágicas marinas es un reto debido a su movilidad, los costos y requerimientos tecnológicos y logísticos para los muestreos costa afuera y en columna de agua (Melo-Merino et al., 2020). Además, suele ser difícil encontrar información de ausencia de dichas especies, requerimiento indispensable para el correcto funcionamiento de algoritmos basados en técnicas de regresión y aprendizaje automático (Brosse et al., 1999; Manel et al., 2001). Aunque los modelos basados en datos de presencia-ausencia han mostrado buenos desempeños para especies marinas (Herrera-Montiel et al., 2019), MacLeod et al. (2008) sugiere que los modelos basados en información únicamente de presencias también pueden ser confiables y acertados. Lo anterior concuerda con los resultados obtenidos para este estudio, en el cual los modelos que incluyeron pseudoausencias (GLM, MaxEnt, GAM, BRT, MARS, CTA, FDA, ANN y GBM) y el BIOCLIM, tuvieron desempeños similares con ajustes entre 0.89 y 1.00. Sin embargo, dado el sesgo espacial y temporal asociado a la información colectada por el POPC, resulta conveniente seleccionar el BIOCLIM para modelar la distribución potencial de C. hippurus en condiciones actuales y proyectar los resultados en escenarios de cambio climático. Por un lado, se descartaría la posibilidad de incluir falsas pseudoausencias dentro de los análisis y por otro lado, se podría aplicar el principio de parsimonia (Coelho et al., 2019) ya que se trata de un modelo cuyo funcionamiento es más sencillo.
Las condiciones ambientales idóneas para la presencia del dorado se estarían presentando sobre la zona ecuatorial del Pacífico Oriental Tropical, donde confluyen masas de agua de características físicas y nutricionales contrastantes que favorecen el desarrollo de un gradiente físico y bioquímico conocido como frente oceánico, fenómeno ampliamente estudiado en la región (Asto et al., 2019). Los frentes oceánicos se caracterizan por ser zonas altamente productivas (Verneil et al., 2019) que activan la cadena alimenticia y ciclo de vida de diferentes especies marinas incluidos C. hippurus (Cai et al., 2020; Lehodey, 2001), además de presentar oscilaciones horizontales y longitudinales relacionados con cambios en la temperatura y salinidad del agua principalmente (Grados et al., 2018; Nieblas et al., 2014).
A pesar de haber identificado las condiciones ambientales idóneas para la presencia y permanencia del dorado, esta especie, al igual que otros pelágicos presentes en las pesquerías industriales, son predadores oportunistas e incluyen en su alimentación diferentes grupos taxonómicos (Rajesh et al., 2016), dieta que se ve favorecida por su capacidad migratoria (Merten et al., 2016) y velocidad en el desplazamiento (Svendsen et al., 2016). En ese orden de ideas, podría considerarse que la distribución de esta especie podría depender en mayor medida de la disponibilidad y distribución de alimento, más que de las condiciones ambientales específicas, situación reportada previamente para otros pelágicos de interés comercial como el atún (Olson et al., 2016).
Adicionalmente, la contracción y reubicación de la distribución modelada para el C. hippurus en condiciones de cambio climático extremo concuerda con un posible proceso de tropicalización de los ecosistemas marinos, fenómeno caracterizado por cambios en la localización de las zonas de mayor idoneidad, así como pérdida de hábitats favorables para las especies, lo cual suele darse desde regiones más cálidas hacia aquellas de menor temperatura (Cheung, et al., 2012b). Considerando los resultados de este estudio, para el 2050 y 2100 se estaría presentando una pérdida progresiva de hábitat para el dorado en la región ecuatorial y una expansión de los entornos favorables hacia el sur. Sin embargo, es importante recordar que C. hippurus es una especie altamente migratoria, predadora y tolerante a un amplio gradiente de temperatura, lo cual sugiere que los posibles cambios en su distribución serían una consecuencia indirecta de la disminución en la disponibilidad y calidad del alimento, lo cual pone en evidencia la necesidad de desarrollar estudios enfocados en la dinámica predador-presa en la cadena trófica de estas especies, bajo escenarios de cambio climático (Evans et al., 2020).
El posible desplazamiento hacia el sur de las zonas de idoneidad de hábitat para esta especie refuerza la necesidad de mejorar las políticas de aprovechamiento energético conducentes a disminuir la emisión de CO2 y a desacelerar el aumento de la temperatura ambiental. A partir de estos resultados se podrán promover estudios que evalúen nuevas estrategias de captura y comercialización de C. hippurus con miras a optimizar el esfuerzo y rentabilidad de la pesquería de esta especie.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 



