Introducción
La concha negra, Anadara tuberculosa (Sowerby, 1833), es un molusco bivalvo de la familia Arcidae, cuya área de distribución abarca desde Baja California, en México, hasta la Bahía de Tumbes, en el norte de Perú (Keen, 1971; MacKenzie, 2001).
La reproducción de A. tuberculosa es continua, con picos variables en dependencia de la localidad y condiciones ambientales, tales como temperatura, lluvias, salinidad y disponibilidad de alimento (García-Domínguez et al., 2008; Lucero-Rincón et al., 2013; Romo-Piñera et al., 2015). A pesar de alcanzar tallas cercanas a los 10 cm de longitud total (Vega et al., 2021), se ha reportado para Colombia que los organismos maduran a partir de los 25 mm (Borda & Cruz, 2004), machos desde 18.87 mm y hembras desde 27.70 mm (Lucero et al., 2012) y 20.18 mm (Lucero-Rincón et al., 2013). En Costa Rica, la madurez sexual inicia entre 23.2 y 26.2 mm (Ampie & Cruz,1989), mientras que en Panamá maduran a partir de los 32 mm (Guilbert, 2007).
En Colombia, A. tuberculosa alcanza la talla media reproductiva poblacional (L50) a los 44 mm en Tumaco (Borda & Cruz, 2004), 39.5 mm y 43.5 mm, en diferentes localidades del Pacífico (Lucero et al., 2012; Lucero-Rincón et al., 2013); en Ecuador, Santa Martha, 41.61 mm para machos y 42.98 para hembras (Panta-Vélez et al., 2020) y en Santo Domingo, México, 36.5 mm (Pérez-Medina, 2005).
Proporción sexual a favor de las hembras ha sido reportada en Isla de las Perlas, Pacífico de Panamá, 3.5H:1M (Guilbert, 2007), en la Reserva de Manglar al Noreste de Ecuador, 2.6H:1M (Flores & Lincadeo, 2010), Pacífico colombiano, 2.46H:1M (Lucero-Rincón et al., 2013; Lucero-Rincón et al., 2021), en Baja California, 2.09H:1M hasta 9H:1M (Romo-Piñera et al., 2015) y en Tumbes, Perú, 1.6:1 (Alemán et al., 2019) y 1.4H:1M (Ordinola et al., 2020). En contraste, la proporción sexual 1H:1M se ha reportado en El Conchalito, México (Pérez-Medina, 2005), en Costa Rica, localidades de Puntarenas (Cruz, 1982; Cruz, 1984), Térraba-Sierpe (Vega, 1994), Golfo Dulce (Silva & Bonilla, 2001; Silva-Benavides & Bonilla, 2015).
Cambios en la proporción sexual a favor de las hembras, de forma progresiva en el tiempo, se ha reportado para Perú, en el 2013 y 2014, con una proporción de 1:1 (Alemán et al., 2014; Alemán et al., 2017); mientras que en el 2019 y 2020, se reportó una proporción a favor de las hembras, aunque no en todas las localidades muestreadas (Alemán et al., 2019; Ordinola et al., 2020). En contraste, en Golfo Dulce, Costa Rica, la proporción sexual se ha mantenido 1:1, entre 2001 y 2015 (Silva & Bonilla, 2001; Silva-Benavides & Bonilla, 2015).
Para México, la relación proporción sexual-tallas se mantuvo 1H:1M, para tallas entre 36 mm y 80 mm de longitud total (LT) (Pérez-Medina, 2005). Sin embargo, para A. anticuata, en Tanzania, se reportó cambios en la proporción sexual asociada al incremento de las tallas, convirtiéndose en significativa la diferencia sobre los 41 mm de LT, para análisis realizados entre los 10 mm y 70 mm de LT (Mzighani, 2005).
El hermafroditismo más común en los moluscos bivalvos es protándrico (Afiati, 2007; Mzighani 2005), condición que ha sido reportada para A. tuberculosa (Lucero-Rincón et al., 2013; Lucero-Rincón et al., 2021; Panta Vélez et al., 2020; Pérez-Medina, 2005); A. antiquata y A. granosa (Afiati, 2007) y A. similis (Manjarres-Villamil et al., 2013). Según estos autores, el hermafroditismo se puede identificar por diferencias en la proporción de sexos a favor de las hembras, hembras de mayor talla, presencia de ovocitos y espermatozoides funcionales, así como la predominancia del tejido gonadal femenino sobre el masculino.
En A. tuberculosa se ha reportado hermafroditismo casual en México y Ecuador, con frecuencia de aparición de esta condición de 0.98 % (N = 205) (Pérez-Medina, 2005) y 1.14 % (N = 394) (Panta-Vélez et al., 2020). Sin embargo, para Colombia se obtuvo 3.1 % (N = 290), considerada como un comportamiento normal, probablemente causada por factores endógenos o exógenos como temperatura, salinidad y nutrientes (Lucero-Rincón et al., 2013; Lucero-Rincón et al., 2021).
Cambios en la proporción sexual y el hermafroditismo pueden indicar desbalance en las poblaciones, en respuesta a cambios de factores naturales o antropogénicos (Panta-Vélez et al., 2020), y en el caso de A. tuberculosa, la tendencia observada, en algunas localidades de su área de distribución, ha sido a la aparición del hermafroditismo acompañado de cambios en la proporción sexual (Lucero-Rincón et al., 2013; Lucero-Rincón et al., 2021; Panta-Vélez et al., 2020; Pérez-Medina, 2005) y cambios en la proporción sexual a favor de las hembras sin hermafroditismo (Flores & Lincadeo, 2010; Guilbert, 2007; Ordinola et al., 2019, Ordinola et al., 2020; Romo-Piñera et al., 2015).
La estimación de la proporción sexual está asociada a la correcta identificación del sexo. En este sentido, estudios reproductivos en Anadara spp. reportan con frecuencia la condición de organismos indeterminados, donde no se puede reconocer el sexo macroscópicamente, creando incertidumbre sobre el efecto que puede producir esta condición en la interpretación de los datos, sobre todo si existe proporción sexual a favor de uno u otro sexo. Por ejemplo, Flores y Licandeo (2010) indican que, de 1 997 especímenes, 333 fueron indeterminadas, sin distinguir entre A. tuberculosa (N = 1 273) y A. similis (N = 428).Panta-Vélez et al. (2020), reportan 20 % de organismos indeterminados en A. tuberculosa (N = 711), mientras que Manjarres-Villamil et al. (2013) observaron un 32.85 % en A. similis (N = 347).
El presente estudio tuvo por objetivo evaluar la proporción sexual, la presencia de hermafroditismos y el efecto de la presencia de organismos indeterminados sobre la proporción sexual, en Anadara tuberculosa, contrastando metodologías histológica y macroscópica, en organismos recolectados en Manglares de David y el Golfo de Montijo, Pacífico de Panamá.
Materiales y métodos
Sitios de muestreo: Golfo de Montijo (GM): Es un Humedal de importancia internacional (Sitio Ramsar), ubicado bajo las coordenadas 7°56’4’’ N & 81°17’33’’ W; 7°59’30’’ N & 81°1’40’’ W; 7°38’20’’ N & 80°58’40’’ W y 7°36’29’’ N & 81° 13’ 37’’ W (Ministerio de Ambiente, 2016). Los manglares y los bosques de Ciénaga constituyen 313 km2, de los cuales 279 km2 pertenecen a los manglares ubicados frente a un litoral costero con una superficie de 534.9 km2 (Cámara et al., 2004) (Fig. 1).
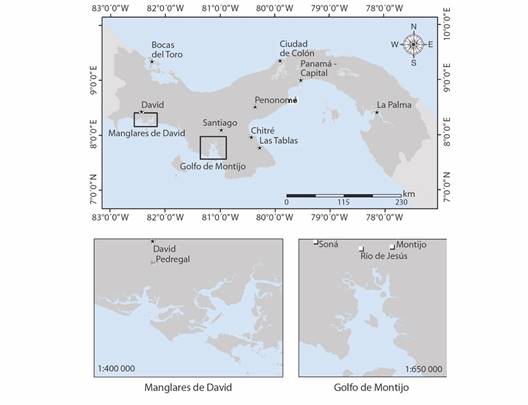
Fig. 1 Zona de estudio, Golfo de Montijo (GM) y Manglares de David (MD), Panamá. / Fig. 1. Study zone within the Montijo Gulf (GM) and mangroves of David (MD), Panama.
Manglares de David (MD): Declarada área protegida a través del Decreto Municipal 21 del 6 de junio de 2007, por medio del cual se adoptaron disposiciones para la protección del ambiente y los manglares en las costas del distrito de David. Se ubica entre las coordenadas 8°22’47’’ N & 82°26’50’’ W; 8°20’09’’ N & 82°12’56’’ W; 8°13’49’’ N & 82°19’12” W y 8°17’19” N & 82°28’49” W. En esta zona desembocan diferentes ríos, como el Platanal que forma el principal estero en puerto Pedregal y los ríos Chico y Chorcha. También desembocan otros ríos de mayor caudal, como David y Chiriquí (Díaz del Olmo et al., 2004) (Fig. 1).
Metodología de análisis: Macroscopía: Entre marzo de 2016 y febrero de 2017, se recolectaron mensualmente y al azar, entre 80 y 140 ejemplares de Anadara tuberculosa procedentes de las capturas manuales de los extractores de concha en MD y GM, las cuales se midieron en su longitud total (LT) con un calibrador Vernier de 0.01 mm de precisión. A cada ejemplar se le realizaron cortes transversales y longitudinales para la evaluación de la gónada, identificar el sexo según su color, naranja para hembras y blanco a crema en machos, así como el estadio de desarrollo reproductivo, según porcentaje de cobertura de la gónada con relación a la masa visceral y su color (Borda & Cruz, 2004; Lucero-Rincón et al., 2013). Este mismo procedimiento se aplicó entre junio de 2019 y marzo de 2020 a ejemplares recolectados en el GM. Adicionalmente, se revisó información no publicada de muestreos realizados en 2004, 2013 y 2015 para el GM.
Histología: Entre marzo de 2016 y febrero de 2017, se recolectaron mensualmente, en MD y GM, 30 organismos adultos con tallas entre 50 y 55 mm de LT, a los cuales se le identificó el sexo y estadio de desarrollo gonadal, aplicando la misma metodología descrita en el apartado de macroscopía (Borda & Cruz, 2004; Lucero-Rincón et al., 2013), para posteriormente extraerle una sección transversal, a nivel de gónada, la cual se fijó durante 24 horas con Formaldehído - Ácido Acético - Cloruro de Calcio (F.A.A.C.C.) (Samoilys & Roelofs, 2000) y se procesó hasta obtener placas con cortes histológicos de 3 µ, teñidas con hematoxilina y eosina (Howard & Smith, 1983). Cada placa se revisó y se fotografió utilizando un microscopio Segeresa con cámara digital, en los objetivos 4x y 10x y se verificó el sexo y la condición de desarrollo gonadal, según los criterios de Lucero-Rincón et al. (2013) y Manjarres-Villamil et al. (2013), que consideran el desarrollo de las células sexuales y las características de los folículos y túbulos seminíferos para definir el estadio de desarrollo gonadal.
En el mismo periodo se recolectaron ejemplares con tallas inferiores a 40 mm de longitud total en MD y GM, a los cuales se les aplicó la misma metodología de procesamiento histológico para identificar la condición sexual y la talla de inicio de la actividad reproductiva (Manjarres-Villamil, et al., 2013).
Análisis de los datos: debido a la aparición de individuos indeterminados en los análisis macroscópicos (no se observó la gónada) y su efecto en el cálculo de la proporción sexual, se procedió a generar una metodología para comparar las estimaciones de proporción sexual por procedimientos macroscópicos e histológicos y, en caso de existir diferencias en la misma, generar un factor de corrección para tratar de igualar ambas estimaciones, como se detalla a continuación:
• Los individuos indeterminados macroscópicamente se verificaron a través de cortes histológicos (Lucero-Rincón et al., 2013), para ubicarlos como machos, hembras o hermafroditas. Esto permitió establecer, del total de indeterminados, que porcentaje correspondía a machos, hembras o hermafroditas.
• Se contabilizaron los individuos clasificados como indeterminados por procedimientos macroscópicos y se multiplicó este valor por el aporte porcentual de machos, hembras y hermafroditas estimado en el paso anterior, para calcular, del total de indeterminados, cuantos correspondían a cada condición.
• La cantidad estimada de machos, hembras y hermafroditas se sumó a la obtenida de cada condición por procedimiento macroscópico y se calculó una proporción sexual ajustada dividiendo la cantidad de hembras por la cantidad de machos.
• Al final se obtuvo una proporción sexual macroscópica, una histología y una tercera ajustada, las cuales se compararon para evaluar la utilidad del factor de corrección.
Para evaluar la variación temporal de la proporción sexual, se analizaron datos macroscópicos para el GM de 2004, 2013, 2015, 2017 y 2020 y se corroboró el resultado, por el análisis placas histológicas de 1994 y se compararon con las obtenidas en 2017. También se realizó un análisis de la proporción macroscópica por clases de tallas, con intervalos de 5 mm, a los ejemplares recolectados en el 2017 para ambas localidades. Para determinar si la proporción sexual era diferente de la esperada (1:1) se aplicó la prueba de X2 para un a = 0.05 (Zar, 2009).
Resultados
Proporción sexual: por macroscopía, en el 2017, se estimó una proporción sexual a favor de las hembras, tanto en el GM (6.2H:1M) como en MD (7.9H:1M), lo cual fue confirmado por análisis histológico, tanto para el GM (3.2H:1M) como en MD (3.7H:1M). Por su parte, para el GM se encontró que la proporción sexual presentó variación temporal, ya que, por análisis macroscópico, pasó de 1.9H:1M en el 2004 a 5.1H:1M en el 2020 y por histología varió de 1H: 1M en 1994 a 3.2H:1M en el 2017 (Tabla 1).
Tabla 1 Variación de la proporción sexual (H:M) en Anadara tuberculosa capturadas en el Golfo de Montijo y Manglares de David analizados en diferentes años y localidades a través de metodología macroscópica e histológica. / Table 1. Sex ratio (F:M) variation in Anadara tuberculosa from the Montijo Gulf and mangroves of David analyzed from different years and localities through macroscopic and histological techniques.
| Loc. | año | Histológica | Macroscópica | |||||
| (H:M) | N | LT (mm) | (H:M) | I | N | LT (mm) | ||
| GM | 1994 | 1:1 | 360 | 45-55 | ||||
| GM | 2004 | 1.9:1* | 192 | 45-55 | ||||
| GM | 2013 | 2.6:1* | 2 | 322 | 30.0-82.7 | |||
| GM | 2015 | 3.0:1* | 71 | 604 | 35-79.3 | |||
| GM | 2017 | 3.2:1* | 360 | 50-55 | 6.2:1* | 179 | 1 376 | 26.2-92.9 |
| GM | 2017 | 1.1:1 | 24 | 20.2-40 | ||||
| MD | 2017 | 3.7:1* | 361 | 50-55 | 7.9:1* | 195 | 1 382 | 31.6-81.9 |
| MD | 2017 | 0.9:1 | 28 | 17.6-40.7 | ||||
| GM | 2020 | 5.1:1* | 111 | 1 222 | 26.0-96.0 | |||
*diferencias significativas, I: indeterminados. / *significant differences, I: undetermined.
Similar a lo observado en el análisis temporal, la proporción sexual varió de acuerdo con las tallas analizadas. Tanto en MD (LT 26.20 - 92.90 mm) como en el GM (LT 31.60 - 81.90 mm) se observó una proporción sexual a favor de las hembras a medida que aumentaron las tallas (Fig. 2), lo que se corroboró por análisis histológico, donde para ejemplares capturados en el GM, con tallas entre 20.2 y 40 mm (Media = 31.11, DE = 5.72, N = 24) y en MD, tallas entre 17.6 y 40.7 mm (Media = 28.51, DE = 6.42, N = 28), se estimó una proporción de 1H:1M, mientras que, para ejemplares entre 50 y 55 mm, tanto para el GM (Media = 52.65, DE = 1.88, N = 360) como para MD (Media = 52.38, DE = 1.87, N = 360) la proporción sexual fue a favor de las hembras (Tabla 1).
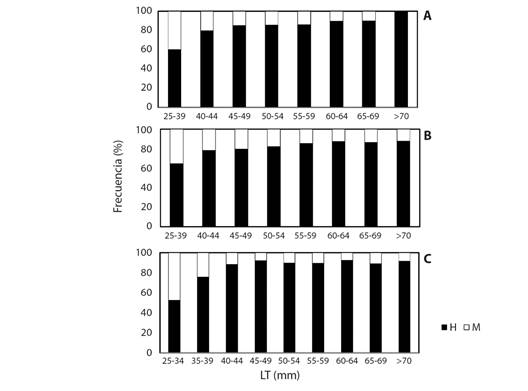
Fig. 2 Variación en la proporción sexual en Anadara tuberculosa capturadas en el Golfo de Montijo (GM) y Manglares de David (MD). A: GM 2017, B: GM 2020, C: MD 2017. / Fig. 2. Sex ratio variation in Anadara tuberculosa from the Montijo Gulf and mangroves of David. A: GM 2017, B: GM 2020, C: MD 2017.
Aunque en ambos ecosistemas se determinó proporción sexual a favor de las hembras, la diferencia radicó en que las estimaciones macroscópicas resultaron más amplías que las histológicas (Tabla 1), definido por la existencia de organismos indeterminados en los análisis macroscópicos. Para el GM, se identificaron 30 ejemplares indeterminados a través de macroscopía, los cuales, al aplicarle a los mismos individuos procesamiento histológico, resultaron 63.3 % machos, 33.3 % hembras y 3.3 % indeterminados, y para MD, de los 58 ejemplares indeterminados, resultaron 55.2 % machos, 29.3 % hembras y 15.5 % hermafroditas. Esto implica que los individuos catalogados como indeterminados por procedimientos macroscópicos, más del 55 % resultaron machos en ambas localidades (Tabla 2).
Tabla 2 Proporción sexual en Anadara tuberculosa obtenida por tres metodologías: observación macroscópica, observación microscópica (placas histológicas) y ajustada, combinando ambas metodologías. / Table 2. Sex ratio in Anadara tuberculosa determined by three methodologies: macroscopic observation, microscopic observation (Histological sections), and adjusted diagnostic (combining both methodologies).
| Estadio Histología | Golfo de Montijo | ||||||||
| CC1 | % | IMA | CC2 | EM | T | PMaA | PMa | PHi | |
| H | 10 | 33.3 | 179.0 | 59.7 | 1 035.0 | 1 094.7 | 3.9:1 | 6.2:1 | 3.2:1 |
| M | 19 | 63.3 | 179.0 | 113.4 | 166.0 | 279.4 | |||
| I | 1 | 3.3 | 179.0 | 6.0 | 49.0 | 55.0 | |||
| HF | 0.0 | 0.0 | 179.0 | 0.0 | 2.0 | 2.0 | |||
| 30.0 | 100.0 | ||||||||
| Manglares de David | |||||||||
| H | 17 | 29.3 | 194.0 | 56.9 | 1 042.0 | 1 098.9 | 4.6:1 | 7.9:1 | 3.7:1 |
| M | 32.0 | 55.2 | 194.0 | 107.0 | 132.0 | 239.0 | |||
| I | 0.0 | 0.0 | 194.0 | 0.0 | |||||
| HF | 9.0 | 15.5 | 194.0 | 30.1 | 7.0 | 37.1 | |||
| 58.0 | 100.0 | ||||||||
CC1: Condición sexual corregida por histología a partir de ejemplares catalogados como indeterminadas por análisis macroscópicos; IMA: Cantidad de ejemplares identificados como indeterminados por análisis macroscópicos; CC2: Cantidad de ejemplares catalogados por categoría (H: hembras, M: machos, I: indeterminados, HF: hermafroditas) como resultado de multiplicar el porcentaje ajustado por histología por la cantidad de indeterminado por análisis macroscópicos; EM: Cantidad de ejemplares ubicados en cada categoría por análisis macroscópicos; T: Total obtenido para cada categoría al sumar CC2 + EM; PMaA: Proporción sexual macroscópica ajustada combinando metodología macro e histológica; PMa: Proporción sexual estimada por análisis macroscópico; PHi: proporción sexual estimada por análisis histológico. / CC1: Corrected sexual condition by histology from catalogued simples as undetermined by macroscopic analysis; IMA: Quantity of samples identified as undetermined by macroscopic analysis; CC2: Quantity of simples by category (H: Females, M: Male, I: Undetermined, HF: hermaphrodites) as a result from the multiplication of the adjusted percentage by histology, by the amount of undetermined by the macroscopic analysis; EM: Quantity of simples located in each category by macroscopic analysis; T: Total obtained for each category when adding CC2 + EM; PMaA: Macroscopic sexual proportion adjusted by combining the macro and histological methodologies; PMa: Estimated sexual proportion by macroscopic analysis; PHi: Estimated sexual proportion by histological analysis.
Mediante análisis macroscópicos se identificaron 179 indeterminados (N = 1 376) para GM y 194 (N = 1 382) para MD. En ambos casos se multiplicó los indeterminados por los porcentajes asignados por análisis histológicos y, al resultado estimado, se le sumó la cantidad de ejemplares machos, hembras y hermafroditas obtenidos por macroscopía, para calcular una proporción sexual ajustada de 3.9H:M en GM y 4.6H:M, para MD, muy similares a las estimadas por histología (Tabla 2).
Hermafroditismo: Para el GM, el primer antecedente para evaluar la presencia de hermafroditismo corresponde a preparaciones histológicas de 360 individuos (LT de 45.00 a 55.00 mm), recolectados en 1994, las cuales fueron reevaluadas, sin encontrar evidencias de hermafroditismo. En el 2017, mediante observaciones macroscópicas, se determinó por primera vez hermafroditismo en dos ejemplares de 49.60 y 51.70 mm de LT, para un rango de tallas analizadas de 31.6 a 81.9 mm de LT, lo cual fue corroborado por análisis histológico, donde se observó la presencia de esta condición en 14 individuos (3.9 %), para tallas de 50.0 a 55.0 mm de LT. En el 2020 se identificó, por macroscopía, la presencia de hermafroditismo en nueve ejemplares (0.74 %) en el rango de tallas de 26.0 a 97.0 mm (Fig. 3, Tabla 3).
Tabla 3 Descripción de la condición de la gónada en organismos hermafroditas en Anadara tuberculosa según método de análisis, tallas y porcentaje de cobertura de la condición masculina y femenina. / Table 3. Gonad condition in hermaphroditic in Anadara tuberculosa individuals according to the method of analysis, sizes, and percentage of coverage of the male and female condition.
| Loc. | Año | HM | % | Método | N | LT (mm) | Observaciones |
| GM | 1994 | 0 | 0 | Histológico | 360 | 45.0-55.0 | Se analizaron placas procesadas en 1994. |
| 2017 | 14 | 3.9 | Histológico | 360 | 50.0-55.0 | 85.7 % desove en ambos sexos. | |
| 14.3 % maduración en curso en ambos sexos. | |||||||
| 50 % dominó el tejido femenino, en el 14.3 % masculino y en el 35.7 % fue similar. | |||||||
| 2017 | 2 | 0.19 | Macroscópico | 1 035 | 31.6-81.9 | Mayor volumen de tejido femenino. | |
| 2020 | 9 | 0.74 | Macroscópico | 1 222 | 26.0-97.0 | Presencia de gónada de ambos sexos y mayor volumen de tejido femenino. | |
| MD | 2017 | 7 | 0.51 | Macroscópico | 1 376 | 26.2-92.9 | Presencia de gónadas de ambos sexos, con predominancia de tejido femenino. |
| 2017 | 48 | 13.3 | Histológico | 361 | 50.0-55.0 | 77 % desove en ambos sexos. | |
| 23 % desove en uno de los sexos y madurez en curso en el otro. | |||||||
| 54 % dominó tejido femenino, 12.5 % tejido masculino y en 33.5 % similar para ambos sexos |
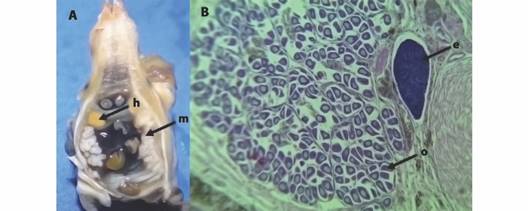
Fig. 3 Anadara tuberculosa hermafrodita. A. Corte trasversal a nivel de gónada, B. Microfotografía (100x). h: Gónada femenina, m: Gónada masculina, e. Espermatozoides, o: ovocitos. / Fig. 3. Anadara tuberculosa hermaphrodite. A. Transverse section at the level of the gonad; B. Photomicrography (100x). h: female gonad, m: male gonad, e: Spermatozoids; o: Oocytes.
En MD se observó en 2017, por macroscopía, siete ejemplares hermafroditas (0.51 %) para tallas entre 26.2 y 92.9 mm, mientras que por histología se identificaron 48 individuos (13.3 %) para tallas entre 50.0 y 55.0 mm de LT. En ambas localidades, por histología se determinó como dominante el tejido femenino (50 %) y el desove simultaneo en más del 75 % de los casos (Tabla 3).
Discusión
La paridad de sexos (1H:1M) en Anadara tuberculosa ha sido reportada para diferentes localidades de Costa Rica (Cruz, 1984; Silva & Bonilla, 2001; Vega, 1994) y México (Pérez-Medina, 2005), contrario a lo reportado para Perú (Ordinola et al., 2019), Colombia (Lucero-Rincón et al., 2013) y Ecuador (Flores & Licandeo, 2010), donde se presentó dominancia de hembras sobre machos. En el caso de Ecuador, se sugiere que las variaciones en la proporción sexual están relacionadas a hermafroditismo protándrico.
En Panamá, la concha negra ha sido estudiada desde 1994 en el GM, cuando se determinó una proporción sexual 1:1 (Rodríguez & González, 1995), resultado que se confirmó en 2006 (Jordán & Gómez, 2006). Si embargo en el 2004, 2013, 2015, 2017 y 2020, se encontró un desbalance en la proporción sexual a favor de las hembras, situación que coincide con los reportado por Guilbert (2007), para esta especie, en el Archipiélago de las Perlas, Pacífico panameño y el presente estudio, en MD; así como para otras especies del género Anadara: A. antiquata (Jahangir et al., 2014; Mzighani, 2005), A. scapha (Baron, 1992) y A. similis (Flores & Licandeo, 2010; Manjarres-Villamil et al., 2013).
Guilbert (2007), explicó la superioridad numérica de las hembras con base en dos posibles hipótesis: la primera, por el efecto que podrían ejercer las propiedades fisicoquímicas del agua que favorecen el desarrollo de las hembras o interfieren en el desarrollo de los machos, sin mayores evidencias de cuáles son estos factores, y la segunda, en una distribución diferencial de machos y hembras, por lo cual los machos podrían ser más difíciles de capturar. Esta última hipótesis contrasta con lo reportado por Vega et al. (2021), para el GM y MD, en un análisis de tallas y densidades para concha negra donde señalan que para los muestreos se recorrieron ampliamente los manglares y el patrón de distribución de machos y hembras fue similar en ambos ecosistemas.
El incremento en la proporción de hembras observado en GM y MD coincide con la disminución de las densidades poblacionales en ambas localidades, debido a la presión pesquera a la que ha estado sometido este recurso (Vega et al., 2021), lo cual coincide con lo expuesto por Romo-Piñera et al. (2009), en Megapitaria Squalida y Breton et al. (2018), en una revisión sobre bivalvos, al plantear que es una estrategia para garantizar la reproducción de la especie. En este sentido, Dalpé et al. (2022), reportaron que en organismos sésiles (Crassostrea gigas), el hecho de estar agregados o no, incide sobre el cambio de sexo, y la proporción sexual, resultando que machos solitarios se convirtieron en hembras con más frecuencia que los gregarios (Yasuoka & Yusa, 2016), con lo que se podría interpretar que la disminución de las densidades puede tener un efecto similar.
Una de las razones de cambios en la proporción sexual es la protandría (Flores & Lincadeo, 2010). Para GM y MD se evidenció que A. tuberculosa presentó diferencias en la proporción de sexos a favor de las hembras y en ejemplares hermafroditas, se presentó ovocitos y espermatozoides funcionales, así como predominancia del tejido gonadal femenino sobre el masculino y machos con maduración a menores tallas que las hembras, lo que es indicio de hermafroditismo protándrico, como lo indican Lucero-Rincón et al. (2013) y Lucero-Rincón et al., (2021), en A. tubercuosa; Afiati (2007) en A. antiquata y A. granosa y Manjarrés-Villamil et al. (2013) en A. similis.
El presente trabajo es el primer reporte de hermafroditismo en A. tuberculosa para Panamá, condición que ha sido documentada previamente en México (Pérez-Medina, 2005), en el Pacífico colombiano (Lucero-Rincón et al., 2013; Lucero-Rincón et al., 2021), Ecuador (Pante-Vélez et al., 2020), así como en otras especies del género: A. antiquata, A. granosa (Afiati, 2007) y A. similis (Manjarres-Villamil et al., 2013).
Los porcentajes de hermafroditismo observados por procedimientos histológicos en MD fue de 13.3 % (N = 361) y en el GM de 3.9 % (N = 360), de los más altos reportados para A. tuberculosa. Estudios realizados por Pérez-Medina (2005) y Panta-Vélez et al. (2020), señalan que es un evento casual, debido a la baja incidencia de la condición; sin embargo, Lucero-Rincón et al. (2021), lo describen como un proceso intrínseco a la especie, no casual, en función de su aparición en casi todos los sitios de muestreo y lo atribuyen a factores intrínsecos o extrínsecos, como la temperatura, nutrición o salinidad. Para el GM, se puede confirmar que la aparición del hermafroditismo es un evento relativamente nuevo, con la certeza de que no estaba presente en 1994, y que su aparición estuvo acompañada de cambios en la proporción sexual a favor de las hembras y la disminución de las densidades de A. tuberculosa (Vega et al., 2021), por lo que lo catalogamos como un evento intrínseco a la especie, como lo indica Lucero-Rincón et al. (2021), asociado a una respuesta de la población de concha negra a la disminución de las densidades, lo cual coincide con lo reportado por Romo-Piñera et al. (2009) para Megapitaria squalida en Baja California, y Breton et al. (2018), en una revisión sobre bivalvos.
Un factor no considerado en organismos con proporción sexual diferencial es el efecto del aporte de los indeterminados al estimado de esta. Es así como, estudios macroscópicos con resultados en la proporción sexuales a favor de las hembras, en A. tuberculosa y A. similis, han reportado porcentajes importante de individuos indeterminados como por ejemplo, Cruz (1984) en Costa Rica, quien comunicó un porcentaje promedio de 13.84 % con un máximo del 42 % (N= 1 094), Flores & Licandeo (2010), en Ecuador, con 16.67% (N= 1 997) y Manjarres-Villamil et al. (2013), en Colombia, con 32.85 % (N= 347), lo que implica que puede existir un sesgo en las estimaciones de la proporción sexual.
En el presente trabajo, el sesgo salió a relucir al realizar evaluaciones histológicas y macroscópicas de los mismos individuos, con lo cual se presentaron dos proporciones sexuales, una macroscópica y otra histológica, donde la primera resultó superior a la segunda, por lo que se generó un factor de corrección, basado en la frecuencia de sexos obtenida mediante la validación histológica de los ejemplares indeterminados macroscópicamente, con lo cual la proporción macroscópica ajustada se acercó a la obtenida a partir de la estimación histológica, tanto en el GM, como en MD, convirtiéndose en una alternativa para ajustar la proporción sexual cuando se hacen evaluaciones macroscópicas y existen desbalance a favor de las hembras.
Futuras investigaciones deben apuntar a confirmar la talla del cambio de sexo de la especie y tratar de identificar los factores responsables de la disminución de las densidades (Vega et al., 2021), y su relación con los cambios en la proporción sexual y el hermafroditismo, para lo cual se deben considerar los análisis histológicos por intervalos de tallas (Flores & Licandeo, 2010), así como los múltiples factores identificados como desencadenantes de estos procesos: situaciones de estrés, mecanismos inestables de determinación del sexo, factores ambientales o nutricionales y la contaminación, que puede actuar como disruptor endocrino afectando el desarrollo reproductivo (Afiati, 2007; Breton et al., 2018; Mzighani, 2005), e inclusive la plasticidad genotípica de la especie, que provoca diferentes respuestas en función de las presiones antropogénicas o ambientales a las que está sometida (Yasuoka & Yusa, 2016).
En ausencia de monitoreo ambiental, el estado de salud de las poblaciones de bivalvos y el conocimiento de la historia de vida de especies particulares, incluyendo la pérdida de la capacidad reproductiva, puede ser un indicador de alteraciones ambientales (Breton et al., 2018), donde los estudios de los factores que definen el sexo son útiles para reflejar la salud de los ecosistemas (Campos et al., 2012). Es así como, en Tegillarca granosa, después de 30 días de exposición a metales pesados (Cu, Zn, Pb y Cd), todos mostraron efectos significativos en la proporción de sexos, aumentando la cantidad de machos, además de reducir los valores del Índice Gonadosomático (Liu et al., 2014), y en Nicaragua se encontró que A. tuberculosa y Larkinia grandis tienen la capacidad de bioacumular metales en sus tejidos, por lo que recomiendan su uso como especies centinelas en los ecosistemas de manglares del Pacífico americano (Aguirre-Rubí et al., 2019).
En conclusión, Anadara tuberculosa, en el GM y MD, ha experimentado cambios en indicadores poblacionales, como la proporción y la condición sexual (aparición del hermafroditismo), asociado a reportes de disminución importantes de las densidades, acompañado de la existencia de tallas grandes (Vega et al., 2021). Estos indicadores reflejan que las poblaciones de la concha negra, en ambos ecosistemas de manglar, están sometidas a estresores que desencadenaron cambios en las poblaciones, sin claridad sobre las causas que originan esos cambios, por lo que es importante dirigir investigaciones hacia la identificación de los factores, naturales o antropogénicos, que puedan estar afectando, ya sea a la población adulta o las fases tempranas del desarrollo del molusco, como puede ser la contaminación ambiental o la sobrepesca del recurso.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


