Introducción
Los ecosistemas costeros alrededor del mundo, especialmente los estuarios, han sido objeto de la alteración de su entorno y de la captura intensiva (sobrepesca) de sus recursos naturales, de los que los moluscos, crustáceos y peces son los más explotados (Gladstone, 2009). La sobrepesca de esos recursos ha sido la causa más evidente del colapso de muchas pesquerías alrededor del mundo (Jackson et al., 2001). La extracción excesiva no solo disminuye las poblaciones hasta densidades críticas, sino que también altera el flujo de energía del ecosistema, llevándolo a otros estados de funcionamiento no necesariamente útiles para el entorno humano (Cloern et al., 2016). En el Golfo de Nicoya la extracción ha sido intensiva, especialmente de especies filtradoras (Ej: moluscos bivalvos y sardinas), depredadoras (Ej: peces pargos y corvinas) o detritófagas (Ej: varios crustáceos). Especies de peces como Cynoscium albus (corvina reina, Sciaenidae) y Lutjanus colorado (pargo colorado, Lutjanidae) son muy apreciadas, entre otras, desde hace décadas, en el mercado local.
El Golfo de Nicoya es el principal ecosistema estuarino de Costa Rica y, desde mediados del siglo XX, en forma cada vez más intensa, soporta varias pesquerías que extraen manualmente algunos moluscos y peces, o emplean diferentes tipos de artes no selectivas para la captura de la fauna epibéntica, de la que se seleccionan preferentemente camarones y algunos peces, descartándose una gran parte del resto de la captura. Entre 1979 y 1981 y con el propósito de aportar información para dar apoyo a la formulación de políticas de manejo del ecosistema del Golfo se ejecutó, con la participación del buque científico Skimmer, un programa de investigación multidisciplinario cuyos resultados han sido resumidos por Vargas (1995). Las evaluaciones de la diversidad, abundancia relativa y distribución espacial de los peces demersales del Golfo fueron incluidas en ese programa y realizadas entre febrero y julio de 1979 y abril de 1980, con una red de arrastre (tipo otter) y en un ámbito de profundidad de 10 a 50 m. La lista de los peces recolectados fue publicada por Bartels, Price, López y Bussing (1983) e incluyó 189 registros, de los que 32 quedaron provisionalmente a nivel de género y los restantes 157 a nivel de especie.
En diciembre de 1993 y febrero de 1994 se hizo una nueva evaluación multidisciplinaria del Golfo de Nicoya, así como de la región de Bahía Coronado y el Golfo Dulce, a bordo del buque científico Víctor Hensen (en adelante, V. Hensen). Parte de los resultados de esa expedición fueron recopilados por Vargas y Wolff (1996). Para la evaluación de los peces demersales se utilizaron dos tipos de redes (otter y beam) y se recolectaron muestras entre los 10 y los 228 m de profundidad en el Golfo de Nicoya. La lista de los peces fue publicada por Bussing y López (1996) y comprende, para el Golfo de Nicoya, 185 registros a nivel de especie y seis a nivel de género. La lista incluyó aparte las 20 especies recolectadas en las cuatro estaciones profundas (64 a 230 m) de la boca del estuario, por lo que el total anotado para el Golfo en ese crucero ascendió a 205 especies y seis a nivel de género.
Las actividades pesqueras en el Golfo de Nicoya continúan actualmente a lo largo del estuario y, con redes de arrastre, a mayores profundidades (Herrera, Clarke, Naranjo-Elizondo, Espinoza, & Wehrtmann, 2016). En este contexto se requieren alternativas actualizadas para el manejo de esos recursos y estas deben estar fundamentadas en una nueva evaluación de las especies sobrevivientes y sus parámetros poblacionales. Para lograr este objetivo es necesaria una base de datos actualizada sobre las especies de peces encontradas previamente en el estuario, su frecuencia en las estaciones y las longitudes de los ejemplares recolectados. En este contexto, la información publicada proveniente de los buques Skimmer y V. Hensen, por su ámbito de profundidad y artes utilizadas, es la más amplia disponible sobre los peces capturados con redes de arrastre en el Golfo de Nicoya. La información más reciente, sobre las especies de peces de la región interna del Golfo de Nicoya, fue publicada por Murase, Angulo, Miyasaki, Bussing y López (2014), con base en los registros desde 1962 del Museo de Zoología de la Universidad de Costa Rica, e incluyó 274 especies.
Por tanto, el objetivo de este estudio es proveer un inventario actualizado de las especies de peces identificados durante, o posteriormente, provenientes de las expediciones de los buques Skimmer y V. Hensen, sus longitudes máximas, frecuencia de algunas especies en las estaciones, así como sugerencias para futuras evaluaciones del ecosistema.
Materiales y Métodos
Las capturas de peces en los ambientes sedimentarios del fondo del Golfo de Nicoya (10o N & 85o W), Pacífico, Costa Rica, fueron hechas a bordo de los cruceros de los buques científicos Skimmer (Febrero y julio de 1979, abril de 1980) y V. Hensen (Diciembre de 1993 y febrero de 1994). Las descripciones de los métodos de captura y de la abundancia, diversidad y distribución de las especies, están incluídas en Bartels, Price, López y Bussing (1983, 1984) y en Wolff (1996), respectivamente. No obstante, aportamos aquí un resumen de los métodos: En el buque Skimmer las recolectas se hicieron en 20 estaciones y en un ámbito de profundidad de 8 a 50 m (Fig. 1A, Fig. 1B y Fig. 1C). Se utilizó una red de arrastre tipo otter (Fig. 2A) con malla de 3.6 cm en el cono final receptor de la captura. En el buque V. Hensen las capturas se hicieron en 12 estaciones entre 10 y 228 m de profundidad (Fig. 1B, Fig. 1C y Fig. 1D) y se utilizaron dos tipos de red: otter (malla 2.5 cm) y beam (malla de 1 cm).
Una vez que la red fue depositada y abierta sobre la cubierta de los buques se procedió a separar los peces en grupos similares por su aspecto externo (Fig. 2B). Los ejemplares de esos grupos fueron revisados por M. López & W. Bussing (Fig. 2C) quienes realizaron, a bordo de ambos cruceros, la identificación de la mayoría de las especies y seleccionaron ejemplares testigo. Los ejemplares seleccionados fueron preservados en formalina (10 % en agua de mar), luego conservados en alcohol etílico (70 %), catalogados, e ingresados a la Colección Ictiológica (Angulo, López, Bussing, Ramírez-Coghi, & Arias-Godínez, 2015) del Museo de Zoología de la Universidad de Costa Rica. En ambos buques se hizo a bordo la medición de las longitudes de la mayoría de los peces identificados, colocando cada ejemplar extendido de costado, con la cabeza hacia la izquierda, sobre un soporte de un metro de longitud dividido en centímetros (Fig. 2D). Para cada ejemplar se determinó la longitud desde la boca hasta el extremo de la aleta caudal (Longitud total, LT). Las longitudes máximas de las especies fueron tomadas de Price, Bussing, Bussing, Maurer y Bartels (1980) para las del buque Skimmer y de Wollf y Vargas (1994) para las del V. Hensen.

Fig. 1. Fig. 1 Localización de las estaciones de recolecta de peces mediante redes epibénticas (Redes de arrastre tipo otter trawl y beam trawl) en el Golfo de Nicoya, Pacífico, Costa Rica: A, C. Buque Skimmer (Otter trawl; 20 estaciones) Febrero y julio de 1979, abril de 1980. Profundidad: 10 m a 50 m. Modificada de Fig. 1 (Bartels, Price, López, & Bussing, 1983). B, D. Buque Víctor Hensen (Otter trawl y beam trawl, 12 estaciones) Diciembre 1993 y febrero 1994. Profundidad: 10 m a 228 m. Modificada de Fig. 1 (Wolff, 1996). La línea discontínua indica la isóbata de 100 m. Las profundidades de las estaciones a lo largo del eje central del Golfo, son: 43 (10 m), 45 (15 m), 01 (33 m), 30 (30 m), 06 (43 m), 52 (118 m), 54 (228 m). La amplitud promedio de la marea es de 3 m. Fotos: K. Price y J. A. Vargas. Location of the fish collecting stations with epibenthic trawl nets (Otter and beam trawls) in the Gulf of Nicoya, Pacific, Costa Rica. A, C. Research vessel Skimmer (Otter trawl, 20 stations), February and July, 1979; April, 1980. Depth: 10 to 50 m. Modified from Fig. 1 (Bartels, Price, López & Bussing, 1983). B, D. Reseach vessel Victor Hensen (Otter trawl and beam trawl, 12 stations). December 1993 and February 1994. Depth: 10 to 228 m. Modified from Fig. 1 (Wolff, 1996). The discontinuos line indicates the 100 m depth contour. The depths of the stations along the central axis of the Gulf, are: 43 (10 m), 01 (33 m), 30 (30 m), 06 (43 m), 52 (118 m), 54 (228 m). The average tidal range is 3 m. Photos: K. Price and J. A. Vargas.
Para actualizar las listas de especies de peces recolectados por ambos buques, se procedió a verificar los nombres citados en Bartels, Price, López y Bussing (1983) (Tabla 1: 189 taxa, 157 a nivel de especie) y en Bussing y López (1996) (Tabla 1: 211 taxa, 185 a nivel de especie), respectivamente. A la lista del Golfo de Nicoya se le agregaron las 20 especies incluidas por Bussing y López (1996) como pertenecientes a las estaciones externas (offshore) del Golfo (51, 52, 53, 54, Fig. 1B). Se procedió luego a revisar las listas digitalizadas comparándolas con los datos publicados por Bussing y López (1993), Bearez (1996), Castellanos-Galindo, Rubio-Rincón, Beltrán-León, Zapata, y Baldwin (2006), Bussing y López (2009, 2015), Angulo et al., (2015), Murase et al., (2014), Espinoza, Díaz, Angulo, Hernández y Clarke (2018) y Smith (2018). También se consultaron las bitácoras de W. B. y M. L., para ambos cruceros. Seguidamente, se revisaron los ejemplares provenientes de esos cruceros y depositados la Colección Ictiológica del Museo de Zoología de la Universidad de Costa Rica (MZUCR) y se agregaron los nombres de las especies en la Colección identificadas o descritas posteriormente a las publicaciones de Bartels et al., (1983) y Bussing y López (1996). Luego, los nombres científicos fueron verificados contra los aceptados actualmente, según la página electrónica World Register of Marine Species (WORMS) y se hicieron los cambios pertinentes. Las listas en Bartels et al., (1983) y Bussing y López (1996), incluyen los nombres agrupados en familias. En este estudio hemos optado, para facilitar su localización, el ordenar alfabéticamente los nombres de las especies y asignarles un código numérico. Con el propósito de aportar información sobre la presencia relativa de algunas especies en las estaciones de cada crucero, se incluyeron los nombres de las 12 especies capturadas en un mayor número de estaciones, así como ejemplos de 10 especies presentes solamente en una estación. Para proveer un marco de referencia sobre la variación de tres parámetros ambientales a lo largo de una gradiente de profundidad en el Golfo de Nicoya, incluimos información con base en Wolff y Vargas (1994) sobre perfiles verticales (superficie-fondo), obtenidos mediante un sensor electrónico, de la salinidad, temperatura y oxigeno disuelto, en tres estaciones (06, 52 y 54; Fig. 1B) del V. Hensen en el eje central del estuario.

Fig. 2 Fig. 2 A-E. Buque Skimmer. A. Red tipo otter en la cubierta después de un arrastre. B. Grupo de peces ordenado para su identificación y medición. C. W. Bussing († 2014) realiza a bordo la identificación de los peces. D. Soporte de madera, marcado en cm, para la medición de longitud total. Fotos: K. Price A-E. Research vessel Skimmer. A. Otter trawl net hanging on deck after trawling. B. Group of fish organized for their indentification and measurement. C. W. Bussing († 2014) performing on board the species identifications. D. Wooden board marked in cm, for the measurement of total lenghts. Photos: K. Price.
Resultados
La lista actualizada de las 250 especies de peces capturadas por los buques Skimmer y V. Hensen se incluye en la tabla 1. A las dos listas originales se les hizo un total de 41 actualizaciones a los nombres. Los nombres en las publicaciones originales aparecen en la columna izquierda de la tabla 1 y en la columna derecha los actualizados. Algunos ejemplares identificados provisionalmente a nivel de género en las listas originales correspondieron a formas juveniles y su asignación a una especie en particular es insegura basada en criterios morfológicos, por lo que no se incluyeron en la lista actualizada. Del total de especies con código numérico en la tabla 1, las recolectadas por el buque Skimmer fueron 157, mientras que 205 estuvieron representadas en los arrastres del V. Hensen. En la tabla 1 se incluyeron en la columna central las longitudes máximas medidas para las especies capturadas por ambos buques. Los cinco ejemplares de mayor longitud medidos en el buque Skimmer, fueron: el congrio Cynoponticus coniceps (103 cm. Código 061), la raya bruja Raya velezi (65 cm de diámetro del disco. 190), el congrio Gymnothorax dovii (59 cm, 096) y la corvina agria Micropogonias altipinnis (57 cm, 135). Con base en la tabla 1, la longitud total máxima promedio de las especies medidas en el Skimmer fue de 26 cm. Los cinco ejemplares de mayor longitud capturados por el buque V. Hensen, fueron: la raya látigo Hypanus longus (117 cm de diámetro. 067), el bagre Sciades dowii (87 cm. 193), la raya Narcine brancroftii (80 cm de diámetro. 140), el bonito Caranx caballus (75 cm. 043) y la corvina reina Cynoscion albus (75 cm. 062). La longitud total máxima promedio de las especies medidas en el V. Hensen fue de 29 cm.
TABLA 1 TABLE 1: Peces recolectados con redes de arrastre (Otter trawl y beam trawl) por los buques científicos Skimmer (S, 1979-1980)1 y Victor Hensen (H, 1993-1994)2, Golfo de Nicoya, Pacífico, Costa Rica Fishes collected with trawl nets (Otter trawl and beam trawl) by the research vessels Slimmer (S, 1979-1980)1 and Victor Hensen (H, 1993-1994)2, Gulf of Nicoya, Pacific, Costa Rica
| Código | Especie | Buques | Nombre actualizado |
|---|---|---|---|
| 001 | Achirus klunzingeri | H | A. klunzingeri (Steindachner, 1880) |
| 002 | Achirus mazatlanus | S, H | A. mazatlanus (Steindachner, 1869) |
| 003 | Achirus scutum | S, H | A. scutum (Günther, 1862) |
| 004 | Albula nemoptera | H | A. nemoptera (Fowler, 1911) |
| 005 | Alectis ciliaris | S | A. ciliaris (Bloch, 1787) |
| 006 | Alphestes multiguttatus | H | A. multiguttatus (Günther, 1867) |
| 007 | Anchoa eigenmannia | S | A. eigennmannia (Meek & Hildebrand,1923) |
| 008 | Anchoa ischana | S, H | A. ischana (Jordan & Gilbert, 1882) |
| 009 | Anchoa lucida | S, H | A. lucida (Jordan & Gilbert, 1882) |
| 010 | Anchoa nasus | S, H | A. nasus (Kner & Steindachner,1867) |
| 011 | Anchoa panamensis | S | A. panamensis (Steindachner, 1876) |
| 012 | Anchoa sipinifer | S | A. spinifer (Valenciennes, 1848) |
| 013 | Anchoa starksi | S, H | A. starksi (Gilbert & Pierson, 1898) |
| 014 | Anchoa walkeri | S, H | A. walkeri Baldwin & Chang, 1970 |
| 015 | Anchovia macrolepidota | S, H | A. macrolepidota (Kner, 1863) |
| 016 | Ancylopsetta dendritica | S, H | A. dendritica Gilbert, 1890 |
| 017 | Anisostremus dovii | S, H | Genyatremus dovii (Günther, 1864) |
| 018 | Anisostremus pacifici | S, H | Genyatremus pacifici (Günther, 1864) |
| 019 | Antennarius avalonis | S, H | Fowlerichthys avalonis (Jordan & Starks, 1907) |
| 020 | Apogon dovii | S | A. dovii Günther, 1862 |
| 021 | Argentina aliceae | H | A. aliceae Cohen & Atsaides, 1969 |
| 022 | Arius dasycephalus | S, H | Cathorops dasycephalus (Günther, 1864) |
| 023 | Arius furthii | S | Cathorops fuerthii (Steindachner, 1876) |
| 024 | Arius jordani | S | Ariopsis seemanni (Günther, 1864) |
| 025 | Arius kessleri | H | Notarius kessleri (Steindachner, 1876) |
| 026 | Arius osculus | H | Notarius osculus (Jordan & Gilbert, 1883) |
| 027 | Arius platypogon | H | Occidentarius platypogon (Günther, 1864) |
| - | Arius seemani | S | Ariopsis seemanni (Günther, 1864) |
| 028 | Arius steindachneri | S | Cathorops steindachneri (Gilbert & Starks,1904) |
| - | Arius sp. 1 | S | Tabla 2 |
| - | Arius sp. A | H | Tabla 2 |
| - | Arius sp. 2 | S | Tabla 2 |
| - | Arius sp. B | H | Tabla 2 |
| 029 | Arothron hispidus | H | A. hispidus (Linnaeus, 1758) |
| - | Auxis sp. | H | Tabla 2 |
| 030 | Azevia panamensis | S, H | Cyclopsetta panamensis (Steindachner, 1876) |
| 031 | Bairdiella armata | S, H | B. armata Gill, 1863 |
| - | Bairdiella sp. | S | Tabla 2 |
| 032 | Batrachoides gilberti | S | B. gilberti Meek & Hildebrand, 1928 |
| 033 | Batrachoides pacificum | S | B. pacifici (Günther, 1861) |
| 034 | Bellator gymnostethus | S, H | B. gymnostethus (Gilbert, 1892) |
| 035 | Bellator laxias | H | B. loxias (Jordan, 1897) |
| 036 | Bellator xenisma | H | B. xenisma (Jordan & Bolmann, 1890) |
| 037 | Bollmannia chlamydes | S, H | B. chlamydes Jordan 1890 |
| 038 | Bollmannia stigmatura | S, H | B. stigmatura Gilbert, 1892 |
| - | Bollmannia sp. | H | Tabla 2 |
| 039 | Bregmaceros bathymaster | H | B. bathymaster Jordan & Bollman, 1890 |
| 040 | Brotula clarkae | S, H | B. clarkae Hubbs, 1944 |
| 041 | Calamus brachysomus | H | C. brachysomus (Lockington, 1880) |
| 042 | Cathorops tuyra | H | C. tuyra (Meek & Hildebrand, 1923) |
| 043 | Caranx caballus | H | C. caballus Günther, 1868 |
| 044 | Caranx caninus | H | C. caninus Günther, 1867 |
| 045 | Caranx otrynter | H | Carangoides otrynter (Jordan & Gilbert, 1883) |
| 046 | Caranx speciosus | H | Gnathanodon speciosus (Forsskal, 1775) |
| 047 | Caranx vinctus | S, H | C. vinctus Jordan & Gilbert, 1882 |
| 048 | Caulolatilus affinis | H | C. princeps (Jenyns, 1840) |
| - | Caulolatilus sp. | S | Tabla 2 |
| 049 | Centropomus armatus | S | C. armatus Gill, 1863 |
| 050 | Centropomus nigrescens | S | C. nigrescens Günther, 1864 |
| 051 | Cephalopholis acanthistius | S | Hyporthodus acanthistius (Gilbert, 1892) |
| 052 | Cetengraulis mysticetus | S, H | C. mysticetus (Günther, 1867) |
| 053 | Chaetodipterus zonatus | S, H | C. zonatus (Girard, 1858) |
| 054 | Chiloconger labiatus | H | C. dentatus (Garman, 1899) |
| 055 | Chloroscombrus orqueta | S | C. orqueta Jordan & Gilbert, 1883 |
| - | Chloropthalmus sp. | H | Tabla 2 |
| 056 | Citharichthys gilberti | S, H | C. gilberti Jenkins & Evermann, 1889 |
| 057 | Citharichthys platophrys | S, H | C. platophrys Gilbert, 1891 |
| 058 | Coeolorhinchus scaphopsis | H | C. scaphopsis (Gilbert,1890) |
| 059 | Coryphaeonoides leucophaeus | H | C. capito (Garman, 1893) |
| 060 | Cyclopsetta querna | S, H | C. querna (Jordan & Bollman, 1890) |
| 061 | Cynoponticus coniceps | S, H | C. coniceps (Jordan & Gilbert, 1882) |
| 062 | Cynoscion albus | S, H | C. albus (Günther, 1864) |
| 063 | Cynoscion phoxocephalus | S, H | C. phoxocephalus Jordan & Gilbert, 1882 |
| 064 | Cynoscion reticulatus | S, H | C. reticulatus (Günther, 1864) |
| 065 | Cynoscion squamipinnis | S, H | C. squamipinnis (Günther, 1867) |
| 066 | Cynoscion stolzmanni | S, H | C. stolzmanni (Steindachner, 1879) |
| 067 | Dasyatis longus | S, H | Hypanus longus (Garman, 1880) |
| 068 | Decodon melasma | H | D. melasma Gomon,1974 |
| 069 | Diapterus aureolus | S, H | Deckertichthys aureolus (Jordan & Gilbert, 1882) |
| 070 | Diapterus peruvianus | S, H | D. peruvianus (Cuvier, 1830) |
| 071 | Diodon hystrix | H | D. hystrix Linnaeus, 1758 |
| 072 | Diplectrum eumelum | H | D. eumelum Rosenblatt & Johnson, 1974 |
| 073 | Diplectrum euryplectrum | H | D. euryplectrum Jordan & Bollman, 1890 |
| 074 | Diplectrum labarum | S, H | D. labarum Rosenblatt & Johnson, 1974 |
| 075 | Diplectrum macropoma | S, H | D. macropoma (Günther, 1864) |
| 076 | Diplectrum maximum | H | D. maximum Hildebrand, 1946 |
| 077 | Diplectrum rostrum | H | D. rostrum Bortone, 1974 |
| 078 | Diplectrum pacificum | S, H | D. pacificum Meek & Hildebrand, 1925 |
| 079 | Diplobatis ommata | H | D. ommata (Jordan & Gilbert, 1890) |
| 080 | Elattarchus archidium | S | E. archidium (Jordan & Gilbert, 1882) |
| 081 | Engyophrys sanctilaurentii | S, H | E. santilaurentii Jordan & Bollman,1890 |
| - | Epinephelus acanthistius | H | Hyporthodus acanthistius (Gilbert, 1892) |
| 082 | Epinephelus cifuentesi | H | E. cifuentesi Lavenberg & Grove, 1993 |
| 083 | Epinephelus exul | H | Hyporthodus exul (Fowler, 1944) |
| 084 | Epinephelus niphobles | H | Hyporthodus niphobles (Gilbert & Starks, 1897) |
| 085 | Epinephelus niveatus | S | Hyporthodus niveatus (Valenciennes, 1828) |
| 086 | Etropus crossotus | S, H | E. crossotus Jordan & Gilbert, 1882 |
| 087 | Etropus peruvianus | H | E. peruvianus Hildebrand, 1946 |
| 088 | Eucinostomus argenteus | S, H | E. argenteus Baird & Girard, 1855 |
| 089 | Eucinostomus currani | H | E. currani Zahuranec, 1980 |
| 090 | Eucinostomus gracilis | S, H | E. gracilis (Gill, 1862) |
| 091 | Gerres cinereus | H | G. cinereus (Wabaum, 1792) |
| 092 | Gobiesox milleri | H | G. milleri Briggs, 1955 |
| 093 | Gobioides peruvianus | S, H | G. peruanus (Steindachner, 1880) |
| 094 | Gobionellus liolepis | S | G. liolepis (Meek & Hildebrand, 1928) |
| 095 | Gymnothorax dovii | S | G. dovii (Günther, 1870) |
| 096 | Gymnothorax equatorialis | S, H | G. equatorialis (Hildebrand,1946) |
| - | Gymnothorax sp. nov. | H | Tabla 2 |
| 097 | Haemulon scudderi | H | H. scudderii Gill, 1862 |
| 098 | Haemulopsis axilaris | S | H. axilaris (Steindachner, 1869) |
| 099 | Haemulopsis elongatus | S, H | H. elongatus (Steindachner, 1879) |
| 100 | Haemulopsis leuciscus | S, H | H. leuciscus (Günther, 1864) |
| 101 | Haemulopsis nitidus | S, H | H. nitidus (Steindachner, 1869) |
| 102 | Hemanthias peruanus | S, H | H. peruanus (Steindachner, 1875) |
| 103 | Hemanthias spinifer | H | H. signifer (Garman, 1899) |
| 104 | Hemicaranx leucurus | S, H | H. leucurus (Günther, 1864) |
| 105 | Hildebrandia nitens | S, H | Rhynchoconger nitens (Jordan & Bollman,1890) |
| 106 | Himantura pacifica | H | Styracura pacifica (Beebe & Tee-Van, 1941) |
| 107 | Hippocampus ingens | S | H. ingens Girard, 1858 |
| 108 | Hippoglossina bolmani | H | H. bollmani Gilbert, 1890 |
| 109 | Hippoglossina tetropthalmus | S, H | H. tetrophthalma (Gilbert, 1890) |
| 110 | Hoplopagrus guentheri | S, H | H. guentherii Gill, 1862 |
| 111 | Hoplunnis pacificus | S | H. pacifica Lane & Stewart, 1968 |
| 112 | Ilisha furthii | S, H | I. fuerthii (Steindachner, 1875) |
| 113 | Isopisthus altipinnis | S, H | I. remifer Jordan & Gilbert, 1882 |
| 114 | Kathetostoma averruncus | H | K. averruncus Jordan & Bollman, 1890 |
| 115 | Kyphosus elegans | S | K. elegans (Peters, 1869) |
| 116 | Larimus acclivis | S, H | L. acclivis Jordan & Bristol, 1898 |
| 117 | Larimus argenteus | S | L. argenteus (Gill, 1863) |
| 118 | Larimus effulgens | S | L. effulgens Gilbert, 1898 |
| 119 | Larimus pacificus | S, H | L. pacificus Jordan & Bollman, 1890 |
| 120 | Lepophidium negropinna | H | L. negropinna Hildebrand & Barton, 1949 |
| 121 | Lepophidium pardale | S | L. pardale (Gilbert, 1890) |
| 122 | Lepophidium prorates | S, H | L. prorates (Jordan & Bollman, 1890) |
| 123 | Lycengraulis poeyi | S | L. poeyi (Kner, 1863) |
| - | Lioglossina tetraophthalmus | S | Hippoglossina tetrophthalma (Gilbert, 1890) |
| 124 | Lophiodes caulinaris | S, H | L. caulinaris (Garman, 1899) |
| 125 | Lophiodes setigerus | S | Lohiomus setigerus (Vahl, 1797) |
| 126 | Lophiodes spirulus | H | L. spilurus (Garman,1899) |
| 127 | Lutjanus argentiventris | H | L. argentiventris (Peters, 1869) |
| 128 | Lutjanus colorado | S | L. colorado Jordan & Gilbert, 1882 |
| 129 | Lutjanus guttatus | S, H | L. guttatus (Steindachner, 1869) |
| 130 | Lutjanus peru | S, H | L. peru (Nichols & Murphy, 1922) |
| 131 | Menticirrhus nasus | S, H | M. nasus (Günther, 1868) |
| 132 | Menticirrhus panamensis | S, H | M. panamensis (Steindachner, 1876) |
| 133 | Microgobius erectus | S, H | M. erectus Ginsburg, 1938 |
| 134 | Micropogonias altipinnis | S | M. altipinnis (Günther, 1864) |
| 135 | Monolene maculipinna | H | M. maculipinna Garman, 1899 |
| - | Muarenesox coniceps | S | Cynoponticus coniceps (Jordan & Gilbert, 1882) |
| 136 | Mulloides dentatus | H | Mulloidichthys dentatus (Gill, 1862) |
| 137 | Mustelus lunulatus | H | M. lunulatus Jordan & Gilbert, 1882 |
| 138 | Myrichthys tigrinus | S, H | M. tigrinus Girard, 1859 |
| 139 | Narcine brasiliensis | H | N. brancroftii (Griffith & Smith, 1834) |
| 140 | Narcine entemedor | S | N. entemedor Jordan & Starks, 1895 |
| 141 | Nebris occidentalis | S, H | N. occidentalis Vaillant, 1897 |
| 142 | Neobythites stelliferoides | H | N. stelliferoides Gilbert, 1890 |
| 143 | Neoopisthopterus tropicus | S, H | N. tropicus (Hildebrand, 1946) |
| 144 | Netuma platypogon | S | Occidentarius platypogon (Günther, 1864) |
| 145 | Ophichthus remiger | H | O. remiger (Valenciennes, 1847) |
| - | Ophichthus sp. B | H | Tabla 2 |
| - | Ophichthus sp. D | H | Tabla 2 |
| - | Ophidion sp. | S | Tabla 2 |
| 146 | Ophioscion imiceps | S | O. imiceps (Jordan & Gilbert, 1882) |
| 147 | Ophioscion sciera | S, H | O. scierus (Jordan & Gilbert, 1884) |
| 148 | Ophioscion typicus | S, H | O. typicus Gill, 1863 |
| 149 | Ophisoma prorigerum | H | Ariosoma prorigerum (Gilbert, 1891) |
| 150 | Opisthonema bulleri | S | O. bulleri (Regan,1904) |
| 151 | Opisthonema libertate | S | O. libertate (Günther, 1867) |
| - | Opisthonema sp. | S | Tabla 2 |
| 152 | Opisthopterus dovii | H | O. dovii (Günther, 1868) |
| 153 | Opisthopterus equatorialis | S, H | O. equatorialis Hildebrand, 1946 |
| 154 | Orthopristis chalceus | S | O. chalceus (Günther, 1864) |
| 155 | Paralabrax humeralis | S | P. humeralis (Valenciennes, 1828) |
| 156 | Paralabrax loro | H | P. loro Walford, 1936 |
| 157 | Paralichthys woolmani | H | P. woolmani Jordan & Williams, 1897 |
| 158 | Paralonchurus dumerilii | S, H | P. dumerilii (Bocourt, 1869) |
| 159 | Paralonchurus rathbuni | H | P. rathbuni (Jordan & Bollman, 1890) |
| 160 | Parapsettus panamensis | S, H | P. panamensis (Steindachner, 1876) |
| 161 | Peprilus medius | S, H | P. medius (Peters, 1869) |
| 162 | Peprilus snyderi | S, H | P. snyderi (Gilbert & Starks, 1904) |
| 163 | Perissias taeniopterus | H | P. taeniopterus (Gilbert, 1890) |
| 164 | Peristedion barbiger | H | P. barbiger Garman, 1899 |
| 165 | Peristedion crustosum | H | P. crustosum Garman, 1899 |
| 166 | Physiculus nematopus | S, H | P. nematopus Gilbert, 1890 |
| 167 | Physiculus rastrelliger | H | P. rastrelliger Gilbert, 1890 |
| 168 | Pliosteostoma lutipinnis | H | P. lutipinnis (Jordan &Gilbert, 1892) |
| 169 | Polydactylus approximans | S, H | P. approximans (Lay & Bennett, 1839) |
| 170 | Polydactylus opercularis | S | Filimanus sealei (Jordan &Richardson, 1910) |
| 171 | Pomadasys branickii | H | P. branickii (Steindachner, 1879) |
| 172 | Pomadasys macracanthus | S, H | P. macracanthus (Günther, 1864) |
| 173 | Pomadasys panamensis | S | P. panamensis (Steindachner, 1876) |
| 174 | Pontinus furcirhinus | H | P. furcirhinus Garman, 1899 |
| 175 | Pontinus sierra | H | P. sierra (Gilbert, 1890) |
| - | Pontinus sp. nov. | H | Tabla 2 |
| 176 | Porichthys greenei | H | P. greenei Gilbert & Starks, 1904 |
| 177 | Porichthys margaritatus | S, H | P. margaritatus (Richardson, 1844) |
| - | Porichthys nautopaedium | H | P. margaritatus (Richardson, 1844) |
| - | Priodonophus equatorialis | S | Gymnothorax equatorialis (Hildebrand, 1946) |
| 178 | Prionotus albirostris | S, H | P. albirostris Jordan & Bollman, 1890 |
| - | Prionotus gimnostethus | S | Bellator gymnostethus (Gilbert, 1892) |
| 179 | Prionotus horrens | S, H | P. horrens Richardson, 1844 |
| 180 | Prionotus ruscarius | S, H | P. ruscarius Gilbert & Starks, 1904 |
| 181 | Prionotus stephanophrys | S, H | P. stephanophrys Lockingnton,1881 |
| 182 | Prionotus teaguei | H | P. teaguei Briggs, 1956 |
| 183 | Pristigenys serrula | H | P. serrula (Gilbert, 1891) |
| 184 | Pronotogrammus eos | S, H | P. eos Gilbert, 1890 |
| 185 | Pseudomyrophis micropinna | H | P. micropinna Wade, 1946 |
| 186 | Pseudopeneus grandisquamis | S, H | P. grandisquamis (Gill, 1863) |
| - | Pseudorhombus dendritica | S | Ancylopsetta dendritica Gilbert, 1890 |
| 187 | Pythonichthys asodes | H | P. asodes Rosemblatt & Rubinoff, 1972 |
| 188 | Raja equatorialis | S, H | R. equatorialis Jordan & Bollman, 1890 |
| 189 | Raja velezi | S, H | R. velezi Chirichigno F., 1973 |
| 190 | Rhinobatos leucorhyncus | H | Pseudobatos leucorhynchus (Günther, 1867) |
| 191 | Rypticus nigripinnis | S, H | R. nigripinnis Gill, 1861 |
| 192 | Sciadeichthys dowii | H | Sciades dowii (Gill, 1863) |
| 193 | Sciadeichthys troschelii | S, H | Notarius troschelii (Gill, 1863) |
| 194 | Scomber japonicus | H | S. japonicus Houttuyn, 1782 |
| 195 | Scorpaena histrio | H | S. histrio Jenyns, 1840 |
| 196 | Scorpaena mystes | H | S. mystes Jordan & Starks, 1895 |
| 197 | Scorpaena russula | S, H | S. russula Jordan & Bollman, 1890 |
| 198 | Selar crumenophthalmus | H | S. crumenophthalmus (Bloch, 1793) |
| - | Selenaspis dowii | H | Sciades dowii (Gill, 1863) |
| 199 | Selene brevoortii | S, H | S. brevoorti (Gill, 1863) |
| 200 | Selene oerstedii | S, H | S. oerstedii Lütken, 1880 |
| 201 | Selene peruviana | S, H | S. peruviana (Guichenot, 1866) |
| 202 | Serranus aequidens | H | S. aequidens Gilbert, 1890 |
| 203 | Serranus psittacinus | H | S. psittacinus Valenciennes, 1846 |
| 204 | Sphoeroides annulatus | S, H | S. annulatus (Jenyns, 1842) |
| 205 | Sphoeroides fuerthii | S, H | S. trichocephalus (Cope, 1870) |
| 206 | Sphoeroides kendalli | S | S. kendalli Meek & Hildebrand, 1928 |
| 207 | Sphoeroides lobatus | S, H | S. lobatus (Steindachner, 1870) |
| 208 | Sphoeroides sechurae | S | S. sechrae Hildebrand, 1946 |
| - | Sphoeroides sp. 1 | S | Tabla 2 |
| 209 | Sphyraena ensis | S | S. ensis Jordan & Gilbert, 1882 |
| 210 | Stellifer chrysoleuca | S, H | S. chrysoleuca (Günter, 1867) |
| 211 | Stellifer ericymba | S | S. ericymba (Jordan & Gilbert, 1882) |
| 212 | Stellifer furthii | S, H | S. fuerthii (Steindachner, 1876) |
| 213 | Stellifer illecebrosus | S, H | S. illecebrosus Gilbert, 1898 |
| 214 | Stellifer mancorensis | S, H | S. mancorensis Chirichigno F., 1962 |
| 215 | Stellifer oscitans | S, H | S. oscitans (Jordan & Gilbert, 1882) |
| 216 | Stellifer zestocarius | S, H | S. zestocarus Gilbert, 1898 |
| - | Stellifer sp. | S | Tabla 2 |
| 217 | Syacium cf longidorsale | H | S. cf longidorsale Murakami & Amaoka, 1992 |
| 218 | Syacium latifrons | S, H | S. latifrons (Jordan & Gilbert, 1882) |
| 219 | Syacium ovale | S, H | S. ovale (Günter, 1864) |
| 220 | Symphurus atramentatus | S, H | S. atramentatus Jordan & Bollman, 1890 |
| 221 | Symphurus callopterus | H | S. callopterus Munroe & Mahadeva, 1989 |
| 222 | Symphurus chabanaudi | H | S. chabanaudi Mahadeva & Munroe, 1990 |
| 223 | Symphurus elongatus | H | S. elongatus (Günter, 1868) |
| 224 | Symphurus fasciolarius | S | S. fasciolaris Gilbert, 1892 |
| 225 | Symphurus gorgonae | H | S. gorgonae Chabanaud, 1948 |
| 226 | Symphurus leei | H | S. leei Jordan & Bollman, 1890 |
| 227 | Symphurus melanurus | S, H | S. melanurus Clark, 1936 |
| 228 | Symphurus oligomerus | H | S. oligomerus Mahadeva & Munroe, 1990 |
| 229 | Symphurus undecimplerus | H | S. undecimplerus Munroe & Nizinski, 1990 |
| 230 | Symphurus williamsi | H | S. williamsi Jordan & Cuvier, 1895 |
| 231 | Synchiropus atrilabiatus | H | S. atrilabiatus (Garman, 1899) |
| 232 | Synodus evermanni | S, H | S. evermanni Jordan & Bolman, 1890 |
| 233 | Synodus scituliceps | S, H | S. scituliceps Jordan & Gilbert, 1882 |
| 234 | Synodus sechurae | H | S. sechurae Hildebrand, 1946 |
| 235 | Torpedo tremens | H | Tetronarce tremens (de Buen, 1959) |
| 236 | Trachinotus paitensis | H | T. paitensis Cuvier, 1832 |
| 237 | Trichiurus nitens | S, H | T. lepturus Linneaus, 1758 |
| 238 | Trinectes fimbriatus | S | T. fimbriatus (Günter, 1862) |
| 239 | Trinectes fonsecensis | S, H | T. fonsecensis (Günter, 1862) |
| - | Trinectes sp. | S | Tabla 2 |
| - | Trinectes sp. nov | H | Tabla 2 |
| 240 | Umbrina bussingi | H | U. bussingi López S.,1980 |
| 241 | Umbrina xanti | H | U. xanti Gill, 1862 |
| 242 | Urolophus halleri | S | U. halleri Cooper, 1863 |
| 243 | Urotrygon aspidura | S | U. aspidura (Jordan & Gilbert, 1882) |
| 244 | Urotrygon chilensis | S, H | U. chilensis (Günter, 1872) |
| 245 | Urotrygon munda | S, H | U. munda Gill, 1863 |
| 246 | Urotrygon rogersi | H | U. rogersi (Jordan & Starks, 1895) |
| 247 | Urorygon nana | H | U. nana Miyake &McEachran, 1988 |
| 248 | Urotrygon serrula | S | U. serrula Hildebrand, 1946 |
| - | Urotrygon sp. nov | S | Tabla 2 |
| 249 | Zalieutes elater | S, H | Z. elater (Jordan & Gilbert, 1882) |
| 250 | Zapteryx exasperata | S, H | Z. exasperata (Jordan & Gilbert, 1880) |
Columna izquierda: código, nombre en la publicación original. Columna central: Buques Skimmer ( S )1 y Hensen ( H )2. Columna derecha: nombre actualizado y autoridad.
1. Bartels, Price, López & Bussing (1983): Cuadro 1 (Págs. 80-85).
2. Bussing & López (1996): Cuadro 1 (Págs. 184-186).
En la tabla 2 incluimos los nombres de las 18 especies adicionales producto de la revisión de la Colección Ictiológica del Museo de Zoología (MZUCR), por lo que el total de especies para ambos buques en el Golfo de Nicoya y entre 8 y 228 m de profundidad asciende a 268, más una posible especie de Syacium por identificar, de la estación VH-51. Ocho especies fueron descritas posteriormente a la publicación (1996) de la lista del V. Hensen: Gymnothorax phalarus, Notarius biffi, N. cookei, Ophictus mecopterus, O. melope, Sphoeroides rosenblatti, Trinectes xanthurus y Urotrygon cimar.
TABLA 2: TABLE 2 Otras especies de peces recolectadas en el Golfo de Nicoya en las expediciones de los buques científicos Skimmer y V. Hensen y catalogadas en la Colección de Ictiología del Museo de Zoología de la Universidad de Costa Rica (MZUCR), e identificadas o descritas después de las expediciones Other species of fish collected in the Gulf of Nicoya by the expeditions of the scientific ships Skimmer and V. Hensen and catalogued in the Ichthyology Collection of the Musem of Zoology, University of Costa Rica (MZUCR), and identified or described after the expeditions
| Código | Especie | Localidad | Catálogo Museo UCR |
|---|---|---|---|
| 251 | Auxis thazard (Lacepede, 1800) | Estación 53 Golfo | MZUCR 0878001 |
| 252 | Bairdiella ensifera (Jordan & Gilbert,1882) | Región superior Golfo | MZUCR 1526001 |
| 253 | Bollmannia marginalis Ginsburg, 1939 | Estación 50 Golfo | MZUCR 2377010 |
| 254 | Caulolatilus princeps (Jenyns, 1840) | Frente a Isla Tortuga | MZUCR 1209004 |
| 255 | Chloropthalmus mento Garman, 1899 | Estación 54 Golfo | MZUCR 2777001 |
| 256 | Gymnothorax phalarus Bussing, 1998 | Estación 51 Golfo | MZUCR 2373012 Holotipo |
| 257 | Notarius osculus (Jordan & Gilbert, 1883) | Frente a Manzanillo | MZUCR 1290004 |
| 258 | Notarius biffi Betancur R., & Acero P., 2004 | Frente a Manzanillo | MZUCR 2386015 |
| 259 | Notarius cookei Acero P., & Betancur R., 2002 | S. Pta. Gavilanes, I. Chira | MZUCR 1518002 |
| 260 | Ophicthus frontalis Garman, 1899 | Boca del Golfo | MZUCR 2354002 |
| 261 | Ophicthus mecopterus McCosker & Rosenblatt, 1998 | Centro del Golfo | MZUCR 2352001 Paratipo |
| 262 | Ophicthus melope McCosker & Rosenblatt, 1998 | Estación 54 Golfo | MZUCR 2350002 Holotipo |
| 263 | Ophidion scrippsae (Hubbs, 1916) | Frente a Bahia Ballena | MZUCR 1281009 |
| 264 | Opistonema medirastre (Berry &Barrett, 1963) | Frente a La Angostura | MZUCR 1510008 |
| 265 | Sphoeroides rosenblattiBussing, 1996 | Punta Morales | MZUCR 127013 Paratipo |
| 266 | Stellifer ephelis Chirichigno F., 1974 | S.E. Isla Chira | MZUCR 1289001 |
| 267 | Trinectes xanthurus Walker & Bollinger, 2001 | N. Isla San Lucas | MZUCR 1513002 |
| 268 | Urotrygon cimar López S. & Bussing, 1998 | Frente a Manzanillo | MZUCR 2386001 Paratipo |
| - | Pontinus sp. nov. | Estaciones 52, 53 Golfo | MZUCR 0626001 |
Las redes utilizadas capturaron preferentemente especies demersales, frecuentes sobre los sedimentos del estuario. No obstante, durante el tiempo en el cual la red es bajada al fondo o subida abierta desde este, se dio la captura de algunas especies presentes en la columna de agua. Estas especies de hábitos pelágicos también fueron incluidas en la lista.
De las 268 especies un total de 249 (93 %) correspondió a peces óseos (Osteichthyes). Los peces cartilaginosos (Chondrichthyes, 19 especies, 7 %) estuvieron representados por una especie de tiburón (Mustelus lunulatus), el pez diablo Zapteryx exasperata, el pez guitarra Pseudobatos leucorhyncus, las rayas eléctricas Diplobatis onmata, Narcine bancroftii, N. entemedor y Tetronarce tremens, y otras 12 rayas: Hypanus longus, Raja equatorialis, R. velezi, Styracura pacifica, Urolophus halleri, Urotrygon aspidura, U. cimar, U. chilensis, U. munda, U. nana, U. rogersi y U. serrula.
De las especies incluidas en la tabla 1 y tabla 2, un total de 31 (11 %) son de la familia Sciaenidae (corvinas). Entre los géneros de corvinas capturados por ambos buques, están: Bairdiella, Cynoscion, Elattarchus, Isopisthus, Larimus, Menticirrhus, Micropogonias, Nebris, Ophioscion, Paralonchurus, Stellifer y Umbrina. El género más diverso fue Stellifer, con ocho especies.
Los peces conocidos como lenguados y peces hoja (Bothidae, Cynoglossidae, Paralichthyidae y Achiridae) habitantes propios del fondo del estuario, estuvieron representados por 32 (12 %) especies (Tabla 1 y Tabla 2) y 13 géneros (Achirus, Ancylopsetta, Citharichthys, Cyclopsetta, Engyophrys, Etropus, Hypoglossina, Monolene, Paralichthys, Perissias, Syacium, Symphurus y Trinectes). El género más diverso en los arrastres fue Symphurus, con 11 especies.
De la familia Serranidae (cabrillas y meros) fueron capturadas 21 especies (8 %) de siete géneros (Alphestes, Diplectrum, Epinephelus, Hemanthias, Hyporthodus, Paralabrax, Pronotogrammus y Serranus). Las anchoas (Engraulidae) incluyeron 11 especies de los géneros Anchoa, Anchovia, Cetengraulis y Lycengraulis. Del grupo de los bagres o cuminates (Ariidae) fueron capturadas 10 especies de cinco géneros (Ariopsis, Cathorops, Notarius, Occidentarius y Sciades). Los roncadores (Haemulidae) aportaron 10 especies, de cuatro géneros (Anisostremus, Haemulon, Haemulopsis y Pomadasys). Los cabros (Triglidae), habitantes del fondo, aportaron ocho especies y dos géneros (Bellator y Prionotus). Las anguilas (Ophichthyidae), también habitantes de ambientes sedimentarios, estuvieron representadas por seis especies de los géneros Ophicthus, Pseudomyriophys y Myrichthys. Tres de las especies nuevas descritas pertenecen al género Ophicthus (Tabla 2). Los pargos (Lutjanidae) estuvieron representados por cinco especies y dos géneros (Hoplopagrus y Lutjanus).
En la tabla 3 se anotaron ejemplos de 12 especies frecuentes en las 20 estaciones del buque Skimmer. Siete especies: Prionotus horrens (16 estaciones) Sphoeroides trichocephalus (14), Syacium ovale (13) Synodus scituliceps (13), Neoopisthopterus tropicus (12), Cyclopsetta querna (11) y Porichthys margaritatus (11) fueron capturadas en más del 50 % de las estaciones.
TABLA 3: Buque científico Skimmer: A. Ejemplos de 12 especies de peces (de un total de 157) más frecuentes en las 20 estaciones y códigos de las estaciones donde se les encontró.
| A. | Especie | Total | Códigos de estación | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| - | Prionotus horrens | 16 | 1 | 2 | 3 | 4 | 6 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| - | Sphoeroides trichocephalus | 14 | 1 | 2 | 3 | 4 | 6 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 20 | - | - |
| - | Syacium ovale | 13 | 2 | 3 | 4 | 6 | 8 | 9 | 10 | 11 | 12 | 14 | 15 | 16 | 17 | - | - | - |
| - | Synodus scituliceps | 13 | 2 | 3 | 4 | 5 | 6 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | - | - | - |
| - | Neopisthopterus tropicus | 12 | 2 | 3 | 4 | 6 | 11 | 12 | 13 | 15 | 16 | 18 | 20 | 21 | - | - | - | - |
| - | Cyclopsetta querna | 11 | 2 | 3 | 4 | 6 | 8 | 9 | 10 | 12 | 13 | 17 | 20 | - | - | - | - | - |
| - | Porichthys margaritatus | 11 | 1 | 4 | 5 | 6 | 8 | 9 | 10 | 11 | 12 | 13 | 16 | - | - | - | - | - |
| - | Deckertichthys aureolus | 10 | 2 | 3 | 5 | 6 | 10 | 11 | 12 | 14 | 15 | 17 | - | - | - | - | - | - |
| - | Diplectrum pacificum | 10 | 3 | 6 | 8 | 9 | 10 | 11 | 14 | 15 | 17 | 20 | - | - | - | - | - | - |
| - | Polydactylus approximans | 10 | 1 | 2 | 3 | 4 | 13 | 14 | 15 | 17 | 16 | 21 | - | - | - | - | - | - |
| - | Achirus scutum | 9 | 1 | 13 | 14 | 16 | 17 | 18 | 19 | 20 | 21 | - | - | - | - | - | - | - |
| - | Stellifer zestocarus | 9 | 1 | 2 | 4 | 15 | 16 | 18 | 19 | 20 | 21 | - | - | - | - | - | - | - |
TABLA 4: B. Ejemplos de 10 especies encontradas en una estación.
| B. | Especie | Estación | Especie | Estación |
|---|---|---|---|---|
| - | Achirus mazatlanus | 3 | Pseudorhombus dendritica | 9 |
| - | Arius dasycephalus | 14 | Sphoeroides lobatus | 14 |
| - | Batrachoides gilberti | 18 | Syacium latitrons | 9 |
| - | Hypanus longus | 18 | Symphurus atramentatus | 10 |
| - | Kyphosus elegans | 4 | Urotrygon serrula | 14 |
* Price, Bussing, Bussing, Maurer & Bartels (1980): Cuadros I, II, IV,V (Pgs. 87-104).
En la tabla 4 se incluyeron ejemplos de 12 especies frecuentes en las 12 estaciones del buque V Hensen. Cinco especies: P. margaritatus (9 estaciones), Synodus scituliceps (8), Bollmannia chlamydes (6), Symphurus callopterus (6), S. elongatus (6) y Synodus evermanni (6) fueron capturadas en el 50 % de las estaciones. En la tabla 3 y tabla 4 también se citaron ejemplos de 10 especies encontradas en una sola estación por cada buque, respectivamente.
TABLA 5: Buque científico V. Hensen: A. Ejemplos de 12 especies de peces (de un total de 207) más frecuentes en las 12 estaciones y códigos de las estaciones donde se les encontró.
| A. | Especie | Total | Códigos de estación | - | - | - | - | - | - | - | - |
| - | Porichthys margaritatus | 9 | 06 | 30 | 31 | 35 | 50 | 51 | 52 | 53 | 54 |
| - | Synodus scituliceps | 8 | 01 | 06 | 30 | 31 | 35 | 50 | 52 | 53 | - |
| - | Bollmannia chlamydes | 6 | 06 | 31 | 50 | 52 | 53 | 54 | - | - | - |
| - | Symphurus callopterus | 6 | 06 | 31 | 50 | 52 | 53 | 54 | - | - | - |
| - | Synodus evermanni | 6 | 06 | 31 | 50 | 51 | 52 | 53 | - | - | - |
| - | Citharychthys platophrys | 5 | 01 | 06 | 52 | 53 | 54 | - | - | - | - |
| - | Cyclopsetta querna | 5 | 01 | 06 | 30 | 35 | 45 | - | - | - | - |
| - | Pontinus sierra | 5 | 31 | 51 | 52 | 53 | 54 | - | - | - | - |
| - | Porichthys greenei | 5 | 01 | 06 | 30 | 35 | 45 | - | - | - | - |
| - | Prionotus horrens | 5 | 01 | 06 | 30 | 31 | 45 | - | - | - | - |
| - | Synchiropus attrilabiatus | 5 | 06 | 51 | 52 | 53 | 54 | - | - | - | - |
| - | Zalieutes elater | 5 | 06 | 31 | 51 | 52 | 53 | - | - | - | - |
TABLA 6: Buque científico V. Hensen: B. Ejemplos de 10 especies encontradas en una estación.
| B. | Especie | Estación | Especie | Estación |
|---|---|---|---|---|
| - | Arius dasycephalus | 45 | Perissias taeniopterus | 51 |
| - | Cathorops tuyra | 43 | Menticirrhus panamensis | 01 |
| - | Coeolorhynchus scaphopsis | 54 | Monolene maculipina | 52 |
| - | Diplectrum maximum | 53 | Ophichthus remiger | 31 |
| - | Gerres cinereus | 31 | Urotrygon munda | 45 |
*Wolff & Vargas (1994): Apéndices I, II (Pgs. 84-92); Wolff (1996): Cuadro 1 (Pág. 180).
En la Fig. 3 se incluyeron dibujos de las doce especies más frecuentes en ambos cruceros.
En la Fig. 4 se dibujaron perfiles (superficie - fondo) de salinidad, temperatura y oxígeno disuelto en tres estaciones (06, 52, 54) del V. Hensen en el eje central del Golfo de Nicoya. En esta región del estuario la salinidad varió entre 28 o/oo en la superficie y cerca de 35 o/oo en el fondo. La temperatura varió entre 28 oC en la superficie, 20 oC a los 60 m y 12 oC cerca de los 230 m. En las estaciones 52 y 54 se observó una termoclina entre los 40 y 60 m (Fig. 4). La variación vertical del oxígeno disuelto (% saturación) fue desde 100 % cerca la superficie, 60 % cerca de los 50 m, y entre 5 y 2 % a profundidades mayores de 150 m. En la estación 06 se observó, a cinco metros bajo la superficie, una saturación mayor al 100 %.
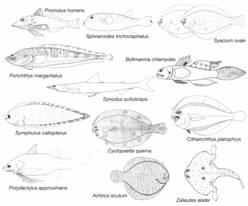
Fig. 3 Fig. 3 Doce de las especies más frecuentes en ambas expediciones (Dibujos no a escala. De Twelve of the more frequent species in both expeditions (Drawings not to scale. From Bussing & López, 2015).
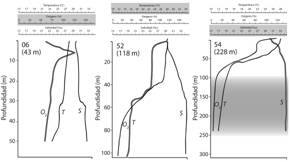
Fig. 4 Fig. 4. Perfiles verticales (superficie - fondo ) obtenidos mediante sensor electrónico tipo CTD, de temperatura (T, ºC), % oxígeno disuelto (O 2) y salinidad (S, ‰), el 3 y 4 de diciembre de 1993, en las estaciones 06, 52, y 54 de la zona externa (boca) del Golfo de Nicoya, Pacífico, Costa Rica. La escala sombreada en gris (arriba) corresponde al perfil resaltado en negro abajo. El área gris (estación 54) representa el área, a profundidades mayores de 100 m, de concentraciones de oxígeno menores del 5 % de saturación. Modificada de Wolff y Vargas (1994, Fig. 1.1). Vertical profiles (surface - bottom) obtained by a CTD electronic sensor, of temperature (T, oC), % dissolved oxygen (O 2) and salinity (S, ‰), on December 3 and 4, 1993, at the stations 06, 52 and 54 on the exterior zone (mouth) of the Gulf of Nicoya, Pacific, Costa Rica. The gray shaded scale (above) corresponds to the black enhanced profile below. The gray shaded area (Station 54) represents the depth below 100 m of oxygen saturation below 5 % Modified from Wolff & Vargas (1994, Fig. 1.1).
Discusión
El total de especies de peces presentes en la costa del Pacífico de Costa Rica fue estimado en 838 por Bussing y López (2009) hace más de una década. De ese total 719 correspondían a registros, entre la zona de entre-mareas y 200 m de profundidad, y depositados en la Colección del Museo de Zoología de la Universidad de Costa Rica (MZUCR). Esas 838 especies para Costa Rica indican una alta diversidad íctica, cuando se le compara, por ejemplo, con las 619 especies encontradas hasta 200 m de profundidad en la más extensa costa del Ecuador continental (Bearez, 1996). Las evaluaciones de la diversidad de la fauna ictiológica del Golfo de Nicoya con base en los arrastres hechos por los buques Skimmer y Victor Hensen datan de hace 40 y 25 años, respectivamente. Esos estudios fueron precedidos, entre otros, por el de Erdman (1971) quien, entre 1951 y 1953, hizo observaciones sobre 54 especies de peces capturadas con anzuelos y otras artes en la región interna del Golfo, y por el de León (1973) en el que mediante redes de arrastre se recolectaron 145 especies en 47 estaciones, desde la boca del Río Tempisque hasta la región media del estuario a la altura del puerto de Puntarenas.
Las 268 especies citadas en este estudio para el Golfo de Nicoya representan cerca del 32 % de las 838 citadas por Bussing y López (2009) para la costa del Pacífico de Costa Rica. Recientemente, y con base en la Colección del Museo de Zoología (MZUCR), Murase et al. (2014) presentaron una lista de 274 especies capturadas en diversos ambientes de la región interna del Golfo de Nicoya, desde la boca del Río Tempisque hasta frente al extremo del puerto de Puntarenas. De esas 274 especies, 188 (68 %) fueron consideradas como habitantes de ambientes sedimentarios, como los estudiados durante los cruceros del Skimmer y V Hensen. En este contexto es importante anotar que las colecciones del MZUCR albergan ejemplares catalogados a partir de 1962 (Angulo et al., 2015) por lo que es necesario verificar la presencia actual de ejemplares en el estuario y el estado de sus poblaciones. Futuros estudios sobre la biodiversidad íctica del Golfo de Nicoya podrían incluir una comparación entre la presente lista y las aportadas por Erdman (1971), León (1973) y Murase et al., (2014). Las ocho especies descritas posteriormente a la publicación de la lista del V. Hensen (Bussing & López, 1996) indican que el estuario todavía podría albergar algunas formas no conocidas, especialmente en aguas profundas. No obstante que la cobertura espacial del Golfo fue mayor durante la expedición del buque Skimmer (20 estaciones) que durante la del V. Hensen (12 estaciones) el uso en el V. Hensen de dos tipos de redes (otter y beam) y la toma de muestras a mayores profundidades (60 a 228 m) permitió la captura de un mayor número de especies.
Dos de los tensores de mayor impacto en el estuario son la extracción de especies mediante redes de arrastre y el daño que esas artes de pesca causan a las comunidades infaunales y epifaunales propias de esos ambientes sedimentarios. Esos tensores son conocidos desde hace décadas (Jones, 1992) y para el Golfo de Nicoya el estudio de Rostad y Hansen (2001) ilustra la utilidad de preservar áreas vedadas a los arrastres, como ocurre para el área superior del estuario. Además, del total de los recursos (peces e invertebrados) capturados mediante redes solo se utiliza una fracción y el resto se descarta, por lo que desde hace tiempo se ha sugerido la posible utilización de algunas especies de peces descartados (Campos, 1983). La presión de pesca sobre el grupo de peces cartilaginosos, como las rayas y tiburones, es importante en Costa Rica (Clarke, Espinoza, Romero-Chaves, & Wehrtmann, 2017) y más de 15 especies están en riesgo y otras podrían estarlo en un futuro (Espinoza, Díaz, Angulo, Hernández, & Clarke, 2018). La mayoría de las especies de peces capturadas en los cruceros del Skimmer y del V. Hensen correspondió a peces óseos y es este el grupo que tradicionalmente ha recibido el mayor interés pesquero, especialmente las especies de las familias Sciaenidae (corvinas), Serranidae (cabrillas y meros) y Lutjanidae (pargos). El impacto de la pesca de arrastre sobre otros grupos, que frecuentemente se descartan, como los lenguados y peces hoja (Bothidae, Cynoglossidae, Paralichthyidae y Achiridae) representados por 31 especies en los arrastres del Skimmer y V. Hensen en el Golfo de Nicoya, debe ser evaluado.
Según Campos, Burgos y Gamboa (1984) muchas de las especies capturadas por redes de arrastre en el Golfo de Nicoya en la época del Skimmer estaban representadas por individuos que no habían alcanzado la edad reproductiva. Por ejemplo, las longitudes esperadas a la primera madurez sexual de 15 especies de peces del Golfo, entre ellas las corvinas: Cynoscion albus (35 cm), C. phoxocephalus (23.5 cm), C. squamipinnis (38 cm), C. stolzmanni (42.5 cm) y Larimus acclivis (21 cm). Los ejemplares de mayor longitud de esas especies capturados en los cruceros del Skimmer y del V. Hensen fueron menores, con excepción de un ejemplar de C. albus (75 cm) obtenido por el V. Hensen y uno de L. acclivis (34 cm) del Skimmer. En futuros estudios se debe medir las longitudes de los peces para efectuar comparaciones con los datos históricos aquí presentados. En este contexto, es útil la información sobre longitudes totales incluida en los informes del Skimmer y del V. Hensen (Price et al., 1980; Wolff & Vargas, 1994). Además, el estudio de Murase et al. (2014) aportó datos sobre las longitudes estándar de 274 especies de peces de la región interna del Golfo de Nicoya y depositados en la colección del MZUCR.
El análisis de la composición de especies de peces por estación recolectados por el V. Hensen dividió el Golfo en tres zonas: una interna, de aguas con profundidades menores a 50 m; otra externa, con profundidades entre 100 y 240 m, y una tercera zona de transición que incluye a las estaciones centrales y de los costados del estuario (Wolff, 1996). En los cruceros del Skimmer y del V. Hensen, como también en los hechos por León (1973) se encontraron dos tipos principales de distribución espacial de las especies de peces: aquellas con una amplia cobertura geográfica y otras presentes solo en ciertas estaciones, tal como lo ilustramos en este estudio. También, con base en la aparición de formas juveniles, fueron identificadas en esos cruceros zonas importantes del estuario para la reproducción de algunas especies. Esto fue reforzado con el hecho de que el estudio del ictioplancton en el Golfo de Nicoya en el crucero del V. Hensen permitió la identificación de larvas de peces pertenecientes a 16 familias (Molina-Ureña, 1996).
El Golfo de Nicoya ha continuado bajo la influencia cada vez mayor de otros tensores, como la contaminación y la alteración de su entorno, así como de tensores regionales o globales, como El Niño-La Niña y el cambio climático. Por tanto, es urgente una nueva evaluación de los componentes del ecosistema a la luz de esos tensores. El enfoque ecosistémico ha sido propuesto como una alternativa al enfoque mono-especifico y busca un balance entre los servicios que presta el estuario y la salud del ecosistema (Jennings, 2004). En apoyo de ese enfoque, los cruceros del Skimmer y V. Hensen proporcionaron datos para la elaboración del primer modelo de Flujo Trófico del Golfo de Nicoya (FTGN), que permite estimar el impacto de la extracción, o adición, de componentes (biomasas de detritus, plancton, infauna, peces, crustáceos, moluscos, etc) al sistema (Wolff, Chavarría, Koch, & Vargas, 1998) La utilidad de este modelo, para evaluar cambios en las pesquerías del Golfo de Nicoya en consulta con los usuarios del sistema, ha sido enfatizado recientemente por Sánchez-Jiménez, Fujitani, MacMillan, Schluter y Wolff (2019).
En el contexto del flujo de energía del estuario, los peces de la familia Sciaenidae (corvinas), por ejemplo, son depredadores importantes en el ecosistema. En el estudio de León (1973), al menos ocho especies de corvinas (Cynoscion squamipinnis, Ophioscion scierus, O. typicus, Stellifer ericymba, S. fuerthii, S. illecebrosus, S. oscitans, y S. zestocarus) fueron capturadas en más del 50 % de las 47 estaciones. Sin embargo, de esas ocho solo S. zestocarus aparece entre las más frecuentes en las 20 estaciones del Skimmer y ninguna entre las 12 del V. Hensen. Por lo tanto, debe ser evaluado el impacto de la remoción por pesca, de estos y otros peces depredadores en el ecosistema.
Entre los posibles cambios en el funcionamiento del Golfo de Nicoya, hay evidencia de que el estuario ha superado los valores de productividad primaria asociados a condiciones eutróficas (Cloern, Foster, & Klechner 2014; Vargas-Zamora et al., 2018). Tal como lo ha indicado Jackson et al. (2001) la extracción de organismos que se alimentan de fitoplancton (como los moluscos bivalvos y algunos peces) ha contribuido a la eutroficación en algunos estuarios en otras latitudes.
Los análisis de los parámetros físicos y químicos obtenidos por el buque Skimmer están disponibles en Voorhis, Epifanio, Maurer, Dittel y Vargas (1983) y en Epifanio, Maurer y Dittel (1983), respectivamente. Los parámetros ambientales recopilados para el Golfo de Nicoya por el V. Hensen fueron publicados por Chaves y Birkicht (1996). La gradiente de salinidad característica del estuario (Voorhis et al., 1983; Lizano & Vargas, 1993), desde aguas salobres en la cercanía del Río Tempisque hasta salinidades propias de mar abierto en la región de la boca, es una barrera importante en la distribución de los peces, tal como lo evidenció el estudio de León (1973). Las observaciones del V. Hensen indican que, en las zonas media e inferior del estuario, otras gradientes se acentúan a profundidades mayores de los 50 m, con temperaturas inferiores a los 12 oC y concentraciones de oxígeno inferiores al 5 % de saturación (Wolff, 1996). Los ambientes de baja temperatura e hipóxicos son característicos de grandes regiones del Pacífico Este Tropical y para algunas especies de peces estuarinas esas condiciones podrían representar barreras en su distribución (Prince & Goodyear, 2006).
Uno de los tensores del Golfo de Nicoya es el ingreso de contaminantes acarreados en gran parte por los ríos que desembocan en el estuario (Fuller et al., 1990; Spongberg 2004; García, Acuña-González, Vargas-Zamora, & García-Céspedes, 2006; Spongberg et al., 2011). Algunos de estos contaminantes podrían influir en la capacidad reproductiva de especies de peces e invertebrados través de la disrupción endocrina (Cheek, 2006; Lee et al., 2005; Gravel, Johanning, McLachlan, Vargas, & Oberdörster, 2006). La presencia combinada de hipoxia y de disrupción endocrina ha sido informada como un factor que podría ser importante en la reproducción de algunos peces estuarinos (Thomas, Rahman, Khan, & Kummer, 2007).
En este contexto complejo, las preguntas más urgentes de responder sobre la ictiofauna del Golfo de Nicoya, son: ¿Cuántas especies de peces integran actualmente la fauna del estuario? y ¿Cuáles estrategias de manejo del ecosistema podrían contribuir a su sobrevivencia?
Este estudio complementa el publicado por Vargas-Zamora, Vargas-Castillo y Sibaja-Cordero (2019) sobre los crustáceos (Decapoda y Stomatopoda) capturados por los buques Skimmer y V. Hensen en el Golfo de Nicoya.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 

