Introducción
Los génerosHylocereussp. ySelenicereussp. son Cactaceae que se utilizan para la producción de frutas exóticas. Estas plantas conocidas por el nombre de''Pitahaya'' o''Dragon fruit'', son cultivadas en regiones tropicales (Flores 2011, Esquivel y Araya 2012). Crecen en regiones estacionalmente secas, su cosecha es anual, ya que su floración activa y fructificación se presentan entre mayo y noviembre de forma natural. Las especies predominantes en Costa Rica son:H. costaricensis,H. stenopterus y H. monocanthus(Bauer 2003) con variaciones de forma fenotípica en algunas estructuras como colores, grosor, configuración de espinas, areolas o tamaños en las frutas entre otros.
La planta es un cactus de forma epífita o hemiepífita, lo que favorece su adaptabilidad en los sitios donde crece, ya sea en bosques o en superficies compactas (Mizrahi 2014). Las personas agricultoras utilizan comúnmente estructuras para guiar su crecimiento, como tutores vivos que pueden ser árboles con baja cantidad de sombra o muertos como postes de madera o de concreto. La planta al ser un cultivo perenne, necesita tutores de alta resistencia y durabilidad en el tiempo, ya que se han encontrado plantaciones con más de 30 años de existencia en Costa Rica.
El cultivo puede reproducirse sexual y asexualmente. Los agricultores en Costa Rica comercializan los tallos de la pitahaya conocidos comúnmente como cladodios. En ocasiones se utilizan bolsas de viveros para la brotación de raíces; en otras ocasiones utilizan camas en el suelo, o bien se siembran directamente en el terreno posterior a su poda. Los tallos presentan estructuras muy definidas en su dureza y edad. Se clasifican en 4 categorías: a) primarios que son los tallos basales generalmente de la semilla asexual que se utilizó para sembrar la planta; b) secundarios, que corresponden a una continuación de los brotes de los tallos primarios; c) terciarios, correspondientes a los tallos que hacen una bifurcación cuando llegan a la parte superior del tutor vivo o muerto; d) cuaternarios, que brotan de los tallos terciarios, en ocasiones por reacciones de poda o inducción de las yemas por alguna anormalidad en tallo terciario, muchos productores les llaman chupones (Suárez 2011). Estos tallos no tienen un tamaño definido, por lo cual se pueden encontrar de distintos tamaños, grosor y aristas (Garbanzoet al. 2019).
El uso de los cladodios para el desarrollo de nuevas plantaciones es una práctica común que se utiliza en el país. Es frecuente utilizar diferentes tamaños entre el largo y el grosor de cada tallo, sin embargo, esas características no poseen parámetros de calidad, en donde se establezcan medidas esenciales e ideales para determinar la calidad de las semillas asexuales utilizadas en el cultivo (Flores 2011). Algunas personas autoras mencionaron que el cultivo de la pitahaya no cuenta con medidas estandarizadas para acortar el tiempo de emisión de raíces y la formación uniforme y vigorosas de estas (Habidet al. 2006, López y Guido 2002).
El objetivo de este trabajo fue evaluar el efecto de diferentes tamaños de cladodios y soluciones naturales, sobre el crecimiento, desarrollo de las raíces y brotes en semilla asexual de pitahaya en la zona de Guanacaste, Costa Rica.
Materiales y métodos
Este trabajo se realizó en el periodo 2015 - 2017 en la Finca Experimental de Santa Cruz de la Universidad de Costa Rica en la Sede de Guanacaste (FESC), localizada en Barrio Limón, dentro de un bosque tropical estacionalmente seco, con coordenadas geográficas de LN 10°17'08'' y LO 85°35'30'', altitud de 54 msnm, precipitación anual promedio de 1718,8 mm.año-1, temperatura máxima media anual de 32,8°C, mínima de 22,8°C con diferencia media entre máximas y mínimas de 10,0°C, humedad relativa media anual de 75% y velocidades de viento medias anuales de 8,0 km.h-1(M. Araya. 2013. Promedios mensuales de datos climáticos de la Estación meteorológica UCR-IMN N°. 74053 promedio 18 años, 1995-2012 (correo electrónico; San José, Costa Rica).
Se realizaron 2 experimentos y sus respectivas validaciones con el fin de determinar una recomendación precisa en la calidad de la semilla para siembras en pitahaya. Los tallos utilizados se obtuvieron de plantaciones deH. costaricensisyH. monocanthusubicados en la FESC y en plantaciones comerciales en la zona de Liberia Guanacaste. Las plantas madre seleccionadas fueron aquellas que cumplieron con más de 2 años de crecimiento para garantizar una madurez fisiológica del cladodio, además que estuviera libre de patógenos, plagas y de diversos largos y grosores.
Se preparó un sustrato comúnmente utilizado en viveros para la siembra de cladodios semillas de pitahaya, para lo cual se generó una mezcla de 40% de cascarilla de arroz (granza) y un 60% de suelo oscuro (textura franca). Esto con el fin de generar un sustrato con buena aireación, consistencia y poca retención de agua para evitar patógenos. Posteriormente se llenaron bolsas de vivero de 2 L de capacidad y se dejaron por un periodo de 7 días para su estabilización bajo una casa malla. No se esterilizaron ni se realizaron análisis microbiológicos al sustrato, con el fin de simular condiciones similares a la reproducción de plantaciones en la zona.
Efecto de soluciones naturales bio-estimulantes en el crecimiento de raíces. Se seleccionaron cladodios de 40 cm independientemente del tipo (Primario, secundarios, terciarios o cuaternarios), que fueron desinfectados con una solución al 100 SL de extracto de semilla de cítricos de efecto fungicida y bactericida en agua a una dosis de 5,0 ml.L-1de agua durante 7 minutos. Posteriormente fueron colocados en una zona aireada y bajo sombra durante 24 horas para ayudar a la cicatrización.
Para la elaboración de las soluciones bioestimulantes de enraizamiento, se preparó una solución de lentejas, se extrajo agua de coco y de pipa (coco sin madurez fisiológica), utiliza de forma habitual por los agricultores de la zona. El extracto de lentejas se elaboró con una tasa de ese grano en un recipiente al cual se le adicionaron 4 tasas de agua y se dejó reposar por 24 horas. Después ese contenido se licúo, se filtró, se separó lo sólido de la solución y se colocó en refrigeración. El agua de coco se extrajo de drupas que presentaran una cáscara de coloración oscura, mientras que el agua de pipa se extrajo de drupas recién cosechadas con una coloración verde y que no mostrara desarrollo de endocarpio (cartílago comestible).
Para la preparación de los tratamientos, los extractos fueron diluidos en concentraciones de 150, 300 y 600 ml.L-1con agua (Tabla 1). Para las secciones que iban a estar en contacto con el sustrato, se sumergió durante 2 minutos para cada solución correspondiente al tratamiento y luego se sembraron los cladodios en las bolsas de vivero (2 L) rellenadas con el sustrato. Una vez establecidos los tratamientos los cladodios se dejaron crecer durante 60 días; se realizó un registro de datos y posteriormente se realizó otro ensayo con las mismas dosificaciones, con el fin de efectuar una validación de los datos obtenidos.
Tabla 1 Soluciones naturales utilizadas para la propagación de pitahaya (Hylocereusspp.) en condiciones de vivero. Santa Cruz, Guanacaste. 2015.
| Tratamiento | Descripción de los tratamientos | Dosis (ml.L-1) |
| Test | Testigo solo agua | 0 |
| SL150 | Solución a base de lentejas | 150 |
| SL300 | Solución a base de lentejas | 300 |
| SL600 | Solución a base de lentejas | 600 |
| SAC150 | Solución agua de coco | 150 |
| SAC300 | Solución agua de coco | 300 |
| SAC600 | Solución agua de coco | 600 |
| SAP150 | Solución agua de pipa | 150 |
| SAP300 | Solución agua de pipa | 300 |
| SAP600 | Solución agua de pipa | 600 |
A los 60 días después de sembrado (dds), se realizó un muestreo destructivo de las plantas. Para mantener la menor destrucción de raíces, se realizó un lavado de los adobes sobre tamiz (14 Merch), con la precaución de no perder raíces durante la ejecución. Se midió el largo de las raíces desde la base del tallo hasta el meristemo de la raíz más larga, con una escala en centímetros. También se obtuvo el peso fresco de las raíces de cada cladodio y se pesaron con una balanza digital (marca T-Scale, modelo ROW -15++). Adicionalmente las raíces se secaron a 70oC durante 48 horas en un horno (resistencia 1800 Watts, potencia 208v monofásico temperatura 0 - 150oC) y por último, se obtuvo el peso seco de las raíces, todo el procedimiento se realizó en la FESC.
Efecto del tamaño del cladodio sobre la brotación en las plantas. Para las pruebas de brotación donde se utilizaron distintos tamaños de cladodios, se procedió a seleccionar materiales de distinto grosor y tamaño. Esta prueba consistió en 2 etapas. Experimento A, donde se evalúo la brotación entre 20 y 50 cm de longitud, según el tamaño usado por las personas productoras. Experimento B, se experimentó con cortes entre los 40 y 110 cm. Para ambas pruebas se obtuvieron cladodios frescos, es decir, se cosecharon y se sembraron el mismo día. Estos fueron medidos con una cinta métrica y cortado según el tamaño correspondiente a cada tratamiento (Tabla 2). Cada cladodio fue desinfectado con un extracto de semilla de cítricos de efecto fungicida y bactericida (100 SL), a una dosis de 5,0 ml.L-1en mezcla con agua. Individualmente para la sección que estuvo en contacto con el sustrato, fue sumergida durante 7 minutos y de dejó reposar durante 60 minutos antes de ser sembrado en las bolsas de vivero de 2 L. Los cladodios utilizados en ambos experimentos se dejaron crecer durante 60 días y se evaluaron mediante muestreos destructivos.
Tabla 2 Descripción de los tratamientos utilizados para la propagación de pitahaya roja (Hylocereussp.) en condiciones de vivero. Santa Cruz, Guanacaste. 2015.
| Experimento A | Experimento B | ||
| Tratamiento | Longitud de corte (cm) | Tratamiento | Longitud de corte (cm) |
| Long 20 | 20 | Long 40 | 40 |
| Long 25 | 25 | Long 50 | 50 |
| Long 30 | 30 | Long 60 | 60 |
| Long 35 | 35 | Long 70 | 70 |
| Long 40 | 40 | Long 80 | 80 |
| Long 45 | 45 | Long 90 | 90 |
| Long 50 | 50 | Long 100 | 100 |
| - | - | Long 110 | 110 |
Las variables de crecimiento evaluadas fueron el largo y ancho de los brotes, número, longitud, peso fresco y seco de las raíces por planta a los 60 dds. Para esto se procedió a medir el grosor del brote en las 3 caras del cladodio a partir de una medición ascendente, luego se promediaron los datos para estimar un parámetro promedio por cladodio. Asimismo, se midió el largo del brote que consistió en medir desde la base del brote hasta el meristemo apical. Para unir ambos factores, se realizó una multiplicación del largo x ancho (LxA) para generar un parámetro ajustado de crecimiento y luego calcular el área foliar mediante la ecuación de regresión:
Y =3,00074x + 10,76532 (r2= 0,97), donde''X'' es el LxA y''Y'' es el área foliar (Garbanzoet al. 2019).
Adicionalmente, se pesaron las raíces de cada repetición mediante una balanza digital (marca T-Scale, modelo ROW -15++), con el fin de estimar el peso fresco de las raíces. Por último, los brotes y las raíces se secaron a 70oC durante 48 horas y se obtuvo la variable peso seco.
Análisis de los datos. El diseño experimental para todos los experimentos fue un diseño irrestricto completamente al azar, con 10 tratamientos y 10 repeticiones para el experimento de extractos naturales en el crecimiento de raíz, 7 tratamientos con 10 repeticiones para el''experimento A'' y 8 tratamientos con 10 repeticiones para el''experimento B'' sobre tamaño del cladodio y brotación. Las variables fueron analizadas mediante pruebas de Shapiro Will para determinar la normalidad de los datos y posteriormente fueron sometidos a pruebas estadística de Kruskal Wallis (α= 0,05) para determinar diferencias estadísticas entre los tratamientos. También se realizó un análisis de regresión lineal para algunas variables mediante el modelo estadístico:
y = β +β1X + ε
Donde
y = variable dependiente''peso seco del brote''.
X = variable independiente''LxA semilla cladodio''.
β y β1constantes del modelo.
ε = error.
Todos los datos fueron calculados mediante el programa estadístico Infostat versión 2017.
Resultados
Efecto de soluciones naturales en el crecimiento de raíces de los cladodios. Las soluciones naturales de lentejas, agua de coco y pipa mostraron un aumento en el desarrollo de raíces (Tabla 3). Al evaluar el primer experimento la longitud de raíces brotadas de los cladodios no mostró un efecto significativo, solo una tendencia de mayor longitud (> 14,20 cm) en las soluciones de agua de coco, pipa y lentejas en comparación al testigo (11,25 cm). Los tratamientos SAC600, SAP150, SAP600, SL150 y SL300 mostraron un mayor número de raíces (> 6,20) significativamente (p<0,01) que las demás soluciones (< 5,70) y el agua (3,60). Las soluciones SAC300 y SL150 mostraron el mayor peso fresco de raíz (7,90 y 6,05 g) que los demás tratamientos, mientras que el peso seco de raíces no se encontró diferencias significativas entre los tratamientos.
Tabla 3 Efecto y validación de 3 distintas concentraciones de lentejas, agua de coco y agua de pipa sobre el crecimiento de raíces en cladodios sembrados en viveros de pitahaya. Santa Cruz, Guanacaste.
| Tratamientos | Longitud raíz (cm) | Número raíces (u) | Peso fresco raíz (g) | Peso seco raíz (g) |
| Experimento 1 | ||||
| Test (agua)* | 11,25+ | 3,50 ab | 2,53 a | 1,31 |
| SL150 | 23,10 | 6,20 bc | 6,02 bc | 3,03 |
| SL300 | 20,80 | 6,50 bc | 4,35 b | 2,36 |
| SL600 | 14,20 | 3,10 a | 2,89 ab | 1,56 |
| SAC150 | 19,20 | 5,10 ab | 5,03 b | 2,51 |
| SAC300 | 21,15 | 5,10 ab | 3,77 ab | 2,29 |
| SAC600 | 20,20 | 7,60 c | 7,90 c | 3,48 |
| SAP150 | 18,25 | 7,90 c | 4,74 b | 2,68 |
| SAP300 | 20,35 | 5,70 ab | 3,81 ab | 1,93 |
| SAP600 | 26,20 | 6,80 bc | 3,88 ab | 2,36 |
| Shap. Wilks | < 0,001 | < 0,001 | < 0,001 | < 0,001 |
| p-value | < 0,1316 | < 0,0093 | < 0,0551 | < 0,2203 |
| Validación | ||||
| Test | 23,58 a | 3,17 ab | 3,28 a | 0,37 a |
| SL150 | 23,42 a | 4,50 de | 4,24 ab | 0,59 bc |
| SL300 | 25,08 a | 5,33 e | 4,86 ab | 0,68 bc |
| SL600 | 30,92 cd | 2,58 a | 5,09 bc | 0,60 bc |
| SAC150 | 26,58 ab | 3,75 cd | 4,11 ab | 0,54 ab |
| SAC300 | 31,75 d | 3,83 cd | 5,04 bc | 0,70 bc |
| SAC600 | 31,08 d | 4,67 de | 4,75 ab | 0,66 bc |
| SAP150 | 27,67 bc | 3,83 cd | 5,51 bc | 0,81 cd |
| SAP300 | 25,50 ab | 5,33 e | 9,76 d | 1,18 d |
| SAP600 | 25,83 ab | 3,50 ab | 6,94 cd | 0,74 cd |
| Shap. Wilks | 0,290 | < 0,001 | < 0,001 | < 0,001 |
| p-value | < 0,014 | < 0,001 | < 0,001 | < 0,001 |
*Test= control 100% agua, SL= solución de lentejas, SAC= soluciones de agua de coco, SAP= solución de agua de pipa. En concentraciones de 150, 300 y 600 ml.L-1. +Medias seguidas por una misma no representan diferencias estadísticas según la prueba de Kruskal Wallis (α= 0,05).
Se realizó una validación del efecto de los extractos naturales en el crecimiento de las raíces de los cladodios y se observó un mayor incremento con el uso de las soluciones. Los tratamientos con soluciones SAC300 (31,75 cm) y SAC600 (31,08 cm) presentaron mayor longitud de raíces en comparación al testigo (23,58 cm). Mientras que la solución SAP300 y SL300 mostró la mayor presencia de raíces (>5,33) en comparación al resto de las soluciones. En la biomasa de las raíces, la solución SAP300 mostró el mayor peso fresco y seco (9,76 y 1,18 g) significantemente (p<0,01) en comparación a los demás y el tratamiento testigo (100% agua) fue el que mostró menos biomasa de raíces.
Efecto del largo del cladodio sobre la brotación en viveros de pitahaya. El tamaño del cladodio tuvo un efecto altamente significativo (p< 0,001) en el crecimiento de los brotes. Al evaluar el tamaño de las semillas de cladodios de pitahaya se encontró una relación proporcional creciente (coe = 0,98, r2=0,96) entre la longitud del cladodio y la variable largo por ancho (LxA) en la semilla (Tabla 4). En el experimento A, se encontró que los cladodios con una longitud mayor de 40 cm mostraron el mayor largo de brote (>50,25 cm) significativamente (p<0,01) en comparación al largo de los brotes (<30,20 cm) de los cladodios por debajo de 35 cm de longitud. Este mismo comportamiento se encontró en las variables: ancho (>4,47 cm), LxA (>298 cm2) y área foliar del brote (>728,5 cm2) significativamente (p<0,01). En el experimento B, se encontró que la brotación en los cladodios de 90 cm de largo (o un LxA mayor a 500 cm2) mostró el mayor largo (>63 cm), ancho (>8,25 cm), LxA (>587 cm) y área foliar del brote (>7570 cm2) en comparación al
resto de los tratamientos.
Tabla 4 Efecto del largo del cladodio sobre la emergencia del brote en viveros de pitahaya. Santa Cruz, Guanacaste.
| Tratamiento | >LxA Cladodio (cm2) | >Largo Brote (cm) | >Ancho Brote (cm) | LxA Brote (cm2) | Área foliar Brote (cm2) |
| ------------------------------------- Experimento A ------------------------------------- | |||||
| Long 20* | 73 | 19,45 a+ | 2,70 a | 53,73 a | 172,01 a |
| Long 25 | 90 | 28,77 a | 2,85 a | 81,37 a | 254,89 a |
| Long 30 | 104 | 24,40 a | 2,85 a | 76,78 a | 241,12 a |
| Long 35 | 113 | 30,20 a | 3,92 ab | 111,01 ab | 343,82 ab |
| Long 40 | 140 | 50,25 b | 4,47 bc | 298,07 bc | 878,15 bc |
| Long 45 | 167 | 51,50 b | 4,58 bc | 239,19 bc | 728,50 bc |
| Long 50 | 200 | 53,70 b | 5,85 c | 262,85 c | 799,49 c |
| Shap. Wilks | < 0,001 | < 0,001 | < 0,001 | < 0,001 | |
| p-value | < 0,002 | < 0,004 | < 0,001 | < 0,001 | |
| ------------------------------------- Experimento B ------------------------------------- | |||||
| Long 40 | 238 | 38,00 a | 5,99 ab | 243,19 a | 740,51 a |
| Long 50 | 268 | 46,86 ab | 5,71 a | 316,67 a | 961,01 a |
| Long 60 | 394 | 45,00 a | 6,94 ab | 343,78 ab | 1042,36 ab |
| Long 70 | 402 | 46,57 a | 7,40 ab | 423,47 ab | 1279,94 ab |
| Long 80 | 445 | 58,71 ab | 6,64 ab | 716,50 ab | 2156,73 ab |
| Long 90 | 514 | 131,43 c | 17,51 c | 2519,26 c | 7570,41 c |
| Long 100 | 562 | 63,00 ab | 8,25 ab | 587,36 ab | 1773,27 ab |
| Long 110 | 610 | 93,57 bc | 12,75 bc | 1422,92 bc | 4280,58 bc |
| Shap. Wilks | < 0,001 | < 0,001 | < 0,001 | < 0,001 | |
| p-value | < 0,001 | < 0,001 | < 0,001 | < 0,001 | |
Los cladodios al presentar mayor tamaño en función de su ancho y largo tienen un comportamiento a mayor acumulación de biomasa fresca y seca en sus brotes. (Figura 1). Las regresiones lineales demostraron que el largo de la semilla tiene un efecto significativo (r2= 0,86) en la acumulación de biomasa seca (peso seco de brote), este mismo efecto se encontró cuando se compararon (r2= 0,83) el ancho y el largo (LxA) de los cladodios semilla con relación en el peso seco del brote.
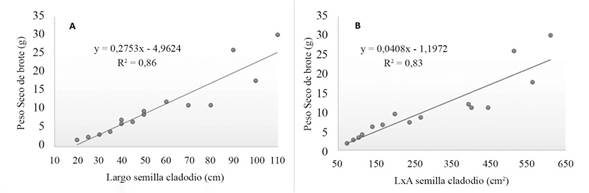
Figura 1 Regresión lineal del largo (A) y LxA (B) de semilla cladodio en la producción de biomasa seca de brote de pitahaya en viveros. Santa Cruz, Guanacaste.
Los cladodios al presentar mayor ancho y largo presentaron un comportamiento creciente en la biomasa de raíces (Tabla 5). Al evaluar el efecto del tamaño de cladodios semilla entre 20 y 50 cm de longitud en el crecimiento de las raíces, se encontró un mayor peso fresco y seco en las raíces (p< 0,01). Esto se demostró al analizar estadísticamente los tamaños de 45 y 50 cm en comparación a semillas de menor longitud. En el experimento B, al analizar los tamaños entre 40 y 110 cm de longitud, se encontró que las semillas superiores a 90 cm mostraron el mayor peso fresco y seco de raíces (p< 0,01) en comparación a tamaños de cladodios inferiores 80 cm en su longitud.
Tabla 5 Efectos del largo del cladodio sobre el crecimiento de las raíces de pitahaya (Hylocereusspp.) en viveros a los 60 días después de siembra.
| Experimento A | Experimento B | ||||||
| Tratamientos | LxA Cladodio (cm2) | Peso fresco raíz (g) | Peso seco raíz (g) | Tratamientos | LxA Cladodio (cm2) | Peso fresco raíz (g) | Peso seco raíz (g) |
| Long 20* | 73 | 1,13 a+ | 0,39 a | Long 40 | 238 | 21,57 c | 2,80 a |
| Long 25 | 90 | 1,43 ab | 0,54 b | Long 50 | 268 | 25,59 c | 3,83 ab |
| Long 30 | 104 | 1,77 bc | 0,74 b | Long 60 | 394 | 49,67 b | 6,82 bc |
| Long 35 | 113 | 2,34 de | 1,05 c | Long 70 | 402 | 35,72 bc | 4,49 ab |
| Long 40 | 140 | 2,09 cd | 0,97 c | Long 80 | 445 | 50,26 b | 6,53 bc |
| Long 45 | 167 | 2,52 de | 1,11 d | Long 90 | 514 | 67,40 a | 9,16 de |
| Long 50 | 200 | 3,56 e | 1,54 d | Long 100 | 562 | 70,82 a | 13,94 e |
| - | - | - | - | Long 110 | 610 | 71,33 a | 11,57 de |
| Shap. Wilks | - | < 0,001 | < 0,015 | Shap. Wilks | - | < 0,001 | < 0,015 |
| p-value | - | < 0,001 | < 0,001 | p-value | - | < 0,001 | < 0,001 |
Discusión
Se encontró que las soluciones naturales tuvieron un efecto positivo en el crecimiento de las raíces y brotación de los cladodios de pitahaya en viveros. Se observó que el agua de coco en solución mostró un incremento significativo en el crecimiento de raíces y brotes. El uso de estos productos es muy utilizado por productores en las zonas rurales para estimular el desarrollo de raíces en esquejes y semillas con el fin de evitar el uso de insumos sintéticos. Algunas investigaciones han utilizado el agua de coco para la germinación y estimulación de los brotes, donde encontraron una mayor germinación y brotación al usar agua de coco en comparación con de ácido giberélico (100 mg.L-1) y escarificación (Patiñoet al.2011). Otras personas autoras han comparado el efecto del agua de coco mezclado con otros extractos naturales (sábila), e identificaron que el agua de coco y el gel de sábila mostraron las mayores brotaciones significativamente a los 60 dds (Alvarado y Munzón 2020). Está bien demostrado el efecto del agua de coco en la estimulación del crecimiento de las células en los tejidos, debido a que contiene concentraciones importantes de auxinas, ácido abscísico, giberelina y citoquininas (Geet al. 2004, Yonget al.2009, García 2008, Quintoet al. 2009, Bertoliniet al.2014, Malsawmkimi-Ringphawan y Alila 2019). Estas hormonas están asociadas a la estimulación en los meristemos apicales en los procesos de elongación, división y diferenciación celular, que promueven el crecimiento de las raíces y brotes en las plantas (Chapman y Estelle 2009, Zhao 2010, Belliniet al.2014, Alcántaraet. al.2019).
Dicho aspecto podría apuntar al efecto positivo que mostró el agua de coco en el aumento del número de raíces y peso en los cladodios con soluciones concentradas de agua de coco y pipa. Es importante mencionar que este trabajo no identificó cualitativamente los compuestos presentes (hormonas) en las distintas soluciones (lentejas, agua de pipa y coco), sin embargo, la validación mostró un respaldo estadísticamente significativo (p<0,01) sobre el efecto en el crecimiento de raíces y la brotación en cladodios de pitahaya.
Se encontró que los cladodios de pitahaya de mayor tamaño presentaron una mejor brotación y crecimiento. Al analizar el crecimiento de distintos tamaños de cladodios en vivero se encontró una relación proporcional al comparar el tamaño o el largo por ancho del cladodio (LxA) con la brotación. Con la regresión lineal se demostró que tanto el tamaño como el grosor tienen un efecto significativo (p<0,01) en la brotación. Es probable que los cladodios de mayor dimensión guarden mayor cantidad de asimilados de reserva que ayude al esqueje a brotar con mayor rapidez (Álvarez-Herreraet al. 2007, Melnyk 2017). Balagueraet al. (2010) encontraron el mismo efecto al usar tamaños de 40 cm y 60 cm enSelenicereus megalanthusHaw, (pitahaya de frutos amarillos) con el uso de dosis crecientes de ácido indolbutírico. Asimismo, es probable que los cladodios usados como semillas con mayor cantidad de cm2de exposición (o LxA) tienen mayor probabilidad de fotosintetizar, ya que esta estructura cumple la función de generar los foto-asimilados en las plantas de pitahaya (Mizrahiet al. 1997, Mizrahi 2014, Liet al. 2019).
El uso del largo por ancho podría ser una alternativa estandarizada para evaluar la calidad de la semilla asexual del cladodio. Esta medida se ha desarrollado y usado en otros trabajos para la cuantificación del crecimiento es una variable alométrica de investigación para cuantificar el desarrollo del crecimiento en los cladodios deHylocereussp. (Garbanzoet al. 2019). Los parámetros más usados para la comercialización y reproducción de los cladodios es la longitud o tamaño, sin embargo, según el manejo del cultivo los cladodios en términos generales presentan tendencias a grosores heterogéneos. Es por esta razón que una buena referencia para valorar la calidad de la semilla asexual de pitahaya se encontraría con el uso del largo por el ancho (LxA), es decir un tamaño superior a 400 cm2garantizaría un mejor desarrollo de la semilla asexual, mientras que un cladodio entre 200 - 400 cm2se categoriza de calidad media y un cladodio menor a 200 cm2de calidad baja. Este mismo efecto sobre el tamaño del esqueje se ha encontrado en la reproducción de otras especies (Álvarez-Herreraet al.2007, Tate y Page 2018, Rianawati 2020). En síntesis, las calidades en los cladodios semillas mostraron un comportamiento distinto en las siembras en campo, para rescatar que los de mayor tamaño, presentaron un desarrollo más rápido de las plantas de pitahaya.















