Introducción
Los bosques naturales o plantados juegan un papel fundamental en aspectos ambientales, económicos y sociales a nivel mundial. De acuerdo con Reed, et al. (1), estos proporcionan leña, medicamentos, ingresos y empleo para millones de personas de áreas rurales. Además, el componente arbóreo brinda beneficios ambientales al regular el aire y el agua, facilita la polinización de los cultivos, enriquece el suelo y reduce la erosión.
La actividad del comercio de la madera puede verse afectada por la tala ilegal y la sobre explotación de los recursos, lo que provoca impactos negativos en la economía y servicios ecosistémicos (2). Lo anterior, ocasiona una alta erosión genética al reducir las reservas de germoplasma en los bosques. Aunado a lo anterior, Quesada (3) menciona que, a medida que transcurre el tiempo, este escenario de explotación provocará que las especies declinen en su capacidad reproductiva y en la alteración del medio en que se desarrollan; por lo tanto, esta situación repercute directamente en el aprovechamiento, ya que la disponibilidad de material vegetal de calidad para programas de mejoramiento sería escaso o inexistente.
El interés por la conservación del germoplasma usado en la reforestación o el manejo de bosques ha contribuido al desarrollo de herramientas en el campo del mejoramiento genético, con el fin de impulsar la actividad forestal. Asimismo, el auge de las tecnologías de propagación vegetativa in vivo ha evolucionado en la última década en Costa Rica, lo que ha permitido avances significativos en la clonación de prácticamente todas las especies forestales comerciales de Costa Rica (4). Debido a lo anterior, se han desarrollado protocolos para la propagación de especies forestales nativas y de esta manera, facilitar la reforestación del mayor número de individuos de calidad genética.
El cultivo de tejidos ha constituido una biotecnología que permite el desarrollo de plantas mejoradas en el laboratorio, ya que tejidos producidos in vitro pueden utilizarse en técnicas como transgénesis, edición genética, producción de soma-clones, inducción de mutaciones, entre otros para seleccionar variantes de interés y preparados para las difíciles condiciones bióticas y abióticas que se presentan en las plantaciones (5). Para facilitar la clonación de materiales seleccionados en el corto plazo, la micropropagación se convierte en una herramienta de la biotecnología que permite la producción de individuos con características genéticas idénticas a la planta que les dio origen. Además, el establecimiento in vitro permite un rápido aumento en el número de plantas o la obtención de material vegetal con elevada calidad sanitaria (6). A pesar de la importancia económica y ecológica de Samanea saman a nivel nacional e internacional, existe poca información en la literatura sobre el establecimiento in vitro del cenízaro. Esta situación limita el establecimiento de programas de uso y conservación de recursos fitogenéticos. Por lo tanto, se vuelve imperante la micropropagación a través del cultivo de tejidos mediante un sistema eficiente de propagación vegetativa. Hasta la fecha, no hay información sobre micropropagación de la especie Samanea saman para producir clones fieles (7).
El objetivo de esta investigación fue desarrollar una metodología para el establecimiento in vitro de S. saman (Cenízaro) para un programa de mejoramiento genético y conservación de germoplasma en Costa Rica.
Materiales y métodos
El estudio se llevó a cabo en el Laboratorio de Biotecnología Forestal del Instituto de Investigación y Servicios Forestales (INISEFOR) de la Universidad Nacional, ubicado en Santa Lucía Barva, Heredia, Costa Rica. El laboratorio cuenta con un área de transferencia e incubación de material vegetal in vitro, así como equipo especializado para este fin.
Material vegetal.
Como material vegetal se emplearon plántulas obtenidas a partir de semillas germinadas en el invernadero, provenientes de la colección de semillas del proyecto “Bases para el mejoramiento genético y conservación de germoplasma de cenízaro (S. saman) en Costa Rica”, adscrito al INISEFOR.
Un grupo de las plantas originadas a partir de semillas fueron mantenidas en un microtúnel con un régimen de riego por aspersión de 1 min tres veces al día (Figura 1A), donde la humedad promedio fue de 74,8 %. Posteriormente, el grupo de plantas fue trasladado fuera del microtúnel pero, siempre dentro del invernadero con un régimen de riegos de 1 min tres veces por día, donde la humedad promedio fue de 68 % se le aplicó Kasugamisida 5 ml/l (fungicida y bactericida) dos veces por semana (Figura 1B).

Figura 1 Plantas de Samanea saman producidas a partir de semillas mantenidas en un invernadero microtúnel (A) y plantas mantenidas fuera del invernadero microtúnel (B).
Figure 1. Samanea saman plants bred from seeds kept in a microtunnel greenhouse (A) and plants kept outside the microtunnel greenhouse (B).
Colecta de material y desinfección inicial
De las plantas madre, se colectaron ápices y segmentos nodales, tomados del último y antepenúltimo segmento nodal (Figura 2A). Tanto los ápices como los segmentos nodales de 2,5 cm de largo se colocaron bajo un flujo constante de agua durante 30 min. Seguidamente, se lavaron con agua y jabón antibacterial al 1 % durante 10 min en agitación.
Posteriormente, se evaluaron diferentes tratamientos de desinfección basadas en las metodologías para germinación in vitro de semillas de S. saman establecidas por Valverde, et al. (8) y Hine, et al. (9), las cuales se detallan en el cuadro 1 y 2 (Figura 2B, 2C y 2D). Una vez aplicados los tratamientos de desinfección, se llevaron a cabo tres lavados con agua destilada estéril.
Cuadro 1 Tratamientos de desinfección empleados para el establecimiento en condiciones in vitro de nudos y ápices de S. saman procedentes del microtúnel correspondientes al primer ensayo.

Cuadro 2 Tratamientos de desinfección empleados para el establecimiento en condiciones in vitro de nudos y ápices de S. saman procedentes de plantas fuera del microtúnel correspondientes del segundo ensayo.


Figura 2 Proceso de desinfección de plantas de S. saman. La primera línea punteada indica un segmento de ápice introducido y la segunda línea punteada los segmentos de nudo introducidos in vitro (A), paso de agitación orbital (B), paso de desinfección en bomba de vacío (C) e introducción in vitro en cámara de flujo laminar (D).
Figure 2. Disinfection process of S. saman plants. The first dashed line indicates an introduced apex segment, and the second dashed line indicates the in vitro introduced node segments (A). Orbital agitation step (B), vacuum pump disinfection step (C) and in vitro introduction into laminar flow chamber (D).
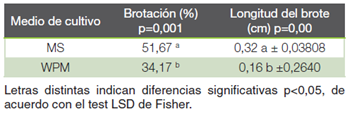
Efecto de la composición basal del medio de cultivo semisólido sobre la brotación de S. saman en etapa de introducción
Los explantes desinfectados fueron cultivados in vitro evaluando el efecto del medio de cultivo Murashige y Skoog (MS) (10) y Woody Plant Media WPM (11). Ambos tratamientos fueron complementados con 3 % de sacarosa, el pH del medio fue ajustado a 5,7 antes de la esterilización por autoclave (21 ºC, 1,1 kg/cm2 presión durante 25 min) y finalmente, se solidificaron con 3 g de Phytagel®. Cada unidad experimental consistió en un explante cultivado en un tubo de ensayo con 10 ml del medio respectivo. Se cultivaron 30 unidades experimentales por tratamiento. El material cultivado se colocó en el cuarto de crecimiento a una temperatura de 25 ºC, con un fotoperíodo de 16 horas luz y 30 μmol m-2 s-1 de intensidad lumínica. La evaluación de la contaminación se realizó cada ocho días durante un mes.
Diseño experimental y análisis estadístico
Se realizaron dos ensayos independientes primeramente se analizó el material proveniente del microtúnel y posteriormente se evaluó el material proveniente fuera de este. Cada protocolo de desinfección fue elaborado por el Instituto de Investigación de Servicios Forestales (INISEFOR), considerando que cada protocolo descrito en el cuadro 1 y 2 es un solo factor.
En el primer ensayo, se validó el material proveniente del microtúnel, evaluando cuatro protocolos de desinfección. El segundo ensayo se validó el material procedente fuera del microtúnel evaluando dos protocolos de desinfección independientes.
Para ambos ensayos cada desinfección consistió en 30 nudos y 30 ápices introducidos en tubos de ensayo y se realizaron con dos repeticiones de cada tratamiento. Como unidad experimental, se consideró un nudo de 2,5 cm de longitud cultivado en un tubo de ensayo (150 mm x 25 mm) con 10 ml de medio de cultivo. Se evaluaron las variables: porcentaje de contaminación, porcentaje de establecimiento in vitro, brotes por nudo desinfectado y longitud de los brotes establecidos. Asimismo, el ensayo se evaluó semanalmente durante un mes. Los datos fueron analizados mediante el programa estadístico Minitab 2.0, en el cual, se realizaron ajustes de Modelo Lineal General con un 95 % de confianza, y las diferencias entre los tratamientos se determinaron con la prueba exacta de Fisher con una confianza del 95 %.
Resultados y discusión
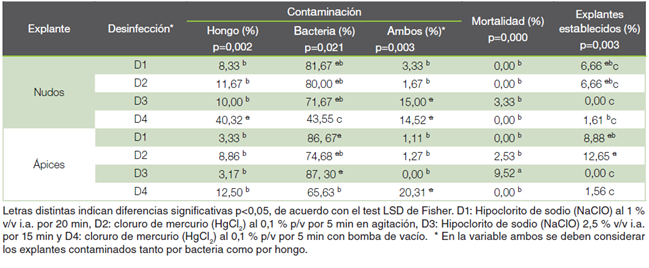
Al evaluar el efecto de cada una de las metodologías de desinfección sobre los ápices y nudos provenientes de invernadero tipo túnel en el primer ensayo, se obtuvo diferencias estadísticamente significativas en cada una de las variables evaluadas (p≤ 0,05) y porcentajes de contaminación mayores al 70 %.
Sin embargo, se destaca que no se observó diferencia estadísticamente significativa entre las metodologías de desinfección D1 y D2 en cuanto al porcentaje de explantes establecidos tanto para los segmentos nodales como para los ápices, obteniendo un promedio de 7 % y 11 % de explantes establecidos en condiciones in vitro, respectivamente (Cuadro 3).
Además, los resultados demuestran que, independientemente del tipo de explante, la metodología de desinfección D3 no logró el establecimiento de explantes en condiciones in vitro. Adicionalmente, es importante mencionar que, aunque la metodología de desinfección D4 logró el menor porcentaje de contaminación bacteriana, independientemente del tipo de explante, el porcentaje promedio de explantes establecidos en condiciones in vitro no sobrepaso el 1,5 %.
Cuadro 3 Respuesta de nudos y ápices provenientes de plantas mantenidas en invernadero microtúnel, después de 28 días de cultivo in vitro de S. saman.
Estos resultados confirman lo investigado por otros autores, los cuales reportan que las plantas de tallo leñoso poseen más dificultad para ser introducirlas in vitro (12),el establecimiento del cultivo es a menudo limitado debido a las tasas de contaminación más elevadas en comparación con las plantas sin tallo leñoso (13) Las complicaciones en el inicio in vitro de especies leñosas se atribuyen principalmente a la presencia de contaminación microbiana en los explantes provenientes del invernadero (14) (15). Además, debido a su crecimiento más lento, estas plantas son más susceptibles durante períodos prolongados a diversos tipos de bacterias y hongos difíciles de erradicar externamente (16), (17).
La humedad elevada en los microtúneles es un ambiente propicio para la proliferación de microorganismos. En países tropicales, las condiciones de temperatura y humedad son propicias para el desarrollo de un sinnúmero de organismos, como es el caso de los hongos (18). Por lo general, se desarrollan en ambientes con humedad relativa de 74 % a 80 % y temperaturas que van de los 23 °C a los 28 °C (19), los cuales, se encuentran dentro del rango de humedad identificado en el invernadero microtúnel de 74,8 % y 26 °C en promedio. Lo anterior evidenció que el manejo fitosanitario de las plantas madre antes de realizar los ensayos de establecimiento in vitro es de suma importancia.
Estalecimiento in vitro de nudos y ápices tomados de plantas mantenidas fuera del microtúnel
Después de identificar los resultados del ensayo del material vegetal del invernadero microtúnel, se aplicó un manejo fitosanitario y se mantuvo las plantas a temperatura ambiente, este proceso demostró mejoras significativas en el establecimiento del protocolo. Al evaluar el efecto del hipoclorito de sodio (NaClO) al 1 % v/v i.a. + tween al 0,1 % v/v durante 20 min (D5) y cloruro de mercurio (HgCl2) al 0,2 % p/v por 5 min con bomba de vacío (D6) sobre los explantes (ápices o nudos) mantenidas fuera del invernadero microtúnel, se obtuvo una diferencia estadística significativa en cada una de las variables evaluadas (P≤ 0,05) (Cuadro 4). Ambas metodologías mostraron ser eficientes en la eliminación de patógenos, obteniéndose porcentajes de contaminación, inferiores al 13 % (Cuadro 4). Se determinó que el uso de hipoclorito de sodio (NaClO) al 1 % v/v i.a de concentración durante 20 min, fue más eficiente para la desinfección de nudos de cenízaro, con un 85 % de explantes libres de contaminación (Figura 3B). Para el caso de los ápices, no se encontraron diferencias estadísticas significativas entre ambas metodologías respecto al porcentaje de establecimiento, los cuales fueron de 98 % y 100 % para los tratamientos D5 y D6 respectivamente (Cuadro 4), sin embargo, se observó que los ápices tratados con la metodología de desinfección que incluía cloruro de mercurio (HgCl2) (Figura 3A), presentaron mejor apariencia.
Cuadro 4 Respuesta de nudos y ápices provenientes de plantas mantenidas fuera microtúnel, luego de 35 días de cultivo in vitro de S. saman.
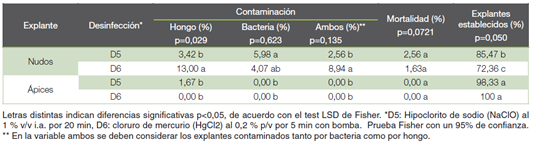
Según lo expuesto por los autores Kasthurirengan et al (7), se logró una introducción exitosa de cenízaro con nudos provenientes de una planta madre de 20 años de edad, aplicando el hipoclorito de sodio (NaClO) al 5,25 % v/v i.a durante 15 min. Por otra parte, Valverde et al (8), lograron un establecimiento usando como material semillas e hipoclorito de sodio al 5,5 % v/v i.a. Lo anterior confirma los resultados obtenidos, ya que se ha demostrado en trabajos previos, que el hipoclorito de sodio (NaClO) funciona exitosamente en el establecimiento in vitro de la especie de S. saman, probablemente debido a ser un material de bajo costo y alta efectividad. Además, uno de los hallazgos de esta investigación, es que se demostró que el uso de cloruro de mercurio (HgCl2) es un método novedoso para la especie.
Asimismo, en el presente estudio se observó una mayor contaminación por nudos en comparación con los ápices. Araya (20), encontró resultados similares para Alnus acuminata Kunth (jaúl), donde los ápices obtuvieron una menor contaminación, cuyo porcentaje de contaminación no fue mayor al 45 %. En su estudio utilizó 4 concentraciones de hipoclorito de sodio (NaClO): 0,5 %, 1,0 %, 2,5 % y 5,0 % v/v i.a.
De esta manera, considerando que los ápices son estructuras juveniles y de crecimiento continuo, se dificulta a los agentes contaminantes almacenarse en el interior de dichos tejidos. Tal y como lo indica Araya (20), los ápices son zonas de crecimiento activo, lo que hace que tanto los hongos como las bacterias se localizan en los primordios externos, que son precisamente los que se eliminan durante los procesos de desinfección y disección. En consecuencia, los explantes tomados a partir del tejido más joven, como los ápices suelen tener niveles más bajos de microorganismos detectables en condiciones in vitro (21), (22).

Figura 3 Explantes de S. saman establecidos in vitro (A) ápices desinfectados con cloruro de mercurio (HgCl2) 0,2 % p/v durante 5 minutos y (B) nudos desinfectados con hipoclorito de sodio (NaClO) al 1 % v/v i.a de concentración durante 20 min
Figure 3. S. saman in vitro explants (A) apex disinfected with 0.2 % w/v mercuric chloride (HgCl2) for 5 minutes, and (B) nodes disinfected with 1 % v/v active ingredient concentration sodium hypochlorite (NaClO) for 20 minutes.
Evaluación de efecto de medio de cultivo y su inducción de brotes en segmentos nodales
De acuerdo con el Cuadro 5, se observó una diferencia significativa entre los dos medios de cultivo, demostrando un mejor desarrollo de los explantes cultivados en medio MS tanto para la variable brotación de nudos (51,67 %) como para la longitud del brote (0,32 cm). De manera cualitativa, los explantes cultivados en medio WPM presentaron mayor oxidación en comparación con aquellos cultivados en medio MS (Figura 4A y Figura 4B). Según los autores Azofeifa (23) Vílchez, et al. (24), el oscurecimiento de tejidos es con frecuencia más pronunciado en un tipo de medio de cultivo que en otro, lo cual puede ser causado por el uso inapropiado de alguno de los nutrientes empleados en el medio. Además, se señala que, en ocasiones, a pesar de lograr una eliminación efectiva de microorganismos, los explantes pueden experimentar muerte en los primeros días de cultivo. Esto se debe a la liberación de compuestos fenólicos, cuya oxidación posterior ocasiona la coloración más oscura del medio y del explante, obstaculizando así el transporte de nutrientes en los tejidos vegetales (25).
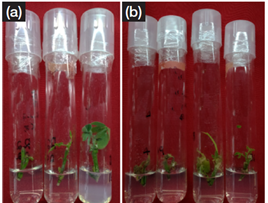
Figura 4 Explantes de S. saman establecidos in vitro sembrados en medio de cultivo semisólido (A) medio de cultivo MS (B) medio de cultivo WPM, establecidos en condiciones in vitro.
Figure 4. S. saman in vitro explants planted in semi-solid culture medium (A) MS culture medium (B) WPM culture medium, established under in vitro conditions.
La media de brotes por explante sin la incorporación de ninguna concentración hormonal al medio de cultivo, fue del 51,67 % para el mejor de los casos. Mientras, Kasthurirengan et al. (7) informaron mejores resultados por brote usando varias concentraciones de 6-bencilaminopurina (BA) y ácido giberélico (GA3) en medio MS en comparación con WPM después de cinco semanas. Estos autores también confirmaron que la especie tuvo un desarrollo óptimo en medio MS.
Por el contrario, Campos et al (26), reportaron que el medio WPM fue más eficiente que el MS para el cultivo in vitro de Swietenia macrophylla King (caoba), para las variables número de hojas, longitud y número de brotes. Además, Vílchez, et al. (24), obtuvo una mejor respuesta de medio WPM en comparación con MS en las variables evaluadas: número de nudos, número de brotes y longitud de brotes, para la especie Psidium guajava L (guayaba).
El presente estudio evidenció, un mejor desarrollo de la especie para el medio MS. Esto podría deberse a concentraciones más altas NH4+ y CaCl2 en el medio en comparación con WPM, asimismo, Vengadesan et al. (27) mencionan que la concentración iónica es relativamente baja para el medio WPM por lo que, puede afectar en la formación y crecimiento de brotes. Resultados similares fueron obtenidos en otras especies leguminosas Acacia sinuata (Lour.) Merr. (27) y Pterocarpus marsupium Roxb (28). Lo anterior, sugiere que el medio MS favorece en la brotación de especies arbóreas leguminosas.
Conclusiones
En la presente investigación sobre la especie S. saman, los resultados indicaron que el material vegetal mantenido fuera del microtúnel (D5 y D6) presentó un menor porcentaje de contaminación en comparación con el material mantenido en el microtúnel (D1-D4), en relación con los tratamientos evaluados. Esto demuestra la importancia del manejo y las condiciones ambientales del material vegetal.
Para el establecimiento in vitro de la especie el uso de hipoclorito de sodio (NaClO) 1 % v/v i.a.+ tween al 0,1 % v/v por 20 minutos como agente desinfectante generó el mayor porcentaje de nudos establecidos en condiciones in vitro (85 %). En el caso de los ápices, no hubo diferencias significativas entre los desinfectantes evaluados, sin embargo, cualitativamente aquellos tratados con cloruro de mercurio (HgCl2) al 0,2 % p/v durante 5 minutos con bomba de vacío mostraron menor oxidación.
Asimismo, la composición basal del medio de cultivo influyó en el número y longitud de brotes de S. saman, mostrando mejores resultados el medio MS en comparación con el WPM