Introducción
Los metales pesados pueden estar presentes en diversos suelos alrededor del mundo y son considerados como uno de los mayores estreses abióticos que pueden afectar y modificar las poblaciones microbianas del suelo, incluidos los hongos formadores de micorrizas arbusculares (HMA) (Begum et al., 2019). Dentro de los metales pesados se encuentra el cadmio (Cd) que está presente en el suelo como resultado de la meteorización de su material parental o producto de actividades antropogénicas como la aplicación de fertilizantes, el riego con aguas contaminadas o el vertimiento de residuos industriales (Suaña Quispe, 2018).
El cadmio inhibe la translocación de nutrientes esenciales como el zinc (Zn2+) y el manganeso (Mn2+) hacia la planta, ya que el Cd se liga a proteínas transportadoras de estos metales, reemplaza al magnesio (Mg) en la molécula de clorofila, impide la apertura estomática y obstaculiza la acción de las enzimas responsables de la síntesis de clorofila, lo que genera una deficiencia en la producción de esta (Colina Navarrete et al., 2022).
La fitorremediación es una tecnología innovadora y amigable con el ambiente que se puede emplear a gran escala para la recuperación de suelos contaminados con metales pesados. Esta tecnología se fundamenta en la capacidad de algunas plantas para acumular, captar, metabolizar, degradar, estabilizar o eliminar contaminantes (Mendarte-Alquisira et al., 2021).
El girasol (H. annuus) puede recuperar el Cd del suelo al comportarse como una planta acumuladora de este metal, ya que tiene la capacidad de estabilizarlo y concentrarlo en tejidos foliares y raíces. Ha sido recomendada para su uso en procesos de remediación de suelos contaminados por dicho elemento (Yazdanbakhsh et al., 2020).
Se conoce que el girasol (H. annuus L.) es un rizofiltrador potencial de cadmio, níquel, cobre, zinc, cromo, plomo y radioisótopos, y adsorbe metales en mayor cantidad en sus raíces que en sus brotes (Alaboudi et al., 2018). La importancia de emplear HMA en procesos de remediación de suelos contaminados se debe a que cumplen un rol importante en la bioacumulación y tolerancia de las plantas a dicho metal (Cheema & Garg, 2022). Así, estos microorganismos se pueden utilizar para eliminarlo de los suelos contaminados, pues realizan simbiosis con más del 80 % de las plantas vasculares, reduce las concentraciones de metales en los brotes y mejoran la tolerancia en las plantas huésped (Han et al., 2021). La simbiosis micorrízica arbuscular ha demostrado un efecto benéfico en el mejoramiento de la nutrición, en el aprovechamiento de agua y en el crecimiento y la adaptación de las plantas ante diversas condiciones de estrés provocado tanto por factores bióticos como abióticos (Janeeshma & Puthur, 2020).
Los HMA tienen en general un efecto positivo sobre el crecimiento vegetal bajo estrés por metales pesados, lo cual fue corroborado por Jinxiu et al. (2020). El desarrollo de futuras estrategias encaminadas a mitigar los efectos negativos de los metales pesados en el suelo y la comprensión de la respuesta de defensa de las plantas ante estas situaciones de estrés son cruciales. Además, un mejor conocimiento de cómo la simbiosis micorrízica arbuscular incrementa la tolerancia de las plantas contra los metales pesados es fundamental. Por lo tanto, el objetivo de este trabajo fue evaluar el efecto de diferentes hongos formadores de micorrizas arbusculares (HMA) en la adsorción de cadmio y en el crecimiento vegetativo del girasol (H. annuus L.).
Materiales y métodos
La presente investigación se realizó por un periodo de dos años (2021- 2023), en condiciones semi-controladas, en el Departamento de Fisiología y Bioquímica Vegetal perteneciente al Instituto Nacional de Ciencias Agrícolas (INCA), ubicado en el municipio de San José de las Lajas, provincia Mayabeque, Cuba.
Se recolectó suelo clasificado como Ferralítico Rojo Lixiviado (Hernández-Jiménez et al., 2019), en los alrededores del INCA y se preparó una disolución de cloruro de cadmio en cantidad equivalente a 100 mg de cadmio por kg de suelo. El medio fue secado a pleno sol y se removió cada 15 días, durante dos meses para facilitar la estabilización del contaminante. Los principales parámetros químicos y físico-químico del suelo contaminado y sin contaminar se indican en el Cuadro 1.
Cuadro 1 Características químicas y físico-químicas de los suelos estudiados en el Instituto Nacional de Ciencias Agrícolas (INCA), San José de las Lajas, Cuba. 2021.
| Indicadores | Suelo no contaminado | Suelo contaminado |
| MO (%) | 3, 07± 0,02 | 2, 03± 0,03 |
| P (ppm) | 158,4±2,2 | 243,8±,2 |
| K (cmol kg-1) | 0,09±0,01 | 5,78±0,01 |
| Ca (cmol kg-1) | 29,33±0,16 | 35,63±0,12 |
| Mg (cmol kg-1) | 6,5±0,2 | 9,8±0,3 |
| Cd (mg kg-1) | 0,5±0,6 | 6,7±2,4 |
| pH (H2O) | 7,2 | 5,3 |
MO: Materia orgánica. / MO: Organic matter.
Este experimento se desarrolló en condiciones semicontroladas en bolsas de plástico negro (macetas) con 2 kg de suelo y las semillas de girasol (Helianthus annuus L.) variedad Cubasol 113. Se emplearon las cepas de micorrizas INCAM-2 (Funneliformis mosseae), INCAM-4 (Glomus cubense) e INCAM-11 (Rhizoglomus intraradices), las cuales se inocularon en el momento de la siembra; se colocaron 2 g por nicho (45 esporas/g). Estos inóculos provienen de la colección del Laboratorio de Micorrizas del INCA.
Los tratamientos aplicados fueron los siguientes:
T1. Suelo no contaminado (control).
T2. Semillas embebidas en agua, suelo contaminado (control +-).
T3. Semillas micorrizadas INCAM-2, suelo contaminado.
T4. Semillas micorrizadas INCAM-4, suelo contaminado.
T5. Semillas micorrizadas INCAM-11, suelo contaminado.
En todos los experimentos se utilizaron diez macetas por cada tratamiento. Se sembraron tres semillas por maceta y, a los siete días de emergidas las plantas, se dejó solo una en cada maceta, con un diseño completamente aleatorizado.
A los 60 días de emergidas las plantas, se midió la altura de la planta, la longitud de la raíz, el número de hojas, el contenido de clorofila y el peso seco de la parte aérea y de la raíz.
Para determinar la colonización radical, se tomaron 200 mg de raicillas secundarias por planta que fueron teñidas según la metodología descrita por Rodríguez Yon et al. (2015). La cuantificación se realizó mediante la examinación aleatoria de 100 campos visuales en microscopio óptico de alrededor de 30 fragmentos de raíces por planta. El cálculo de la intensidad se llevó a cabo por medio de la metodología descrita por Trouvelot et al. (1986).
La concentración de Cd en el suelo y en los órganos de las pantas se determinó por adsorción atómica (Jinxiu et al., 2020).
Este experimento se repitió tres veces en el tiempo (n= 30). Los resultados que se presentan son los promedios de sus repeticiones.
Para el análisis de los datos se verificó la distribución normal a través de la prueba de Kolmogorov-Smirnov y la homogeneidad de varianza de los datos. Los resultados se sometieron a análisis de varianza (ANDEVA) de clasificación simple y doble (en función de los objetivos del experimento). En caso de diferencias significativas, las medias se compararon según la prueba de Tukey (p ≤ 0,05). Para el procesamiento de los datos se utilizó el paquete estadístico STATGRAPHICS Plus, versión 5.0 para Windows.
Resultados
La influencia de las cepas de HMA en la longitud del tallo y la raíz de plantas de girasol crecidas en un suelo contaminado con cadmio se muestra en la Figura 1. A los 60 días de emergidas las plantas, todas las plantas tratadas del suelo con presencia de Cd disminuyeron la longitud del tallo y la raíz, en relación con el tratamiento control (T1). Sin embargo, las que crecieron con HMA aumentaron la longitud del tallo y la raíz en comparación con las que no fueron inoculadas (T2); además, el mayor efecto se obtuvo con las cepas INCAM-4 (G. cubense) e INCAM-11 (R. intraradices), sin diferencias significativas entre ellas, las cuales fueron superiores en sus valores a los tratamientos control e inoculados con F. mosseae.
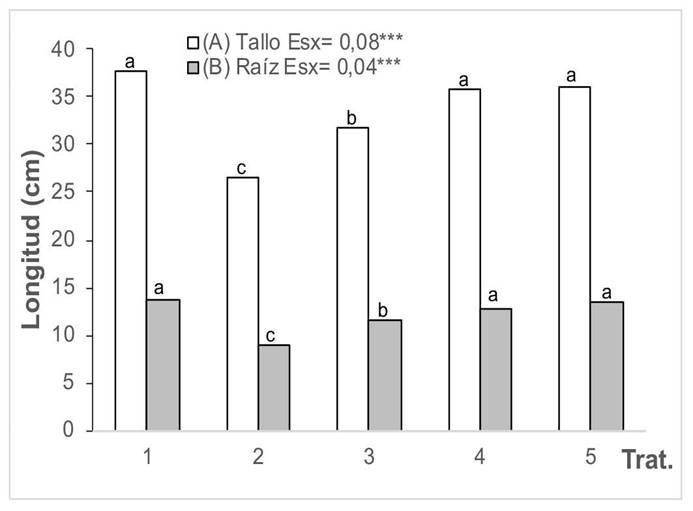
Figura 1 Longitud del tallo (A) y la raíz (B) de las plantas de girasol (Helianthus annuus L.) tratadas con micorrizas en un medio contaminado con cadmio, en el Instituto Nacional de Ciencias Agrícolas (INCA), San José de las Lajas, Mayabeque, Cuba, en los años 2021-2023.
Dentro de los tratamientos que se aplicaron, los mejores resultados se obtuvieron con la cepa INCAM-11. Se alcanzó mayor longitud del tallo y la raíz en las plantas que no recibieron aplicaciones del metal.
Al analizar el número de hojas (Figura 2), se observó una disminución en el número de hojas vivas en las plantas de los tratamientos en que se aplicó Cd. En relación con los tratamientos donde estuvo presente el Cd, los tratamientos con HMA mostraron un mayor número de hojas en comparación con los que no tuvieron presencia de HMA. Dentro de los tratamientos con HMA, las cepas G. cubense y R. intraradices obtuvieron los mejores resultados, con diferencias significativas respecto a la cepa F. mosseae.
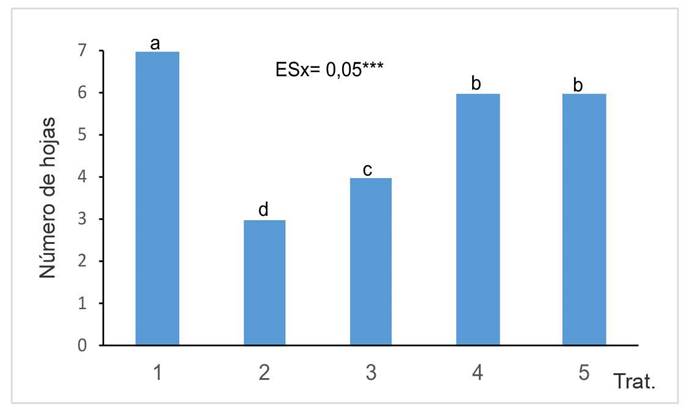
Figura 2 Número de hojas desarrolladas por las plantas de girasol (Helianthus annuus L.) tratadas con micorrizas en un medio contaminado, en el Instituto Nacional de Ciencias Agrícolas (INCA), San José de las Lajas, Mayabeque, Cuba, en los años 2021- 2023.
Es de destacar que el número de hojas cloróticas se incrementó con la presencia de cadmio en el suelo. Sin embargo, a pesar del efecto tóxico causado por el Cd, se observaron diferencias significativas en comparación con el tratamiento sin HMA.
El contenido en pigmentos fotosintéticos (Figura 3) se redujo en las plantas cultivadas en suelo contaminado sin el uso de HMA (T2), en comparación con el tratamiento control (T1). En las plantas en las que se usaron diferentes cepas de HMA, se encontraron diferencias significativas entre ellas. Los tratamientos en los que se aplicó la cepa R. intraradices la que mostraron las menores afectaciones, con resultados similares al tratamiento control.
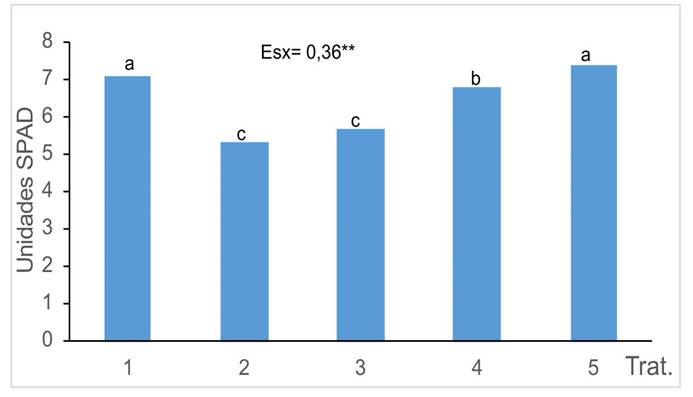
Figura 3 Índice de verdor de las plantas de girasol (Helianthus annuus L.) tratadas con micorrizas en un medio contaminado con Cd, en el Instituto Nacional de Ciencias Agrícolas (INCA), San José de las Lajas, Mayabeque, Cuba, en los años 2021- 2023.
Al analizar el efecto del Cd en la masa seca de la raíz y la parte aérea de las plantas de girasol tratadas con HMA (Figura 4), se hizo evidente la afectación que produce la contaminación del medio en este indicador. Se comprobó que ninguna de las cepas de HMA aplicada atenuó completamente el efecto de la contaminación en la masa seca de la parte aérea, aun cuando favorecieron este indicador en comparación con las plantas en medio contaminado en que no se aplicó HMA. Además, se detectó que las distintas cepas estudiadas mostraron diferencias significativas; se lograron los mejores resultados cuando se aplicaron las cepas G. cubense y R. intraradices. En cuanto a la masa seca de la raíz, se registró una tendencia semejante.
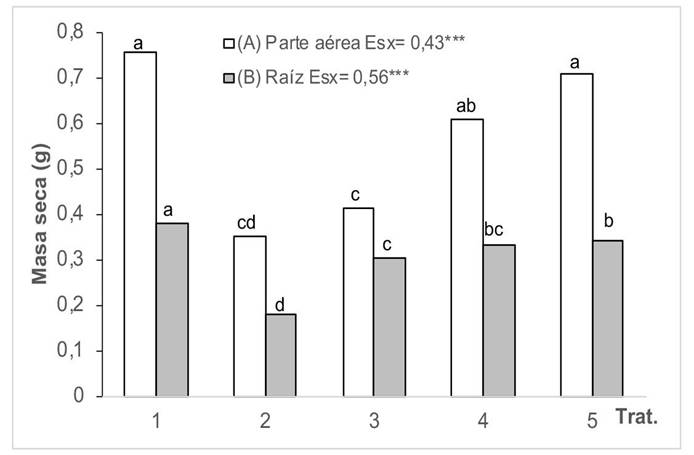
Figura 4 Masa seca de la parte aérea (A) y de la raíz (B) de plantas de girasol (Helianthus annuus L.) cultivadas en un suelo contaminado con Cd y tratadas con diferentes cepas de HMA, en el Instituto Nacional de Ciencias Agrícolas (INCA), San José de las Lajas, Mayabeque, Cuba, en los años 2021-2023.
El efecto de los tratamientos en las estructuras micorrízicas se evaluó a través de los indicadores colonización micorrízica y densidad visual (Cuadro 2), los cuales reflejan el nivel de ocupación de la raíz de la planta hospedera por el hongo micorrízico. A los 60 días de aplicados los tratamientos, todas las cepas de HMA incrementaron los niveles de colonización y densidad visual; aunque los mayores valores de estas variables se alcanzaron con R. intraradices, los cuales difirieron significativamente del resto.
Cuadro 2 Porcentaje de infección y densidad visual de la micorrización de plantas de girasol (Helianthus annuus L.) inoculadas con micorrizas, en el Instituto Nacional de Ciencias Agrícolas (INCA), San José de las Lajas, Mayabeque, Cuba, en los años 2021- 2023.
| Tratamientos | Porcentaje de infección | Densidad visual |
| 1. Semillas embebidas en agua, suelo no contaminado (control) | 13,0 | 0,55 |
| 2. Semillas embebidas en agua, suelo contaminado | 11,0 | 0,72 |
| 3. Semillas micorrizadas INCAM-2 (F. mosseae), suelo contaminado | 33,0 | 1,72 |
| 4. Semillas micorrizadas INCAM-4 (G. cubense), suelo contaminado | 40,0 | 4,48 |
| 5. Semillas micorrizadas INCAM-11 (R. intraradices), suelo contaminado | 60,0 | 5,01 |
Con respecto a los niveles de Cd en la raíz y la parte aérea de las plantas de girasol (Cuadro 3), se evidenció en todos los tratamientos que la raíz es el órgano en el cual se produce la mayor acumulación de Cd.
Cuadro 3 Contenido de Cd (mg kg-1) en los órganos de plantas de girasol (Helianthus annuus L.) inoculadas con diferentes cepas de micorrizas, en el Instituto Nacional de Ciencias Agrícolas (INCA), San José de las Lajas, Mayabeque, Cuba, en los años 2021-2023.
| Tratamientos | Raíz | Parte aérea |
| 1. Semillas embebidas en agua, suelo no contaminado (control) | 0, 5590d | 0, 1988d |
| 2. Semillas embebidas en agua, suelo contaminado | 2, 6645c | 0, 2963c |
| 3. Semillas micorrizadas INCAM-2 (F. mosseae), suelo contaminado | 4, 5874b | 0, 3874b |
| 4. Semillas micorrizadas INCAM-4 (G. cubense), suelo contaminado | 5, 9382a | 0,5590b |
| 5. Semillas micorrizadas INCAM-11 (R. intraradices), suelo contaminado | 6, 0178a | 1,9879a |
| Esx | 0,064 | 0,006 |
En general, se verificó que, con la aplicación de HMA, se registró un incremento en la concentración de Cd en todas las partes de las plantas, por lo que se manifestó el efecto estimulador de la aplicación de HMA. Los mayores valores de estas variables se alcanzaron con R. intraradices, los cuales difirieron significativamente del tratamiento control.
Discusión
En la altura de las plantas y la longitud de la raíz, se observó una influencia negativa en el crecimiento a causa de la presencia de cadmio en el medio. Una posible causa es que el Cd inhibe la apertura estomática e impide el desarrollo normal de las plantas. Esto concuerda con lo experimentado por autores que han comprobado que el exceso de cadmio produce efectos tóxicos sobre las plantas, lo que inhibe su crecimiento (Herrera-Peraza et al., 2021).
La presencia de HMA tuvo un efecto positivo en las plantas, ya que los tratamientos con HMA mostraron una mayor altura y longitud de la raíz en comparación con las plantas crecidas en medio con Cd sin la presencia de HMA (tratamiento 2). Al respecto, Carrillo-Saucedo et al. (2022) plantean que el micelio de los hongos aumenta la captura con HMA, debido al beneficio que los HMA otorgan a las plantas en la adsorción de agua y nutrientes; de esta manera, las plantas se nutren mejor, aumentan la fotosíntesis y producen un mayor número de hojas, lo que favorece su desarrollo.
En los tratamientos con cadmio y HMA, se observó que la presencia de los hongos provocó que las plantas se comportaran de forma similar al tratamiento sin cadmio, por lo que se puede decir que los HMA aumentan la tolerancia frente al cadmio en las plantas, debido a que estos pueden acumular Cd dentro de las vesículas que producen en las raíces (Riopedre-Galán et al., 2022).
La resistencia a los efectos tóxicos del cadmio podría ser un efecto de la inmovilización de metales pesados en los grupos activos de los componentes de la pared celular, como la quitina, la melanina, la celulosa, los polisacáridos y las estructuras lipídicas (Belezaca Pinargote et al., 2020). De forma similar, la inmovilización puede ocurrir mediante la quelación con proteínas secretadas por el hongo, tales como las metalotioneínas, polipéptidos como las fitoquelatinas y glicoproteínas como la glomalina, que por su riqueza en cisteína son capaces de adsorber el metal pesado en sus grupos tioles y carboxilo (Audet & Charest, 2007).
Elementos metálicos como el cobre (Cu), cobalto (Co), plomo (Pb) y Cd causan una disminución en el contenido de clorofila y de proteínas en las plantas; sin embargo, en este trabajo, se observó un mayor índice de verdor asociado a las plantas micorrizadas con altas concentraciones de Cd. Además, se ha descrito que los HMA mejoran la adsorción de nutrientes y minerales esenciales como el zinc (Zn2+), hierro (Fe2+) y manganeso (Mn2+) (Li et al., 2020).
Algunos estudios han demostrado que los HMA pueden disminuir la concentración de Cd en las plantas al aumentar su biomasa (Vallejos-Torres et al., 2021). En esta investigación, el crecimiento de las plantas de girasol y su biomasa aumentaron significativamente en los tratamientos que presentaban HMA y altas concentraciones de Cd, lo que concuerda con lo indicado por Janeeshma y Puthur (2020).
En este trabajo, todas las plantas de girasol inoculadas mostraron colonización, a pesar del poder inhibitorio que el cadmio ejerce sobre los hongos micorrícicos, ya sea porque inhibe la germinación de esporas o la propia colonización de las raíces (Bernardo et al., 2018). Estos resultados coinciden con Joner y Leyval (2001), quienes afirmaron que los hongos micorrícicos pueden subsistir en suelos contaminados con metales pesados.
Los resultados obtenidos en los parámetros de crecimiento concuerdan con Cengiz et al. (2009), en donde la altura y otros parámetros de crecimiento se vieron afectados de forma negativa por la presencia de metales pesados en el suelo, con un menor el efecto del estrés en plantas que fueron inoculadas con hongos micorrícicos. Los resultados encontrados coinciden con Rabie (2005), quien determinó, en ensayos de trigo y poroto colorado micorrizados con Glomus mosseae y expuestos a cobre, que la simbiosis disminuía el efecto negativo del cobre sobre el peso seco de las plantas.
La adsorción de cadmio según las partes de la planta de girasol, fue en el orden raíz-tallo-hojas. Los resultados evidencian que la mayor adsorción del cadmio se produce a nivel radicular, mientras que, por el proceso de translocación, este metal es trasladado hacia el tallo y las hojas de la planta.
El transporte del cadmio está restringido por sitios de intercambio de compuestos activos, localizados en las paredes celulares. Una amplia proporción se acumula en el tejido de las raíces y en menor cantidad en la parte alta de la planta, lo cual explica el mayor contenido de cadmio en las raíces de las plantas de girasol, mientras que este contenido disminuyó en la parte aérea (Munive Cerrón et al., 2020).
Conclusiones
Las cepas de HMA inoculadas en plantas de girasol mostraron un comportamiento favorable en la adsorción de Cd y en los indicadores de crecimiento evaluados, independientemente de la especie utilizada. La cepa de mayor eficiencia fue G. intraradices. Por lo tanto, el empleo de la inoculación con hongos micorrízicos arbusculares en plantas de girasol resultó efectivo para la remediación de los medios evaluados con altos niveles de metales.















