Introducción
El garbanzo (Cicer arietinum L.) se consideró durante muchos años una especie de hospedero restringido para la nodulación, razón por la cual los estudios de diversidad de bacterias promotoras del crecimiento de plantas (PGPB, por sus siglas en inglés), que se asociaban a esta especie de planta se limitaron durante largo tiempo al género Mesorhizobium (Zhang et al., 2020). Se ha descrito la presencia de nuevas especies asociadas al cultivo, tales como Rhizobium leguminosarum (Martínez-Hidalgo et al., 2015); Achromobacter xylosoxidans (Egamberdieva et al., 2017); Burkholderia andropogonis y Ochrobactrum ciceri (Velázquez et al., 2017) entre otras, lo que denota que existe una amplia diversidad de bacterias capaces de asociarse al garbanzo (Zhang et al., 2020).
Son limitadas las investigaciones relacionadas con la simbiosis rizobio-garbanzo, debido a que los microorganismos noduladores o endosimbiontes que lo benefician son pocos y a que además no se considera una planta modelo a nivel de estudios biológicos (Cruz González, 2018). De ahí, la importancia de incrementar los conocimientos acerca de esta simbiosis y del proceso de interacción, ya que los exudados radicales liberados por cada cultivar difieren en su composición química y concentración. Además, por la necesidad de obtener aislados eficientes con potencial de asociarse a cultivares de garbanzo más nodulantes y productivos, como alternativa nutricional para reducir las aplicaciones de fertilizantes minerales. Por esta razón, la implementación de prácticas que limiten la aplicación de insumos sintéticos, como la biofertilización, se convierte en una alternativa viable e importante para lograr un desarrollo agrícola sostenible a nivel ecológico (Chávez-Díaz et al., 2020), que permita reducir el impacto negativo provocado por el exceso de agroquímicos y conservar el equilibrio en el medio ambiente (Rosabal et al., 2021).
El garbanzo se encuentra dentro de los cultivos que brindan beneficios a los agroecosistemas, ya que mejora las condiciones del suelo por la fijación biológica del nitrógeno (FBN), en simbiosis con los rizobios, al alcanzar hasta 300 kg ha-1 de N cultivado como abono verde. Favorece, además, la fertilidad del suelo, ya que contribuye a mantener e incrementar la biomasa microbiana encargada de mejorar su estructura y hacer más accesibles los nutrientes, lo que favorece la sanidad de los cultivos y aumenta la resistencia a las enfermedades (Vargas-Blandino & Cárdenas-Travieso, 2021). Además, el garbanzo se destaca por ser una especie de interés para el consumo humano y animal (Apáez Barrios et al., 2020), con un contenido proteico de alrededor del 20 %, cantidad elevada de carbohidratos (40 %), de alta digestibilidad, es rico en ácidos grasos insaturados y posee pocos elementos antinutritivos (León de la Rocha et al., 2019). De igual forma, a su consumo se le confiere un efecto beneficioso en la prevención de enfermedades crónicas como las cardiovasculares, diabetes, algunos tipos de cáncer y problemas digestivos (Hidalgo et al., 2018).
El presente trabajo tuvo como objetivo caracterizar e identificar un aislado obtenido a partir de nódulos de plantas de garbanzo y evaluar su efectividad en condiciones de campo.
Materiales y métodos
Sitio de estudio y material vegetal
El aislamiento de presuntos rizobios se realizó a partir de la colecta de nódulos provenientes de plantas sanas y vigorosas del cultivar de garbanzo (C. arietinum) variedad Nacional-29, en el año 2012 en la provincia de Artemisa, Cuba, en un suelo Ferralítico Rojo Lixiviado agrogénico (Hernández Jiménez et al., 2015), con un pH de 7,36 y un contenido de materia orgánica de 2,09 %. Se empleó un termómetro, un pluviómetro y un higrómetro, para evaluar las variables meteorológicas en el período de noviembre-febrero, durante la realización de los experimentos. Se registró una temperatura promedio entre 13,5 °C y 21,8 °C, con precipitaciones medias anuales desde 1016 a 1024 mm y entre 66 % y 85 % de humedad relativa.
Caracterización morfológica, fisiológica y-bioquímica
El aislado de rizobio R3 se cultivó por agotamiento (diluciones sucesivas de la muestra en condiciones de esterilidad) en placas Petri, por triplicado, sobre medio de cultivo levadura manitol agar (LMA) con Rojo Congo (Yuan et al., 2020). Se caracterizó su morfología mediante la descripción de las colonias formadas en un cultivo de 24 h a 30 °C. Los aspectos del cultivo que se tuvieron en cuenta para la caracterización fueron: tiempo de aparición, forma, color, aspecto, borde y textura de las colonias, mediante su observación en microscopio estereoscópico (Leica KL 300 LED, 3X de aumento). Las características micromorfológicas y tintoriales, se describieron mediante tinción de Gram según el procedimiento descrito por Madigan et al. (2019) y se visualizó la respuesta del aislado en un microscopio óptico (Leica DM300, 1000 X de aumento). Se evaluó la producción de ácidos o bases y la producción de cetolactasa. En el primer caso, se utilizó el medio de cultivo LMA con azul de bromotimol y en el segundo, el medio de cultivo Levadura Lactosa Agar (LLA) (Yuan et al., 2020). Las placas se incubaron durante siete días a 28-30 °C.
Para la caracterización fisiológico-bioquímica se ejecutaron diez pruebas que incluyeron presencia de las enzimas citocromo oxidasa y catalasa, hidrólisis del almidón, gelatina y caseína, utilización de citrato como fuente de carbono, producción de indol a partir de triptófano, fermentación de la glucosa, utilización de azufre y motilidad, esta última por el método de la gota colgante. En todos los casos las muestras se incubaron durante dos a cinco días, a una temperatura de 28-30 °C y se realizaron las pruebas por triplicado.
Tolerancia a diferentes valores de pH y temperatura
La tolerancia a valores de pH se realizó mediante el uso de placas Petri con medio de cultivo LMA ajustado a diferentes valores de pH (3; 3,5; 4; 4,5; 5; 5,5; 6; 6,5; 7; 7,5; 8; 8,5; 9 y 9,5) con HCl 1N ó NaOH 1N (Bécquer et al., 2016), se sembró el aislado mediante una estría central y luego se incubaron a 30 °C. Se observó su crecimiento cada 24 horas durante 12 días (Gómez Padilla et al., 2017). De forma similar, se determinó la tolerancia a diferentes temperaturas, pero en este caso el aislado se sembró en el medio LMA y las placas se incubaron a los valores de temperatura (ºC): 25; 26; 27; 28; 29; 30; 31; 32; 33; 34; 35; 36; 37; 38; 39 y 40. Para ambos casos se consideró como respuesta positiva el crecimiento microbiano sobre el medio y como resultado negativo, la ausencia de este (Flores-Félix et al., 2020).
Identificación taxonómica
Se trabajó con el aislado R3 procedente de la provincia Artemisa, Cuba, cuyo código de conservación en el Centro Nacional de Recursos Genéticos (CNRG) del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias, en Tepatitlán de Morelos, México: es CM-CNRG 562. El mismo se revitalizó en medio de cultivo LMA para su posterior identificación. Con el fin de extraer el ADN genómico del aislado, se cultivó en medio triptona extracto de levadura (TY, por sus siglas en inglés) (Paudel et al., 2020), durante 24 h, a 28-30 °C. Una colonia aislada se suspendió en 100 µL de agua ultra pura estéril y se centrifugó durante 2 min a 19 000 g. Las células se resuspendieron en una solución de 100 µL de hidróxido de sodio (NaOH, 0,05 M), luego se calentó a 100 ºC, durante 4 min. Transcurrido este tiempo se adicionaron 900 µL de agua destilada estéril y se centrifugó a 19 000 g por 2 min. Se retiraron 700 µL del sobrenadante, que se mezclaron con igual volumen de glicerol al 25 % (v/v) y se conservó a -20 °C.
La amplificación de los genes ARNr 16S, atpD, gltA, y recA (Cuadro 1) se realizó por la Reacción en Cadena de la Polimerasa (PCR, por sus siglas en inglés) en un termociclador (SelectCycler). Se utilizaron los iniciadores 27f (secuencia 5’-AGA GTT TGA TCM TGG CTC AG -3') y 1492r (5'- CGG TTA CCT TGT TAC GAC TT -3') (Rasheed et al., 2020). La mezcla de reacción consistió en: 2 µL de cada cebador a una concentración de 10 µM, 25 µL de DreamTaq Green PCR Master Mix (2X); 4,0 µL de ADN y 17 μL de agua ultra pura. Para la PCR se empleó un termociclador con la siguiente programación: una desnaturalización inicial a 95 ºC, 5 min; 30 ciclos de 95 ºC, 30 s (desnaturalización); 59 ºC, 30 s (hibridación o alineamiento) y 72 ºC, 90 s (extensión), y una extensión final a 72 ºC, 7 min.
Cuadro 1 Iniciadores empleados en la amplificación y secuenciación de genes. Centro Nacional de Recursos Genéticos (CNRG), Tepatitlán de Morelos, México. 2020.
| Gen | Iniciador | Secuencia (5’-3’) | Fuente |
| 16S Rrna | 785F | GGATTAGATACCCTGGTA | Kumar et al. (2016) |
| 907R | CCGTCAATTCMTTTRAGRTT | ||
| atpD | atpD294F | ATCGGCGAGCCGGTCGACGA | Zhao et al. (2017) |
| atpD771R | GCCGACACTTCCGAACCNGCCTG | ||
| gltA | gltA428F | CSGCCTTCTAYCAYGACTC | Khalid et al. (2014) |
| gltA1111R | GGGAGCCSAKCGCCTTCAG | ||
| recA | recA6F | CGKCTSGTAGAGGAYAAATCGGTGGA | Zhao et al. (2017) |
| recA555R | CGRATCTGGTTGATGAAGATCACCAT |
El producto de la amplificación se visualizó por electroforesis en gel de agarosa 0,9 % (m/v) en buffer Tris acetato EDTA (TAE) 1X. La corrida se realizó durante 40 minutos, a 90 V. Los geles se fotografiaron mediante el empleo de un fotodocumentador GoodView (Beijing SBS. GenetechCo. Ltd.) en una relación de 1 μL:50 mL (colorante: agarosa). El tamaño correcto del amplicón (1500 pares de bases) se confirmó mediante su comparación con el marcador de peso molecular GeneRuler 1 kb DNA Ladder (Thermo Scientific #SM1332), al exponer el gel a luz ultravioleta.
Los productos de la PCR se secuenciaron (MACROGEN Inc. Corea) y las secuencias en formato *.abi se transformaron a formato FASTA con el programa BioEdit versión 7.0.9.0. Se analizaron en las bases de datos del NCBI mediante el programa MegaBlast versión 2.2.22 y se construyó una minería de secuencias homólogas del GenBank, por medio del programa Clustal X, versión 2.0. Se generó el alineamiento que se editó con el programa Seaview versión 4.0. Con la secuencia consenso, se realizó un nuevo análisis en el programa MegaBlast versión 2.2.22 para determinar la reconstrucción filogenética de las secuencias. La asignación final de identidades se realizó en base a la concordancia de la comparación de la agrupación de las secuencias con secuencias homólogas y la identidad porcentual mayor al 99 % en las bases de las plataformas BLAST (base de nucleótidos y de 16S de Bacterias y Archeas) leBiBi y EzBiocloud.
Efectividad en el crecimiento y rendimiento de garbanzo en condiciones de campo
El ensayo se llevó a cabo en lotes agrícolas del INIFAT, Cuba, en un suelo Ferralítico Rojo Compactado (Hernández Jiménez et al., 2015), para medir la efectividad en el crecimiento y rendimiento de la variedad de garbanzo Nacional-29 en condiciones de campo. Se utilizaron dos cepas, 1) el aislado R3 bajo estudio y 2) la cepa de referencia (Mesorhizobium ciceri INIFAT GR-1), empleada para la inoculación de garbanzo en Cuba. En ambos casos, los inóculos se prepararon mediante un proceso de fermentación sumergida en zaranda orbital en medio de cultivo LM. Para esto, se empleó un agitador orbital de 200 rpm, durante 48 h y a una temperatura de 28-30 °C, hasta obtener una concentración de 2,4 x 1010 UFC mL-1. Los mismos se diluyeron en agua, a razón de 1:10 (v:v) y se aplicaron mediante imbibición de las semillas variedad Nacional 29 durante 15 min. Para los tratamientos testigos, las semillas solo se embebieron en agua durante igual periodo de tiempo. En todos los casos, las semillas se orearon a la sombra sobre un tamiz, antes de proceder a la siembra en un suelo Ferralítico Rojo Lixiviado (Hernández Jiménez et al., 2015).
El ensayo contó con cuatro réplicas por tratamiento y un tamaño de parcela de 30 m2, con seis surcos de 5 m de largo por 6 m de ancho para cada tratamiento, y una distancia entre plantas de 0,20 m y 0,70 m, entre surcos. Se realizaron las atenciones culturales recomendadas para el cultivo de garbanzo en Cuba (Shagarodsky et al., 2021). Se utilizó además como tratamiento control un testigo absoluto sin aplicación de microorganismos ni fertilizantes.
A los 60 días después de la siembra, se extrajeron diez plantas por cada tratamiento, a las que se les determinó número de nódulos (u) y masa seca de nódulos por planta (g), esto último, mediante el uso de una estufa a 70 °C, durante 72 h. En el momento de la cosecha, se desecharon los bordes de cada parcela y se utilizaron diez plantas por surco para determinar a cada una de ellas los siguientes indicadores: número de vainas (u), masa seca de 100 granos y masa seca de los granos (g), las que se le determinaron con una balanza semi-analítica (0,01 g de error). Para cuantificar la masa seca de los granos se utilizó una balanza de precisión (1 g de error).
Para los experimentos en condiciones de laboratorio se utilizó un diseño completamente aleatorizado, mientras que los ensayos con plantas se realizaron bajo un diseño de bloques al azar. Los resultados fueron sometidos a un análisis de varianza y las medias se compararon según el test de Tuckey (p < 0,05). El análisis estadístico se realizó con el software InfoStat (Di Rienzo et al., 2018).
Resultados
Caracterización morfológica, fisiológica y bioquímica
El aislado R3 mostró características culturales, morfológicas y tintoriales similares a las de los rizobios, i.e, cocobacilos o bacilos pequeños, Gram negativos, sin esporas. Creció a los dos días de la siembra, con colonias de 1 mm de diámetro de coloración blanquecina, sin absorción de rojo congo, circulares, convexas y mucilaginosas, con una coloración beige. Las células con una forma cocobacilar, sin esporas, Gram negativas. El crecimiento mostró cambio de coloración de verde a amarillo en el medio de cultivo LMA con azul de bromotimol, lo que indica su capacidad para producir ácidos y una respuesta negativa a la cetolactasa. Además, mostró una respuesta positiva a las pruebas de oxidasa, catalasa, hidrólisis de caseína, utilización de citrato y motilidad. Sin embargo, la respuesta fue negativa a la hidrólisis de almidón y de gelatina, a la producción de indol a partir del triptófano, el uso de azufre a partir del crecimiento en medio Kliger y a la degradación de la celulosa.
Tolerancia a diferentes valores de pH y temperatura
El aislado no creció a valores de pH entre 3 y 5 ni a pH de 9,5. No obstante, mostró crecimiento a pH entre 5,5 y 9,0. Tampoco creció a valores de temperatura entre 25 y 27 ºC, ni a 40 ºC. Sin embargo, toleró rangos desde 28 hasta 39 ºC (Cuadro 2).
Cuadro 2 Crecimiento del aislado R3 obtenido a partir de la colecta de nódulos en la provincia de Artemisa, Cuba a diferentes niveles de pH y temperatura. Cuba. 2020.
| Valores de pH | |||||||||||||||
| 3 | 3,5 | 4 | 4,5 | 5 | 5,5 | 6 | 6,5 | 7 | 7,5 | 8 | 8,5 | 9 | 9,5 | ||
| - | - | - | - | - | + | + | + | + | + | + | + | + | - | ||
| Temperatura (oC) | |||||||||||||||
| 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
| - | - | - | + | + | + | + | + | + | + | + | + | + | + | + | - |
Crecimiento (+) ausencia de crecimiento (-). / Legend: Growth (+) absence of growth (-).
Identificación taxonómica
En el árbol filogenético de la cepa R3 con la secuencia de los cuatro genes (Figura 1), la cepa se identifica como perteneciente a la especie Rhizobium pusense. Los porcentajes de identidad entre las cepas de las diferentes especies de Rhizobium se indican en el Cuadro 3.

Figura 1 Árbol filogenético de la cepa R3 de Rhizobium pusense obtenida a partir de la colecta de nódulos en la provincia de Artemisa, Cuba construido con la secuencia concatenada de los genes 16S rRNA, atpD, gltA y recA, con el método de máxima verosimilitud y el modelo de sustitución nucleotídica de Tamira Nei 93, con 1000 repeticiones Bootstrap. Centro Nacional de Recursos Genéticos (CNRG), Tepatitlán de Morelos, México. 2020.
Cuadro 3 Porcentajes de identidad con la secuencia de la cepa R3 y cepas de referencia relacionadas. Centro Nacional de Recursos Genéticos (CNRG), Tepatitlán de Morelos, México. 2020.
| 16S rRNA | atpD | gltA | recA | |
| Rhizobium pusense FDAARGO3_633 | 99,85 | 98,19 | 99,11 | 99,48 |
| Rhizobium pusense CFBP5875 | 99,85 | 99,60 | 99,25 | 99,83 |
| Rhizobium pusense IRBG74 | 99,85 | 98,79 | 99.40 | 99,48 |
| Rhizobium etli CFN_42 | 94,44 | 88,58 | 85,88 | 88,31 |
Códigos de las cepas empleadas en el: / Codes of the strains used in the: GenBank.16S rRNA: MK108017, atpD: OP795820, gltA: OP795821 y recA: OP795822.
Efectividad en el crecimiento y rendimiento de garbanzo en condiciones de campo
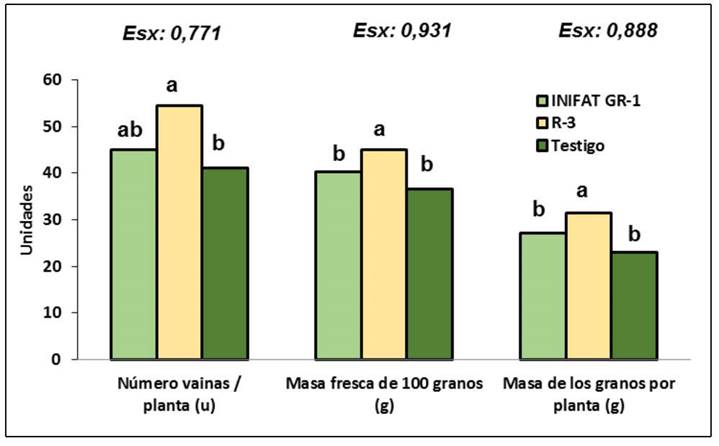
La cepa R3 mostró una mejor respuesta con diferencias significativas con respecto al tratamiento inoculado con la cepa INIFAT GR-1 y el testigo sin inocular, con un mayor número y masa seca de los nódulos (Figura 2), de igual manera se expresó este resultado en los indicadores vinculados al rendimiento del cultivo que se evaluaron como el número de vainas por planta, la masa seca de 100 granos y la masa seca de los granos por planta (Figura 3).

Figura 2 Número y masa seca de los nódulos de plantas de garbanzo (Cicer arietinum L.) de la variedad Nacional-29 inoculadas o no (testigo). Cuba. 2020.
Discusión
El aislado R3 mostró características similares a las que se describen para los rizobios (Madigan et al., 2019). Entre las que se destacan una respuesta positiva frente a la prueba de la catalasa y la oxidasa, no hidrolizan almidón ni gelatina, pero sí caseína, utilizan citrato como fuente de carbono y tienen una respuesta negativa en el medio Kliger y a la producción de indol a partir del triptófano (Singha et al., 2017).
La mayoría de los rizobios crecen en valores de pH cercanos a la neutralidad (Bécquer Granados, 2022), sin embargo, se ha demostrado que algunas cepas de esta familia pueden tolerar rangos de pH desde 3,5 hasta 9 (Gómez Padilla et al., 2017). El aislado R3 creció a pH 5,5 y también a valores de pH 9; lo que sugiere la presencia de mecanismos de adaptación que le permiten sobrevivir en estas condiciones (Moreno Reséndez et al., 2018), aspecto que constituye una ventaja para el uso en la práctica de este microorganismo como principio activo de un biofertilizante para beneficiar al cultivo del garbanzo, ya que, de mantener su efecto estimulador del crecimiento en las diferentes condiciones de acidez, podría utilizarse en distintos tipos de suelo y en diferentes agroecosistemas.
Los rizobios pueden crecer en temperaturas entre 28-30 °C (Fernández Canigia, 2020). Otras investigaciones han obtenido resultados similares a los alcanzados en el presente estudio e incluso superiores, donde aislados de nódulos de Vigna unguiculata toleraron hasta 45 °C (Gómez Padilla et al., 2017). Esto sucede con la tolerancia de algunas cepas a diferentes valores de pH y temperaturas, lo que puede favorecer su multiplicación en la rizosfera y contribuir a una mayor colonización de la especie. Otros autores señalaron que estos factores, le confieren a los rizobios mayores posibilidades de sobrevivir y competir con otras bacterias del suelo, lo que favorece la colonización de las leguminosas y la fijación de nitrógeno atmosférico (Moreno Reséndez et al., 2018).
El análisis filogenético mostró que la cepa R3 pertenece al género Rhizobium y a la especie pusense. El mismo, es originario de la India y se aisló por primera vez de la rizosfera de garbanzo, de ahí que sea posible su presencia asociada a esta especie vegetal bajo las condiciones de Cuba, aunque este constituye el primer informe en el país que demuestra su presencia en el cultivo.
La mayor cantidad de nódulos formados con la inoculación de R. pusense cepa R3, sugiere una mayor afinidad entre esta cepa y el cultivar de garbanzo Nacional 29 y, por lo tanto, una mejor colonización del sistema radical y establecimiento de los bacteroides dentro de los nódulos, lo que conlleva a un incremento de la masa nodular (Velázquez et al., 2017). Ello implica un mayor suministro de N a la planta, que, junto a otros nutrientes y agua, se convertirán en biomasa aérea, por tanto, en mayor capacidad de realizar fotosíntesis, lo que permitirá una mayor producción de legumbres y granos. Respecto a esto, otros estudios plantean la posibilidad de lograr una nodulación eficiente garantiza los elementos necesarios para el crecimiento y el desarrollo de las plantas (Chandra et al., 2018).
Estos resultados constituyen el primer informe de la especie R. pusense en Cuba, asociada al cultivo del garbanzo y sugieren que la cepa R3 podría constituir el principio activo de un nuevo bioproducto para beneficiar el cultivo.
Conclusiones
Se identifica por primera vez en Cuba la especie R. pusense asociada a nódulos de garbanzo (C. arietinum L.). La cepa mostró un crecimiento positivo a pH entre 5,5 y 9,0 y rangos de temperatura desde 29 hasta 38 ºC, lo que evidencia su tolerancia a estos factores. Su inoculación en garbanzo estimuló la formación de nódulos e incrementó las variables del rendimiento. Los resultados constituyen un punto de partida para la utilización de esta cepa como principio activo de un biofertilizante que beneficie el cultivo del garbanzo en las condiciones de Cuba.