INTRODUCCIÓN
Copoazú ( Theobroma grandiflorum Wild. Ex. Spreng. K. Schum.) es una especie arbórea presente en la Amazonia continental, perteneciente al mismo género del cacao ( Theobroma cacao ) de la familia Malvaceae. Es considerada como una especie promisoria, ya que todas las partes de su fruto tienen diferentes usos potenciales como: derivados tradicionales, productos innovadores en la cosmética y la industria alimentaria. En esta última porque hasta 45% de copoazú en fruta fresca se compone de la pulpa que rodea la semilla que también puede ser utilizada para la producción de chocolate ( Alves et al., 2007 ; Genovese y Lannes, 2009 ).
El estudio de las adaptaciones fisiológicas de los organismos al medio ambiente, permite comprender los mecanismos que explican algunas respuestas ecológicas. Mediante estudios ecofisiológicos es posible determinar las condiciones para el desarrollo de una especie, ecotipo o cultivo, incluso, de variedades dentro de un cultivo, contribuyendo a mejorar su productividad ( Melgarejo et al., 2010 ). Del mismo modo, es necesario la evaluación de los factores que limitan la fotosíntesis, entre otros, lo relacionado con la apertura estomática y su incidencia en el intercambio de gases.
Se han observado variaciones genéticas como la correlación negativa entre densidad estomatica y tamaño de estomas, con biomasa ( Doheny-Adams et al., 2012 ). Enfoques experimentales que combinan herramientas fisiológicas y genéticas, han tenido éxito en función de la relación de los estomas con los procesos fisiológicos de la planta ( Masle et al., 2005 ; Dow y Bergmann, 2014 ; Easlon et al., 2014) . En consecuencia, la conductancia estomática (gs) es un factor importante en el ciclo y el equilibrio de agua, CO2, y la energía entre las plantas y la atmósfera. El contenido de clorofila de las hojas a menudo se utiliza como parámetro del estado fisiológico de la planta ( García et al., 2005 ; Matsumoto et al., 2005 ). En algunos estudios, la dependencia de la conductancia estomática se relaciona con la clorofila de la hoja ( Matsumoto et al., 2005 ). Asimismo, la disminución de la conductancia estomática puede tener efecto negativo sobre la tasa fotosintética, por lo que puede reducir el potencial de rendimiento de los cultivos ( Gilbert et al., 2011 ).
El contenido de pigmentos fotosintéticos por unidad de área de las hojas, constituye uno de los indicadores de la capacidad fotosintética de las plantas, ya que representa una medida de las dimensiones del sistema fotosintético y de su eficiencia ( Huang et al., 2004 ; García et al., 2005 ). Esto determina la producción de biomasa de la planta en diferentes condiciones. De ahí, que el estudio de los pigmentos fotosintéticos puede contribuir a esclarecer el comportamiento y respuesta de copoazú con la utilización de la energía lumínica, intercambio gaseoso, agua y nutrimentos durante su ciclo de desarrollo, lo que ayudaría a diseñar sistemas agroforestales eficientes ( Fortes et al., 2010 ). Por lo tanto, el objetivo del presente trabajo fue evaluar la variabilidad en el contenido de pigmentos fotosintéticos y la conductancia estomática diaria en relación con las variables ambientales en ecotipos de copoazú ( Theobroma grandiflorum ).
MATERIALES Y MÉTODOS
Sitio y áreas de estudio
El banco de germoplasma de copoazú del Centro de Investigaciones Macagual César Augusto Estrada Gonzales, propiedad de la Universidad de la Amazonia, está compuesto por diez ecotipos (UA-039, UA-045, UA-067, UA-068, UA-075, UA-166, UA-31, UA-37, UA-67, UA-75), con once años de plantados y en etapa productiva, con manejos agronómicos como fertilización con 15-15-15 en cuatro dosis anuales (50 g/árbol/dosis), de los cuales no se cuenta con la información sobre el origen y procedencia, ya que pertenecieron a un programa de mejoramiento genético del Ministerio de Agricultura de Colombia. El banco de germoplasma se ubica geográficamente a 1°37’N y 75°36’W, a 300 msnm, con un clima AF según la clasificación de Köppen. Las condiciones meteorológicas se caracterizan por una precipitación anual promedio de 3793 mm, con monomodal entre los meses de abril a septiembre, brillo solar de 1707 horas/año, temperatura promedio de 25,5 °C y humedad relativa de 84,3%.
Colecta de material vegetal
En enero del año 2015, periodo de mínima precipitación coincidiendo con un periodo de mayor intensidad lumínica, del total de ecotipos que conforman el banco de germoplasma de copoazú se seleccionaron al azar a las 9:00 am, cuatro plantas de cada ecotipo, las cuales estaban a pleno sol, donde se colectaron cuatro hojas completamente desarrolladas por planta, ubicadas en el estrato medio. Estas fueron llevadas al laboratorio de fisiología vegetal de la Universidad de la Amazonia donde se congelaron a -10 ºC, hasta el momento de extracción de los pigmentos. De cada hoja se hizo un macerado en un mortero con nitrógeno líquido, para obtener tres muestras de 0,3 g pesados en balanza analítica, los que fueron usados para la extracción de los pigmentos fotosintéticos.
Extracción y cuantificación de pigmentos fotosintéticos
Utilizando acetona (80%) como solución extractora, y siguiendo la metodología propuesta por Melgarejo et al. (2010) se realizó el proceso de extracción del contenido de clorofila a, b, total y carotenoides. Del extracto, y utilizando un espectrofotómetro Uv-vis con lector de microplacas, se hicieron lecturas a diferentes longitudes de onda para luego hallar los contenidos de clorofilas y carotenoides; posteriormente, se emplearon las ecuaciones propuestas por Lichtenthaler (1987) para obtener el contenido de pigmentos. Para Chl a (mg/g) = 12,25*(A663)-2,79*(A647), Chl b (mg/g) = 21,5*(A647)-5,1*(A663), C (c+x) (mg/g) = (1000*(A470)-1,82*(Chl a)-85,02*(Chl b))/198 y Chl (a+b) (mg/g) = 7,15*(A663)+18,71*(A647) donde A es la absorbancia (nm).
Variables ambientales y conductancia estomática
Dentro del banco de germoplasma fue ubicada una estación meteorológica para evaluar humedad relativa del aire (%), temperatura del aire (°C) y radiación global (µmol/m2/s). A partir del máximo y mínimo de la temperatura y humedad se calculó el déficit de presión de vapor (DPV, MPa), mediante la metodología propuesta por Allen et al. (2006) . De manera aleatoria, y utilizando la misma madurez fisiológica y posición que las utilizadas para pigmentos fotosintéticos en cuatro hojas de cuatro plantas de cada ecotipo, fue tomada la conductancia estomática (gs) con un porómetro de hoja SC-1 (Decagon Devices, Pullman), cada dos horas durante el curso diario entre las 04:00 – 18:00 h, en la época de mínima precipitación, durante tres días consecutivos (enero-2015), lo cual coincidió con un periodo de mayor intensidad lumínica.
Diseño experimental y análisis de datos
Para analizar el contenido de pigmentos fotosintéticos en cada ecotipo se utilizó un diseño completamente al azar, utilizando un modelo estadístico Yi = µ + Gni + Єi donde: Yi = una observación; µ = media; Gni = efecto del i-ésimo ecotipo, Є(i) = error debido al ecotipo. En el caso de la conductancia estomática fue un modelo bifactorial con diseño completamente al azar en parcelas divididas. La parcela principal fue el ecotipo y la subparcela cada hora Yijk = µ + Gni + Єi + Hj + GnHij + Єk(ij), donde: Yijk = una observación; µ = media; Gni = efecto del i-ésimo ecotipo; Єi = error debido al ecotipo; Hj = efecto de la j-ésima hora; GnHij = interacción ecotipo x hora; Єk(ij) = error debido a la hora. Los supuestos de normalidad y homogeneidad de varianzas fueron evaluados usando gráficos Q-Q-Plot y diagramas de dispersión entre residuos estudentizados y predichos. Para cada uno de los datos de pigmentos fotosintéticos, variables ambientales y conductancia estomática, se realizó análisis de estadística descriptiva y de varianza mediante la prueba de Tukey (P<0,05). La correlación entre gs y las variables ambientales se realizó utilizando el coeficiente de Pearson, así como regresiones para determinar el comportamiento diario. Los análisis se realizaron utilizando el programa Infostat ( Di Rienzo et al., 2015 ).
RESULTADOS Y DISCUSIÓN
Pigmentos fotosintéticos
Se encontraron diferencias significativas entre el contenido de clorofila a, b, total y carotenoides a nivel de ecotipo (P<0,0001; Cuadro 1 ). Al comparar los contenidos de pigmentos fotosintéticos, el ecotipo UA-31 presentó los mayores valores en comparación con el ecotipo UA-37UA-37, niveles más bajos de clorofila o su degradación repercuten en la reducción en la capacidad fotosintética de la hoja, debido a que limita el proceso fotoquímico, ya que la absorción de radiación depende de su contenido ( Pezeshki, 2001 ). La importancia de analizar los pigmentos fotosintéticos radica en la relación que tiene el contenido de estos con la radiación fotosintéticamente activa ( Bertolde et al., 2012 ), para la transformación de la energía lumínica a química a diferentes longitudes de onda (P700 y P680) ( García et al., 2005 ), lo cual permite una mayor tasa de asimilación de CO2 ( Jaimez et al., 2008 ).
Cuadro 1 Contenido de pigmentos fotosintéticos en ecotipos de copoazú ( Theobroma grandiflorum ) del banco de germoplasma de la Universidad de la Amazonia, Colombia. 2015. Table 1. Contents of photosynthetic pigments in copoazu ecotypes ( Theobroma grandiflorum ) from the germoplasm bank at the University of the Amazon, Colombia. 2015.
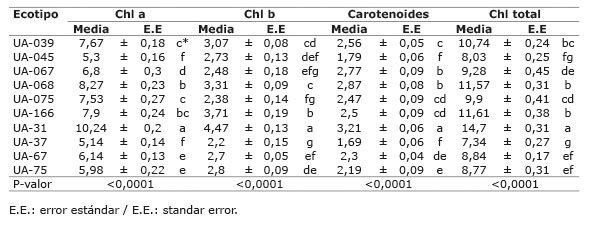
*Letras diferentes en las columnas significan diferencias significativas entre ecotipos mediante la prueba de Tukey (P<0,05) / Different letters in the column means significant differences between ecotypes by Tukey test (P<0.05).
E.E.error estándar / E.E.: standar error.
El rango de clorofila total de 7,34 a 14,7 mg/g observado en este estudio fue menor que lo reportado por Daymond y Hadley (2004) , cuyo rango varió de 8,06 a 15,0 mg/g para cuatro genotipos de cacao en condiciones de temperatura controladas en invernadero, las diferencias obtenidas podrían ser atribuidas a que la respuesta de las plantas cultivadas en el campo a las condiciones ambientales no es necesariamente la misma cuando se realiza bajo condiciones controladas como las de invernadero. Lo anterior guarda relación con lo expuesto por Ofori et al. (2015) , quienes encontraron un rango de 5,59 a 9,25 cuando se evaluó la tolerancia a la sequía en el cacao ( Theobroma cacao L.), bajo sombra y sin sombra.
En cuanto al contenido de carotenoides, el genotipo UA-31 presentó el valor promedio más alto (3,21), diferenciándose estadísticamente del resto, por lo que se presume un mejor desarrollo de las funciones como la disipación del exceso de energía de las clorofilas excitadas y la eliminación de especies reactivas de oxígeno ( Lawlor, 2001 ), cuya formación indica condiciones de estrés oxidativo ( Schützendübel y Polle, 2002 ). El genotipo UA-37 presentó el menor contenido de carotenoides, este resultado puede asociarse a la aparición de lesiones en el fotosistema II (PSII) al ser plantas sometidas a plena exposición solar, ya que los carotenoides forman parte del fotosistema I (PSI), PSII y síntesis; asimismo, la degradación de estos pigmentos se asocia, normalmente, con la disminución en la eficiencia fotosintética ( Baker, 2008 ).
Conductancia estomática y relación con variables ambientales
Se presentaron diferencias significativas a nivel de ecotipo (P<0,0001), hora (P<0,0001) y en la interacción ecotipo*hora (P<0,0001; Cuadro 2 ). El comportamiento diario (04:00 a 18:00 horas) para la gs fue cuadrático (gs=647,46-81,42(hora)+3,47(hora)2. R2=0,85), debido a la incidencia de las condiciones ambientales.
Cuadro 2 Comportamiento diario de la conductancia estomática (mmol/m2/s) en ecotipos de copoazú ( Theobroma grandiflorum ) ubicados en el banco de germoplasma de la Universidad de la Amazonia, Colombia. 2015. Table 2. Daily behavior of stomatal conductance (mmol/m2/s) in copoazu ecotypes ( Theobroma grandiflorum ) from the in germoplasm bank at the University of the Amazon, Colombia. 2015.
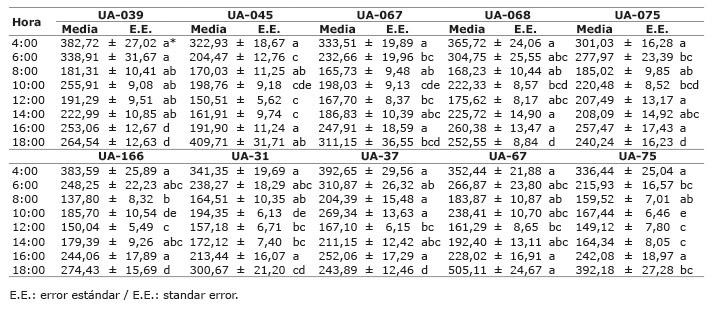
En promedio, independientemente de la hora los ecotipos que presentaron mayores valores de gs fueron UA-67, UA-039 y UA-37, una mayor conductancia estomática con frecuencia resulta en una mayor tasa de fotosíntesis, sin embargo, esto promueve un incremento de la transpiración que repercute negativamente en el estado hídrico de la planta, estas relaciones han sido demostradas por diferentes autores ( Daymond et al., 2011 ; Raja-Harun y Hardwick 1988 ; Sena-Gomes et al., 1987 ) para plantas de Theobroma cacao L. Las diferencias entre ecotipos se debió a posibles adaptaciones fisiológicas, tales como mayor densidad estomática y contenidos de clorofila, así ha sido reportado para especies como copoazú, arazá ( Eugenia stipitata ) ( Barrera et al., 2009 ) y Feijoa ( Acca sellowiana Berg) ( Naizaque et al., 2014 ). La importancia ecofisiológica de la gs se debe a la relación con el proceso de difusión de CO2 al interior de la hoja, a partir de la regulación de la apertura estomática, priorizando la ganancia de carbono en relación a la pérdida de agua ( Caplan y Yeakley, 2010 ).
En contraste con lo mencionado anteriormente, el ecotipo UA-31, seguido de UA-166, mostraron en promedio una menor gs, este comportamiento puede asociarse a un mecanismo adaptativo en regiones donde la humedad relativa es baja, por lo que, para la conservación del agua se realiza a través de la reducción de la gs, a pesar de que se correlaciona con una reducción en la asimilación de carbono ( Maherali et al., 2008 ). De acuerdo con Almeida et al. (2014) , existe una relación directa entre la transpiración y la conductancia estomática, este complemento se ha evidenciado en diferentes especies del género Theobroma incluida T. grandiflorum . Asimismo, se ha encontrado que una amplia proporción de la variación observada en la tasa de fotosíntesis en clones de cacao, podría ser explicada por la variación en la conductancia estomática ( Daymond et al., 2011 ).
La gs presentó una correlación negativa con la temperatura (-0,84; P<0,0001), radiación (-0,91; P<0,0001) y DPV (-0,94; P<0,0001), indicando que un incremento en alguna de estas variables tendría un efecto negativo sobre el intercambio gaseoso del copoazú, en tal sentido diversos autores han encontrado relaciones similares, por ejemplo, Joly y Hahn (1989) encontraron que las altas temperaturas conducen una reducción de la conductancia estomática y una disminución de la fotosíntesis; por otra parte, Balashimha et al. (1991) , Baligar et al. (2008) y Bobich et al. (2010) , encontraron correlaciones negativas entre DPV y la gs en Theobroma cacao L., y otras especies perennes, planteando que la fotosíntesis decrece significativamente con el aumento del DPV.
Una tendencia contraria se presentó para la humedad relativa (0,90; P<0,0001), al respecto Daymond et al. (2011) al evaluar la variación genotípica en la fotosíntesis del cacao y su relación con la gs, destacaron la influencia de la humedad relativa sobre la fotosíntesis. Las variaciones de las condiciones climáticas durante el día repercuten en procesos fisiológicos, se registró los mayores valores de temperatura y DPV al medio día ( Figura 1 ). Los valores encontrados en este estudio para DPV al medio día responden a las condiciones de déficit hídrico debido a la alta radiación ( Oren et al., 1999 ).
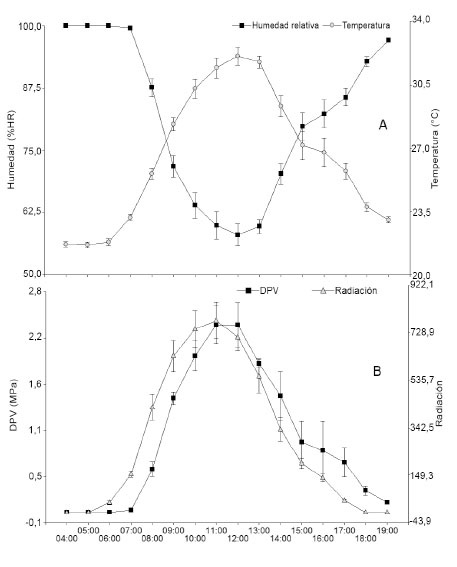
Figura 1 Tendencia de las variables ambientales durante las horas de muestreo (n=30 días) en el Centro de Investigaciones Macagual Cesar Augusto Estrada González de propiedad de la Universidad de la Amazonia, Colombia. 2015.A. Temperatura, humedad relativa. B. Déficit de presión de vapor, radiación. Figure 1. Environmental variables trend during the hours of sampling at the Research Center of Macagual Cesar Augusto Estrada González owned by the University of Amazonia, Colombia. 2015. A. Temperature, relative humidity. B. Vapor pressure déficit, radiation.
Se ha planteado que si el déficit de presión de vapor es alto, dado por una alta temperatura y una baja humedad, tendrá efectos negativos en la conductancia estomática y la tasa fotosintética ( Bobich et al., 2010 ), característica presentada en la mayoría de los ecotipos. En este sentido se ha sugerido que existe una estrecha correlación entre la conductancia y la fotosíntesis en un amplio rango de condiciones ambientales, ya que los estomas responden a los cambios ambientales como la radiación y el déficit de presión de vapor ( Lombardozzi et al., 2012 ).
A nivel de ecotipo se presentaron diferencias en los contenidos de pigmentos fotosintéticos, al igual sobre las estrategias de adaptación relacionadas con la gs, debido a la variación climática diaria que afectó la conductancia estomática.














