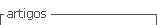Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Agronomía Mesoamericana
versão On-line ISSN 2215-3608versão impressa ISSN 1659-1321
Agron. Mesoam vol.21 no.2 San Pedro Dez. 2010
Nota Técnica
Reducción de la cantidad de Vibrio mimicus con calor o ácido acético en huevo de tortuga (Lepidochelys olivacea)1
Mónica Pereira-Zamora2, Eric Wong-González2
1 Tesis para optar por el grado de licenciada en Tecnología de Alimentos
2 Escuela de Tecnología de Alimentos, Centro Nacional de Ciencia y Tecnología de Alimentos, Universidad de Costa Rica, San José, Costa Rica. mpereira@griffithlaboratories.com; eric.wong@ucr.ac.cr (autor para correspondencia).
Dirección para correspondencia
Resumen
Reducción de la cantidad de Vibrio mimicus con calor o ácido acético en huevo de tortuga (Lepidochelys olivacea). Este estudio se realizó en el Centro Nacional de Ciencia y Tecnología de Alimentos en el año 2000, con el fin de determinar la reducción de Vibrio mimicus en huevo de tortuga lora utilizando calor o ácido acético. Para ellos se determinó el tiempo de coagulación a diferentes temperaturas o niveles de pH con el fin de seleccionar los que podían utilizarse para la reducción del patógeno sin afectar las cualidades sensoriales del huevo crudo. Los huevos inoculados con Vibrio mimicus con cargas superiores a 6,0 log10UFC/g, fueron tratados con las diferentes alternativas de inmersión en agua caliente o soluciones de ácido acético por un tiempo determinado. Los tratamientos con calor (45, 55 ó 65ºC por 20 minutos) lograron reducciones entre 1,4 y > 6,0 log10UFC/g, mientras que la inmersión en ácido acético (pH 3,0; 3,5; 4,0 ó 4;5 por una hora) sólo logró reducciones entre 0,2 y 1,5 log10UFC/g causadas probablemente por la neutralización observada del pH en el tiempo.
Palabras clave: Patógenos acuáticos, inocuidad, destrucción microbiana, ácido acético, pasteurización.
Abstract
Reduction of Vibrio mimicus using heat or acid on turtle eggs (Lepidochelys olivacea). This research was conducted at the National Center for Food Science and Technology, in 2000, to determine the reduction of Vibrio mimicus in lora turtle eggs treated with heat or acetic acid. Coagulation time at different temperatures and pH levels were determined to select treatments that could be used to reduce pathogen abundance without diminishing raw egg’s organoleptic characteristics. Eggs inoculated with Vibrio mimicus levels higher than 6.0 log10CFU/g were treated with different alternatives of immersion in hot water or acetic acid solutions. Heat treatments (45, 55 or 65ºC for 20 min) produced reductions ranging from 1.4 to > 6.0 log10CFU/g, while immersion in acid (pH 3.0, 3.5, 4.0 or 4.5 for one hour) only provided reductions between 0.2 and 1.5 log10CFU/g, probably due to the observed neutralization of pH over time.
Key words: Aquatic pathogen, food safety, microbial destruction, acetic acid, pasteurization.
Introducción
Los huevos de tortuga lora, provenientes del Refugio Nacional de Vida Silvestre de Ostional, Santa Cruz, Guanacaste, son comercializados en Costa Rica por la Asociación de Desarrollo Integral de Ostional (ADIO). Se estima que la cantidad de huevos extraídos y comercializados durante cada arribada representa un 1,4% (cerca de 500 000 huevos) del total de éstos desovados por las tortugas (Morera 2000). Los huevos se distribuyen en comercios y restaurantes ubicados en todo el país. Las ventas en el Valle Central representan más de un 60% del total de huevos comercializados, lo que comprueba la gran aceptación que tiene este producto entre los habitantes del Área Metropolitana (Morera 2000).
El consumo de huevos de tortuga representa un problema de salud pública porque éstos pueden estar contaminados con bacterias patógenas propias de los ambientes marinos presentes en la arena donde se desovan los huevos. Se ha comparado la presencia de vibrios enteropatógenos: V. parahaemolyticus, V. fluvialis, V. damsela y V. furnisii , en cieno del Golfo de Nicoya, Puntarenas, Costa Rica (García y Antillón 1990). Estudios realizados indican que un alto porcentaje de las cepas de V. mimicus, aisladas de ambientes acuáticos, juegan un papel significativo como causantes de enfermedades intestinales (Chowdhury et al. 1989, Alam et al. 1996).
Los huevos de tortuga representan un factor de riesgo para la salud de los consumidores pues se consumen crudos sin ningún tratamiento previo (Campos et al. 1996). Los autores mencionados anteriormente indican, además, que los huevos pueden causar diarrea provocada por el V. mimicus. Esta bacteria se aisló de todos los nidos muestreados y en un 47% de los huevos analizados de la de arribada (Acuña et al. 1999). Los brotes de gastroenteritis asociados con el consumo de mariscos ocasionados por V. mimicus han llevado a considerar a este vibrio como un patógeno de interés para la salud pública (Alam et al. 1996). Entre 1991 y 1994, en Costa Rica, se reportaron 33 casos de diarrea por V. mimicus y todas las cepas clínicas produjeron la toxina colérica (Campos et al. 1996). Todo lo mencionado anteriormente demuestra que el V. mimicus contamina los huevos de tortuga in situ, por lo que resulta importante estudiar e implementar alternativas tecnológicas que destruyan o reduzcan la bacteria para garantizar la inocuidad de los huevos sin afectar sus cualidades organolépticas. De acuerdo con la FDA (2001), es importante que las alternativas tecnológicas que se apliquen en el procesamiento de productos alimenticios con el objetivo de garantizar su inocuidad, logren al menos una reducción de 5 log10 UFC/g de las bacterias patógenas de mayor significancia en el alimento en cuestión.
En un estudio realizado, se demostró que el V. mimicus se reproduce en la superficie externa de la cáscara del huevo de tortuga lora, pero, sin embargo, no es capaz de penetrarla después de 72 horas de incubación a 25ºC (Pereira et al. 2007), condiciones similares a las aplicadas durante la comercialización de los huevos. Esto significa, como señalan los autores, que cualquier tratamiento que se aplique para reducir la contaminación del vibrio, y mejorar la inocuidad de los huevos, debe aplicarse en su superficie exterior. Por otra parte, se ha demostrado que la clara y yema del huevo de tortuga lora constituyen medios de cultivo adecuados para la reproducción del vibrio (Pereira y Wong 2008). Esto implica que cualquier contacto del interior con la cáscara, producto del mal manejo de los huevos, o de su apertura, puede favorecer la multiplicación de la bacteria a niveles peligrosos.
La aplicación de calor en la conservación de alimentos es ampliamente conocida, principalmente por su efecto destructor de microorganismos y enzimas (Fellows 1994). En el caso de los huevos, se utilizan tratamientos moderados de pasteurización (menos de 70ºC), pues a temperaturas elevadas pueden afectarse sus cualidades organolépticas y provocar la coagulación de la clara (Cunningham 1973).
Se han recomendado diversos tratamientos térmicos para los huevos con cáscara, por ejemplo, el calentamiento en un baño de agua a 54,4ºC durante 30 minutos (Frazier y Westhoff 1993). Todos los miembros del género Vibrio son sensibles al calor y mueren rápidamente cuando se exponen a temperaturas elevadas (Madden 1988).
El ácido acético se encuentra entre los ácidos orgánicos más utilizados debido a sus propiedades de solubilidad, sabor y baja toxicidad en el control de microorganismos. Además es una sustancia naturalmente presente en diversos alimentos, por lo que es reconocido como un compuesto GRAS (generalmente reconocido como seguro) y la ingestión diaria permisible (ADI) es ilimitada. Su pKa es de 4,75, por lo que se considera eficaz hasta niveles de pH cercanos a 4,5 (Wi ley 1997).
Diversos autores han demostrado la sensibilidad de los vibrios a diferentes ácidos. Por ejemplo, Dalsgaard et al. (1997) encontraron una reducción en los niveles de V. cholerae de tres logaritmos, en diferentes alimentos con un 3,5% y 5% de jugo de limón después de 120 minutos. Para el caso específico del ácido acético, se ha reportado que la inmersión de hojas de lechuga contaminadas artificialmente con 106- 107 NMP/g de V. cholerae O1 en soluciones con un 0,2% y 0,3% durante quince minutos, logró reducciones a niveles por debajo de 0,5 NMP/g (Uboldi y Porto 1996). Wong (1995), reportó reducciones mayores a 5 log10 UFC/g de V. cholerae en soluciones de ácido acético con diferentes niveles de pH (4,5; 5,0 y 5,5) después de una hora de contacto.
Con el fin de proponer una alternativa tecnológica de procesamiento que garantice la inocuidad de los huevos de tortuga sin afectar significativamente sus características organolépticas, el objetivo fue determinar el efecto de la aplicación de calor o ácido acético sobre el número de Vibrio mimicus en huevos de tortuga lora.
Materiales y métodos
El trabajo experimental se llevó a cabo en el año 2000, en el Laboratorio de Microbiología del Centro Nacional de Ciencia y Tecnología de Alimentos (CITA), localizado en la Ciudad Universitaria Rodrigo Facio de la Universidad Costa Rica.
Los huevos de tortuga lora se obtuvieron del Refugio Nacional de Fauna Silvestre Ostional ubicado en la costa del Pacífico en Ostional, Santa Cruz, Guanacaste (clima tropical en época lluviosa). Éstos fueron recolectados durante los tres días siguientes después de declararse oficial el evento de desove, cuando es legal recolectar los huevos. Para la recolección de la muestra la llevó a cabo el siguiente procedimiento de recolección: se extrajeron los huevos de los nidos y se colocaron en bolsas plásticas limpias y cerradas. Para su transporte al laboratorio, los huevos se colocaron en una hielera a una temperatura entre 5-10ºC por un periodo de diez horas. Una vez en el laboratorio se refrigeraron (5-7ºC) y se utilizaron y/o analizaron en menos de 72 horas.
La cepa de Vibrio mimicus que se usó para la inoculación artificial de los huevos, fue obtenida de la bacterioteca del Instituto Costarricense de Investigación y Enseñanza en Nutrición y Salud (INCIENSA), y corresponde al códigoT4, es no toxigénica (ctxA-) y fue aislada en Costa Rica de huevos de tortuga lora. Esta cepa fue mantenida en medio Cary-Blair durante todo el estudio. Dos días antes de realizar las pruebas, se tomó una asada de este medio y se suspendió en caldo infusión cerebro y corazón (CICC) y después de 18-24 horas de incubación a 37ºC se pasó a tubos con agar tripticasa y soya inclinado (ATS), los cuales se incubaron a 37ºC para obtener el cultivo fresco. El inóculo se preparó a partir del cultivo fresco con 18 horas de incubación tomando asadas que se suspendieron en solución salina al 0,85% cuya turbidez se comparó con el patrón de Mc.Farland #05 (1,5 x 108 UFC/ml). Se confirmó la viabilidad del inóculo mediante su crecimiento en agar TCBS. La inoculación de los huevos se realizó colocándolos diez minutos en un litro de solución salina al que se agregó 10,0 ml del inóculo, para obtener un número inicial en los huevos de aproximadamente 106 UFC/g.
Para los recuentos de V. mimicus en los huevos (número inicial inoculada o final después de tratamientos) se procedió de la siguiente manera: se tomó cada huevo y se pesó en una bolsa estéril, se agregó el volumen de agua peptonada alcalina (APA) necesario para obtener una relación peso del huevo-diluyente de 1:10 y se frotó manualmente la superficie durante dos minutos sin romper el huevo para liberar todas las bacterias a la solución. A partir de ésta se hicieron diluciones decimales seriadas en APA. De cada dilución se inoculó 0,1 ml por el método de esparcimiento en placas con agar TCBS, por duplicado, y se incubaron a 37ºC durante 18-24 h. En aquellos casos en que se esperaba un recuento inicial muy bajo, se procedió a inocular 0,2 ml de la primera dilución (10-1) en cinco placas de agar TCBS con el fin de obtener una mayor sensibilidad en el recuento. Después del periodo de incubación, se procedió a contar las colonias típicas. Las reducciones se calcularon por diferencia entre el recuento inicial y final y se reportaron como log10 UFC/g.
Para determinar el tiempo de coagulación a diferentes temperaturas se colocaron 24 huevos en agua en un baño de temperatura regulada a 45, 50, 55, 60, 65 ó 70 ºC. Se tomaron, en cada caso, dos huevos cada 10 minutos por un lapso de dos horas. Cada muestra se analizó visualmente para determinar la presencia de coagulación, definida como un cambio apreciable en las características de la yema o clara (color blanco) en comparación con un huevo crudo. El tiempo de coagulación, para cada temperatura, se definió como el tiempo anterior al tiempo en que se observó coagulación. De forma análoga, se determinó el tiempo de coagulación para soluciones de diferente pH, ajustado a 3,0; 3,5; 4,0 y 4,5 con ácido acético comercial utilizando un pHímetro. En este caso, se registró, además, el pH inicial (cero h) y el pH final (dos horas). Para determinar el efecto de la inmersión en agua caliente se utilizó un diseño irrestricto aleatorio con tres tratamientos. Para ello se colocaron tres huevos inoculados en baños con temperatura controlada a 45, 55 ó 65ºC y se determinó el recuento final de V. mimicus después de 20 minutos. Se realizó un análisis de regresión para estudia r la tendencia del recuento en función de la temperatura. En el caso de las soluciones ácidas, se utilizó un diseño similar y se realizó un procedimiento análogo colocando tres huevos en soluciones de pH 3,5; 4,0 ó 4,5 durante una hora. Para este caso se aplicó un análisis de covariancia para estudiar la tendencia del recuento en función del pH. El pH final se utilizó como covariable para corregir el efecto del cambio en el pH durante los tratamientos. Ambos experimentos se realizaron por triplicado y los análisis de resultados se efectuaron utilizando el programa estadístico SPSS 8.0 para Windows (SPSS Inc. 1998).
Con base en los resultados se escogió la mejor alternativa para reducir la presencia de V. mimicus en los huevos. Se realizó una evaluación sensorial de los huevos tratados con la alternativa escogida (55ºC por 20 min) para determinar su efecto sobre las características organolépticas. Para esto se preparó una salsa especial, conocida como "sangrita", utilizando salsa de tomate tipo "Ketchup", salsa de tomate natural, culantro y cebolla picados, salsa tip o inglesa y sal. Tanto los huevos tratados como sin tratar (control) se sirvieron en recipientes de vidrio cubiertos por esta salsa. Se aplicó una prueba triangular de diferencia, de acuerdo con Watts et al. (1992) presentando a 22 jueces entrenados y consumidores de huevo de tortuga, tres muestras al azar (dos iguales y una diferente), y solicitando la escogencia de la muestra diferente. Se empleó luz roja para evitar errores de asociación y enmascarar las variaciones normales de tamaño y color que presentan los huevos. Se aplicó el análisis estadístico asociado con la prueba triangular que consiste en demostrar si los jueces aciertan al azar o en realidad perciben una diferencia , con base en un modelo que responde a una distribución binomial (Watts et al. 1992).
Resultados y discusión
Debido a que el huevo de tortuga lora se consume crudo, resulta importante que los tratamientos que se apliquen para garantizar su inocuidad no afecten las cualidades sensoriales, principalmente, que no causen la coagulación de sus componentes. Para estudiar el efecto de una pasteurización leve (calor) sobre la destrucción del Vibrio mimicus en los huevos era necesario definir el ámbito de temperaturas que podían ensayarse, por lo que se hizo una prueba de coagulación a temperaturas entre 45 y 70ºC.
Los tiempos de coagulación determinados presentaron un comportamiento normal, pues disminuyen conforme aumenta la temperatura (Figura 1). Estos tiempos (10 a 70 minutos) son relativamente altos si se comparan con los valores reportados para la clara del huevo de gallina, la cual coagula a 62ºC en menos de 10 minutos (Belitz y Grosch 1988). En ese sentido, la clara del huevo de tortuga lora es más termoestable que la del huevo de gallina, probablemente por presentar un menor contenido de proteína y un mayor contenido de agua (Mora 1995).
Por otra parte, es importante considerar que el tiempo de aplicación de calor influye en aspectos de eficiencia y costos de proceso, por lo que resulta importante escoger el tiempo más corto posible para los tratamientos. Con base en ésto, y lo discutido anteriormente, para evaluar el efecto del calor sobre la reducción del vibrio en los huevos, se escogió ensayar tres temperaturas: 45, 55 y 65ºC, por un tiempo de 20 minutos (tiempo máximo que se puede aplicar a 65ºC). Se decidió mantener el tiempo de tratamiento constante para efectos de comparación.
Se determinó un efecto significativo de la temperatura (p>0,0001) indicando una tendencia a una mayor reducción al aumentar la temperatura (Cuadro 1). Esta significancia es probablemente causada por el hecho de que a 45 ºC se observó una reducción de tan sólo 1,4 log10 UFC/g, mientras que a 55 y 65ºC se observó una reducción total del inóculo inicial (> 6,0 y 5,5 log10 UFC/G respectivamente).
El tratamiento térmico a 45ºC resultó insuficiente para eliminar la bacteria patógena de los huevos. Es probable que a esta temperatura no se logren los efectos letales sobre las células bacterianas, o que el tiempo sea insuficiente. Este resultado concuerda con Shultz et al. (1984) quienes reportaron un tiempo superior a los 60 minutos como el requerido para lograr una reducción 6 log10 UFC/g de Vibrio cholerae a 49ºC en carne de cangrejo. Por otro lado, Boutin et al. (1982) reportaron reducciones del orden de 1,7 log10 UFC/g de Vibrio cholerae en ostras enlatadas y tratadas a 48,9ºC por 60 minutos.
Los resultados a 55 y 65ºC coinciden, de manera general, con lo que han reportado otros autores en otros alimentos en los que se ha aplicado una pasteurización leve. Por ejemplo, el mismo estudio de Boutin et al. (1982) reportó reducciones mayores que 5 log10 UFC/g cuando la temperatura se elevó a 57,2ºC y se calentó el mismo producto por 30 minutos.
Considerando los efectos negativos, ampliamente reportados en la literatura, que causa la aplicación de calor sobre las cualidades nutritivas y sensoriales de los alimentos, es claro que se prefiere aplicar la temperatura más baja posible que logre la meta planteada. En este caso, para cumplir con las disposiciones de la FDA (FDA 2001) en cuanto a reducción de patógenos, basta con aplicar 55ºC por 20 minutos para lograr una reducción de 5 log10 UFC/g.
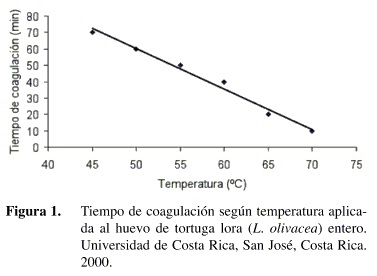
De forma análoga al estudio del efecto del calor, se realizó un análisis para determinar el efecto de la inmersión de los huevos en soluciones de ácido acético de diferente pH. En el Cuadro 2 se muestran los tiempos de coagulación determinados para cuatro niveles de pH (3,0; 3,5; 4,0 y 4,5). A pesar del conocido efecto desnaturalizante de los ácidos sobre las proteínas (Belitz y Grosch 1988), no hubo coagulación evidente de la clara del huevo de tortuga a ninguno de los niveles iniciales de pH en las soluciones aplicadas por dos horas. Esto demuestra que el efecto del ácido sobre la clara es menor que el efecto que produce el calor. Esto coincide con el hecho de que la cáscara funciona como membrana semipermeable para la entrada de ciertas sustancias, pero no es un aislante que impida la penetración de calor (Mora 1995).
Con el fin de determinar si los iones hidronio eran capaces de atravesar la cáscara, se midió el pH de una clara y de una yema control, cuyos valores fueron de 8,08 y 6,93, respectivamente. Después de sumergir los huevos durante una hora en una solución de ácido acético de pH 3,0, el pH de la clara fue de 6,23 y el de la yema de 6,86 y al cabo de dos horas, fue de 5,67 para la clara y 6,72 para la yema. Esto demuestra que los iones hidronio migran al interior del huevo probablemente por difusión, como sucede con el agua y el oxígeno (Acuña 1980). En el caso de la yema, la reducción del pH no es tan notoria.
Otro efecto importante que se observó durante el estudio de coagulación fue el hecho de que el pH no se mantuviera constante a través del tiempo (Cuadro 2). Este comportamiento coincide con el descrito por Wong (1995) en un estudio realizado con pianguas. Esta neutralización puede deberse a la reacción entre el carbonato de calcio presente en la cáscara y el ácido. Se debe mencionar que esta reacción produce un debilitamiento de la cáscara, el cual fue evidente para la solución de pH 3,0, donde se observó gran producción de burbujas de CO2 y la formación de un sedimento.
Por otro lado, el nivel de pH pareciera afectar la velocidad de la reacción de neutralización (Cuadro 2). Por ejemplo, para la solución con un pH inicial de 3,0 se tienen niveles de pH que sobrepasan los valores obtenidos para la solución de pH 3,5. Esto provocó que se descartara la solución de un nivel de pH 3,0 para medir el efecto sobre la reducción del V. mimicus, porque se alcanzan valores de pH elevados en poco tiempo, con una mayor cantidad de vinagre, y con un efecto adverso sobre las características de la cáscara.
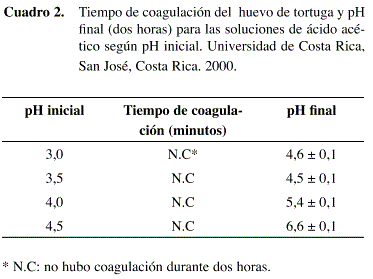
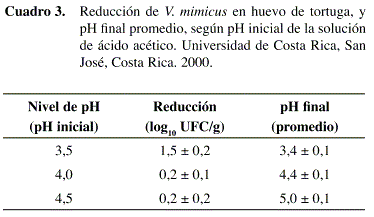
En síntesis, los niveles de pH que se evaluaron sobre la reducción de Vibrio mimicus fueron 3,5; 4,0 y 4,5. Como se observa en el Cuadro 3 las reducciones determinadas varían entre 0,2 y 1,5 log10 UFC/g. Se determinó un efecto significativo del nivel de pH (p=0,0081) causado probablemente por la diferencia entre la reducción observada a pH de 3,5 en comparación con los otros niveles donde la reducción fue prácticamente nula. Los resultados concuerdan con Jay (1994), quien afirma que el efecto letal del ácido aumenta conforme el pH se aleja del valor óptimo de crecimiento (que para el V. mimicus es cercano a 7,0). Además, entre menor es el pH, mayor es la proporción de ácido no disociado, lo que aumenta la efectividad del ácido acético como agente antimicrobiano (ICMSF 1980).
En general, estos resultados no corresponden con lo esperado porque las reducciones son relativamente bajas, si se comparan con las obtenidas por otros autores como Rivera, et al. (1994) quienes lograron reducir el V. cholerae en al menos 7 log10 UFC/g en hojas de lechuga colocadas durante 30 min en una solución con jugo de limón (pH de 3,4). Sin embargo, sí coincide con lo reportado por Heath y Wallace (1978) para los huevos de gallina, donde una solución de ácido acético diluida no consiguió eliminar la flora contaminante de la superficie y, por el contrario, disminuyó el espesor y la calidad de la cáscara.
De acuerdo con Wong (1995), una solución de ácido acético con un nivel de pH de 4,5 logró una reducción de V. cholerae de 5 log10 (UFC/ml) después de una hora. Lo anterior sugiere que la cáscara del huevo de tortuga tiene un efecto protector sobre el V. mimicus que podría ser resultado de su superficie irregular, lo que impide que el ácido entre en contacto con las células microbianas. Además, la reacción que se da entre los componentes de la cáscara y el ácido, podría crear un microambiente con un pH neutro en las inmediaciones de la cáscara, el cual puede brindar protección contra los efectos inhibitorios del pH, similar al efecto buffer que ha sido reportado en otros alimentos (Beuchat 1975).
El factor más importante y de mayor peso a considerar en la elección de una de las dos alternativas evaluadas es la capacidad para reducir el V. mimicus, que es el objetivo principal de su aplicación. Con respecto a ésto, el tratamiento térmico a 55ºC durante 20 min logra una reducción de más de seis logaritmos en el recuento, lo que se considera satisfactorio si se toma en cuenta que los niveles naturales de esta bacteria probablemente nunca sobrepasarían ese orden. Por el contrario, la inmersión en una solución de ácido acético de pH 3,5 a temperatura ambiente, no logra una reducción considerable en el recuento y no asegura la calidad microbiológica de los huevos de tortuga.
Los panelistas no detectaron una diferencia significativa (p=0,1630) entre los huevos tratados y sin tratar. Solamente 10 de los 22 jueces acertaron en la prueba triangular por lo que se puede afirmar que los huevos a los que se les aplicó el tratamiento escogido fueron percibidos igual que los huevos sin tratar.
Se determinó que el calor no afectó ni el sabor, ni la textura, ni otras características sensoriales de los huevos con sangrita. Además, un 60% de los jueces que acertaron la diferencia consideraron que ésta era "ligera", un 20% la consideró como "moderada" y el restante 20% la clasificó como "mucha", lo que refleja que la prueba tenía una dificultad elevada y que para la mayoría de los que detectaron diferencia, ésta era más bien leve. El resultado de esta prueba indica que la alternativa tecnológica escogida fue apropiada para tratar los huevos de tortuga, garantizó su inocuidad, y mantuvo las características organolépticas deseadas en el alimento preparado.
Agradecimiento
Agradecemos a la M.Sc. Elena Campos del INCIENSA por su aporte en la realización de esta investigación y por suministrar la cepa de Vibrio mimicus que fue utilizada.
Literatura citada
Acuña, R. 1980. Aspectos de la fase terrestre de la tortuga lora (Lepidochelys olivacea). Tesis M.Sc. en Biología. Universidad de Costa Rica, Escuela de Biología. San José. p. 115. [ Links ]
Acuña, M; Díaz, G; Bolaños, H; Barquero, C; Sánchez, O; Sánchez, L; Mora, G; Chaves, A; Campos, E. 1999. Sources of Vibrio mimicus contamination of turtle eggs. Applied and Environmental Microbiology 65(1):1-3. [ Links ]
Alam, M; Miyoshi, S; Yamamoto, S; Tomochika, K; Shinoda, S. 1996. Expression of virulence-related properties by, and intestinal adhesiveness of, Vibrio mimicus strains isolates from aquatic environments. Applied and Environmental Microbiology 62(10):3871-3874. [ Links ]
Belitz, H; Grosch, W. 1988. Química de los alimentos. 2 ed. Acribia, Zaragoza. p. 1134 [ Links ]
Beuchat, LR. 1975. Environmental factors affecting survival and growth of Vibrio parahaemolyticus. Journal of Milk Food Technology 38:476-780. [ Links ]
Boutin, B; Bradshaw, J; Stroup, W. 1982. Heat processing of oysters naturally contaminated with Vibrio cholera Serotype 01. Journal of Food Protection 45(2):169-172. [ Links ]
Campos, E; Bolaños, H; Acuña, MT; Díaz, G; Matamoros, MC; Raventós, H; Sánchez, L; Sánchez, O; Barquero, C. 1996. Vibrio mimicus diarrhea following ingestion of raw turtle eggs. Applied and Environmental Microbiology 62(4):1141-1144. [ Links ]
Chowdhury, M;Yamanaka, H; Miyoshi, S; Aziz, K; Shinoda, S. 1989. Ecology of Vibrio mimicus in aquatic environments. Applied and Environmental Microbiology. 55(8):2073-2078. [ Links ]
Cunningham, FE. 1973. Egg product pasteurization. In Egg Science and Technology. 4 ed. AVI Publishing Company, Connecticut. p. 591. [ Links ]
Dalsgaard, A; Reichert, P; Mortensen, H; Sandström, A; Kofoed, P; Larsen, J; Mølbak, K. 1997. Application of lime (Citrus aurantifolia) juice to drinking water and food as a cholera-preventive measure. Journal of Food Protection 60(11):1329-1333. [ Links ]
Fellows, P. 1994. Tecnología del procesado de los alimentos: principios y prácticas. Acribia, Zaragoza. p. 708. [ Links ]
FDA (Food and Drug Administration). 2001. Final rule, HACCP procedures for the safe and sanity processing of juice, Federal register 66(13):sp. [ Links ]
Frazier, W;Westhoff, D. 1993. Microbiología de los alimentos. 4.ed. Acribia, Zaragoza. p. 681. [ Links ]
García, V; Antillon, F. 1990. Aislamiento de vibrio enteropatógenos de bivalvos y cieno del Golfo de Nicoya, Costa Rica. Revista de Biología Tropical 38(2):437-440. [ Links ]
Heath, JL; Wallace, J. 1978. Dilute acid immersion as a method of cleaning shell eggs. Poultry Science 57:149-155. [ Links ]
ICMSF (International Comission on Microbiological Specifications for Foods). 1980. Ecología Microbiana de los Alimentos 1. Acribia, Zaragoza. p. 274. [ Links ]
Jay, J. 1994. Microbiología moderna de los alimentos. 3 ed. Acribia, Zaragoza. p. 672. [ Links ]
Madden, J. 1988. Vibrio. Food Technology 42(4):191-192. [ Links ]
Mora, R. 1995. Composición química del huevo de tortuga lora (Lepidochelys olivacea) y evaluación de su calidad física y microbiológica durante su almacenamiento. Tesis Lic. en Tecnología de Alimentos. Universidad de Costa Rica, Escuela de Tecnología de Alimentos. San José. p. 69. [ Links ]
Morera, R. 2000. Informe de extracción y comercialización de huevos de la tortuga marina lora del Pacífico durante las arribadas de 1999 en playa Ostional. ADIO, Ostional, Guanacaste. p. 13. [ Links ]
Pereira, M; Hernández, F; Wong, E. 2007. Penetración de Vibrio mimicus a través de la cáscara del huevo de tortuga lora (Lepidochelys olivacea). Agronomía Mesoamericana 18(2):247-254. [ Links ]
Pereira, M; Wong, E. 2008. Sobrevivencia de Vibrio mimicus en la clara y en la yema del huevo de tortuga lora (Lepidochelys olivacea). Agronomía Mesoamericana 19(2):261-266. [ Links ]
Rivera, P; Monge, R; Hernández, F. 1994. Susceptibility of the bacterium Vibrio cholerae to acid pH in salad vegetables: an ultraestructural view. Revista de Biología Tropical 42(2):97-100. [ Links ]
Shultz, L; Rutledge, J; Grodner, R; Biede, S. 1984. Determination of thermal death time of Vibrio cholerae in blue crabs (Callinectes sapidus). Journal of Food Protection 47(1):4-6. [ Links ]
SPPS Inc. 1998. SPSS 8.0 for Windows brief guide. Prentice Hall, New Jersey. p. 168. [ Links ]
Uboldi, E; Porto, E. 1996. Influence of different types of vinegar and of sodium hypochlorite on the survival of Vibrio cholerae in artificially contaminated lettuce leaves (Lactucca sativa) and on the natural microflora. Coletanea do Instituto de Tecnologia de Alimentos. 26(2):199-207. [ Links ]
Watts, B; Ylimaki, G; Jeffery, L; Elías, L. 1992. Métodos sensoriales para la evaluación de alimentos. Centro Internacional de Investigaciones para el Desarrollo, Ottawa. p. 152. [ Links ]
Wiley, R. 1997. Frutas y hortalizas mínimamente procesadas y refrigeradas. Acribia, Zaragoza. p. 374. [ Links ]
Wong, E. 1995. Estudio de diferentes métodos para la depuración artesanal de pianguas (Anadara tuberculosa) y su eficacia en la eliminación de Vibrio cholerae. Tesis Lic. en Tecnología de Alimentos. Universidad de Costa Rica, Escuela de Tecnología de Alimentos. San José. p. 76. [ Links ]
Recibido: 5 de febrero, 2010. Aceptado: 22 de noviembre, 2010.