Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Agronomía Mesoamericana
versão On-line ISSN 2215-3608versão impressa ISSN 1659-1321
Agron. Mesoam vol.21 no.2 San Pedro Dez. 2010
Respuesta a la aplicación de nematicida en banano en la zona de Urabá, Colombia 1
Juan David Castillo-Russi2, Mario Araya-Vargas3, Luis Fernando Patiño-Hoyos4
1 Parte de la tesis de Licenciatura del primer autor.
2 Universidad Nacional de Colombia sede Bogotá. nematodeman@hotmail.com
3 Apdo 375-7150 Turrialba, Costa Rica. mario.araya@lapavic.com.ec; marayavargas@gmail.com
4 Facultad de Ciencias Agrarias-Politécnico Colombiano Jaime Isaza Cadavid. Medellín-Colombia.lfpatino@elpoli.edu.co
Dirección para correspondencia
Resumen
Respuesta a la aplicación de nematicida en banano en la zona de Urabá, Colombia. El objetivo del presente trabajo fue determinar si los nematodos fitoparásitos afectan la producción de banano en la zona de Uraba, Colombia. El estudio se realizó en tres fincas comerciales de banano (Musa AAA) donde se aplicaron dos tratamientos. En el primer tratamiento se aplicó el nematicida ethoprop, el cual fue usado para reducir las poblaciones de nematodos fitoparásitos y el segundo tratamiento fue utilizado como control. El experimento se replicó en tres fincas en la zona de Urabá: Estadero (zona sur), Toscana (zona centro) y La Llave (zona norte) y se evaluó las poblaciones de nematodos, contenidos de raíces, daño en las raíces y variables de producción. En las tres fincas se encontró que los nematodos predominantes fueron: Radopholus similis (67-74%) y Helicotylenchus multicinctus (22-28%). El ethoprop incrementaron en 2,5 kg (P= 0,025), 2 kg (P= 0,0612) y 2,2 kg (P= 0,046) el peso del racimo y en 0,4 (P= 0,0202), 0,7 (P= 0,1994) y 0,3 (P= 0,0459) unidades el número de manos, en las fincas Estadero, Toscana y La Llave, respectivamente. Estos aumentos concuerdan con una reducción significativa en la población de nematodos fitoparásitos y un aumento en el contenido de raíces. Los resultados reflejan que los fitonematodos en las fincas comerciales donde se desarrollaron los experimentos, estan reduciendo la producción y que el control químico con nematicida es factible, sin embargo es necesario encontrar otras estrategias de manejo.
Palabras claves: Helicotylenchus multicinctus, Musa AAA, Mononchus spp., Radopholus similis.
Abstract
Response of banana to nematicide application in Urabá, Colombia. The objective of this study was to determine if plant parasitic nematodes affect banana production in Urabá, Colombia. The study was conducted in three commercial banana (Musa AAA) farms were two treatments were applied. Treatment one was the application of the nematicide ethoprop used to reduce nematode populations, and the other treatment was an untreated control. The experiment was replicated in three farms of the Urabá zone: Estadero (southern zone), Toscana (central zone) and La Llave (northern zone) where nematode population, root content, root damage and yield variables were recorded. Radopholus similis (67-74%) and Helicotylenchus multicinctus (22-28%) were the most abundant nematodes in the three farms. Ethoprop increased in 2.5 kg (P= 0.025), 2 (P= 0.0612) and 2.2 kg (P= 0.046) bunch weight and in 0.4 (P= 0.0202), 0.7 (P= 0.1994) and 0.3 (P= 0.0459) units the number of banana "hands" in Estadero, Toscana and La Llave farms, respectively. Increases in bunch weight and number of hands agree with a significant reduction in nematode population and an increase in root content. The results show that in commercial banana farms where the experiments were conducted, nematodes reduce yield and chemical control using nematicides is feasible; however, it is necessary to find other management strategies.
Key words: Helicotylenchus multicinctus, Musa AAA, Mononchus spp., Radopholus similis.
Introducción
A pesar de que Radopholus similis, Helicotylenchus multicinctus, Meloidogyne spp., Pratylenchus coffeae y Hoplolaimus spp. parasitan las raíces de banano (Musa AAA) (Speijer y De Waele 1997, Tarté y Pinochet 1981, Araya 2004), pocos estudios se han realizado al respecto en la zona bananera de Urabá.
Según Marín et al. (1998), R. similis y otros nematodos parásitos del banano llegaron a Colombia en el año de 1892 junto con la primera importación de la variedad Gros Michel procedente de Jamaica. Sin embargo, como el cultivar Gros Michel presenta resistencia moderada a R. similis (Speijer y De Waele 1997), el daño no fue muy evidente. Al ser reemplazada la variedad Gros Michel, susceptible a Fusarium oxysporum, por los clones del subgrupo Cavendish (Valery, Grande Naine y Williams) que eran resistentes a Fusarium pero más susceptibles a R. similis el daño se hizo más notorio (Jaramillo y Quirós 1984).
Radopholus similis y Helicotylenchus multicinctus son los más abundantes en la zona de Urabá (Gómez 1980, Cubillos et al. 1980, Jaramillo y Quirós 1984) y Meloidogyne spp., P. coffeae y Hoplolaimus spp. se presentan de forma esporádica.
Jaramillo y Quirós (1984) citan que Augura y la UPEB (Unión de países exportadores de banano) reportaron un incremento del 20,9% en la producción con la aplicación de nematicidas. Esta cifra concuerda con el 20% de pérdidas en rendimiento mencionada por Sasser y Freckman (1987). En Urabá pocas fincas han aplicado nematicidas porque los agricultores consideran que los nematodos fitoparásitos no generan pérdidas económicas significativas al cultivo.
En los últimos años el área cultivada ha aumentado progresivamente de 29 532 ha en el año 1999 hasta 32 327 hectáreas en el 2007. Contrariamente, se ha venido presentando una disminución en la productividad pasando de 2288 cajas/ha/año en 1999 a 1984 cajas en el 2007 (Augura 2008). Como posibles causas del descenso en la productividad, se ha planteado el deterioro del sistema radical de las plantas y su relación con los nematodos fitoparásitos.
Estudios realizados en Urabá indican que las poblaciones de nematodos presentes exceden los umbrales económicos establecidos para la aplicación de nematicida en otros países (Londoño 2003). Sin embargo, no exiten datos que demuestren que las poblaciones de nematodos reducen la producción en las plantaciones urabaenses. Por tanto, en el presente trabajo se evaluó el efecto de una aplicación de nematicida en la reducción de nematodos fitoparásitos y su impacto en el contenido de raíces y rendimiento del banano en plantaciones comerciales de Urabá, Colombia.
Materiales y métodos
El experimento se desarrolló independientemente en tres fincas del área bananera de la zona de Urabá, Colombia: Estadero (zona sur, Chigorodó), Toscana (zona centro, Carepa) y La Llave (zona norte, Apartadó). El municipio de Chigorodo está ubicado a 34 msnm, Carepa a 28 y Apartadó a 25 msnm. La temperatura promedio para la zona de Urabá es de 28 °C, humedad relativa de 87%, radiación solar de 5 horas luz, precipitación promedio anual de 2896 mm y evaporación promedio de 1996 al 2002 de 1303 mm.
Las prácticas agrícolas normales de fertilización, control de Sigatoka, deshija, protección de racimo y cosecha se realizaron en las tres fincas. La finca Estadero presenta suelo arcillo arenoso (50% arena: 6% limo: 44% arcilla), con pH de 4,7, materia orgánica de 1,3%, P 34 ppm, un contenido de bases de Aluminio (Al) 0,9; Calcio (Ca) 12,1; Magnesio (Mg) 4,3 y Potasio (K) 4,3 meq/100 de suelo y una capacidad de intercambio catiónico efectiva (CICE) de 18 meq/100 de suelo. La precipitación acumulada desde setiembre de 2003 a julio de 2004 fue de 1081 mm. Esta finca carece de coberturas vegetales vivas. Asimismo la recolección de residuos de nylon utilizado para el amarre de las plantas y la incorporación de materia orgánica es esporádica.
La finca Toscana tiene un suelo de textura franco arcillosa (24% arena, 35% limo y 40% arcilla), un pH de 4,7, materia orgánica 3%, P 13 ppm, Al 1,4; Ca 9,5; Mg 4,8 y K 1,15 meq/100 g de suelo. La CICE es de 16,9 meq/100 g de suelo y la precipitación acumulada del mismo período fue de 2619 mm. La finca presenta cobertura de Vigna peduncularis (frijolillo), se aplica constantemente materia orgánica, se colecta el nylon utilizado en el amarre de plantas y el control de maleza se realizó manualmente.
La textura del suelo en La Llave es franco arcillosa (20% arena, 44% limo y 30% arcilla), con pH de 5,2, materia orgánica 2,3%, P 14 ppm, un contenido de bases de Al 0,5; Ca 18,3; Mg 6,1 y K 0,70 meq/100 g de suelo y una CICE de 25,6 meq/100 g de suelo. La precipitación acumulada del mismo período fue de 1803 mm. Se está comenzando a establecer V. peduncularis (frijolillo), la aplicación de materia orgánica es semestral y se hacen aplicaciones continuas de herbicidas alrededor de la planta y no es frecuente la recolección de nylon del suelo.
En cada finca se seleccionaron dos hectáreas que fueron divididas en 16 parcelas cada una de 1250 m² con 225-230 unidades de producción. Se evaluaron dos tratamientos; el testigo sin aplicación y la adición de ethoprop en un diseño de bloques completamente al azar con ocho repeticiones por tratamiento.
La aplicación del ethoprop se hizo con la bomba de espalda granuladora manual Swissmex específica para el producto y calibrada a la dosis recomendada de 3 g i.a. por punto de aplicación, depositándolo sobre la superficie del suelo, de la base del pseudotallo hasta 40 cm en semicírculo, dirigido al hijo de sucesión.
Para estimar poblaciones de nematodos y el daño causado por éstos a la raíz, se tomaron muestras con un palín en la base del pseudotallo en el intermedio de la planta recién florecida y su hijo de sucesión, colectando todas las raíces presentes en un hoyo de 17 cm de longitud, 17 cm de ancho y 25 cm de profundidad, con un volumen total de 7225 cm³ de suelo. Cada muestra se conformó por las raíces de cuatro plantas en cada una de las parcelas experimentales. Se realizaron monitoreos mensuales de raíces durante diez meses, y se realizó un monitoreo inicial antes de la aplicación del nematicida.
Para la evaluación de raíces, se lavó la muestra proveniente de campo y se separó en funcionales (raíces blancas, cremosas y con lesiones causadas por nematodos) y no funcionales (raíces completamente necrosadas) y se registró su peso. El porcentaje de daño en raíces funcionales se estimó siguiendo la metodología descrita por Moens et al. (2001). Se seleccionaron aleatoriamente 10 raíces funcionales y se cortaron en segmentos de 10 cm, los cuales se partieron a la mitad de manera longitudinal y se evaluó la longitud (cm) del tejido necrosado en ambas mitades. Posteriormente, en los 10 cm de longitud se sumó el daño de los 10 segmentos y se dividió entre los mismos. Por último, se multiplicó por 100 para obtener el porcentaje de daño por muestra.
La extracción de nematodos se llevó a cabo a través del método de licuado-tamizado (Taylor y Loegering 1953) modificado por Araya (2002). Las raíces funcionales se picaron en trozos de 2 a 3 cm, se homogeneizaron y se tomó una muestra aleatoria de 25 g la cual se maceró con 300 ml de agua destilada en una licuadora durante 10 segundos en alta y baja velocidad, respectivamente. La suspensión de nematodos se tamizó en un juego de cribas sobrepuestas de arriba hacia abajo de 0,25/0,106/0,025 mm (No 60/140/500). El tamiz de 0,25 mm se lavó por dos minutos y el de 0,106 mm por un minuto y se colectó los nematodos en el último tamiz. Los nematodos se pasaron a un beacker que se aforó a 200 ml; posteriormente, se homogeneizó la suspensión con un inyector de burbujas durante 30 segundos y se tomó una alícuota de 5 ml para el conteo de nematodos con la ayuda de un microscopio. De cada muestra de raíces se procesaron dos submuestras y se promedió los valores para realizar el análisis estadístico. El número de nematodos se expresó por 100 g de raíces funcionales.
Se realizaron dos evaluaciones de cosecha, una previa a la aplicación del nematicida para descartar diferencias entre tratamientos y una al final para evaluar el efecto del tratamiento en dichas variables. Para esto se evaluó el peso del racimo (kg), número de manos, y de frutos de la segunda mano basal y calibre (unidades) y longitud del fruto central de la segunda mano basal (pulgadas). Del mismo modo, se evaluaron 15 racimos por parcela dando un total de 120 racimos por tratamiento.
Se calculó el área bajo la curva del número de nematodos y peso de raíces de las diez evaluaciones y al igual que los datos de cosecha por parcela se sometieron a un análisis de varianza individual por finca y combinado. La comparación de tratamientos se hizo individualmente por finca usando como término de error de la prueba de F el cuadrado medio del error conjunto de las tres fincas. El porcentaje de eficacia del ethoprop en el control de nematodos y la recuperación del sistema radical se calculó por bloque: Eficacia= ABC testigo - ABC ethoprop / ABC testigo x 100 (ABC= área bajo la curva). Los datos fueron procesados en el programa de PC-SAS versión 8,2 (SAS Institute, Inc. Cary, NC).
Resultados y discusión
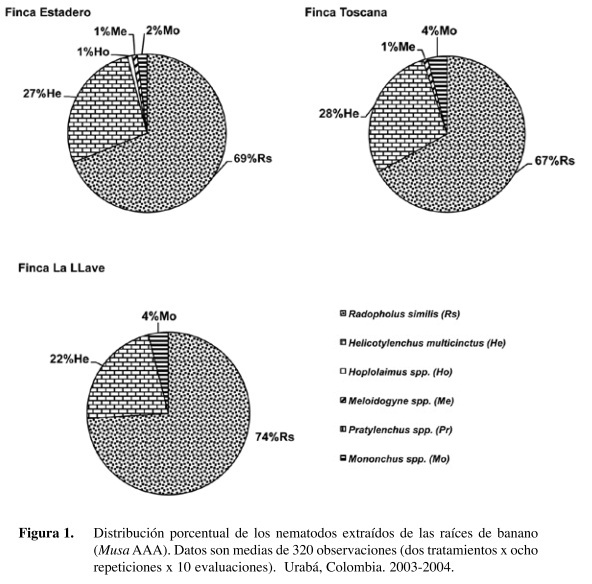
El nematodo fitoparásito predominante en las tres fincas fue R. similis (69 a 74%) seguido por H. multicinctus (22 a 27%) (Figura 1). En finca Estadero se presentaron en baja proporción poblaciones de Meloidogyne spp. (1%) y Hoplolaimus spp. (1%). Asimismo, en Toscana se presentó alrededor del 1% de Meloidogyne spp. En las tres fincas, el tercer nematodo presente en las evaluaciones de raíces fue el predador Mononchus spp. Este nematodo se encontró en mayor proporción en las fincas Toscana (214% más) y La Llave (126% más).
En las tres fincas (Cuadro 1) hubo reducción de las poblaciones de nematodos fitoparásitos y predadores (P<0,0001). En la finca Estadero, la aplicación del nematicida, no redujo las poblaciones de R. similis (P= 0,4663) ni de Mononchus spp. (P= 0,8423), pero si disminuyó poblaciones de H. multicinctus (P< 0,0001) y la población total de nematodos fitoparásitos (P= 0,0018). El nematicida redujo las poblaciones presentes en finca Toscana (P< 0,0001) y La Llave (P= 0,0118). Con una sola aplicación de nematicida se logró reducir significativamente las poblaciones de nematodos fitoparásitos a menos de 10 000 especímenes por cada 100 g de raíces durante seis meses en las tres fincas (Figura 2).
En las tres fincas, la aplicación de nematicida mejoró el contenido de raíz total (P< 0,0001) y funcional (P< 0,0001) y redujo la raíz no funcional (P= 0,0013) y el porcentaje de daño de la raíz funcional (P= 0,0005) (Cuadro 2). Dichos resultados con excepción de la raíz no funcional y el porcentaje de daño de las raíces funcionales en finca Estadero, concuerdan con lo observado en cada finca particular. Los aumentos en raíz total y funcional por planta fueron de 36,7 (P= 0,0023), 20,5 (P= 0,0594) y 33,9 g (P= 0,0092) y de 40,3 (P= 0,0008), 49,4 (P= 0,0001) y 51,8 g (P= 0,0002) para finca Estadero, Toscana y La llave, respectivamente. En las fincas Toscana y La Llave la reducción en el porcentaje de daño fue de 6,5 (P= 0,0001) y 3,6 % (P= 0,00341), respectivamente. Además, se registró menos raíz no funcional por planta en el tratamiento con nematicida, en las mismas fincas: 29 (P= 0,0025) y 17,9 g (P= 0,034), respectivamente. Entre las fincas no se encontraron diferencias estadísticamente significativas en el contenido de raíces ni en el porcentaje de daño de las raíces funcionales.
La eficacia de la aplicación de nematicida en el control de R. similis fluctuó entre el 1,8 al 41%, en H. multicinctus del 40-62% y en la población total de nematodos fitoparásitos del 25-46% (Cuadro 3). El uso de nematicida incrementó los contenidos y proporción de raíces. La eficacia en la recuperación de raíz total fluctuó del 6 al 10% y en funcional de 25 al 29%. La reducción de raíz no funcional fue de un 3 a 16% y el daño en raíces funcionales de 1,6 a 30%.
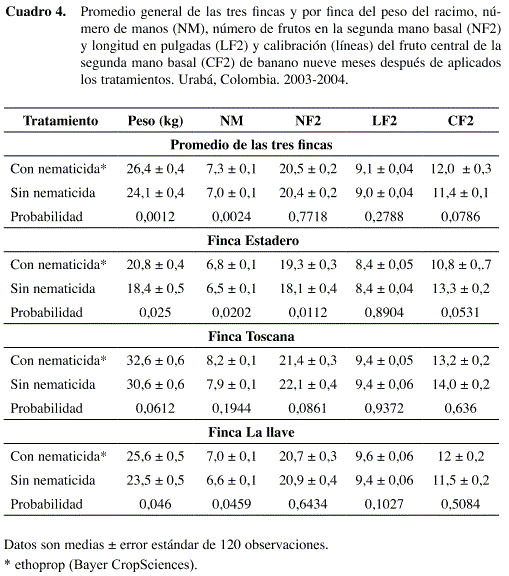
No se encontró diferencia en las variables de producción entre las parcelas testigo y las parcelas a tratar con nematicida en la evaluación de cosecha realizada antes de establecer los tratamientos (Datos no presentados). En la cosecha realizada a los nueve meses de aplicados los tratamientos, el análisis combinado de las tres fincas mostró mayor peso (P= 0,0012) del racimo y número de manos (P= 0,0024) en las áreas tratadas con nematicida (Cuadro 4). Dicho resultado es congruente con el análisis individual de cada finca. El uso del nematicida en las fincas Estadero, Toscana y La Llave incrementó en 2,5 kg (P= 0,025), 2 kg (P=0,0612) y 2,2 kg (P=0,046) el peso del racimo y en 0,4 (P= 0,0202), 0,7 (P= 0,1994) y 0,3 (P= 0,0459) unidades el número de manos, respectivamente.
La aplicación del nematicida aumentó (P= 0,0112) el número de frutos de la segunda mano solamente en la finca Estadero. El calibre (P> 0,05) y la longitud (P> 0,10) del fruto central de la segunda mano no se afectaron por la aplicación de nematicida en ninguno de los experimentos. Cuando se compararon las fincas promediando los tratamientos, el mayor peso del racimo (P< 0,0001) se encontró en la finca Toscana. Esto concuerda con mostrar un mayor número de manos (P< 0,0001), y de frutos en la segunda mano (P< 0,0001) y mayor calibración (P< 0,0001) en el fruto central de la segunda mano.
Los nematodos fitoparásitos predominantes en las tres fincas fueron R. similis y H. multicinctus lo que coincide con otros estudios realizados en banano (Gómez 1980, McSorley y Parrado 1986, Crozzoli et al. 1995, Bridge et al. 1997, Speijer y Fogain 1998, Araya et al. 2002, Araya y De Waele 2004 y Ssango et al. 2004). Sin embargo, los nematodos fitoparásitos Hoplolaimus spp. y Meloidogyne spp. también se encontraron parasitando raíces de banano pero en baja proporción. Posiblemente la causa principal de que se presentaran bajas poblaciones de estos nematodos fue por el efecto supresivo ejercido por R. similis. Radopholus similis posee un hábito de alimentación similar al de Hoplolaimus spp., con un ciclo de vida más corto, mayor potencial reproductivo y mayor afinidad con el hospedero (Thorne 1961, Marín et al. 1998). En tejido infectado por M. incognita la presencia de R. similis provocó deterioro y desintegración de las células gigantes, afectando el desarrollo y la reproducción de Meloidogyne spp. (Tarté y Pinochet 1981, Santor y Davide 1992). Adicionalmente a los nematodos fitoparásitos se encontró en las tres fincas nematodos predadores del género Mononchus spp.
La finca Estadero fue la única donde se reportaron poblaciones de Meloidogyne spp. y Hoplolaimus spp. La diversidad en nematodos fitoparásitos en esta finca coincide con un bajo contenido de materia organica (1,3%) y ausencia de coberturas vegetales. Mientras que la finca Toscana con un alto contenido de materia orgánica del 3% presenta altas poblaciones de Mononchus spp. Futuras investigaciones deben elucidar aspectos básicos en la biología de Mononchus spp. para conocer su función en suelos bananeros y su potencial como controladores biológicos. Bilgrami (2008) describe características del potencial que tienen estos nematodos como agentes biocontroladores, dentro de las cuales se destacan la capacidad de búsqueda de su presa, producción en masa, longevidad y compatibilidad con agroquímicos. Yeates (1987, 1999) y Yeates y Wardle (1996) destacan la importancia de los Mononchus como indicadores biológicos de la calidad del suelo en los agroecosistemas e indica que juegan un papel importante en el reciclaje de nutrientes.
La aplicación de ethoprop redujo las poblaciones de R. similis, H. multicintus y total de nematodos fitoparásitos en las fincas Toscana y La Llave, pero no en la finca Estadero. La reducción en la población de nematodos fitoparásitos es congruente con una disminución en el daño de las raíces y un aumento en los contenidos de raíces funcionales y totales. El efecto del nematicida reduciendo poblaciones de nematodos y aumentando contenidos de raíces es paralelo con otras investigaciones realizadas en Colombia (Cubillos et al. 1980), en países bananeros del oeste de África (Vilardebo y Guerout, 1976), en Costa Rica (Flores y Salazar 1987, Figueroa 1987, Araya y Cheves 1997, Araya y Lakhi 2004, Moens et al. 2004), en Australia (Stanton y Pattison 2000) y en Costa de Marfil (Quenehervé et al. 1991a, 1991b).
En la evaluación inicial de las variables de producción (antes de aplicar los tratamientos) no se observaron diferencias significativas, lo que indica que las variaciones registradas en la segunda evaluación de cosecha realizada nueve meses después de aplicados los tratamientos es producto del efecto del nematicida. Por ende, el aumento en producción, contenido de raíces y reducción de nematodos fitoparásitos demuestra que los endoparásitos migratorios R. similis y H. multicinctus están limitando la producción de banano en la zona de Urabá, Colombia.
El aumento en el peso del racimo se sustenta en el aumento en el número de manos y coincide con resultados obtenidos por Gómez (1980), Tarté (1980), Jaramillo y Quirós (1984), Figueroa (1987), Sarah (1989), Quénéhervé et al. (1991a, 1991b), Crozzoli et al. (1995), Araya y Cheves (1997) y Moens y Araya (2002). No se observaron diferencias significativas en el número de manos, longitud y calibración del fruto central de la segunda mano probablemente porque estas variables son menos sensibles como lo reporta Jaramillo y Quirós (1984). Quizá con un mayor número de aplicaciones de nematicida por generación se encuentre respuesta a estas variables.
El aumento promedio de las tres fincas en el peso del racimo (2,3 kg) puede llegar a significar hasta 170 cajas de 18,14 kg (3 t) por hectárea por año si consideramos una población efectiva de 1400 plantas por hectárea, un ratio de 1, un retorno de 1,2 y un 80% de aprovechamiento que fueron los promedios del año 2004 para la zona de Urabá. El costo del producto (US $3,05/kg) por hectárea (1500 plantas) fue de US $106,5. Los costos fijos de fertilización, control de malezas y Sigatoka negra, deshija, apuntalamiento, embolse, transporte de los racimos a la planta empacadora y otros fueron iguales para las parcelas tratadas o sin tratar con nematicida, puesto que el aumento se estimó con base en el peso de los racimos. Lo que variaría serían los costos variables de empaque, transporte y embarque que suman US $2 por caja. El beneficio neto sería la diferencia del precio de venta por caja US $5, menos los costos variables (US $2) y el costo del ethoprop y su aplicación US $106,5/ha. Es decir que fue económicamente rentable su aplicación en las condiciones en que se desarrollaron los tres experimentos.
Al demostrar el impacto que están teniendo los nematodos fitoparásitos en la producción de banano en Uraba, no se busca promover la aplicación de nematicidas sino demostrar que tan limitantes están siendo los nematodos fitoparásitos en Urabá para encontrar alternativas de manejo diferentes como el uso de hongos endofíticos (Pocasangre 2000, Kashaija et al. 1998), micorrizas (Smith y Kaplan 1988, Pattison, 2001, Calvet et al. 2001, Elsen et al. 2003), rizobacterias (Kashaija et al. 1998), adiciones de materia orgánica (Kashaija et al. 1998, McIntyre et al. 2000), coberturas vegetales (Wang et al. 2002, Chitwood 2002), extractos de semillas (Musabyimana y Saxena 1999), avermectinas (Jansson y Rabatin 1997, 1998) y cultivares con resistencia a nematodos (De Waele y Elsen 2002).
Literatura citada
Araya, M. 2004. Los fitonematodos del banano (Musa AAA subgrupo Cavendish cultivares Grande Naine, Valery y Williams) su parasitismo y combate. In Memorias XVI Reunión ACORBAT. Oaxaca, Méx. p. 84-105. [ Links ]
Araya, M; De Waele, D. 2004. Spatial distribution of nematodes in three banana (Musa AAA) root parts considering two root thickness in three farm management systems. Acta Oecologica 26:137-148. [ Links ]
Araya, M; Lakhi, A. 2004. Response to nematicide application in Musa AAA cv. Grande Naine originated from in vitro propagative material and cultivated on a virgin soil. Nematologia Brasileira 28(1):55-61. [ Links ]
Araya, M; De Waele, D; Vargas, R. 2002. Occurrence and population densities of nematode parasites of banana (Musa AAA) roots in Costa Rica. Nematropica 32: 21-33. [ Links ]
Araya, M. 2002. Metodología utilizada en el laboratorio de nematología de CORBANA S.A. para la extracción de nematodos de las raíces de banano (Musa AAA) y plátano (Musa AAB). CORBANA , Costa Rica 28(55):97-110. [ Links ]
Araya, M; Cheves, A. 1997. Comparación de tres diferentes formulaciones comerciales de terbufos en el combate de nematodos, la recuperación del sistema radicular y en el rendimiento del banano (Musa AAA). CORBANA 22(48):9-22. [ Links ]
AUGURA. 2008. Coyuntura bananera colombiana 2007. Unidad de Estadística y análisis económico. Departamento de Sistemas. p. 16-17. [ Links ]
Bilgrami, AL. 2008. Biological control potentials of predatory nematodes. In Ciancio, A; Mukerji, K.G. eds. Integrated management and biocontrol of vegetable and grain crops nematodes. Dordrecht, Netherlands p. 3-28. [ Links ]
Bridge, J; Fogain, R; Speijer, P. 1997. The root lesion nematodes of bananas. Musa Pest Factsheet No. 2, INIBAP, Montpellier, France. 4 p. [ Links ]
Calvet, C; Pinochet, J; Camprubí, A; Estaún, V; Kabana, R. 2001. Evaluation of natural chemical compounds against root-lesion and root-knot nematodos and sideeffects on the infectivity of arbuscular mycorrhizal fungi. European Journal of Plant Pathology 197:601-605. [ Links ]
Chitwood, D. 2002. Phytochemical based strategies for nematode control. Annual Review of Phytopathology 40:221-249 [ Links ]
Crozzoli, R; Martínez, G; Rivas, D. 1995. Manejo y fluctuaciones poblacionales de Helycotylenchus multicinctus y Meloidogyne incognita en banano en Venezuela. Nematropica 25:61-66. [ Links ]
Cubillos, G; Barriga, R; Pérez, L. 1980. Control químico de nematodos en banano Cavendish cv. Grande Naine en la región de Urabá, Colombia. Fitopatología Colombiana 9(2):58-70. [ Links ]
De Waele, D; Elsen, A. 2002. Migratory endoparasites: Pratylenchus and Radopholus species. In Starr, JL; Cook, R; Bridge, J. eds. Plant resistence to parasitic nematodes. CAB International. Wallingfor, UK. p. 175-206. [ Links ]
Elsen, A; Baimey, H; Swennen, R; De Waele, D. 2003. Relative mycorrhizal dependency and mycorrhizanematode interaction in banana cultivars (Musa AAA) differing in nematode susceptibility. Plant and soil 256:303-313. [ Links ]
Figueroa, A. 1987. Efectos del combate de nematodos en una finca bananera. In Memorias Reunión ACORBAT. San José, Costa Rica. p. 215-217. [ Links ]
Flores, A; Salazar, L. 1987. Efecto de tres nematicidas no fumigantes para el combate de Radopholus similis en banano (Musa acuminata) cv. Grande. In Memorias VII Reunión ACORBAT. San José, Costa Rica. p. 193-201. [ Links ]
Gómez, TJ. 1980. Determinación de la infestación de fitonematodos en plantaciones bananeras de Urabá, Colombia. Fitopatología Colombiana 9(1):1932. [ Links ]
Jansson, RK; Rabatin, S. 1998. Potential of foliar, dep, and injection applications of avermectins for control of plant-parasitic nematodes. Journal of Nematology 30(1):65-75. [ Links ]
Jansson, RK; Rabatin, S. 1997. Curative and residual efficacy of injection applications of Avermectins for control of plant-parasitic nematodes on banana. Supplement to the Journal of Nematology 29(4S):695-702. [ Links ]
Jaramillo, R; Quirós, J. 1984. Evaluación de cinco nematicidas en el control de Radopholus similis (Cobb) Thorne en la zona bananera de Urabá, Colombia. AUGURA-UPEB. Augura (10)1:73-88. [ Links ]
Kashaija, IN; Fogain, R; Speijer, PR. 1998. Habitat management for control of banana nematodes. In Frison, EA; Gold, CS; Karamura, EB; Sikora, RA. eds. Movilizing IPM for sustainable banana production in Africa. INIBAP. Montpellier, France p. 109-118. [ Links ]
Londoño, DM. 2003. Nematodos fitoparásitos: una limitante para la producción bananera de Urabá? Boletín técnico Cenibanano 3:6-9. [ Links ]
Marín, DH; Sutton, T; Barker, K. 1998. Dissemination of bananas in Latin America and the Caribbean and its relationship to the occurrence of Radopholus similis. Plant Disease 82:964- 974. [ Links ]
McIntyre, BD; Speijer, PR; Riha, SJ; Kizito, F. 2000. Effects of mulching on biomass, nutrients, and soil water in banana inoculated with nematodes. Agronomy Journal 92:1081-1086. [ Links ]
McSorley, R; Parrado, JL. 1986. Helicotylenchus multicinctus on bananas: an international problem. Nematropica 16:73-91. [ Links ]
Moens, T; Araya, M; Swennen, R; De Waele, D. 2004. Enhanced biodegradation of nematicides after repetitive applications and its effect on root and yield parameters in commercial banana plantations. Biology and Fertility of Soils 39:407-414. [ Links ]
Moens, T; Araya, M. 2002. Efecto de Radopholus similis, Meloidogyne incognita, Pratylenchus coffeae y Helicotylenchus multicinctus en la producción de Musa AAA cv. Grande Naine. Corbana 28(55):43-56. [ Links ]
Moens, TAS; Araya, M; De Waele, D. 2001. Correlations between nematode numbers and damage to banana (Musa AAA) roots under commercial conditions. Nematropica 31:55-65. [ Links ]
Musabimana, T; Saxena, RC. 1999. Efficacy of Neem seed derivates against nematodes affecting banana. Phytoparasitica 27:43-49. [ Links ]
Pattison, T. 2001. Mycorrhiza and burrowing nematodes on bananas. Nematology Newsletter 12:9-14. [ Links ]
Pattison, T. 2003. Screening rhizobacteria for plant growth promotion and suppression of burrowing nematode on banana. In Smith, L; Smith, M. eds. Devoloping healthier banana roots with mycorrhizae. Final report. Queensland Department of Primary Industries. Queensland, Australia p. 82-92. [ Links ]
Pocasangre, L. 2000. Biological enhancement of banana tissue culture plantlets for the biologycal control of Fusarium oxysporum f.sp. cubense and Radopholus similis on banana. Ph D. Thesis. University of Bonn Germany. 95 p. [ Links ]
Quénéhervé, P; Mateille, T; Topart, P. 1991a. Effect of cadusaphos compared with three other non-fumigant nematicides on the control of nematodes and on the yield of banana cv. Poyo in the Ivory Coast. Revue of Nematology 14(2):207-211. [ Links ]
Quénéhervé, P; Cadet, P; Mateille, T; Topart, P. 1991b. Population of nematodes in soils under bananas, cv. Poyo, in the Ivory Coast. 5. Screening of nematicides and horticultural results. Revue of Nematology 14(2): 231-249. [ Links ]
Santor, W; Davide, RG. 1992. Interelationship of Radopholus similes and Meloidogyne incognita in banana. In Davide, RG. ed. Studies on nematodes affecting bananas in Philippines. Philippine agriculture and resourses. Research foundation Inc. Philippines, Los Baños, Laguna. p. 71-77. [ Links ]
Sarah, JL. 1989. Banana nematodes and their control in Africa. Nematological review. Nematropica 19(2):199-216. [ Links ]
Sasser, JN; Freckman, DW. 1987. A world prespective on nematology; the role of the society. In Veech, JA; Dickson, DW. eds. Vistas on nematology. Society of Nematologyst, INC. p. 7-14. [ Links ]
Smith, GS; Kaplan, DT. 1988. Influence of mycorrhizal fungus, phosphorus and burrowing nematode intereactions on growth of rough lemon citrus seedlings. Journal of nematology 20(4):539-544. [ Links ]
Speijer, PR; Fogain, R. 1998. Musa and Ensete nematode pest status in selected African countries. In Frison, EA; Gold, CS; Karamura, EB; Sikora, RA. eds. Movilizing IPM for sustainable banana production in Africa. INIBAP. p. 99-108. [ Links ]
Speijer, PR; De Waele, D. 1997. Screening of Musa germplasm for resistance and tolerance to nematodes. IPGRI-INIBAP. 47 p. [ Links ]
Ssango, F; Speijer, PR; Coyne, DL; De Waele, D. 2004. Path análisis: a novel approach to determine the contribution of nematode damage to East African Highland banana (Musa spp. AAA) yield loss under two crop management practices in Uganda. Field Crops Research 90(2-3):177-187. [ Links ]
Stanton, JM; Pattison, AB. 2000. Inplementing strategic control of nematodes on banana. Final Report. Horticultural Research and Development Corporation, Queensland Department of Primary Industries, Queensland Government. Queensland, Australia . 98 p. [ Links ]
Tarté, R. 1980. La importancia del conocimiento de la biología y comportamiento de los nematodos parásitos del banano en el desarrollo de métodos eficientes de control. Augura 6(2):13-21. [ Links ]
Tarté, R; Pinochet, J. 1981. Problemas nematológicos del banano: contribuciones recientes a su conocimiento y combate. UPEB. 32 p. [ Links ]
Taylor, AL; Loegering, WQ. 1953. Nematodes associated with root lesions in abacá. Turrialba 3(1-2):8-13. [ Links ]
Thorne, G. 1961. Principles of nematology. McGraw Hill Book Company, Inc. p. 203-224. [ Links ]
Vilardebo, A; Guerout, R. 1976. A review of experiments on nematode control with Ethoprop (Prophos), phenamiphos and Carbofuran in French speaking West Africa. Nematropica 6(2):51-53. [ Links ]
Wang, K; Sipes, BS; Schmitt, DP. 2002. Crotalaria as a cover crop for nematode management: a review. Nematropica 32:35-57. [ Links ]
Yeates, GW. 1987. Nematode feeding and activity: the importance of development stages. Biology and fertility of soils (3):143-146. [ Links ]
Yeates, GW. 1999. Nematodes diversity in agroecosystems. Agriculture, Ecosystems and Environment 74:113-135. [ Links ]
Yeates, GW; Wardle, DA. 1996. Nematodes as predators and prey: relationships to biological control and soil processes. Pedobiologia 40:43-50. [ Links ]
Mario Araya-Vargas. Apdo 375-7150 Turrialba, Costa Rica. mario.araya@lapavic.com.ec; marayavargas@gmail.com
Luis Fernando Patiño-Hoyos. Facultad de Ciencias Agrarias-Politécnico Colombiano Jaime Isaza Cadavid. Medellín-Colombia.lfpatino@elpoli.edu.co
Recibido: 10 de setiembre, 2009. Aceptado: 18 de noviembre, 2010.