Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agronomía Mesoamericana
versión On-line ISSN 2215-3608versión impresa ISSN 1659-1321
Agron. Mesoam vol.21 no.1 San Pedro jun. 2010
Cultivo in vitro de Geophila macropoda (Ruiz & Pav. DC) a partir de embriones cigóticos1
María del Pilar Vargas-Castillo2, Ana Abdelnour-Esquivel2
1 Parte del proyecto inal de graduación para optar al título de Bachillerato en Ingeniería en Biotecnología del Instituto Tecnológico de Costa Rica. Cartago, Costa Rica.
2 Centro de Investigación en Biotecnología, Instituto Tecnológico de Costa Rica. Cartago, Costa Rica. marvargas@itcr.ac.cr, aabdelnour@itcr.ac.cr
Resumen
Cultivo in vitro de Geophila macropoda (Ruiz & Pav. DC) a partir de embriones cigóticos. El objetivo de esta investigación fue desarrollar un protocolo para el cultivo in vitro de Geophila macropoda. Este trabajo se efectuó en Guácimo de Limón, Costa Rica, entre junio del 2006 y febrero del 2007. En la fase de establecimiento in vitro se utilizaron estacas y embriones cigóticos. En el cultivo in vitro, la contaminación bacteriana impidió establecer altos porcentajes de material vegetal. Con embriones se obtuvo hasta del 89%. Para la multiplicación de brotes, se evaluaron cinco concentraciones de bencilaminopurina (BAP). Los mejores resultados se obtuvieron en el medio complementado con 2 mg/l BAP con 13,4 nuevas plántulas a partir de una vitroplanta inicial. El enraizamiento se alcanzó en medio Murashige & Skoog al 50% de las sales recomendadas por tales autores y sin reguladores de crecimiento. Durante la aclimatación se obtuvo una sobrevivencia del 100%.
Palabras clave: Oreja de ratón, micropropagación, Bencilaminopurina, cobertura vegetal.
Abstract
In vitro culture of Geophila macropoda (Ruiz & Pav. DC) from zygotic embryos. The goal of this research was to develop a protocol for the in vitro culture of Geophila macropoda. The work was conducted in Guácimo, Limón, Costa Rica between June 2006 and February 2007. For the in vitro establishment phase, the explants used were microcuttings and zygotic embryos. Bacterial contamination prevented the establishment of high percentages of plant material, whereas the use of embryos resulted in a response as high as 89%. For shoot proliferation, five concentrations of benzilaminopurine (BAP) were tested. The best results were obtained with 2 mg/l BAP with 13.4 new seedlings from an original vitroplant. Rooting was accomplished in a half Murashige & Skoog medium, without adding any plant growth regulator. During the acclimatization period the survival rate was 100%.
Key words: "Mouse ear", micropropagation, Benzylaminopurine, cover crop.
Introducción
Geophila macropoda (oreja de ratón) es una dicotiledónea rastrera que se desarrolla de los 0 a 800 msnm y se encuentra distribuida en regiones de bosques húmedos y muy húmedos. Por su porte bajo, se recomienda como cobertura en las plantaciones de banano, no impide las labores propias de la plantación, su sistema radical es poco profundo, adaptación al pisoteo y a la sombra, además de ser muy susceptible al contacto directo con fertilizantes sólidos. Análisis realizados en plantaciones que ya han incorporado esta especie a sus programas de coberturas indican que no afecta el crecimiento de las plantas de banano, y no compite con el cultivo (Herrera 1997, Sancho y Ce rvantes 1997, Fernández et al. 2001). G. macropoda como cobertura del banano podría ser muy eficiente en el control de la erosión, disminuir la aplicación de herbicidas, enriquecer la microflora y mejorar las propiedades físicoquímicas del suelo (Araya y Cheves 1997).
Esta especie se reproduce a través de semilla sexual y por medio de estolones. La propagación por semillas presenta la ventaja de que la recolección manual y posterior dispersión es sencilla, sin embargo, hubo bajos porcentajes de germinación (Pinilla y García 2002) en siembras con semillas de G. macropoda en plantaciones de Colombia. Por lo tanto, en las plantaciones de banano se ha adoptado el método de propagación asexual por estolones, pero requiere varios años para que un área sea colonizada completamente. Esto se ha convertido en una limitación para su establecimiento. Además, los procesos de poda, transporte y manejo de los estolones afectan su viabilidad, especialmente cuando son trasladados a largas distancias. Una posible solución a este problema podría ser la siembra de material clonal, pero producido in vitro por micropropagación. Esta técnica tiene gran potencial comercial debido a la velocidad de multiplicación, las plántulas obtenidas son de alta calidad, presentan buena vigorosidad y se encuentras libres de patógenos (Amhed et al. 2001). Por el alto volumen de plantas producidas en corto tiempo, sin patógenos y en un periodo reducido, esta técnica representa una alternativa muy atractiva para la producción masiva de plantas para la siembra de nuevas parcelas.
No se encontró información sobre investigaciones previas de manejo in vitro de oreja de ratón, por lo cual el objetivo del presente trabajo fue desarrollar un protocolo para el cultivo in vitro de G. macropoda.
Materiales y métodos
La parte experimental se desarrolló entre junio del 2006 y febrero del 2007 en el Laboratorio de Biotecnología del Centro de Investigación San Luis del Instituto Tecnológico de Costa Rica ubicado en Guácimo, Limón, Costa Rica.
Fase 1. Establecimiento in vitro. Como material experimental se utilizó tanto material vegetativo (estacas y ápices de estolones) como sexual (embriones cigóticos).
Estacas y ápices
Los estolones de G. macropoda fueron recolectados de campo, lavados y sembrados en bandejas con suelo estéril. Se mantuvieron en condiciones de invernadero, con riego diario para promover su crecimiento.
Para el establecimiento aséptico del material al laboratorio, las plantas fueron lavadas con agua a presión por cinco minutos, para eliminar restos de suelo y se les realizó una primera reducción, eliminando las hojas y raíces, dejando el explante de un tamaño aproximado a los 2 cm. Posteriormente se lavaron tres veces con agua y jabón. En la cámara de flujo laminar, se enjuagaron de nuevo tres veces pero con agua destilada estéril, y fueron incubados en etanol de 70° por dos minutos, luego se enjuagaron tres veces más con agua destilada estéril y se colocaron en una solución de hipoclorito de sodio al 75% i.a. por cinco minutos. Una vez más se les realizaron tres enjuagues con agua destilada estéril.
El material se redujo una segunda vez, retirando las zonas dañadas por la desinfección y el explante (un segmento conteniendo un nudo o un ápice) se inoculó en frascos de cultivo de 175 ml a los que se adicionó 20 ml del medio de sales (MS) de cultivo descrito por Murashige & Skoog (1962), complementado con 0 ó 1 mg/l de bencilaminopurina (BAP), 30 g/l de sacarosa y 2 g/l de Gellan Gum como gelificante, el pH se ajustó a 5,8 y se esterilizó por autoclavado (1,2 atm/m2, 121°C, 21 min). En un segundo ensayo de desinfección se agregaron 100 mg/l de sulfato de estreptomicina a los mismos medios de cultivo descritos anteriormente. Los explantes se mantuvieron en el cuarto de crecimiento bajo condiciones de 16 horas luz a 25 ºC 2000 lux y se realizaron evaluaciones semanales contabilizando el número de brotes totales, hiperhidratados, oxidados, muertos y contaminados con hongos o bacterias.
Establecimiento de embriones
Para el establecimiento de embriones al cultivo in vitro, se colectaron frutos maduros (color oscuro) en fincas bananeras ubicadas en la provincia de Limón, Costa Rica. Estos fueron llevados al laboratorio donde se lavaron tres veces con agua y jabón. A un grupo de frutos se les extrajo las semillas después de desinfectados y al otro se le sometió a un tratamiento adicional que consistió en colocar los frutos en un recipiente plástico con un litro de agua destilada (que cubriera todos los frutos), durante una semana y se mantuvo en el invernadero.
Como referencia se tomaron los trabajos realizados in vitro con café (Coffea spp.), la especie más conocida de la familia Rubiaceae, y que tiene estudios en el área de micropropagación a partir de embriones cigóticos. Las recomendaciones son utilizar el medio Murashige y Skoog (1962) completo, y con alguna citocinina, preferiblemente BAP, ya que responde mejor que la cinetina y la 2-iP (isopenteniladenina) (Madhava y Screenivasan 2004). Experiencias previas con estos explantes, demostraron que 1 mg/l de BAP en el medio de establecimiento permite un desarrollo adecuado de los explantes. Así, que para el establecimiento in vitro de embriones de G. macropoda se consideró esta concentración y se mantuvo como control un medio sin la adición de regulador de crecimiento y se realizaron seis ensayos de desinfección para el establecimiento in vitro de embriones en cada medio de cultivo.
Para la extracción de las semillas, los frutos se pasaron por una criba 14 mesh, recolectando éstas en otra malla, cuatro mesh. Posteriormente, se lavaron tres veces con agua y jabón. Las semillas fueron llevadas a la cámara de flujo laminar, donde se lavaron tres veces con agua destilada estéril, luego se colocaron en alcohol de 70° por dos minutos, se lavaron tres veces con agua estéril y se colocaron en una solución de hipoclorito de sodio al 1,75% i.a. por diez minutos. Una vez más, se les realizaron tres enjuagues con agua destilada estéril y se procedió a la extracción de los embriones, los que se colocaron en medio MS complementado con 1 mg/l de BAP, 30 g/l de sacarosa y 2 g/l de Gellan Gum, pH 5,8. Se mantuvo un tratamiento testigo cultivado en el mismo medio, pero sin la adición del regulador de crecimiento. Todos los cultivos se ubicaron en condiciones de 16 horas luz, 2000 lux a 25 ºC. La evaluación se realizó semanalmente, descartando el material contaminado, cuantificándolo y clasificando el patógeno en hongo o bacteria; asimismo se contabilizaron los explantes que mantuvieron latencia y aquellos que murieron, también se evaluó la germinación de los embriones y desarrollo de plántulas, descartando el material contaminado (cuantificando la presencia de hongo o bacteria); se contabilizaron los explantes que mantuvieron latencia y aquellos que murieron. Después de cinco semanas de cultivo se procedió a la multiplicación del material regenerado. Se realizaron seis ensayos de desinfección y establecimiento in vitro de este tipo de explante.
Fase 2. Multiplicación. Cuando los explantes regenerados, alcanzaron un tamaño de aproximadamente 5 cm, ya fueran los introducidos por ápice, por estaca o embrión, los brotes se dividieron en segmentos que contenían un nudo, dejando las microestacas de uno, y fueron cultivados en los medios de multiplicación, que consistieron en seis concentraciones de BAP (0, 0,5; 1; 2; 3 y 4 mg/l). El material se evaluó semanalmente, cuantificando el número de brotes y su vigor, hiperhidratación y oxidación.
Se realizó un ensayo con los mismos tratamientos de citocinina, pero sin agregar gelificante al medio de cultivo. Se utilizaron erlenmeyers de 250 ml conteniendo 0,5, 1 y 2 ml por brote con 25 explantes cada frasco. Se evaluaron la hiperhidratación y oxidación, según la cantidad de medio adicionada por explante, cada tratamiento tuvo tres repeticiones por volumen. Se mantuvo un bloque en agitación y otro en reposo, ambos en luz difusa.
Fase 3. Enraizamiento. Para inducir el enraizamiento, cuando los brotes alcanzaron una longitud de aproximadamente 4 cm y dos hojas, se transfirieron al medio básico con las sales minerales completas o a la mitad de la concentración con cuatro dosis (0, 0,5; 1 y 2 mg/l) de ácido indol-3-acético (AIA). El material se evaluó semanalmente, desechando aquellos explantes contaminados (se separaron según la presencia de hongos o bacterias) y se cuantificó la cantidad de raíces.
Fase 4. Aclimatación. Después de cuatro semanas en medio de enraizamiento, las plantas obtenidas in vitro fueron llevadas al invernadero, donde se mantuvieron durante dos días en el frasco de cultivo. Pasado este periodo se lavaron las raíces para eliminar los restos de medio y se sembraron en bandejas con una mezcla de suelo estéril, granza y turba, en proporción 1,5:1:1. Las plántulas fueron mantenidas en condiciones de sombra por dos semanas y en las condiciones normales del invernadero las siguientes tres semanas, con riego diario. Se evaluó la sobrevivencia del material.
Resultados
Fase 1. Establecimiento in vitro
Ápices y estacas
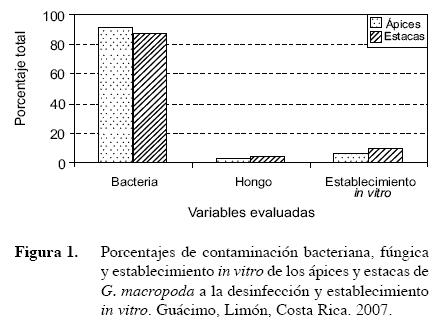
Para la esterilización superficial y establecimiento in vitro del material inicial o explante, el etanol de 70º es uno de los desinfectantes que se utiliza comúnmente, previo al tratamiento con hipoclorito de sodio. Este tratamiento de desinfección se considera efectivo contra bacterias y hongos (George 1996; Lummerding 2001). Sin embargo, durante el establecimiento in vitro de material vegetativo de G. macropoda, con el uso de estos desinfectantes se presentó una alta contaminación bacteriana que alcanzó valores cercanos al 90%. Tres días después de la inoculación de los explantes, la presencia de bacterias fue evidente, observándose un exudado de coloración crema y apariencia pastosa. La bacteria fue identificada como Gram negativa. El material establecido asépticamente, sólo alcanzó un 6,1% en ápices y un 9,3% en estacas (Figura 1). Por otra parte, la contaminación por hongos fue menor del 2%. La desinfección empleada no fue efectiva, ya que el número de explantes establecidos fue muy bajo, lo que implica que el tiempo requerido para aumentar el número de materiales producidos, por esta vía, serían mucho mayores que cuando se logra establecer asépticamente los explantes iniciales. Se sugiere evaluar mayores concentraciones de cloro u otros desinfectantes que permitan aumentar el número de explantes establecidos in vitro.
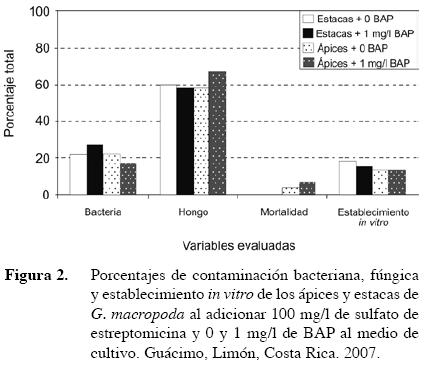
La adición de antibióticos al medio de cultivo es una práctica común cuando las bacterias se convierten en un factor limitante para el establecimiento in vitro del material de interés (George et al. 2008). En los ensayos en que se agregó 100 mg/l de sulfato de estreptomicina al medio de cultivo, la contaminación bacteriana disminuyó considerablemente, pasando de 91,8% en ápices y 87% en estacas en el medio sin antibiótico a 19,2% y 24,2%, respectivamente en este tratamiento, lo que era de esperarse ya que el sulfato de estreptomicina tiene efecto antimicrobial contra bacterias tanto Gram negativas como Gram positivas (López 2005). Sin embargo, el porcentaje de material aséptico no alcanzó valores mayores al 21%, debido a contaminación fúngica (Figura 2).
La cercanía de un laboratorio de fitopatología parece haber influido en el aumento de esporas de estos hongos durante el establecimie nto in vitro, ya que fueron identificados en el laboratorio (Fusarium sp. y Monilia sp) al tiempo del establecimiento in vitro de material. Además, la implementación de un manejo previo en invernadero al material, con aplicaciones de fungicidas y bactericidas, puede ayudar a la obtención de explantes más limpios, lo cual permitiría procesos de esterilización menos drásticos (Debergh 1999) y en este caso, la etapa de pretratamiento en invernadero fue mínima. Aunque el valor de respuesta fue bajo, duplicó el obtenido durante el primer ensayo y la contaminación bacteriana disminuyó considerablemente.
El tejido vegetal, madre o explante inicial más joven, creció más rápido y con menores cantidades de bacteria endógena. Entre mayor fue la edad del explante, mayor fue la desinfección requerida (Lummerding 2001). En general, se afirma que el tamaño del explante puede influenciar el estado fitopatológico del retoño y el éxito de la fase de iniciación (Debergh 1999), por lo cual el uso de plantas madres sanas y uniformes permite con mayor facilidad el alcance de las metas de calidad deseadas (Hennen 1999); por lo tanto, es recomendable la preselección del material vegetal, preferiblemente en el campo, antes de iniciar todo el proceso de micropropagación (George et al. 2008).
Embriones
Los embriones fueron el segundo tipo de explante utilizado para el establecimiento in vitro de G. macropoda. No se observaron diferencias en el porcentaje de germinación entre aquellos embriones aislados de semillas sin el tratamiento previo de incubación en agua y las que lo tuvieron (datos no mostrados), sin embargo; estas últimas presentaron más uniformidad en grosor y color de la testa, y al momento de realizar la extracción de los embriones, se facilitó la separación del embrión del resto de la semilla. Esto podría explicarse con base en el periodo de incubación en agua previo al aislamiento que permitió la imbibición de las semillas y una mejor distinción de sus componentes anatómicos (Azcón-Bieto y Talon 2008).
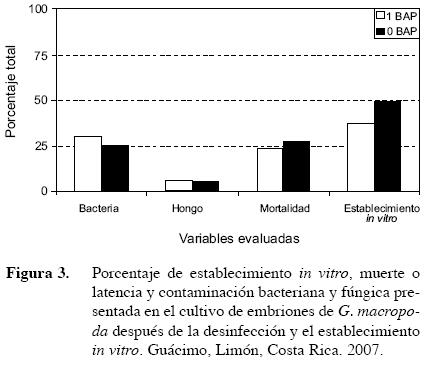
Contaminación bacteriana y fúngica (alrededor del 25% y 5% respectivamente), en el cultivo de embriones, fue menor que en los ensayos de desinfección de material vegetativo. Por la forma en que se desarrolla el embrión después de la fecundación, éste se encuentra en condiciones asépticas dentro de la semilla, por lo que la desinfección superficial de ésta y el aislamiento del embrión en condiciones controladas permitió mayores cantidades de material inicial establecido in vitro (Flores 1999). El promedio total de germinación y desarrollo de la plántula varió entre el 36,8% en los embriones cultivados en el medio MS + 1 mg/l BAP y 49,9% en el testigo sin la adición de citocinina (Figura 3). Estos resultados coinciden con lo expresado por Raghavan (2003) sobre el uso de auxinas, giberelinas y citocininas en el cultivo de embriones cigóticos. Este investigador demostró que en muchos casos el uso de estos reguladores del crecimiento afectaban negativamente el desarrollo y morfogénesis de los embriones cultivados y que en muchas de las especies estudiadas no se encontró evidencia de la necesidad de adicionar estas sustancias para la germinación de los embriones.
En las dos concentraciones de BAP utilizadas en el medio de cultivo, se encontraron valores semejantes de muerte y latencia de los explantes (cercanos al 25%). Los bajos porcentajes de germinación de la semilla sexual de G. macropoda han sido a menudo justificados considerando la impermeabilidad de la testa. El cultivo in vitro de semillas sexuales permitió comprobar este hecho, ya que de las 150 cultivadas, ninguna germinó in vitro. Sin embargo, el cultivo de los embriones cigóticos aislados sí permitió la obtención de respuesta, lo cual parece indicar que la baja capacidad de germinación de las semillas podría tratarse de dificultades para la imbibición y de inmadurez de ésta, aún cuando el fruto ya estuviera maduro. La observación al estereoscopio de los embriones extraídos mostró que su estructura era similar a un estadio torpedo.
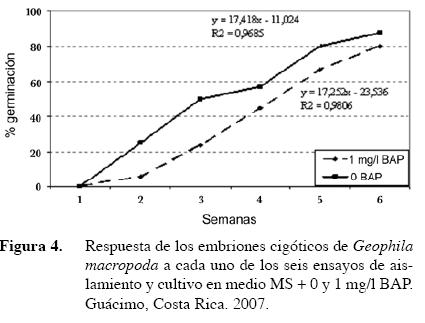
La respuesta de los embriones aumentó significativamente en cada uno de los seis ensayos de desinfección, lo que parece indicar que es importante considerar, que en el desarrollado de destrezas para el aislamiento en el último ensayo se obtuvo 89% de respuesta, valor que podía considerarse suficientemente alto para continuar la propagación de la especie a nivel comercial.. Las ecuaciones que describen este aumento están incluidas en la Figura 4. En el caso de los ensayos en medio con 1 mg/l de BAP, la ecuación que mejor la definió fue y= -11,027 + 17,418x, con un R2 de 0,9685 y un coeficiente de correlación de 0,9841; mientras que el control puede definirse por la ecuación y= -23,54 + 17,254x, con un R2 de 0,9806 y un coeficiente de correlación de 0,9902.
En el medio complementado con 1 BAP, los embriones presentaron un desarrollo anormal, con hiperhidratación y crecimiento desigual. Mientras que en el medio sin reguladores del crecimiento, los embriones se desarrollaron normalmente, incluso con radícula. Adicionalmente, no se observó diferencia en el periodo de respuesta con respecto a la concentración de BA: los embriones respondieron entre 12 y 16 días después de la inoculación, en ambos medios.
La respuesta de los embriones al cultivo in vitro, fue superior a la obtenida por material vegetativo y siembra de semillas (datos no presentados), con una respuesta superior en el medio sin regulador, de 49% contra 21% en material vegetativo (en el mejor de los casos).
Fase 2. Multiplicación
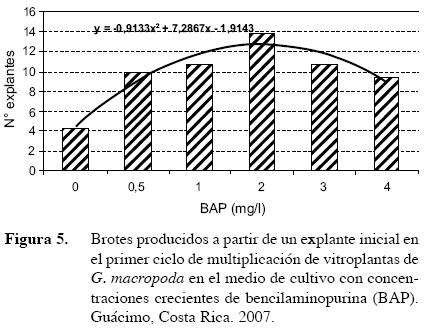
En cuanto a la multiplicación de los explantes se contabilizó el número de brotes obtenidos a partir de uno (Figura 5). El control (medio básico sin BAP) produjo 4,2 explantes, cifra que aumentó conforme aumentó la concentración del regulador del crecimiento, hasta llegar a 2 mg/l de BAP; tratamiento que produjo 13,7 brotes por explante inicial. Los medios de cultivo enriquecidos con mayores concentraciones de BAP (3 y 4 mg/l), indujeron una disminución en el número de explantes (diez y ocho brotes respectivamente). Este comportamiento está definido por la ecuación y= 0,9133x2 + 7,2867x – 1,9143.
En el total de explantes hubo tres grupos con diferencias significativas entre ellos, el mayor número de brotes se obtuvo en el tratamiento MS + 2 mg/l BAP (Cuadro 1). El efecto de las citocininas es evidente en cultivo in vitro y se ha demostrado que gran número de especies con la adición de BAP al medio de cultivo, son capaces de superar la dominancia apical y liberar las yemas laterales de la dormancia (George 2008). Son varios los autores que utilizan BAP para la multiplicación de distintas especies y por lo general, se utilizan concentraciones que varían entre 0,5 y 5 mg/l. La multiplicación de brotes de Cedrus libani fue rápida en un medio complementado con 5 mg/l BAP, sin embargo los autores recomendaron el medio con 2 mg/l de la citocinina, porque los brotes presentaban una apariencia más saludable (Hosseyni et al. 1999). Para la inducción de brotes y la multiplicación de Gerbera jamesonic Bolus, se utiliza un medio MS fortificado con 2 mg/l de BAP, mientras que para la propagación de brotes de Vitis vinifera L., un medio con 1,5 mg/l de la citocinina es suficiente (BARI 2003). En la propagación in vitro de la leguminosa Onobrychis viciifolia Scop., la mayor longitud de los brotes fue observada en el medio con 2 mg/l de BAP (Sancak 1999).
De acuerdo con los resultados obtenidos en esta investigación, el medio MS complementado con 2 mg/l de BAP, 30 g/l sacarosa y 2 g/l de gelificante se seleccionó como el recomendado para la multiplicación de explantes de G. macropoda. La selección se hizo principalmente porque en este medio se obtuvo la mayor cantidad de éstos, así como el valor más alto de los sanos.
La hiperhidratación se da en condiciones in vitro. Las plantas que se originan son frágiles y tienen una apariencia vidriosa (el fenómeno era conocido como vitrificación). La hoja es el órgano más afectado, ya que desarrolla un mesófilo desorganizado de parénquima esponjoso, con grandes espacios intercelulares. Las plantas hiperhidratadas usualmente mueren, debido a que la fotosíntesis y la respiración no se llevan a cabo correctamente (Ziv 2000). Se ha mencionado que las causas de estas malformaciones están ligadas a factores como los nutricionales, la baja intensidad luminosa durante la incubación, la humedad relativa en el recipiente de cultivo y a elevadas dosis de reguladores de crecimiento que producen un efecto tóxico en el explante (López 1996). Por otra parte, el oscurecimiento y la oxidación de tejidos cultivados in vitro puede ser el resultado de la oxidación de algunos componentes celulares por radicales libres o de compuestos fenólicos para producir quinonas, que al reaccionar pueden generar daño y hasta muerte celular (Azofeifa 2009). En cultivo de tejidos in vitro, la oxidación puede presentarse en cualquier etapa del proceso donde se produzca estrés al material; durante el establecimiento, como resultado del efecto abrasivo de los desinfectante y en las siguientes etapas como resultado de los cortes que se realizan al explante. También pueden influir la composición del medio de cultivo, el tipo de envase, la hiperhidricidad, la aireación, la edad, y el genotipo del material, las especies leñosas son las más propensas a sufrir oxidaciones severas.
La hiperhidratación y oxidación se presentaron en porcentajes menores del 20% en los medios que contenían de 0 a 2 mg/l BAP; sin embargo, en aquellos explantes cultivados en presencia de 3 y 4 mg/l de BAP, los porcentajes fueron mayores variando entre 28,66% y 41% de hiperhidratación y entre 20% y 32% de oxidación para cada concentración de BAP respectivamente (Cuadro 2). El análisis estadístico mostró diferencias significativas entre las concentraciones de 3 y 4 mg/l de BAP con respecto a las concentraciones entre 0 y 0,5 mg/l. Es importante señalar que en el presente estudio el nivel de oxidación fue bajo y se presentó en la base del explante sin limitar el crecimiento del mismo.
Cuando las estacas y ápices fueron cultivados en medio líquido, no se observó desarrollo de yemas, pero los explantes se elongaron y engrosaron, mostrando que los mismos permanecieron viables, pero no mostraron capacidad de multiplicación en estas condiciones. Aún cuando el cultivo de brotes en medio líquido puede resultar eficiente en algunas especies, este tipo de cultivo es más recomendado para células u otros órganos pequeños como anteras, por otra parte, para brotes y microestacas, el uso de soportes que permitan a los explantes sobresalir y tener mejor aireación es lo más recomendado (George 2008).
Fase 3. Enraizamiento
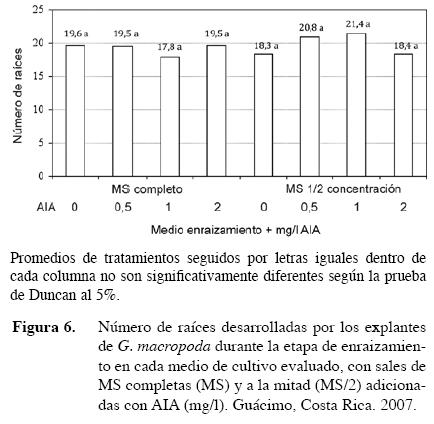
Al evaluarse los dos medios de cultivo (MS completo y MS a la mitad de la concentración de sales), cada uno con cuatro concentraciones de AIA (0, 0,5; 1 y 2 mg/l) para inducir el enraizamiento de la oreja de ratón, se observó que, en todos los medios, los brotes desarrollaron raíces, sin embargo, se encontraron diferencias estadísticas entre los tratamientos con respecto al número de raíces (Figura 6).
Al hacer un análisis de contrastes ortogonales no se observaron diferencias significativas entre grupos, comparando los medios completos con aquellos que sólo tenían la mitad de la concentración de sales; los medios con y sin AIA; y el medio MS/2 + 0 mg/l AIA con todos los demás. En general, todas las raíces desarrolladas fueron finas, pero aquellas observadas en el medio MS completo con 2 mg/l de AIA fueron levemente más gruesas y ramificadas.
Estos resultados coinciden con los obtenidos para el enraizamiento de Fragaria vesca, una Rosaceae con crecimiento estolonífero similar a la especie en estudio, en la que se utiliza el medio MS completo o con la mitad de sales, sin adición de reguladores (Reed et al. 2004, BARI 2003). Estos requerimientos también se han informado para especies como Musa spp (Sandoval et al. 1991), Gmelina arbórea (Gamboa y Abdelnour 1999), Tectona grandis (Abdelnour y Muñoz 2005) y muchas otras.
A partir de la segunda semana, los explantes habían desarrollado casi todas las raíces, pero muy cortas. En la cuarta semana, éstas presentaban una longitud promedio de 4 cm, por lo que cuatro semanas se consideró un periodo suficiente para esta fase del proceso. Es posible afirmar que la especie no requiere el estímulo de reguladores de crecimiento exógenos para obtener un número de raíces aceptable que le permitan sobrevivir a la fase de aclimatación, como se analizará más adelante. En esta fase, al igual que en el establecimiento, el medio de cultivo recomendado es un MS sin adición de reguladores.
Fase 4. Aclimatación
El mantenimiento de alta humedad en el suelo y en el ambiente son esenciales en las primeras semanas del proceso de aclimatación cuando se trasladan las plantas producidas en el cultivo in vitro a condiciones de casa de mallas o invernadero. Las vitroplantas presentan cambios substanciales sobre todo en características epidérmicas, hojas delgadas y delicadas, con menor capacidad fotosintética y estructuras cerosas superficiales escasas, estomas deficientes; todo ésto resulta en transpiración excesiva y marchitamiento de las plantas si no se someten a cuidados especiales para corregir estas anormalidades, incrementar la sobrevivencia y acelerar la aclimatación o endurecimiento (Gangopadhyay et al. 2002, Pospóšilová et al. 1999). El sustrato utilizado en esta investigación (suelo estéril, granza y turba) permitió al explante desarrollarse de mejor manera, manteniendo un buen nivel de humedad que le permitió a las plántulas desarrollar aún más raíces, mientras mantenía su crecimiento aéreo. En esta etapa únicamente se evaluó la sobrevivencia de las plantas, según el medio de enraizamiento de origen y según la bandeja en la que fueron sembradas. Hubo un riego diario o de día por medio, según la temperatura en el invernadero. En esta etapa la sobrevivencia fue del 100% en todos los tratamientos de enraizamiento utilizados.
En la Figura 7 se presentan varias etapas de desarrollo de vitroplantas de G. macropoda durante la fase de aclimatación. Los explantes con cuatro semanas en fase de enraizamiento, con raíces y al menos dos hojas (7a) se llevaron al invernadero. Cuando las plantas cumplieron dos y cuatro semanas en la etapa de endurecimiento, algunas presentaron variación somaclonal, que se mostró como una alteración de la coloración foliar (7b). El porcentaje de plantas que presentaron estas características alcanzó el 1,6% del total de plantas aclimatadas, y todas ellas provenían del mismo medio de multiplicación, aquel complementado con 3 mg/l de BAP.
La detección de la variación somaclonal suele llevarse a cabo en la fase de aclimatación, donde se puede realizar una selección del material y eliminar aquel variegado, si fuera necesario (Sahijram et al. 2003). La aplicación de reguladores de crecimiento vegetal exógenos puede incidir en la variabilidad inducida por las condiciones de cultivo. Altas concentraciones de bencilaminopurina demostraron la inducción de variabilidad genética en banano, también hay reportes que indican que esta sustancia puede inducir aberraciones en el número cromosómico. Sin embargo, en cualquier programa de micropropagación, un valor de variación somaclonal entre 3 y 5% es permisible (Sahijram et al. 2003), por lo cual el porcentaje de variantes obtenidos en esta investigación es aceptable.
La duración apropiada para la etapa de la micropropagación fue determinada con base en el comportamiento del material. A las ocho semanas los estolones contaban con al menos cuatro nudos y un número suficiente de hojas para ser llevados a campo. Normalmente las fincas donde se siembra esta especie, utilizan diez estolones por punto de siembra. Debido a que las plantas originadas en el laboratorio son más jóvenes y vigorosas, se sugiere evaluar a nivel de campo la densidad de siembra. Además, el agrupar cinco plantas por bolsa desde el invernadero, facilitaría la labor de siembra en campo.
El cultivo de tejidos vegetales como método de propagación es un procedimiento utilizado ampliamente en gran cantidad de especies. En Fragaria al comparar plantas propagadas por métodos tradicionales contra vitroplantas, se observó que estas últimas producen más hojas, estolones e inflorescencias, aunado a ésto, la producción y la resistencia a daño foliar son mucho mayores (Zebrowska et al. 2003). Estas características se presentaron en las vitroplantas de G. macropoda, por lo que la rapidez y el alto volumen de plantas producidas en el proceso de micropropagación, la calidad de las plantas y la alta tasa de sobrevivencia en invernadero hacen de esta metodología una opción con gran potencial para ser utilizada en la siembra de grandes extensiones.
Recibodo: 9 de mayo, 2009. Aceptado: 17 de mayo, 2010.
Literatura citada
Abdelnour, A; Muñoz, A. 2005. Micropropagación de teca (Tectona grandis) (en línea) Kurú: Revista Forestal 2(5):1-11. Costa Rica. Consultado 26 feb. 2010. Disponible en http://www.itcr/publicaciones/revista kuru/pdf/ABDELNOUR31Ago05.pdf [ Links ]
Amhed, Z; Akhter, F; Haque, S; Banu, H; Rahman, M; Faruquzzaman, M. 2001. Novel Micropropagation System. OnLine Journal of Biological Sciences (en línea) 1(11):1106-1111. Bangladesh. Consultado 22 junio 2006. Disponible en http://www.ansinet.org/fulltext/jbs/jbs1111106-1111.pdf [ Links ]
Araya, M; Cheves, A. 1997. Poblaciones de los nemátodos parásitos del banano (Musa AAA ), en plantaciones asociadas con coberturas de Arachis pintoi y Geophilla macropoda. Agronomía Costarricense 21(2):217-220. [ Links ]
Azcón-Bieto, J; Talón, M. 2008. Fundamentos de Fisiología Vegetal. 2 ed. McGraw Hill Interamericana. España. p. 537-556. [ Links ]
Azofeifa, A. 2009. Problemas de oxidación y oscurecimiento de explantes cultivados in vitro. Agronomía Mesoamericana 20:153-175. [ Links ]
BARI (Bangladesh Agricultural Research Institute). 2003. Technology developed through tissue culture (en línea). Bangladesh. Consultado 25 enero 2007. Disponible en http://www.bari.gov.bd/non_commodity_achievement/biotechnology-2.htm [ Links ]
Debergh, P. 1999. Quality issues in a tissue culture laboratory. Kluwer Academic Publishers. Plant Biotechnology and In Vitro Biology in the 21st Century. Proceedings of the IXth International Congress of the International Association of Plant Tissue Culture and Biotechnology. Jerusalem, Israel Altman, A; Ziv, M; Izhar, S. eds. Netherlands. p. 625-628. [ Links ]
Fernández, O; Segura, A; Garita, I; Arcilla, L; Cerrud, E. 2001. Efecto de la cobertura de oreja de ratón (Geophila repens) sobre el crecimiento del banano. In: Informe Anual 2001. San José, Costa Rica. Chiquita Brands Intl., Dpto. de Manejo Integrado de Plagas y Malezas CTO. p. 4. [ Links ]
Flores-Vi ndas, E. 1999. La planta: estructura y función. Vol 1. Libro Universitario Regional. Cartago, Costa Rica. 367 p. [ Links ]
Gamboa, JP; Abdelnour, A. 1999. Micropropagación de melina (Gmelina arborea RO XB). Agronomía Costarricense 23:69-76. [ Links ]
Gangopadhyay, G; Das, S; Mitra, SK; Poddar, R; Modak, BK; Mukherjee, KK. 2002. Enhanced rate of multiplication and rooting through the use of coir in aseptic liquid culture media. Plant Cell Tissue and Organ Culture. Netherlands 68:301-310. [ Links ]
George, E. 1996. Plant propagation by tissue culture; part 2. In Practice. 2 ed. Exegetics Limited. England. 1361 p. [ Links ]
George, E; Hall, MA; De Klerk, G. 2008. Plant propagation by tissue culture. 3 ed. Springer. Netherlands p. 1-3. [ Links ]
Hennen, G. 1999. Quality from a young plant perspective. Kluwer Academic Publishers. Plant Biotechnology and In Vitro Biology in the 21st Century. Proceedings of the IXth International Congress of the International Association of Plant Tissue Culture and Biotechnology.Jerusalem, Israel. Altman, A; Ziv, M; Izhar, S. eds. Netherlands. p. 643-646. [ Links ]
Herrera, F. 1997. Plantas invasoras y su potencial de uso en agricultura tropical: Coberturas en café (Coffea arabica) y banano (Musa acuminata). Boletín Técnico Estación Experimental Fabio Baudrit Moreno 30(1): 51-61. [ Links ]
Hosseyni, N; Ozan, A; Kaya, Z. 1999. Basal nutrient and hormonal requirements for direct organogenesis of Cedrus libani A. Rich. Plant Biotechnology and In Vitro Biology in the 21st Century. Proceedings of the IXth International Congress of the International Association of Plant Tissue Culture and Biotechnology. Jerusalem, Israel. p. 53-56. [ Links ]
López, C. 1996. Vitrificación de plantas cultivadas in vitro (en línea). Encuentros en la Biología No. 28. Universidad de la Rioja, España. Consultado 26 feb. 2010. Disponible en http://dialnet.unirioja.es/servlet/articulo?codigo=277153. [ Links ]
López, S. 2005. Evaluación de antibióticos, productos cúpricos y un controlados biológico en el control preventivo de Pseudomonas sp. en Leucadendron cv. Safari Sunset. Me moria de Título Presentada a la Universidad de Talca como parte de los requisitos para optar al título de Ingenie ro Agrónomo (en línea). Universidad de Talca. Chile. Consultado 26 feb 2010. Disponible en <<http://www.bionativa.cl/pdf/tesis/nacillus/t2.pdf>> [ Links ]
Lummerding, P. 2001. Mi cropropagation Protocol Development for Se a buckthorn (Hippophae rhamnoides) (en línea). Selections for Commercial Orchard Production. Canada. p. 1-39. Consultado 15 ago 2006. Disponible en http://www.agr.gov.sk.ca/afif/Projects/19980162.pdf [ Links ]
Madhava, M; Sreenivasan, CS. 2004. Effect of abscisic and cytokinins on cultured zygotic embryos of Coffea arabica L.Cv.Cauvery (Catimor). Plant Cell, Tissue and Organ Culture 79:279-284. [ Links ]
Murashige, T; Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco cultures. Physiol. Plant. 15:473-497. [ Links ]
Pinilla, C; García, J. 2002. Manejo integrado de malezas en plantaciones de banano. C. I. Uniban S.A. Colombia. p. 222-235. [ Links ]
Pospóšilová, J; Tichá, I; Kadleček, P; Haisel, D; Plzáková, S. 1999. Acclimatization of micropropagated plant to ex vitro conditions. Biologia Plantarum. Czech Republic. 42:481-497. [ Links ]
Raghavan, V. 2003. One hundred years of zygotic embryo culture investigations. In Vitro Cell Developmental Biology 39:437-442. [ Links ]
Reed, BM; Engelmann, F; Dulloo, ME; Engels, JMM. 2004. Technical guidelines for the management of field and in vitro germplasm collections. IPGRI Handbook for Ge nebanks Nº 7. International Plant Ge netic Resources Institute. Rome, Italy. p. 72. [ Links ]
Sahijram, L; Soneji, JR; Bollama, KT. 2003. Analyzing somaclonal variation in micropropagated bananas (Musa spp.). In Vitro Cell. Dev. Biol.—Plant 39:551–556. [ Links ]
Sancak, C. 1999. In Vitro micropropagation of sainfoin (Onobrychis viciifolia Scop.) (en línea). Ankara, Turkey. Consultado 25 ene. 2007. Disponible en http://journals.tubitak.gov.tr/botany/issues/ bot-99-23-2/bot-23-2-8-98062.pdf [ Links ]
Sancho F; Cervantes, C. 1997. El uso de plantas de cobertura en sistemas de producción de cultivos perennes y anuales en Costa Rica. Agronomía Costarricense 21(1):111-120. [ Links ]
Sandoval, J; Brenes, G; Pérez, L. 1991. Micropropagación de plátano y banano (Musa AAB, AA) en el CATIE. Serie Técnica. Informe técnico No. 186. Centro Agronómico Tropical de Investigación y Enseñanza (CATIE), Turrialba, Costa Rica. 24p. [ Links ]
Zebrowska, JI; Czernas, J; Gawronski, J; Hortynski, JA. 2003. Suitability of strawberry (Fragaria x ananassa Duch.) microplants to the field cultivation. (en línea). Food, Agriculture & Environment. Poland. 1(3&4): 190-193. Consultado 25 enero 2007. Disponible en http://www.world-food.net/scie ntficjournal/2003/issue3/pdf/agriculture/agriculture-15.pdf [ Links ]
Ziv, M. 2000. Bioreactor technology for plant micropropagation. Horticultural Reviews. Wiley & Sons, Inc. Jerusalem, Israel. V. 24. p. 1-30. [ Links ]