1. Introducción
1.1. Enfoque
La Dosimetría Biológica (DB) implica el uso de ensayos citogenéticos para registrar la frecuencia de aberraciones cromosómicas y con base en ella, estimar la dosis absorbida de radiaciones ionizantes a la que un individuo ha estado expuesto (Lamadrid, Romero, González y García, 2014). El análisis de cromosomas dicéntricos se ha convertido en el estándar de oro en la DB y se trata de una técnica rutinaria en los programas de protección radiológica y de respuesta a emergencias en muchos países, donde se aplica en casos de sobreexposiciones reales o sospechosas en los que se ha demostrado el valor del método y se han definido sus limitaciones (Sproull, Camphausen y Koblentz, 2017). Es particularmente importante su aplicación cuando resultan sobreexpuestas personas que no portan dosímetros físicos o los mismos resultan dañados, convirtiéndose en una fuente de información insustituible para la toma de decisiones médicas al proporcionar la información más precisa sobre la dosis recibida por las personas afectadas. Es una herramienta de reconocido valor cuando, por cualquier causa, ocurren exposiciones masivas a radiaciones ionizantes (OIEA, 2014).
La DB ha tenido un rol protagónico en el esclarecimiento de las dosis de radiación durante grandes accidentes nucleares como el de Chernóbil (Pyatkin, Nugis y Chirkov., 1989) pero también ha sido decisiva en el esclarecimiento de las dosis en accidentes ocurridos debido a pérdidas de fuentes radiactivas que han afectado a miembros del público o trabajadores, como el accidente de Goiania, Brasil (IAEA, 1988) en Cochabamba Bolivia (IAEA, 2004) o el de Nueva Aldeas Chile (IAEA, 2009) por solo mencionar alguno de los más significativos ocurridos en la región y a los cuales han respondido laboratorios de DB latinoamericanos.
1.2. Establecimiento de un Servicio de Dosimetría Biológica en el INISA
Para la apertura de un servicio de DB, son necesarias varias condiciones, entre las cuales destacan la adquisición de equipo moderno que permita el análisis ágil de diferentes marcadores de exposición a radiación ionizante (Romm et al., 2013), la capacitación del personal a cargo de los ensayos, en el análisis e interpretación de resultados y la elaboración de curvas dosis-efecto para los distintos marcadores y tipos de radiación (International Organization for Standardization, 2014).
Con el apoyo de la Universidad de Costa Rica y el Organismo Internacional de Energía Atómica (OIEA), a través del Proyecto Nacional de Cooperación Técnica llamado: Establecimiento de un Servicio de DB en Costa Rica, se lograron adquirir nuevos equipos que permitieron ampliar las capacidades técnicas ya existentes en el país, entre estos destaca el equipo automatizado (Metafer4) de MetaSystem.
Este proyecto también contempló capacitaciones para el personal a cargo del laboratorio de DB: entrenamientos en el Laboratorio de DB del Instituto de Radioprotección y Seguridad Nuclear (IRSN) de Francia (2016), en la Universidad Autónoma de Barcelona (UAB) (2017), en el laboratorio de DB de la Autoridad Nuclear de Argentina (ARN) (2017) y se realizaron distintas visitas de expertos al país por parte de representantes del Centro de Protección e Higiene de las Radiaciones (CPHR) de Cuba (2015, 2017 y 2018) y de la Autoridad Regulatoria Nuclear de Argentina. (2017). Gracias a estos intercambios bilaterales con el Laboratorio Radiobiología del CPHR, se realizaron entrenamientos de capacitación en la técnica de análisis de cromosomas dicéntricos.
El INISA organizó en 2015 un curso de DB dirigido a entidades nacionales, estudiantes universitarios y a público en general, con el objetivo de introducir el tema en el país y en diciembre del 2017 se impartió un curso de estadística para DB. Ambos cursos fueron organizados como parte de las misiones de expertos anteriormente mencionadas.
El desarrollo de los aspectos técnicos de la DB ha estado acompañado de la coordinación con las estructuras nacionales de respuesta a emergencias radiológicas. Así, el INISA ha establecido una alianza estratégica con la Dirección de Protección Radiológica y Salud Ambiental, específicamente con la Unidad de Protección Radiológica del Ministerio de Salud, ente rector que canaliza las emergencias radiológicas en Costa Rica. También hay colaboración con expertos del Centro de Investigación en Ciencias Atómicas Nucleares y Moleculares (CICANUM) de la Universidad de Costa Rica.
En el ámbito internacional también se han establecido relaciones de cooperación. En el año 2014 se logró la incorporación del Servicio de DB del INISA a la Red Latinoamericana de DB (LBDNet), la cual fue fundada en el 2007 y que actualmente cuenta con la participación de laboratorios de Argentina, Brasil, Chile, Cuba, México, Perú, Uruguay, Ecuador, Bolivia, Paraguay y Venezuela (García et al., 2016). En 2017, Costa Rica fue sede del segundo taller regional de la LBDNet para elaborar curvas de calibración, usando el repositorio de imágenes BioDoseNet resguardado por la Oficina Federal Alemana de Protección Radiológica, en el que participaron los laboratorios de Bolivia, Ecuador, Paraguay y Venezuela, donde existen limitaciones para la irradiación de muestras de sangre y preparar curvas de calibración (García et al., 2019). Los especialistas del INISA se sumaron a equipos de trabajo de esos países, aportando sus experiencias en la identificación de dicéntricos. En ese mismo año Costa Rica fue sede de la reunión anual de la LBDNet.
Para establecer un servicio de DB, es esencial contar con curvas de calibración dosis-efecto, las cuales permiten establecer una relación matemática entre las dosis de radiación y la frecuencia de un biomarcador citogenético observable en cada punto de dosis (ISO, 2014). El desarrollo de capacidades técnicas y conocimientos, así como la adquisición de equipamiento, permitió al INISA desarrollar su primera curva de calibración dosis-efecto, utilizando como biomarcador los cromosomas dicéntricos. Los análisis sobre migración y colectivos migrantes deben anclarse en bases interpretativas multidimensionales, pero, al mismo tiempo, particularizarse en fenómenos, poblaciones y contextos concretos. Dicho esto, la presente investigación se enfocó en la comprensión del fenómeno de la salud, a través de su representación social, en la población migrante nicaragüense en un contexto urbanizado de Costa Rica durante el año 2019.
2. Referente teórico
2.1. Genotoxicidad de las radiaciones ionizantes
Las radiaciones ionizantes son ondas electromagnéticas o partículas que transportan energía. Cuando la energía de las radiaciones es suficiente como para producir la ionización de átomos y moléculas con los que interactúa, se conoce como radiación ionizante (RI) y es capaz de inducir cambios estructurales o conformacionales en biomoléculas como el ADN (OIEA, 2016).
Los efectos biológicos sobre el ADN pueden ser indirectos en los cuales se produce la radiólisis del agua, y los radicales •OH generados y otras especies reactivas del oxígeno y del nitrógeno pueden inducir la ruptura de una o ambas cadenas de nucleótidos o inducir modificaciones en las bases nitrogenadas (Giaccia, Hall y Amato, 2012; Sage y Shikazono, 2017). Los efectos biológicos de la radiación como agente genotóxico también pueden ser directos, en este mecanismo los fotones o partículas de RI depositan su energía en los átomos constituyentes de la molécula de ADN, causando daños en su estructura como rupturas de hebra simple o hebra doble (Cannan y Pederson, 2016).
Además de las rupturas mono y bicatenarias y el daño a las bases nitrogenadas, la RI es capaz de producir un amplio espectro de daño al ADN dentro de los cuales se encuentran: sitios apurínicos o apirimidínicos, formación de aductos entre el ADN y las proteínas, alteraciones cromosómicas como la formación de cromosomas dicéntricos, anillos céntricos, fragmentos acéntricos y translocaciones, y la formación de micronúcleos (MN) y de puentes nucleoplásmicos (OIEA, 2014).Todos estos tipos de daño en el ADN participan en numerosas condiciones y patologías como el envejecimiento y la carcinogénesis.
La efectividad biológica relativa (RBE), la cual se define como la relación entre una dosis impartida por fotones y la dosis de otro tipo de radiación para producir el mismo efecto biológico (Sørensen et al., 2017), está determinada por las propiedades físicas de la radiación como su carga eléctrica, energía y transferencia lineal energética (LET, cantidad de energía depositada por la RI por unidad de distancia). La RI con bajo LET (rayos X, rayos gama, partículas beta) induce menor concentración de eventos de ionización y por lo tanto lesiones del ADN en menor densidad que la RI con alto LET (partículas alfa, protones) (Lavelle y Foray, 2014).
2.2. Ensayo de cromosomas dicéntricos.
El daño radioinducido al material genético puede ser evaluado mediante distintos métodos citogenéticos. Estos ensayos constituyen una herramienta auxiliar en la protección radiológica y un instrumento fundamental en la investigación en el campo de la radiobiología. Muchos de estos ensayos son utilizados en la estimación de la dosis de radiación que un individuo ha recibido, procedimiento conocido como DB. Sin embargo, para tal estimación es necesario conocer la relación o curva dosis respuesta que se asocia a la aparición de los biomarcadores que serán utilizados como biodosímetro (Suto, Akiyama, Noda y Hirai, 2015).
Debido a que los distintos tipos de RI presentan distinta RBE, para la estimación de dosis mediante el método de la DB, se debe conocer el tipo de radiación a la que estuvo expuesto el individuo y cada laboratorio debe tener sus propias curvas de calibración dosis-efecto para cada tipo de RI y de ser posible, contar con distintos biomarcadores.
De manera general, los biomarcadores son parámetros biológicos que brindan información sobre el estado fisiológico o patológico de un individuo o población (Torres-Bugarín, Zavala-Cerna, Nava, Flores-García y Ramos-Ibarra, 2014). Los principales ensayos utilizados para la detección de daño cromosómico radioinducido son el ensayo de cromosomas dicéntricos, el ensayo de MN con bloqueo de la citocinesis, el ensayo de translocación cromosómica por FISH, ensayo de focos γ-H2AX y de perfiles de expresión genómica (Baeyens et al., 2011).Los ensayos mencionados (a excepción de perfil genómico y los focos γ-H2AX) se basan en la descripción del efecto de la radiación en relación a la frecuencia por metafase de una aberración cromosómica inducida por la exposición (Milosević-Djordjević, Grujiciĉ, Vaskoviĉ, y Marinkoviĉ,, 2010; Özdal et al., 2016; Wolff et al., 2011).
El ensayo de cromosomas dicéntricos es una prueba ampliamente validada y su biomarcador es sumamente específico a la exposición a radiaciones, siendo los cromosomas dicéntricos generados solo por RI y unas pocas sustancias radiomiméticas (Lee, Woo Jin, Wilkins, y Jang , 2019).Otras ventajas de esta prueba son la posibilidad de la evaluación de la exposición meses después de su ocurrencia, la posibilidad de análisis de exposiciones parciales o de cuerpo entero así como de exposiciones hasta el rango de 6 Gy (Alsbeih, Al-Hadyan, Al-Harbi, Bin Judia y Moftah , 2020; Rungsimaphorn,Rerkamnuaychoke y Sudprasert , 2016).
Por las razones expuestas anteriormente, este ensayo se ha convertido en el estándar de oro en dosimetría biológica y constituye una prueba esencial en la investigación de accidentes radiológicos e investigación radiobiológica (García et al., 2019). Así, el objetivo de este trabajo fue el establecimiento de un servicio de dosimetría biológica para Costa Rica, elaborando una curva de calibración dosis-efecto para rayos gamma.
3. Métodología
3.1 Enfoque
La investigación es de tipo cuantitativa, transversal, descriptiva y observacional, ya que se analiza la asociación entre un efecto (frecuencia de cromosomas dicéntricos) con una dosis absorbida debido a exposición a RI.
3.2 Población del estudio
Se tomaron muestras de sangre de dos voluntarios, uno femenino y otro masculino. Los participantes leyeron y firmaron el consentimiento informado respectivo.
3.3 Técnicas de recolección
3.3.1 Recolección e irradiación de muestras de sangre
Se consideraron las recomendaciones del OIEA descritas su Manual de Dosimetría Citogenética (OIEA, 2014). La irradiación se realizó en el Servicio de Radioterapia del Hospital San Juan de Dios, con una fuente de Co-60 del equipo modelo THERATON 780E. Para su irradiación, las muestras se colocaron en un maniquí de agua de plástico con una geometría de 10 cm x 10 cm x 0,11 mm. El campo de irradiación fue de 10x10 cm² y el maniquí de agua fue ubicado a 80 cm de distancia de la fuente, utilizándose la técnica de dos campos opuestos laterales, la temperatura del agua en el maniquí se mantuvo entre 36-37 °C. La tasa de dosis (Dw) inicial del equipo en la puesta en funcionamiento fue de 3.75 Gy/min (11 mayo de 2011), se recalculó para las fechas de irradiación de muestras, por lo tanto, se irradió con las siguientes tasas de dosis: Dw =1,55 Gy/min (29 de enero de 2018, fecha de inicio de las irradiaciones) y Dw = 1,31 Gy/min (15 de mayo de 2019, fecha de última irradiación).
Se irradiaron las muestras de sangre en 11 puntos de dosis en el rango de 0 a 5 Gy: 0Gy, 0,1Gy, 0,25Gy, 0,5Gy, 0,75Gy, 1Gy, 1,5Gy, 2Gy, 3Gy, 4Gy y 5Gy. La sangre se recolectó e irradió en tubos de recolección de muestras con heparina de litio de 4 mL, marca Vacuteiner© (alto y ancho del tubo: 13x75mm). El volumen de sangre irradiada fue de 3.5mL ± 0,5mL (la muestra se tomó hasta agotar el vacío del tubo). Después de la irradiación la muestra de sangre se mantuvo a 37± 0,5 °C en baño maría por 2 horas, luego se transportó al INISA, para su cultivo (OIEA, 2014).En concordancia con el abordaje y el enfoque investigativo, para acercarse a la temática y la población en cuestión fue necesario visitar las zonas donde se reúnen las mayores comunidades de personas nicaragüenses en Costa Rica. Una locación específica está ubicada en el cantón central de San José, específicamente en el distrito #3, Hospital: el parque Braulio Carrillo, también conocido popularmente como parque de La Merced (Miranda, 2019; Alvarado, 2018). La fase de recolección de datos fue llevada a cabo entre abril y noviembre del año 2019.
3.3.2. Cultivo de linfocitos
El cultivo de linfocitos, la cosecha de células en metafase, la preparación de extensiones cromosómicas y el análisis citogenético de cromosomas dicéntricos se realizó considerando el protocolo descrito por el OIEA (OIEA, 2014), modificado con base en recomendaciones del Laboratorio de DB de la Autoridad Regulatoria Nuclear de Argentina y las destrezas adquiridas en las capacitaciones recibidas por el personal del laboratorio de citogenética del INISA.
Se sembró por duplicado 0,8 mL de sangre en 10 mL de medio de cultivo PBMax en cajas de cultivo T25. Se agregaron 10μL de solución de trabajo de Bromodeoxiuridina (BrdU), marca Sigma, lo que permitió distinguir entre cromosomas metafásicos de células que se encuentran en la primera división mitótica (M1) de aquellas que se encuentren en segunda división (M2). Posteriormente se adicionó fitohemaglutinina hasta llegar a una solución de trabajo del 3% y se incubó a 37 °C en atmósfera al 5 % de CO₂, por 48 horas. Al cabo de 45 horas de incubación, se agregó 200μL de colcemid (marca Gibco) a cada cultivo, para lograr el arresto mitótico. Se cultivó por 3 horas más, para un total de 48 horas.
3.3.3. Cosecha de linfocitos.
A las 48 horas de cultivo se inició la cosecha. Los cultivos se centrifugaron a 1200 -1300 rpm durante 10 min y se retiró el sobrenadante, luego se resuspendió el botón celular, se agregaron 7 mL de KCl (0,075 mol/L) a 37°C para someterlo a choque hipotónico. Los tubos se incubaron por 35 min, luego se agregó 1 mL de fijador (solución 3:1 de metanol/ácido acético) a cada tubo antes de centrifugar a 1200 rpm durante 10 min. Se descartó el sobrenadante, dejando 1mL para luego resuspender el botón celular. Posteriormente se agregó 10 mL del fijador (se añadió gota a gota de forma continua, homogeneizando con vórtex a 1400 rpm). Se repitió de dos a tres veces el ciclo de centrifugado y lavado con fijador hasta que el botón celular se observó blanquecino. Por último, se dejó reposar 1 h y luego se centrifugó, para quitar el sobrenadante, dejando el doble de fijador del tamaño del botón celular. Las células pueden guardarse en su primera fijación o en las siguientes, en refrigeración durante 24-48 h (OIEA, 2014).
3.3.4. Preparación de extensiones celulares:
Las células se gotearon sobre portaobjetos limpios y se secaron al aire durante 24 h. Una vez secos, se sumergieron en solución de naranja de acridina (10-6 mol/L) durante 10 minutos. Se enjuagaron dos veces en agua destilada y se dejaron secando. Se cubrieron con una película de solución de Na₂HPO₄ 0.07 mol/L y se irradiaron con luz ultravioleta por 30 minutos. Se enjuagaron con agua destilada y se secaron. Se sumergieron en solución de Ba(OH)₂ saturada durante 5 minutos y se enjuagaron en agua destilada. Se sumergieron por pocos segundos en HCl 0.1 mol/L para eliminar cristales depositados, y se enjuagaron rápidamente con agua destilada, se dejaron secando. Se tiñeron con giemsa al 4% durante 6 minutos y luego se enjuagaron con agua destilada (Chebotarev, Selezneva y Platonova , 1978).
3.3.5. Análisis microscópico
Se utilizó un microscopio automatizado para la captura de imágenes, el Metafer de MetaSystem versión 3.13.3. El análisis se considera semi automatizado ya que el equipo capturó las imágenes, pero el conteo de dicéntricos fue realizado por personal del laboratorio de citogenética del INISA. Las células analizadas y aberraciones encontradas se registraron en el sistema informático MetaArchive 5.4. Posteriormente, se elaboró una hoja de cálculo en Excel 2016 con la cantidad de células analizadas por punto de dosis, indicando el total de dicéntricos y el número de dicéntricos por célula. Con esto se calculó la frecuencia de dicéntricos en cada punto de dosis y su distribución.
Se contó el número de cromosomas y la cantidad de dicéntricos. Para la inclusión de metafases en el conteo, estas debían cumplir con los siguientes criterios de análisis citogenético:
3.4. Procesamiento de análisis
Para el procesamiento estadístico de los datos se utilizaron los programas DoseEstimate V5.2 2 (Ainsbury, Lloyd, 2010) y R versión 4.03 (R Core Team, 2020). DoseEstimate se utilizó para el ajuste de la curva de calibración y la estimación de las dosis incógnitas. R se utilizó para obtener el estadístico de dispersión del ajuste de la calibración, para ello se especificó en la función glm de R la familia Quasipoisson. Adicionalmente, se aplicó el programa R para realizar el análisis gráfico comparativo de la curva estimada con la curva de calibración publicada para el ensayo de dicéntricos en el Manual para Dosimetría Citogenética del OIEA (OIEA, 2014). Se consideró el estadístico de bondad de ajuste Ji-cuadrado y la prueba t de Student para significación estadística de los coeficientes estimados. Para la dosis incógnita se estableció como criterio de aceptación que la estimación realizada por la dosimetría biológica no se desviara más de un 20% con respecto a la dosis determinada por la dosimetría física. Ambos programas están recomendados por el OIEA para la dosimetría biológica (OIEA 2014) y con ellos se obtienen resultados similares tanto en el ajuste de curvas como en la estimación de dosis por lo que solo se presentan los resultados obtenidos con R (figura 1). DoseEstimate es de más fácil uso por los laboratorios que no cuentan con especialistas que dominen R, está más difundido en la LBDNet y es el que utilizaría el INISA en sus cálculos de dosis en situaciones de accidente.
4. Resultados
4.1 La frecuencia de aberraciones cromosómicas obtenidas en cada dosis de irradiación se muestra en la tabla 1.
Tabla 1 Frecuencia de cromosomas dicéntricos por punto de dosis de rayos gamma
| Dosis (Gy) | Total células analizadas | Total dic¹ | Distribución de dic por célula | Y² dic | U | |||||
| 0 | 1 | 2 | 3 | 4 | 5 | |||||
| 0 | 2007 | 3 | 2004 | 3 | 0 | 0 | 0 | 0 | 0,001 | -0,039 |
| 0,1 | 2011 | 9 | 2002 | 9 | 0 | 0 | 0 | 0 | 0,004 | -0,134 |
| 0,25 | 2000 | 21 | 1980 | 19 | 1 | 0 | 0 | 0 | 0,011 | 2,76 |
| 0,5 | 2000 | 54 | 1948 | 50 | 2 | 0 | 0 | 0 | 0,027 | 1,52 |
| 0,75 | 1880 | 100 | 1783 | 94 | 3 | 0 | 0 | 0 | 0,053 | 0,226 |
| 1 | 1045 | 102 | 943 | 102 | 0 | 0 | 0 | 0 | 0,098 | -2.22 |
| 1,5 | 489 | 101 | 390 | 97 | 2 | 0 | 0 | 0 | 0,207 | -2,59 |
| 2 | 316 | 99 | 233 | 70 | 11 | 1 | 1 | 0 | 0,313 | 1,19 |
| 3 | 196 | 100 | 116 | 61 | 18 | 1 | 0 | 0 | 0,51 | -0,849 |
| 4 | 100 | 101 | 29 | 47 | 19 | 4 | 1 | 0 | 1,01 | -1,91 |
| 5 | 61 | 105 | 9 | 20 | 18 | 9 | 3 | 2 | 1,72 | -0,694 |
| 1dic: cromosoma(s) dicéntrico(s) | ||||||||||
| 2Y: frecuencia | ||||||||||
Se aprecia un incremento de la frecuencia de cromosomas dicéntricos al aumentar la dosis de rayos gamma. Atendiendo a la distribución de dicéntricos la mayoría de las muestras irradiadas se ajustan a la distribución de Poisson como se espera para un escenario homogéneo.
4.2 Curva dosis efecto
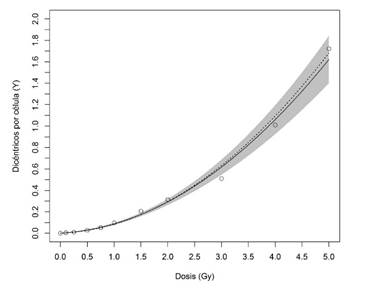
La curva dosis efecto para rayos gama según los datos obtenidos se muestra en la figura 1.
La curva continua representa el ajuste a partir de los datos obtenidos por el INISA para el ensayo de cromosomas dicéntricos. El área sombreada representa la incertidumbre de la estimación con un nivel de confianza del 95%. La curva punteada representa la curva referida en el manual del OIEA para el ensayo de dicéntricos (OIEA, 2014).
Los coeficientes de la curva se muestran en la tabla II junto a los coeficientes de la curva del manual del OIEA (OIEA, 2014)
Tabla 2 Coeficientes estimados de la curva de calibración con errores estándar (ES) del INISA y la utilizada como ejemplo en el manual del OIEA (OIEA, 2014) para rayos gamma (60-Co).
| - | C ± ES | α ± ES | β± ES | χ2 | GL | Dispersión |
| INISA | 0.00129 ±0.00084 | 0.02737 ± 0.00658 | 0,05938 ± 0,00450 | 10,48 | 8 | 1.3095 |
| Manual OIEA | 0.00128 ±0.00047 | 0.02103± 0.00516 | 0,06307 ±0,00401 | 6,61 | 8 | 0.8256 |
ES: desviación estándarGL: grados de libertad
Se verificó la bondad de ajuste con la prueba de χ2 (ji-cuadrado) que utiliza el ajuste de máxima verosimilitud, con resultado de χ2 =10,48; GL = 8; p= 0,2329.
4.3 Validación de la curva
La curva se validó calculando dos dosis incógnitas. Para ello se irradiaron muestras de forma homogénea a 1,5 Gy y 4 Gy. Las condiciones de irradiación y cultivo de linfocitos fueron las mismas usadas para generar la curva de calibración. La dosis suministrada es comparada con la dosis estimada utilizando la curva de calibración. Se consideró como criterio de aceptación que la dosis estimada se encuentre en un rango que contempla el 20% de la dosis suministrada y el valor del z score sea mayor que -3 y menor que 3. Los resultados obtenidos se muestran en la tabla III.
Tabla 3 Análisis de las dosis incógnitas.
| Dosis irradiada (Gy) | Células analizadas | Dic observados | Dic/cel | u Test | Dosis estimada (Gy) | 95% ICi | 95 % ICs | z score |
| 1.5 Gy | 500 | 85 | 0,17 | -0,08 | 1,47 ± 0,101 | 1,292 Gy | 1,659 Gy | -0,3 |
| 4 Gy | 500 | 100 | 0, 87 | -0,98 | 3,62 ± 0,139 | 3,240 Gy | 4,011Gy | -1,44 |
La exposición a panoramas pacíficos, seguros y sin conflictos armados, junto al empleo y la estabilidad financiera, conducen a que la persona migrante vincule el vocablo «salud» a conceptos que poseen como tronco común también la abstracción. De hecho, mentalmente, la salud se halla conexa y de cierto modo homologada con nociones como el bienestar, la felicidad, la tranquilidad, la paz, la vida, el amor y la superación personal.
Esa homologación semántica aparece como la primera representación asociada a la salud entre las personas migrantes nicaragüenses. Dado que la salud se encuentra igualada a concepciones como las descritas, se representa como una meta de vida. Es decir, se trata de una sensación etérea, agradable y futura que evoca tranquilidad, seguridad y estabilidad personal y familiar. Este hecho se evidencia en la figura 3.
5. Discusión
Los resultados obtenidos para la estructuración de la curva dosis-efecto nos muestran que la frecuencia de cromosomas dicéntricos aumenta conforme la dosis y su comportamiento se ajusta al modelo lineal cuadrático. Los coeficientes calculados α(constante lineal), β(constante cuadrática) y C (frecuencia basal de dicéntricos) tienen valores similares a los reportados internacionalmente.
Los puntos de datos ajustados no fueron estadísticamente diferentes de los observados, lo que confirma un buen ajuste de la curva de calibración dosis-efecto. No obstante, la dispersión del modelo mayor a 1 condicionó el ajuste de los errores de los coeficientes de la curva del INISA los cuales se incrementan en relación con su magnitud tal y como se recomienda(OIEA, 2014). Para una regresión de Poisson se espera idealmente una dispersión igual a 1. Por otro lado, la magnitud de la dispersión no justificó el cambio a un modelo diferente al de Poisson. La sobredispersión está condicionada fundamentalmente por la desviación del punto correspondiente a la dosis de 3 Gy (Fig. 1), aspecto que puede ser atendido con la adición de nuevos puntos a la calibración como perspectiva del laboratorio con dosis incógnitas en el entorno cercano 3 Gy pero que en ningún caso limita la aplicación de la curva para la estimación adecuada de las dosis en casos de accidentes o en ejercicios de intercomparación en los cuales se vea involucrado el laboratorio. Internamente la curva se validó calculando dos dosis incógnitas. Las dosis suministradas fueron de 1,5 y 4 Gy y las dosis estimadas fueron 1,47 y 3,616 Gy respectivamente, no existen diferencias significativas entre ambos valores (z score inferior a 3). Se han realizado ejercicios de intercomparación dentro de la LBDNet en los cuales participa Costa Rica y cuyos resultados preliminares no han sido publicados, muestran un buen desempeño del laboratorio usando su curva de calibración, lo cual ratifica también la adecuada calificación de los observadores del INISA.
La presente investigación muestra la trayectoria y actividades del laboratorio de Citogenética del INISA que han permitido la apertura del primer Servicio de DB de la región centroamericana, lo que permite que puedan realizarse estimaciones de dosis acorde a las prácticas internacionales reconocidas ante potenciales situaciones de exposiciones accidentales o accidentes radiológicos, además de la realización de investigaciones innovadoras en el campo de la radiobiología y la radioprotección.
Dentro de las investigaciones actualmente en ejecución, se encuentra el desarrollo de una curva de calibración dosis-efecto para rayos X utilizando el ensayo de micronúcleos con bloqueo de la citocinesis para el rango de dosis de 0 a 4 Gy y el ensayo de cromosomas dicéntricos para dosis en el rango de 0 a 14 Gy. De igual forma se ha inicio la aplicación del ensayo de cromosomas dicéntricos con cafeína para la estimación de altas dosis de radiación en el rango de los 6 a18 Gy. Estos proyectos se ejecutan con el apoyo de proyectos nacionales financiados por el OIEA y coordinados por la Dirección de Protección Radiológica y Salud Ambiental del Ministerio de Salud. Además, del apoyo de los hospitales de la Caja Costarricense del Seguro Social (CCSS) y del Centro de Radiocirugía Robótica, cuyas instalaciones y equipos, son necesarios para irradiar las muestras de sangre utilizadas en la elaboración de curvas de calibración dosis efecto.
El servicio de DB del INISA también ha comenzado a contribuir de manera significativa a las actividades de la LBDNet. Además de la organización de talleres de capacitación, el servicio ha aportado las imágenes para la reciente intercomparación con el ensayo de cromosomas dicéntricos organizando por LBDNet, lo cual coloca a Costa Rica dentro del reducido número de países de la región que ha brindado este tipo de material para el desarrollo de estos ejercicios.
El abordaje desarrollado por el INISA para implementar un servicio de DB responde al enfoque sugerido en el proyecto regional sobre respuesta a emergencias radiológicas del OIEA, en el que se recomienda la adecuación de laboratorios de citogenéticas existentes en instituciones de salud o universitarias para desarrollar en los países que lo requieran este tipo de servicio. La peculiaridad de Costa Rica fue la de combinar este enfoque con el desarrollo de un proyecto nacional con apoyo gubernamental y del OIEA, lo cual permitió que el país fortaleciera sus capacidades técnicas y la preparación de su personal en un tiempo relativamente corto. Expertos del OIEA que colaboraron en el desarrollo de este proyecto sugirieron al organismo que países de la región con condiciones similares a las de Costa Rica e interesados en desarrollar este tipo de servicio enviaran becarios al laboratorio del INISA. Bajo este enfoque ya el laboratorio recibió en 2019 una becaria de Nicaragua.
Todo lo anterior confirma que las capacidades creadas en el INISA en la DB son indudablemente una fortaleza en la vigilancia en salud de poblaciones expuestas a radiaciones ionizantes, no solo a nivel nacional sino también para la región centroamericana.
Dedicatoria
A la Dra. Isabel Castro Q.E.P.D, por impulsar la Dosimetría Biológica en Costa Rica, gestora de este proyecto.