Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Costarricense de Cardiología
versión impresa ISSN 1409-4142
Rev. costarric. cardiol vol.3 no.3 San José dic. 2001
Introducción
La experiencia con los betabloqueantes y con los antagonistas de la aldosterona en IC es relativamente reciente, por el contrario hace ya más de una década que los IECA vienen demostrando sus efectos beneficiosos (14,15). Desde el estudio CONSENSUS publicado en 1987, que demostró que los IECA reducían significativamente la mortalidad en la IC severa (12), han aparecido otros grandes estudios que han demostrado igualmente la eficacia de estos fármacos en formas menos graves de IC incluso previenen IC en la disfunción ventricular asintómatica (13,16,17). Los IECA han demostrado mejorar los síntomas, la calidad de vida y la tolerancia al ejercicio, disminuir la progresión de la enfermedad en la disfunción ventricular asintomática y aumentar la supervivencia en la IC asociada a función sistólica disminuida. Como promedio producen mejoría clínica en un 50-80% de los pacientes, mejorando su clase funcional en 0,5-1 grado de la NYHA, reduciendo la hospitalización en un 15% y disminuyendo la mortalidad anual en un 16% en pacientes con IC moderada y en un 31% en pacientes con IC severa (18). Además, han demostrado que también disminuyen la mortalidad en pacientes con disfunción ventricular postinfarto de miocardio ya sea sintomática o asintomática (19-21). Incluso mejoran la situación clínica y función ventricular en pacientes con IC asociada a infarto de miocardio previo y fracción de eyección normal (22). Por todo ello, y en función de los datos disponibles en la actualidad, las principales directrices de tratamiento establecen que los IECA son fármacos de primera elección en IC. De hecho, están indicados en todos los pacientes con IC clínica o disfunción ventricular asintomática con fracción de eyección inferior a 35%, a menos que haya contraindicaciones específicas para su uso terapéutico (23-25). En la Tabla I se exponen los principales estudios a largo plazo realizados con IECA en IC o disfunción ventricular izquierda asintomática.

La utilidad clínica de los IECAs en pacientes con IC clásicamente se atribuye a la inhibición que ejercen sobre el SRAA (26). Sin embargo, existen dudas sobre la capacidad de los IECA para la inhibición a largo plazo del SRAA. De hecho, en las primeras descripciones del enalapril ya se evidenciaba su falta de capacidad para mantener inhibido el SRAA durante 24 horas (27). Actualmente se sabe que en el tratamiento crónico con IECA, los niveles de angiotensina II y de aldosterona pueden volver a elevarse, al menos en algunos pacientes. Esto se puede deber, en parte, a que los IECA son inhibidores competitivos cuya acción puede sobrepasarse con el aumento endógeno compensatorio de renina plasmática y angiotensina I (28-31). Pero, incluso a pesar de que los niveles circulantes de angiotensina II puedan estar disminuidos por acción del IECA, persiste actividad tisular de dicha enzima no inhibida que puede jugar un papel muy relevante a nivel local y concretamente en miocardio (32). Por otra parte, se ha observado que existen otras vías de producción de angiotensina II desde angiotensina I mediante la acción de enzimas distintas de la ECA como la quimasa, la catepsina G o la CAGE (enzima generadora de angiotensina sensible a quimostatina), incluso se han descrito vías alternativas que pueden transformar directamente angiotensinógeno en angiotensina II como t-PA (activador tisular del plasminógeno) tonina o catepsina G (Figura 1). Por tanto, la producción de angiotensina II puede escapar, al menos parcialmente, al efecto inhibidor de los IECA (33-35). Este fenómeno, que ocurre a pesar de un bloqueo efectivo de la ECA, parece tener relación con la progresión de la enfermedad. Un reciente estudio ha demostrado que el 50% de los pacientes con IC mantienen niveles elevados de angiotensina II pese al tratamiento crónico con IECAs y son estos pacientes, en los que los niveles de angiotensina II persisten elevados a pesar del IECA, los que presentan una mayor activación neurohormonal y un peor pronóstico (36).
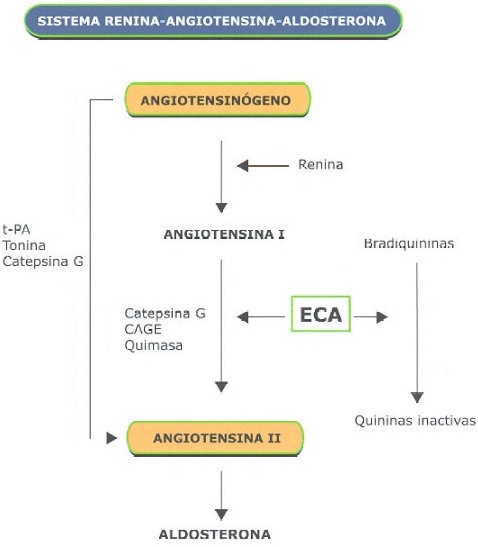
Pero la ECA no sólo actúa catalizando el paso de angiotensina I a angiotensina II; la ECA es una enzima es muy inespecífica y, además de la acción sobre angiotensina I, es bien conocido que actúa también transformando la sustancia P y la bradiquinina en productos inactivos. Por tanto, los IECA no sólo disminuyen la formación de angiotensina II sino también aumentan el nivel de sustancia P y bradiquininas al bloquear su degradación. La bradiquinina ulteriormente estimula la producción de óxido nítrico y consecuentemente produce natriuresis, vasodilatación y regresión de la hipertrofia y fibrosis, lo que puede añadir efectos beneficiosos adicionales a la acción de los IECA (37). Dado que con los IECA no existe una inhibición completa del SRAA, en los últimos años se ha propuesto que el efecto beneficioso a largo plazo de los IECA podría residir más en el sistema de las quininas que en la propia inhibición del SRAA. De hecho se ha implicado a las quininas tanto en el mantenimiento de la tensión arterial a largo plazo, como en diferentes acciones de los IECA como el efecto cardioprotector postinfarto o la reducción de la progresión de la aterosclerosis (38).
Por otra parte, a pesar de la incuestionable evidencia científica de los beneficios de los IECA en IC, se observa una infrautilización de estos fármacos en la práctica clínica (39-41). Probablemente este hecho se debe, en gran parte, a que muchos clínicos consideran que los IECA pueden causar efectos secundarios importantes en los pacientes con IC, principalmente hipotensión, disfunción renal, hiperkalemia y tos. Respecto a la hipotensión, en pacientes con disfunción sistólica asintomática los IECA producen una leve disminución de las cifras de presión arterial sistólica y diastólica. En el estudio CONSENSUS, que incluía a pacientes en clase funcional IV, la hipotensión apareció en el 11.8% de los pacientes que recibieron 5 mg. de enalapril y el 3,2% de los que recibieron 2,5 mg. (12). En formas menos graves de IC, como son los pacientes del estudio SOLVD, la hipotensión se observó en un 1% de pacientes, aunque la incidencia fue algo mayor (4,75%) al inicio del tratamiento (13). El riesgo de presentar hipotensión es más elevado en pacientes con IC severa, en aquellos tratados con altas dosis de diuréticos y en los pacientes de mayor edad. Por tanto, se recomienda el inicio gradual del tratamiento, siendo especialmente cuidadoso en estas situaciones (25). En cuanto a la insuficiencia renal, se observan incrementos mínimos de niveles de creatinina en pacientes normotensos con disfunción ventricular asintomática; sin embargo, en caso de IC severa se objetivó un incremento de la creatinina entre un 10-15% tras el inicio del tratamiento, que retornaba a los valores iniciales tras suspenderlos (12). Una vez más el deterioro de la función renal era mayor en pacientes con depleción de volumen (altas dosis de diuréticos), con deterioro previo de la función renal y en los de mayor edad (42). Pero el efecto adverso más frecuente y característico de los IECA es la tos seca. Este es un efecto secundario relativamente frecuente y, aunque no es grave, puede ser un problema muy importante porque es motivo de abandono del tratamiento en un 10-20% de pacientes. Sería importante, por tanto, disponer de fármacos que, con una eficacia similar o mejor que la de los IECA, presenten menos efectos adversos, lo que podría evitar que fueran infrautilizados en la práctica clínica (18,43). Surge así la necesidad de buscar moléculas que actúen bloqueando de un modo más selectivo y eficaz la angiotensina II y combinen efectos cardiovasculares al menos tan favorables como los del IECA con un mejor perfil de tolerancia (44).
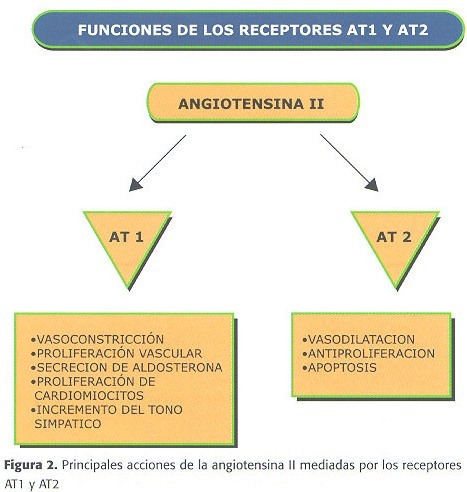
Por otra parte, mientras los IECA inhiben la degradación de bradiquinina y por tanto aumentan la liberación de óxido nítrico con sus posibles efectos beneficiosos, los BRA carecen de este efecto. Pero una de las principales ventajas clínicas de los BRA frente a los IECA es su excelente tolerancia que ha demostrado ser similar al placebo, en particular es especialmente relevante la ausencia de efectos adversos como la tos irritativa o el angioedema, ambos en relación con el aumento de sustancia P y quininas. Es decir, si bien con los BRA se perderían los efectos favorables derivados de la activación de las quininas, en contrapartida se logra un perfil de tolerancia único. Pero además, se ha demostrado que los BRA también pueden producir un aumento de la producción de oxido nítrico por otras vías, a través de la activación del receptor AT2, (53,54). Por tanto, si los efectos hemodinámicos parecen ser superponibles a los de los IECA y sin embargo, no presentan muchos de los efectos adversos de éstos últimos, es lógico que los BRA se hayan convertido en una alternativa muy válida en casos de intolerancia a IECA (55). En el momento actual los BRA ya comercializados y disponibles para uso clínico son losartán, valsartán, irbesartán, candesartán, telmisartán y eprosartán.
Por todo lo expuesto, los BRA se revelan como una opción muy atractiva para el tratamiento de la IC, bien como alternativa a los IECA o bien como tratamiento coadyuvante asociado a IECA. En efecto, varios estudios a corto plazo en pacientes con IC han demostrado que los BRA son bien tolerados, tienen efectos hemodinámicos beneficiosos y aumentan la tolerancia al ejercicio (56-59). Con estos antecedentes, en los últimos años se han desarrollado diversos ensayos clínicos dirigidos tanto a comparar IECA con BRA como a analizar las posibles ventajas de la combinación IECA-BRA bajo la hipótesis de obtener un mayor beneficio mediante una inhibición más completa del SRAA junto al efecto adicional secundario al aumento de las quininas.
Estudios con BRA en insuficiencia cardiaca
El ELITE II concluyó en 1999, se presentaron sus resultados en la reunión de la AHA (American Heart Association) en Noviembre de ese mismo año y se publicó en el primer semestre del año 2000. Este estudio randomizado doble ciego incluyó 3152 pacientes de edad > 60 años en clase funcional II-IV con disfunción ventricular izquierda (fracción de eyección <40%) y un seguimiento de 555 días. Los resultados del ELITE II no confirmaron las excelentes expectativas suscitadas con el ELITE I y se demostró que losartán no fue superior al captopril en la reducción de la mortalidad total ni en la reducción de la muerte súbita. Sin embargo, al igual que ocurrió en el ELITE I, losartán fue significativamente mejor tolerado que captopril. Con el BRA se observó una menor tasa de abandono de tratamiento debido a efectos secundarios (9.7% frente a 14.7%, p<0.001). Los investigadores concluyeron que los IECA siguen siendo el tratamiento de primera elección de la IC y cuando estos no son tolerados, losartán es un fármaco útil como tratamiento alternativo (62). Una vez más, se volvía a demostrar que en medicina la información concluyente sobre morbi-mortalidad sólo se puede obtener con estudios específicamente diseñados en ese sentido.
En una primera lectura los resultados un tanto decepcionantes del estudio ELITE II apagaron muchas ilusiones sobre el papel de BRA en IC. De hecho, tras los resultados del ELITE I se había llegado a sugerir que los BRA podrían desbancar a los IECA en el tratamiento de la IC. Sin embargo, la realidad del ELITE II, ha hecho que actualmente los BRA queden relegados a una segunda línea en el tratamiento de la IC. Pero la interpretación de estos resultados puede tener también una lectura más positiva, el ELITE II nos permite sugerir que el tratamiento con un BRA puede ser tan útil como el IECA en IC y con una tolerancia significativamente mejor. Por otra parte, se ha sugerido que quizá no fue acertado comparar una dosis habitual de losartán (50 mg en una toma diaria) con la dosis máxima de captopril (150 mg distribuidos en tres tomas diarias). Esta dosis de captopril, si bien es la que ha demostrado reducir la morbi-mortalidad en los ensayos clínicos (19), en la práctica clínica raramente se alcanza (63). ¿Podrían haber sido distintos los resultados del ELITE II si se hubiera decidido titular la dosis de losartán buscando el efecto de máximo bloqueo del receptor AT1?. Desafortunadamente es probable que nunca tengamos la respuesta a esta pregunta, porque en la actualidad no hay en marcha ningún estudio que pueda responderla y nos quedará abierta la interrogante de si losartán con una dosis superior que permita un efecto mayor sobre el SRAA podría obtener mejores resultados que los observados en el ELITE II con la dosis habitual.
Respecto a la IC, en modelos experimentales se han observado efectos muy beneficiosos con la combinación de IECA y BRA, ofreciendo ventajas sustanciales sobre la monoterapia con cualquiera de ellos en cuanto a función ventricular, hemodinámica y remodelado cardíaco (67). En la práctica clínica también hay datos que sugieren efectos favorables aditivos con el tratamiento combinado tanto en la hemodinámica como en la activación neurohormonal, la función ventricular o la situación clínica. En un estudio a corto plazo que incluyó 43 pacientes con IC, la combinación de losartán con la dosis máxima de un IECA producía una mayor vasodilatación, y se demostró que era segura (68). En otro estudio doble ciego 83 pacientes con IC que recibían IECA, fueron asignados aleatoriamente a 3 grupos, dos de los cuales recibieron valsartán en dos dosis distintas (80 mgr dos veces al día y 160 mgr dos veces al día) y un tercer grupo, placebo. En el grupo que recibió valsartán 160 mgr dos veces/dia se observó un efecto hemodinámico y hormonal aditivo favorable (69). En el estudio piloto RESOLVD (no diseñado para analizar morbi-mortalidad) se investigaron los efectos de otro BRA (candesartán) sólo frente a un IECA (enalapril) y a la combinación de ambos en pacientes con IC. Se incluyeron 768 pacientes en clase funcional II-IV que fueron randomizados en 6 grupos: candesartán en tres dosis diferentes (4, 8 y 16 mgr/día) combinación de candesartán (en dosis 4 y 8 mgr) y enalapril (10 mgr dos veces al día) y enalapril sólo (10 mgr dos veces al día). El estudio demostró, tras un seguimiento de 43 semanas, que candesartán sólo era al menos tan efectivo, seguro y bien tolerado como enalapril. Pero además la combinación de IECA y BRA se mostró más eficaz para prevenir dilatación ventricular y la activación neurohormonal que cualquiera de los fármacos por separado, si bien los resultados clínicos no fueron favorables para la combinación (70). Desde el punto de visto de la sintomatología, también se ha observado que la adición de un BRA (losartán) durante seis meses en pacientes con IC tratados con dosis óptimas de IECA mejora la capacidad de ejercicio y la situación clínica de los pacientes (71).
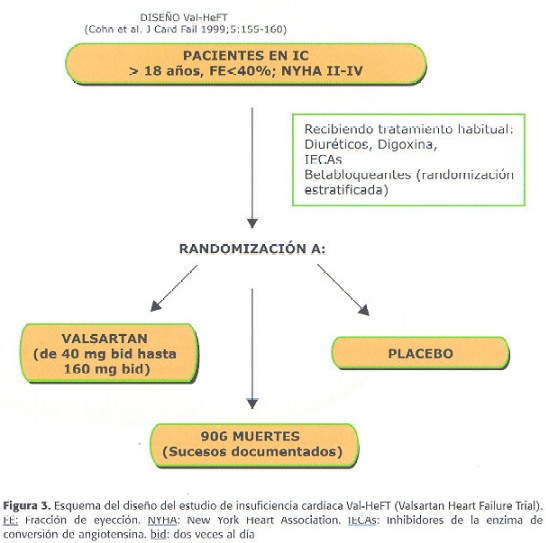
Pero, a pesar de que todos estos datos son muy atractivos desde el punto de vista clínico, para determinar de forma concluyente la utilidad de la combinación IECA-BRA en IC se necesitan grandes estudios de morbi-mortalidad que confirmen o no estas buenas expectativas. on este objetivo se diseñaron dos grandes estudios, ValHeFT (Valsartan Heart Failure Trial) y CHARM (Candesartan cilexetil in Heart failure Assessment of Reduction in Mortality and morbidity). En el mes de Mayo del 2000 se concluyó el estudio ValHeFT, y los primeros resultados se dieron a conocer en la reunión de la AHA de Noviembre de ese año. En este estudio se investigó el efecto de valsartán en pacientes con IC clase funcional II-IV y fracción de eyección <40% que estaban recibiendo la terapia convencional para IC, que incluía IECAs (93% de los pacientes), diuréticos (86%), digital (67%) y betabloqueantes (35%). Se incluyeron 5010 pacientes que se asignaron aleatoriamente a valsartán (titulado hasta 160 mg dos veces al día) o a placebo (Figura 3). Se analizaron dos variables primarias, mortalidad total y la combinación de morbilidad y mortalidad (que incluía muerte, parada cardíaca resucitada, hospitalización por IC y necesidad de tratamiento vasodilatador o inotrópico i.v. durante al menos 4 horas) y otras variables secundarias referentes a la progresión de la enfermedad, a la estructura y la función cardíaca y a la calidad de vida (72). Los resultados presentados en la citada reunión, aún pendientes de publicación, demostraron que valsartán no modificó la mortalidad total, pero sí la combinación de morbilidad y mortalidad, que se redujo significativamente en un 13.3% (p=0.009), fundamentalmente a expensas de una marcada reducción del 27.5% en las hospitalizaciones debidas a IC (p=0.00001). Estos beneficios parecen ser más relevantes en aquellos pacientes no tratados con IECA (7%) o con betabloqueantes (65%). En todas las variables secundarias analizadas se demostró un beneficio significativo del tratamiento con valsartán. Este estudio, por tanto, parece confirmar los beneficios clínicos de la combinación de IECA y BRA en IC en términos de morbi-mortalidad. No obstante, hay que recordar que estos son resultados iniciales aún no publicados y están pendientes de conocerse algunos aspectos muy importantes de este estudio que pueden ayudar a definir mejor el papel de valsartán en estos pacientes.
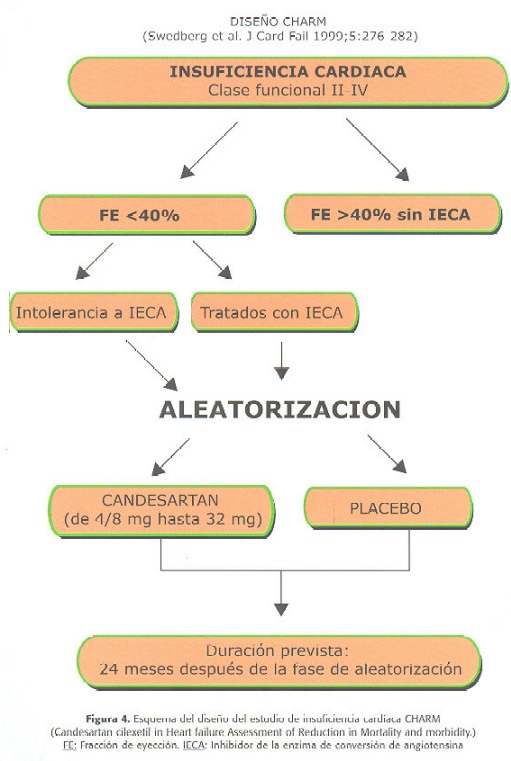
Aún está en marcha otro estudio de IC con BRA II que puede aportar información adicional de gran utilidad clínica. El estudio CHARM que está actualmente finalizando su periodo de inclusión analiza el efecto de un BRA II (candesartán) en distintas situaciones de IC. Existen tres ramas de inclusión en este estudio. Una rama incluye pacientes con fracción de eyección <40% e IC tratados con IECA, es decir, un grupo similar a Val-HeFT (n=2500). Otra rama se compone de pacientes con IC y fracción de eyección <40% intolerantes a IECA (n=2000). Y una tercera rama recoge pacientes con IC y fracción de eyección >40% (n=3000). Todos los pacientes se randomizan a candesartán (titulando hasta 32 mg día) o placebo (Figura 4) (73). Este estudio aportará datos muy relevantes desde diferentes perspectivas. Por una parte, este estudio demostrará si se confirman los resultados de Val-HeFT para la combinación IECA-BRA en IC, por otra parte, si los pacientes intolerantes a IECA se favorecen de un BRA; y por último si los BRA son útiles en las situaciones de IC de predominio diastólico. El CHARM que probablemente finalice en el 2002 podrá por tanto, completar la información necesaria para conocer con precisión el papel de los BRA II en IC.
Pero además de estos estudios específicos de IC, otros dos estudios están dirigidos a investigar el papel de los BRA en pacientes postinfarto, tanto con IC como con disfunción ventricular izquierda asintomática, son el estudio OPTIMAAL (Optimal Trial In Myocardial infarction with the Angiotensin II Antagonist Losartan) y el estudio VALIANT (VALsartan In Acute myocardial iNfarcTion). El OPTIMAAL incluye 5000 pacientes postinfarto de alto riesgo y compara los efectos de losartán con los de captopril. La hipótesis es que losartán es superior a captopril con una reducción de mortalidad total del 20% y se espera que concluya en el 2001 (74). El estudio VALIANT compara valsartán, captopril y la combinación de ambos en 14.500 pacientes con IC y/o disfunción ventricular postinfarto. La hipótesis de este estudio es que la combinación de valsartán y captopril reduce la mortalidad en un 15-17% y que valsartán y captopril serán equivalentes en términos de mortalidad. Se espera que finalice en el 2003.
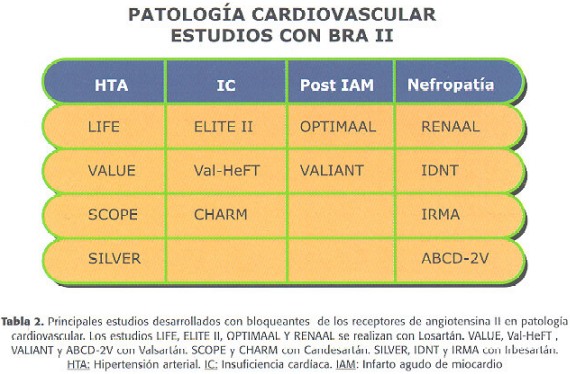
Por último, recordar que durante los próximos meses/años vamos a tener un conocimiento muy completo sobre el efecto de los BRA en la patología cardiovascular. De hecho, junto a estos estudios de IC y postinfarto existe un amplio programa de investigación clínica con diferentes moléculas, que analiza el papel de estos fármacos en la protección cardiovascular desde diferentes perspectivas clínicas (Tabla II).
8. Cohn JN, Levine TB, Olivari MT, Garberg V, Lura D, Francis GS. Plasma norepinephrine as a guide to prognosis in patients with chronic congestive heart failure. N Engl J Med 1984;311: 819-823. [ Links ]
9. Swedberg K, Eneroth P, Kjekshus J, Wilhelmensen L. Hormones regulating cardiovascular function in patients with severe congestive heart failure and their relation to mortality. Circulation 1990; 82: 1730-1736. [ Links ]
10.Ruilope LM, Barrios V, Volpe M. Renal implications of the renin-angiotensin-aldosterone system blockade in heart failure. J Hypertens 2000;18:1545-1561. [ Links ]
11.Rosendorff C. The renin-angiotensin system and vascular hypertrophy. J Am Coll Cardiol 1996; 28: 803-812. [ Links ]
12.The CONSENSUS Trial Study Group. Effect of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med 1987; 316: 1429-1435. [ Links ]
13.The SOLVD Investigators. Effects of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med 1991; 325: 293-302. [ Links ]
14.Garg R, Yusuf S, for The Collaborative Group on ACE Inhibitor Trials. Overview of randomized trials of angiotensin-converting enzyme inhibitors on mortality and morbidity in patients with heart failure. JAMA 1995; 273: 1450-1456 [ Links ]
15.Barrios V, Ortega J. ACE inhibitors in the treatment of heart failure. Heart Failure 1999; Train Lett no.7: 2-5. [ Links ]
16.Cohn JN, Johnson G, Ziesche S, Cobb F, Francis G, Tristani F et al. A comparison of enalapril with hydralazine-isosorbide dinitrate in the treatment of chronic congestive failure. N Engl J Med 1991; 325: 303-310. [ Links ]
17.The SOLVD Investigators. Effect of enalapril on mortality and the development of heart failure in asymtomatic patients with reduced left ventricular ejection fractions. N Engl J Med 1992; 327: 685-691. [ Links ]
18.Remme WJ. Heart failure management: why evidence does not influence clinical practice.Eur Heart J Supplements 2000; 2 (Suppl I) 115-121. [ Links ]
19.Pfeffer MA, Braunwald E, Moyé LA, Basta L, Brown EJ, Cuddy TE et al, on behalf of the SAVE Investigators. The effect of captopril on morbidity and mortality in patients with left ventricular dysfunction following myocardial infarction. Results of the Survival and Ventricular enlargement (SAVE) trial. N Engl J Med 1992; 327: 669-677. [ Links ]
20.Acute lnfarction Ramipril Efficacy (AIRE) lnvestigators. Effects of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure. Lancet 1993; 342: 821828. [ Links ]
21.Kiber L, Torp-Pederson C, Carlsen JE et al. for the TRACE Study Group. A clinical trial of the angiotensin-converting enzyme inhibitor trandolapril in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 1995; 333: 1670-1676. [ Links ]
22.Aronow WS, Kronzon I. Effect of enalapril on congestive heart failure treated with diuretics in elderly patients with prior myocardial infarction and normal left ventricular ejection fraction. Am J Cardiol 1993; 71: 602-604. [ Links ]
23.Backer DW, Konstam MA, Bottorff M, Pitt B. Management of heart failure I. Pharmacologic treatment. J Am Med Assoc 1994; 272: 13611366. [ Links ]
24.Guidelines for the evaluation and management of heart failure. Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (committee on Evaluation and Management of Heart Failure). Circulation 1995; 92: 2764-2784. [ Links ]
25.The Task Force of the Working group on Heart Failure of the European Society of Cardiology. Guidelines: The treatment of heart failure. Eur Heart J 1997; 18: 736-753 [ Links ]
26.Biollaz J, Burnier M, Turini GA, Brunner DB , Porchet M, Gómez HJ, Jones KH, Ferber F, Abrams WB, Gavras H, Brunner HR. Three new longacting converting enzyme inhibitors: relationship between plasma converting enzyme activity and response to angiotensin I. Clin Pharmacol Ther 1981; 29: 665-670. [ Links ]
27.Bioliaz J. Brunner HR, Gavras I, Waeber B, Gavras H. Antihypertensive therapy with MK 421: Angiotensin ll-Renin relationships to evaluate efficacy of converting enzyme blockade. J Cardiovasc Pharmacol 1982; 4: 966-971. [ Links ]
28.Benedict CR, Francis GS, Shelton B et al for the SOLVD investigators. Effect of long-term enalapril therapy on neurohormones in patients with left ventricular dysfunction. Am J Cardiol 1995; 75: [ Links ] 1151-1157.
29.Nussberger J, Fleck E, Bahrmann H, Detius W, Schultheiss HP lI; Brunner HR , for the Study Group of Neurohormonal Regulation in Congestive Heart Failure. Dose-related effects of ACE inhibition in man: quinapril in patients with moderate congestive heart failure. Eur Heart J 1994; 15: 113-122. [ Links ]
30.Schunnkert H, Ingelfinger JR, Hirsch AT, Pinto Y, Remme WJ, Jacob H, Dzau VJ. Feedback regulation of angiotensin converting enzyme activity and M-RNA levels of angiotensin II. Circ Res 1993; 72: 312-318. [ Links ]
31.Struthers AD. Aldosterone escape during ACE inhibitor therapy in chronic heart failure. Eur Heart J 1995; 16: 103-106. [ Links ]
32.Dzau VJ, Sasamura H, Hein L. Heterogeneity of angiotensin syntetic pathways and receptors subtypes: physiological and pharmacological implications. J Hypertens 1993; 11 (Suppl 3): 513-518 [ Links ]
33.Juillerat L, Nussberger J, Menard J, Mooser V, Christen Y, Waeber B, Graft P, Brunner H. Determinants of angiotensin 11 generation during converting enzyme inhibition. Hypertension 1990; 16: 564-572.
34.Urata H, Healey B, Stewart RW, Bumpus FM, Husain A. Angiotensin II-forming pathways in normal and failing human hearts. Circ Res 1990; 66: 883.890. [ Links ]
35.Aldigier JC, Hunag H, Dalamy F et al. Angiotensin-converting enzyme inhibition does not supress plasma angiotensin II increase during exercise in humans. J Cardiovasc Pharmacol 1993; 21: 289-295. [ Links ]
36.Roig E, Pérez-Villa F, Morales M, Jiménez W, Orús J, Heras M et al. Clinical implications of increased plasma angiotensin II despite ACE inhibitor therapy in patients with congestivo heart faílure. Eur Heart J 2000; 21: 53-57. [ Links ]
37.Willenheimer R, Dahlöf B, Rydberg E. Erhardt L. ATI -receptor blockers in hypertension and heart failure: clinical experience and future directions. Eur Heart J 1999; 20: 997-1008. [ Links ]
38.Ferrari R, Guardigli G. Cicchitelli G, Valgimigli M, Soukhomovskaia O, Ceconi C. Cardioprotection with ACE inhibitors non-angiotensin Il- related mechamisms. Eur Heart J Supplements 2000; 2 (Suppl I): 122-128. [ Links ]
39.Deedwania PC. Underutilization of evidence-based therapy in heart failure. An opportunity to deal a winning hand with ace up your sleeve. Arch Intern Med 1997; 157: 2409. [ Links ]
40.van Veldhuisen DJ, Charlesworth A, Crijns HJ, Lie KI, Hampton JR. Differences in drug treatment of chronic heart failure between European countries. Eur Heart J 1999; 20: 666-672. [ Links ]
41.Barrios V, Tamargo J, Llisterri JL, Palazuelos V, Lozano JV, Prieto L et al. Encuesta sobre la situación de la insuficiencia cardíaca en Atención Primaria. Rev Esp Cardiol 2000; 53(supl 2): 60. [ Links ]
42.Ruilope IM, Barrios V, Segura J, Campo C. The kidney in heart failure: role of angiotensin II. Curr Opin Nephrol Hypertens 1999;8:153-156. [ Links ]
43.Rodriguez G, Llisterri JL, Alonso FJ, Barrios V, Rodriguez L. La insuficiencia cardíaca congestiva en atención primaria (II). Tratamiento, criterios de derivación y seguimiento. SEMERGEN 2000; 26: 66-76. [ Links ]
44.Barrios V, Jiménez JJ. Corazón e hipertensión. En: LM Ruilope, ed. Nuevas Fronteras en Hipertensión, n°3. Barcelona: Doyma 1998;29-63. [ Links ]
45.Timmermans PBMWM, Wong PC, Chiu AT et al. Angiotensin II receptors and angiotensin II receptors antagonists. Pharmacol Rev 1993; 45: 206-251. [ Links ]
46.Dzau VJ, Mukoyama M, Pratt RE. Molecular biology of angiotensin receptors: target for drug research? J Hypertens 1994; 12 (suppl 2): 51-55. [ Links ]
47.Smith RD, Timmermans PBMWM. Human angiotensin receptors subtypes. Curr opin Nephrol Hypertens 1994; 3: 135-140. [ Links ]
48.Meffert S, Stoll M, Steckelings UM, Bottari SP, Unger T. The angiotensin II AT2 receptor inhibits proliferation and promotes differentiation in PC12W cells. Mol Cell Endocrinol 1996; 122: 59-67. [ Links ]
49.Ruilope LM, Barrios V. Pharmacologic treatment in Hypertensive Heart Disease. Crawford MH, DiMarco JP (eds). Cardiology. Mosby: London; 2001: 8.1-8.8. [ Links ]
50.Thürmann PA, Kenedi P, Schmidt A, Harder S, Rietbrock N. lnfluence of the angiotensin II antagonist valsartan on left ventricular hypertrophy in patients with essential hypertension. Circulation 1998; 98: 2037-2042. [ Links ]
51.Kahan T, Maimqvist K, Edner M, Held C, Osbakken M. Rate and extent of left ventriocular hypertrophy regression: A comparison of angiotensin II blockade with irbesartan and beta-blockade. J Am Coll Cardiol 1998; 31 (suppl C): 258C. [ Links ]
52.van Kats JP, Duncker DJ, Haitsma DB, Schuijt MP, Niebuur R, Stubenitsky R et al. Angiotensin-converting enzyme inhibition and angiotensin II type receptor blockade prevent cardiac remodeling in pigs after myocardial infarction. Role of angiotensin Il. Circulation 2000; 102: 1556-1563. [ Links ]
53.Siragy HM, Carey RM. The subtype 2 (AT2 ) angiotensin receptor mediates renal production of nitric oxide in conscious rats. J Clin lnvest 1997; 100: 264-269. [ Links ]
54.Liu YH, Yang XP, Sharov VG, Nass O, Sabbah HN, Peterson E, Carretero OA. Effects of angiotensin-converting enzyme inhibitors and angiotensin II type 1 receptor anatgonists in rats with heart failure. Role of kinins and angiotensin II type 2 receptors. J Clin lnvest 1997; 99:1926-1935. [ Links ]
55.Lombera F, Barri V, Soria F, Placer L, Cruz JMa, Tomás L et al. Guías de práctica clínica de la Sociedad Española de Cardiología en hipertensíón arterial. Rev Esp Cardiol 2000; 53: 66-90. [ Links ]
56.Gottlieb S, Dickstein K, Fleck E et al. Hemodynamic and neurohormonal effects of the angiotensin II antagonist losartan in patients with congestive heart faílure. Circulation 1993; 88: 1602-1609. [ Links ]
57.Dickstein K, Chang P, Willenheimer R et al. Comparison of the effects of losartan and enalapril on clínicas status and exercise perfomance in patients with moderate or severe chronic heart failure. J Am Coll Cardiol 1995; 26: 438-445. [ Links ]
58.Vigay N, Alhaddad IA, Marty Denny D et al.. Irbesartan Heart Failure Group. lrbesartan compared with lisinopril in patients with mild to moderate congestivo heart failure. J Am Coll Cardiol 1998; 31: 68A. [ Links ]
59.Riegger GAJ, Bouzo H, Petr P, Münz J, Spacek R, Pethig H et al. Improvement in exercise tolerance and symptoms of congestivo heart failure during treatment with candesartan cilexetil. Circulation 1999; 100: 2224-2230. [ Links ]
60.Pitt B, Segal R, Martinez FA Meurers G, Cowley AJ, Thomas 1 et al, on behalf of ELITE Study investigators. Randomised trial of losartan versus captopril in patients over 65 with heart failure (Evaluation of Losartan in the Elderly Study, ELITE). Lancet. 1997; 349:747-752.
61.Pitt B, Poole-Wlison P, Segal R, Martínez FA, Dickstein K, Camm AJ et al. Effects of losartan versus captopril on mortality in patients with symptomatic heart failure: Rationale, design, and baseline characteristics of patients in the Losartan Heart Failure Survival StudyELITE Il. J Card Fail 1999; 5: 146-154. [ Links ]
62.Pitt B, Poole-Wilson PA, Segal R, Martinez FA, Dickstein K, Camm AJ et al. on behalf of ELITE Study lnvestigators, Robert Segal et al. Effect of losartan compared with captopril on mortality in patients with symptomatic heart failure: randomised trial -the Losartan Heart Failure Survival Study ELITE lI. Lancet 2000; 355:1582-1587. [ Links ]
63.Mair FS, Crowiey TS, Bundred PE. Prevalence, etiology, and management of heart failure in general practice. Br J Gen Pract 1996; 46: 77-79. [ Links ]
64.Azizi M, Chatellier G, Guyene TT, Murieta-Geoffroy D, Menard J. Additive effects of combined angiotensin-converting enzyme inhibition and angiotensin II antagonism on blood pressure and renin release in sodium-depleted normotensives. Circulation 1995; 92:825-834. [ Links ]
65.Azizi M, Linhart A, Alexander J, Goldberg A, Menten J, Sweet J, Menard J. Pilot study of combined blockade of the renin-angiotensin system in essential hypertensive patients. J Hypertens 2000; 342: 11391147. [ Links ]
66.Ruilope LM, Aldigier J, Ponticelli C, oddou-Stock P, Botteri F, Mnn JF, on behalf of the European Group for the lnvestigation of Valsartan in Chronic Renal Disease. Safety of the combination of valsartan and benazepril in patients with chronic renal dísease. J Hypertens 2000; 18: 89-95. [ Links ]
67.Spinale FG, de Gasparo M, Whitebread S, Hebbar L, Clair MJ, Melton DM et al. Modulation of the renin-angiotensin pathway through enzyme inhibition and specific receptor blockade in pacing-induced heart failure: Effects on left ventricular performance and neurohormonal systems. Circulation 1997; 96: 2385-2396. [ Links ]
68.Hamroff G, Blaufarb I, Mancíni D Katz SD, Bijou R, Jondeau G et al. Angiotensin II-receptor blockade further reduces afterload safely in patients maximally treated with angiotensin-converting enzyme inhibitors for heart failure. J. Cardiovasc Pharmacol 1997; 30:533-536. [ Links ]
69.Baruch L, Anand I, Cohen IS, Ziesche S, Judd D, Cohn JN. Augmented short-and long-term hemodynamic and hormonal effects of an angiotensin receptor blocker added to angiotensin converting enzyme inhibitor therapy in patients with heart failure. Circulation 1999; 99: 2658-2664. [ Links ]
70.McKelvie RS, Yusuf S, Pericak D, Avezum A, Burns RJ, Probstfield J et al, for the RESOLVD Pilot Study lnvestigators. Comparison of candesartan, enalapril, and their combination in congestive heart failure. Randomized Evaluation of Strategies for Left Ventricular Dysfunction (RESOLVD) Pilot Study. Circulation 1999; 100: 1056-1064. [ Links ]
71.Hamroff G. Stuart D, Mancini D, Blaufarb I, Bijou R, Patel R et al. Addition of angiotensin II receptor blockade to maximal angiotensinconverting enzyme inhibition improves exercise capacity in patients with severe congestive heart failure. Circulation 1999; 99: 990-992. [ Links ]
72.Cohn JN, Tognoni G, Glazer RD, Spormann D, Hester A. Rationale and design of the Valsartan Heart Failure Trial: A large multinacional trial to assess the effect of valsartan, an angiotensin-receptor blocker, on morbidity and mortality in chronic congestivo heart failure. J Card Fail 1999; 5: 155-160. [ Links ]
73.Swedberg K Pfeffer M, Granger C, Held P, McMurray J, Ohlin G et al, for the CHARM-programme investigators. Candesartan in Heart FailureAssessment of Reduction in Mortality and Morbidity (CHARM): Rationale and Design. J Card Fail 1999; 5: 276-282. [ Links ]
74.Dickstein K Kjekshus J, for the OPTIMAAL study group. Comparison of the effects of losartan and captopril on mortality in patients floowing acute myocardial infarction: The OPTIMAAL trial design. Optimal Therapy in Myocardial infarction with the Angiotensin II Antagonist Losartan. Am J Cardiol 1999; 83: 477-481. [ Links ]
* Servicio de Cardiología.
Hospital Ramón y Cajal. Madrid, España.
correspondencia: Cardiología. Hospital Ramón y Cajal;
Ctra. de Colmenar km. 9.100; 28034 Madrid, España.