Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina Legal de Costa Rica
On-line version ISSN 2215-5287Print version ISSN 1409-0015
Med. leg. Costa Rica vol.28 n.2 Heredia Sep. 2011
Original
Resumen:
Abstract:
To the diagnostic challenge is a liver neoplasia is not well differentiated, in this study proposes the use of an immunohistochemical profile that includes cytokeratin (CK) 7, 19 and 20 and thyroid transcription factor(TTF-1) for demonstrate its effectiveness in the differential diagnosis of hepatocellular carcinoma, cholangiocarcinoma and metastatic adenocarcinoma and thereby facilitate the diagnosis in daily practice.
Key words:
Hepatocellular carcinoma, cholangiocarcinoma, metastatic adenocarcinoma, immunohistochemistry, cytokeratins, thyroid transcription factor.
Introducción
El diagnóstico histológico de carcinoma hepatocelular es relativamente sencillo, cuando las características arquitecturales y celulares son semejantes a las del hígado normal. Sin embargo, los que presentan un patrón seudoglandular o son poco diferenciados, pueden ser difíciles de diferenciar de colangiocarcinomas y metástasis de adenocarcinomas, especialmente en biopsias por aguja(1).
Estos retos diagnósticos pueden ser atribuidos a la variedad de neoplasias que se originan en las células del hígado, además, a que este órgano es blanco de metástasis que pueden simular las variantes principales del carcinoma hepatocelular(2).
La inmunohistoquímica se ha utilizado para facilitar el diagnóstico diferencial entre las tres entidades, pero ante la falta de un anticuerpo altamente específico para carcinomas hepatocelulares se utilizan múltiples anticuerpos con diferentes sensibilidades y especificidades para hepatocarcinomas, colangiocarcinomas y metástasis de adenocarcinomas(3). Varios marcadores por inmunohistoquímica han sido descritos para la identificación de estos tumores, incluyendo alfa-fetoproteína, antígeno carcinoembrionario, citoqueratina 7, citoqueratina 20, citoqueratina 19 y TTF-1(4).
Las citoqueratinas son una compleja subclase de genes de filamentos intermedios que se compone de 20 diferentes polipéptidos. Se clasifican en tipo A o clase I (citoqueratinas 9 a 20) y tipo B o clase II (citoqueratinas 1 a 8). En el hígado humano normal el perfil de citoqueratinas es citoqueraina 8 y 18 en hepatocitos, mientras que en conductos biliares están presentes las citoqueratinas 7, 8, 17, 17, 18 y19(5).
Estas diferentes expresiones se han utilizado para hacer la diferenciación entre carcinoma hepatocelulares de colangiocarcinomas(1).
Las características de la tinción canalicular con anticuerpo anti antígeno carcinoembrionario, se reporta ser muy específico para diferenciación hepatocelular, entre un
Las metástasis al hígado corresponden al 98% de las lesiones malignas del hígado y se diagnostican hasta en el 4% de todas las biopsias hepáticas en general. El 40% de las personas que fallecen de cáncer presentan metástasis al hígado. Los carcinomas de pulmón, mama, colon, páncreas y estómago son los que más frecuentemente metastatizan al hígado(6).
El Factor de Transcripción Tiroideo -1 (TTF-1), es un miembro de la familia NKx2 de factores de transcripción de homeodomaina, que se expresa en el núcleo del epitelio pulmonar y tiroideo y sus tumores, y en el sistema nervioso central. Diferentes estudios han demostrado una reactividad granular citoplasmática en hepatocitos y carcinomas hepatocelulares mediante una unión a las mitocondrias, lo cual puede ser usado para diferenciarlos de otros carcinomas, por su diferente localización(7).
En este estudio se estudian los anticuerpos de inmunohistoquímica TTF-1, citoqueratina 7 (CK-7), citoqueratina 20 (CK-20) y citoqueratina 19 (CK-19), para demostrar su probable eficacia en el diagnóstico diferencial de hepatocarcinomas, colangiocarcinomas y metástasis de adenocarcinoma.
De los archivos del Servicio de Anatomía Patológica del Hospital México y del Hospital Calderón Guardia de
Los casos fueron histológicamente diagnosticados como carcinomas hepatocelulares (n=24), colangiocarcinomas (n=20) y carcinomas metastásicos al hígado (n=13). El origen de los carcinomas metastásicos fueron de colon (n=19), estómago (n=2) y glándula mamaria (n=1).
Los casos escogidos para estudio fueron aquellos en que obtuvo el bloque de parafina y el mismo contara con tejido suficiente para realizar el estudio de inmunohistoquímica de los 4 anticuerpos.
Se graduaron los colangiocarcinomas y las metástasis adenocarcinomas en bien, moderadamente y poco diferenciados según su tendencia a la formación de estructuras glandulares. Los hepatocarcinomas se graduaron según el estadiaje propuesto por Edmondson y Steiner, que los gradúa del I al IV utilizando como criterios irregularidad del núcleo, radio núcleo citoplasma, y diferenciación celular(2).
Se realizaron estudios de inmunohistoquímica con cuatro anticuerpos:anti CK-7 (Clona OVTL1,BioGenex), antiCK-19 (clona RCK108, DAKO), anti CK-20 (clona Ks20.8, Biocare) y anti TTF-1 (clona 8G7G3/1, (Biocare). En resumen, se hicieron cortes de parafina a 5 micrómetros sobre láminas cargadas positivamente, se desparafinaron y se lavaron en bufer Tris salino
La expresión de las citoqueratinas 7, 20 y 19 se definió como positivo un marcaje de membrana citoplasmática y como negativo la tinción citoplasmática difusa sin membrana. La expresión del anticuerpo TTF-1 se definió como positivo con un marcaje granular en el citoplasma de al menos un 50% de las células tumorales y como negativo si había solo marcaje nuclear o de membrana. La expresión de los 4 anticuerpos se graduó de 0 a 3 cruces siendo tres cruces reactividad muy fuerte y 0 cruces negativo. Se determinó el porcentaje de células positivas haciendo un promedio de toda la muestra y no solo en las áreas más positivas.
La presencia de tinción citoplásmica granular en los hepatocitos no tumorales con TTF-1 y la tinción de membrana citoplásmica de los conductos biliares con CK-7 y CK-19 fue utilizado como control interno positivo y su presencia fue requisito necesario para considerar la tinción como adecuada.
Para analizar los datos se utilizó el programa estadístico WinSTAT® para Microsoft® Excel versión 2007.1. En el análisis de las variables se realizó el Test de Fisher y la prueba de Chicuadrado, estableciendo una p (punto crítico) de 0.05 como estadísticamente significativo (≤ 0.05).
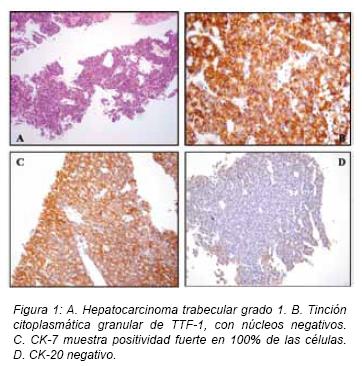
Los carcinomas hepatocelulares según la clasificación de Edmondson y Steiner se observó que de los 24 casos de hepatocarcinomas, 12 corresponden a grado 1 (50%) (ver Figura 1A), 7 a grado 2 (29%) y
En relación con los resultados de inmunohistoquímica,
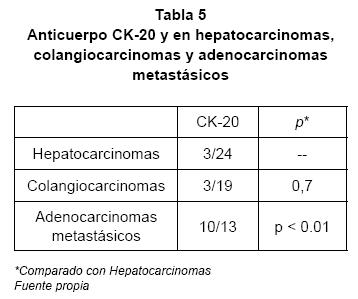
Con el anticuerpo CK-20, los hepatocarcinomas fueron positivos sólo en 3 de los 24 casos. Los colangiocarcinomas fueron positivos en 3 de 19 casos. Los adenocarcinomas metastásicos fueron positivos en 10 de los 13 (ver Tabla 2).
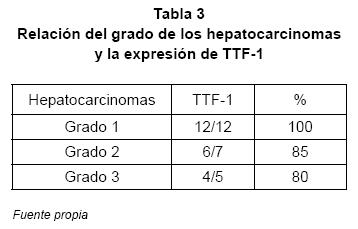
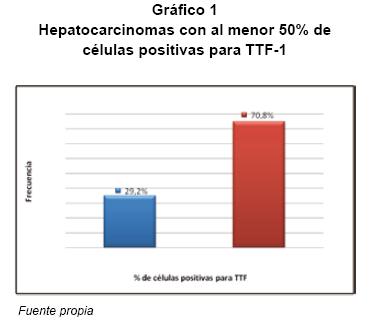
Al estudiar la relación del grado de diferenciación de los hepatocarcinomas y la expresión de TTF-1, se obtuvo que en los grado 1 hubo una expresión del 100% (12 de 12 casos) (ver Figura 1B), en los grado 2 del 85% (6 de 7 casos) y en los grado 3 del 80% (4 de 5 casos) (ver Tabla 3). Además, al establecer un 50% o más de células positivas para TTF-1 en tinción citoplásmica, para determinar la sensibilidad del anticuerpo, de los 22 casos de hepatocarcinomas positivos para TTF-1, 17 (70,8%) lo fueron en 50% o más de las células tumorales (ver Figura 1).
El principal objetivo era analizar el perfil de inmunohistoquímica de lesiones tumorales primarias y metastásicas del hígado, las cuales muestran en biopsias por aguja una gran complejidad diagnóstica(3). El fin del análisis era determinar la utilidad del anticuerpo TTF-1 en conjunto con otros anticuerpos (CK-19, CK-7 y CK-20) en el diagnóstico diferencial de las lesiones hepáticas, y comparar los resultados con los publicados en la literatura en los últimos años.
Los resultados obtenidos en este estudio mostraron una alta frecuencia de positividad de la tinción citoplasmática granular del anticuerpo TTF-1 en los hepatocarcinomas, lo cual fue positivo en 22 de los 24 casos de hepatocarcinomas (91,7%). Estos resultados son similares a los reportados por Lei et al, donde encontraron positividad en 37 de 40 casos estudiados (93%)(7), mientras que el estudio de Tad et al reportó positividad en 54 de de 76 casos de hepatocarcinomas estudiados (71%)(8).
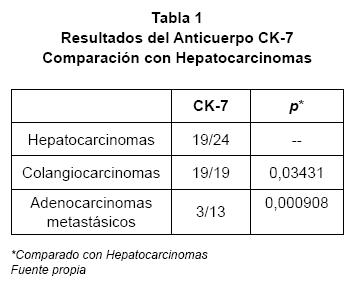
Por otro lado la expresión del anticuerpo TTF-1 en colangiocarcinomas y metástasis de adenocarcinomas fue baja o nula, mientras que en los colangiocarcinomas fueron positivos solo en el 10,5%. En el caso de los adenocarcinomas metastásicos, los 13 casos fueron negativos. Estos resultados también son consistentes con los reportados en los estudios antes citados, que encontraron positividad en 2 de 20 casos de colangiocracinomas (10%) y en 1 de 20 casos de adenocarcinomas metastásicos (5%)(7). Mientras que el grupo de Wieczorek et al no estudió colangiocarcinomas, pero si estudió diferentes tipos de adenocarcinomas, encontrando que los 72 casos de carcinoma de células renales, los 22 casos de carcinomas de corteza suprarrenal fueron negativos, en conjunto con 85 casos de adenocarcinomas de diferentes orígenes de los cuales sólo tres casos fueron positivos para TTF-1 (4%)(8).
Estos tres estudios muestran resultados similares tanto para hepatocarcinomas, colangiocarcinomas y adenocarcinomas en lo que ha su expresión de TTF-1 se refiere.
Además, cuando se realizó el estudio de Chicuadrado a los resultados obtenidos en los tres estudios, se encontró que lo mismos son estadísticamente significativos (p< .001) cuando se comparó su expresión en hepatocarcinomas contra la expresión en colangiocarcinomas y en adenocarcinomas metastásicos. En el estudio de Wieczorek, se reportó que el grado de diferenciación de los hepatocarcinomas repercutió en la expresión de TTF-1, 100% en los grado 1, 74% en los grado 2, 71% en los grado 3 y 43% en los grado 4(8). En nuestro estudio se obtuvieron los siguientes resultados: en los grado 1 hubo una expresión del 100% (12 de 12 casos) y en los grado 2 del 85% (6 de 7 casos), y en los grado 3 del 80% (4 de 5 casos). Estos resultados son consistentes con los de del estudio anterior y sugieren que el grado de diferenciación se relaciona con la expresión del TTF-1, siendo más prevalente en los grado 1. Sin embargo estas diferencias no son estadísticamente significativas (p 0,31561), lo cual puede estar en relación al reducido número de casos.
En el estudio de Lei et al, también se estudió de una forma diferente la relación del entre el grado de diferenciación de los hepatocarcinomas y su expresión de TTF-1. Para hacerlo determinaron el número de casos con expresión en 50% o más de las células y compararon los grupos, encontrando que todos los bien diferenciados, el 75% de los moderadamente diferenciados y el 56% de los poco diferenciados (5/9 casos) fueron positivos, siendo estos datos estadísticamente significativos (p 0,026)(7). En nuestros casos se definió también el corte de 50% o más de células positivas para TTF-1 y se compararon los grupos; en el caso de los grado 1, 10 de los 12 casos fueron positivos, de los grado 2, en 3 de 7 casos y los grado 3, 4 de 5 casos. Los resultados obtenidos a pesar de no ser estadísticamente significativos, están en relación con lo planteado en la literatura, que menciona que entre mejor diferenciado el hepatocarcinoma, más sensible es el TTF-1 y se expresa en mayor porcentaje de células tumorales(9).
En los estudios de Pan et al(9) y de Gu et al(10) ya se había demostrado que tanto el Hep Par 1 como el TTF-1 se unen a una proteína en las mitocondrias de los hepatocitos. Por otro lado en el trabajo de Lei et al encontraron que en sus casos el Hep Par 1 y el TTF-1 mostraron sensibilidad y especificidad similar, 90% de los casos de hepatocarcinoma fueron positivos para TTF-1 y Hep Par(7). Los colangiocarcinomas mostraron positividad en el 20% para el TTF-1, mientras que 30% lo fueron para Hep Par 1; en los adenocarcinomas metastásicos 10% fueron positivos para TTF-1 y 20% para Hep Par 1 . En el trabajo de Tad et al se reportó una positividad de 71% para TTF-1 en hepatocarcinomas y de 66% para el antígeno hepático específico(7).
Los trabajos revisados demuestran que la tinción citoplásmica del TTF-1 en los hepatocitos y en las lesiones neoplásicas derivadas de estos es marcaje real, y que su sensibilidad es similar a la reportada para el anticuerpo Hep Par 1, esto sostiene la viabilidad de incluir al TTF-1 dentro del panel de diagnóstico de las lesiones neoplásicas del hígado. Además, la utilidad de este anticuerpo en el diagnóstico de otras patologías como las de tiroides y pulmón hacen de este anticuerpo uno de uso común en los servicios de patología, a diferencia del Hep Par 1, el cual tiene utilidad limitada y no está dentro del panel básico de inmunohistoquímica de muchos laboratorios de patología.
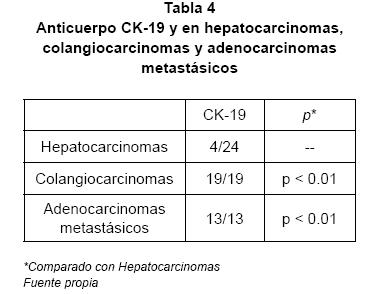
En lo que respecta al uso de la citoqueratina 19 como un complemento del anticuerpo TTF-1 en el diagnóstico diferencial hepatocarcinomas y lesiones con patrón glandular, en el trabajo de Lei et al se reportaron que de 20 casos estudiados con colangiocarcinoma, todos fueron positivos para CK-19, lo mismo que los 20 casos de adenocarcinomas metastásicos, mientras que solo 2 de 40 hepatocarcinomas fueron positivos para la citoqueratina 19(7).
Otro estudio que analizó el valor diagnóstico de las citoqueratinas en el diagnóstico diferencial de hepatocarcinomas y colangiocarcinomas, también reportó una significativa diferencia en la expresión de citoqueratina 19 entre los hepatocarcinomas y los colangiocarcinomas(1). A pesar de los pocos casos de este trabajo los resultados son similares a los del reporte de Lei et al y a los obtenidos en nuestro trabajo. En un trabajo de Lau et al, que también estudió el perfil de inmunohistoquímica de hepatocarcinomas, colangiocarcinomas y adenocarcinomas, sus resultados mostraron una menor sensibilidad de
A pesar de la baja sensibilidad obtenida en su estudio para los colangiocarcinomas con
Los resultados obtenidos en nuestro estudio, y los revisados en la literatura, dejan en claro la utilidad de la citoqueratina 19 en el diagnóstico diferencial de las lesiones primarias de hígado, sólo o como parte de un panel de anticuerpos y en estudios recientes lo consideran un gran complemento del TTF-1 para este fin(7).
En el caso de los adenocarcinomas 36% fueron positivos para CK7 y 30% para CK 20(4).
En nuestro trabajo la citoqueratina 7 fue positiva en 19 de los 24 casos de hepatocarcinomas (79%), en todos los casos de colangiocarcinoma (100%) y en 3 de los 13 casos de adenocarcinomas metastásicos (23%). En este caso, el alto porcentaje de positividad de CK 7 en los hepatocarcinomas no correlaciona con el reportado en la literatura, sin embargo el resultado en los colangiocarcinomas y en las metástasis que en su mayoría correspondían a adenocarcinomas de colon, si fue el esperado. En nuestros casos no solamente los hepatocarcinomas fueron positivos para CK 7 sino también los hepatocitos no neoplásicos adyacentes a los tumores de todos los casos estudiados, esto sugiere un problema técnico en el bloqueo de la biotina, abundante en el tejido hepático.
Los resultados de la citoqueratina 20 si fueron los esperados respecto a la literatura, ya que sólo 3 de los 24 hepatocarcinomas (12,5%) fueron positivos, 3 de los 19 colangiocarcinomas (15%) y 10 de los 13 adenocarcinomas metastásicos (76,9%).
Los datos obtenidos de las citoqueratinas 7 y 20 indican que por sí solas son de poca utilidad en diferenciar hepatocarcinomas de colangiocarcinomas, sin embargo utilizadas dentro de un panel de inmunohistoquímica con la citoqueratina 19 y el TTF-1 permiten, diferenciar con bastante certeza entre lesiones primarias y metastásicas del hígado, además de brindar información sobre el diagnóstico diferencial de los sitios primarios de tumor que con más frecuencia dan metástasis al hígado.
Bibliografía
1. Stroescu, H.V., Dragnea, A. y Popescu, I. (2006). The diagnostic value of cytokeratins and carcinoembryonic antigen immunostaining in differentiating hepatocellular carcinomas from intrahepatic cholangiocarcinomas. J Gastrointestin Liver Dis. 15, 914. [ Links ]
2. Burt, A., ed. (2006). MacSween’s Pathology Factor-1 and Hepatocyte Antigen Immunohis of the Liver.
3. Geller, S. A. y Alsabeh, R. (2008). Application of Immunohistochemistry and intestinal Neoplasms. Arch Pathol Lab Med. 132, 490-499. [ Links ]
4. Lau, P. S., Geller, S. A. y Alsabeh, R. (2002). 9. Pan, C., Tsay, S. y Chiang, H. (2004). Comparative immunohistochemical profile of hepatocellular carcinoma, cholangiocarcino and metastatic adenocarcinoma. Hum Pathol. 33(12), 1175-1181. [ Links ]
5.Taylor, C.R., ed. (2006). Inmunomicroscopy; A diagnostic Tool for the Surgical Pathologist. Major Problems in Pathology. (19 ed).
6.Carter, D., ed. (2009). Sternberg’s Diagnostic Surgical Pathology.
7.Lei, J. Y., DiSant’Agnese, P. A. y Huang, J. (2006). Cytoplasmic staining of TTF-
8.Wieczorek, P. J., Glickman, J. N. y Pinkus, G.(2002). Comparison of Thyroid Transcription Factor-1 and Hepatocyte Antigen Immunohistochemical Analysis in the Differential Diagnosis of Hepatocellular Carcinoma, Metastatic Adenocarcinoma, Renal Cell Carcinoma, and Adrenal Cortical Carcinoma. Am J Clin Pathol. 118(6), 911-921. [ Links ]
9.Pan, C., Tsay, S. y Chiang, H. (2004). Cytoplasmic Immunoreactivity for Thyroid Transcription Factor-
10.Gu, S.V., Ma, C., Zhang, L. y Yang, M. (2007). Cytoplasmic Immunoreactivity of Thyroid Transcription Factor-1 (Clone 8G7G3/1) in Hepatocytes: True Positivity or Cross-Reaction? Am J Clin Pathol. (128): 382-388. [ Links ]
* Anatomopatólogo, Hospital México, Caja Costarricense de Seguro Social. Presidente de la Asociación de Patólogos de Costa Rica. Correo electrónico: ferbrenes@gmail.com
+ Servicio de Cirugía, Hospital Nacional de Niños, Caja Costarricense del Seguro Social
º Anatomopatólogo, Hospital México, Caja Costarricense de Seguro Social.