Introducción
El medio ambiente marino es un reservorio excepcional de productos naturales, muchos de los cuales exhiben características estructurales que no se encuentran en compuestos naturales terrestres [1]. El número de productos naturales aislados de organismos marinos aumenta rápidamente, y actualmente exceden los 18000 [2]. Muchos de los estudios están dirigidos hacia el descubrimiento de sustancias novedosas con actividad biológica, debido a la impetuosa necesidad por la obtención de nuevos fármacos que puedan controlar las cepas evolutivamente más resistentes de microorganismos [3].
Esta alta biodiversidad de los ecosistemas marinos ha resultado en un importante recurso de compuestos químicos, los cuales se han reportado que tienen aplicaciones terapéuticas variadas como actividad antibacterial, antifúngica, antiviral, anticáncer, también actuando como inhibidores y promotores de crecimiento en tejidos vegetales y animales [4]- [9]. Muchos de los nuevos fármacos que son utilizados en la terapia moderna, principalmente en el área de la oncología y en las enfermedades infecciosas, son conocidos por ser derivados de productos naturales [10]. Además, una importante cantidad de los fármacos sintéticos tienen como base química la estructura de estos compuestos naturales aislados de organismos marinos [11].
Los cnidarios son un filo que agrupa alrededor de 10000 especies de animales relativamente simples, que viven exclusivamente en ambientes acuáticos, mayoritariamente marinos, y representan una promisoria fuente de potenciales fármacos [12]- [13]. Interesantemente, estos organismos ocupan una peculiar posición dentro de los animales venenosos; en algunos ambientes acuáticos están en la parte alta de la cadena alimenticia, tienen la capacidad de monopolizar los recursos en su hábitat, así como el espacio disponible, lo que los convierte en organismos dominantes en los lugares donde logran desarrollarse [14]- [17]. El potencial de los cnidarios para ser utilizados como fuente de fármacos se ha demostrado con un significativo número de reportes de moléculas activas aisladas de estos organismos entre el 2000 y el 2010 [13]. La cantidad ha aumentado considerablemente en los últimos años [18].
Los celenterados producen proteínas y péptidos activos biológicamente, incluidas toxinas formadoras de poros (citolisinas), fosfolipasas, inhibidores de proteinasas y neurotoxinas [19]- [22]. En años recientes, las toxinas citolíticas de anémonas marinas han atraído el interés de muchos investigadores, debido a sus actividades biológicas tan variadas; se han reportado antitumorales, antiparasitica, antimicrobiana y otras actividades debido a su poderosa acción membrano-lítica, y a la posibilidad de dirigir estas proteínas y péptidos hacia tejidos específicos [23] - [28].
Actualmente no hay información reportada de la actividad biológica de Aiptasia pallida en Costa Rica. El principal objetivo del presente estudio fue reportar la presencia o ausencia de actividad hemolítica como un primer diagnóstico relacionado con la química de la anémona marina A. pallida como parte de la exploración de nuevos compuestos.
Materiales y métodos
Recolección de las muestras
El material biológico fue recolectado en tanques de acuacultura de la Estación de Biología Marina, ubicada en la provincia de Puntarenas, Costa Rica (Latitud 9º 97¢66.75¢¢ N y Longitud 84º 82¢89.22¢¢ O). Las anémonas marinas fueron cuidadosamente desprendidas de las paredes de los tanques, para luego ser lavadas con agua destilada, colocadas en tubos de muestreo plásticos, para finalmente ser transportadas al laboratorio a una temperatura de alrededor de 4°C. Las muestras se mantuvieron a dicha temperatura durante el transporte para prevenir la descomposición, pérdida de concentración y la actividad normal de los biocompuestos presentes, como lo recomiendan [29] y [30]. Unos especímenes se preservaron en formalina al 5% y también en etanol al 70%, para su posterior confirmación taxonómica y para ser depositados en la colección de cnidarios del Museo de Ciencias Biológicas (Facultad de Ciencias Exactas y Naturales, Universidad Nacional).
Preparación y extracción del material
El extracto crudo fue obtenido por trituración y homogenización de todo el cuerpo del organismo con agua destilada (1:2 m/v), con ayuda de un mortero previamente enfriado a 4°C. Los sólidos se separaron inicialmente por decantación, para luego separar los sólidos más finos por centrifugación a 13675 rpm por 20 min a 4°C en una centrifuga Eppendorf 5418R. El sobrenadante obtenido fue colectado en tubos eppendorf y almacenado a -22°C hasta su análisis [26]- [27].
Actividad Hemolítica
La concentración de proteínas del extracto crudo fue determinada por el método de Bradford [31] con Azul Brillante de Coomassie G-250 al 0.01%, utilizando albumina de suero bovino (BSA) como estándar. La absorbancia fue medida espectrofotométricamente a 280 nm. Se realizó una electroforesis en gel de poliacrilamida con dodecil-sulfato de sodio (SDS-PAGE) al extracto crudo a diferentes concentraciones, utilizando gel de poliacrilamida al 15%. El extracto fue disuelto en buffer Laemmli [32], (10% SDS, 0.02 M 2-mercaptoetanol, pH 6.8) y fue calentado a 100°C por 10 min. Las bandas de proteínas fueron teñidas con tinción Azul de Coomassie al 0.05% (m/v). Se utilizó un marcador de peso molecular (8 a 220 kDa) marca ColorBurstTM (Sigma Aldrich), como control positivo para bandas de actinoporinas se utilizaron esticolisina II (StII) de la anémona marina Stichodactyla helianthus y una nueva actinoporina aislada cromatográficamente de Anthopleura nigrescens[26], [33].
La actividad hemolítica fue evaluada turbidimétricamente a 600 nm a temperatura ambiente (25°C ± 2°C), como se describe en el método utilizado por Martinez y otros [34]. La suspensión de eritrocitos fue preparada utilizando células rojas de sangre fresca (RBC), lavadas por centrifugación y resuspendidas en Tris-buffered saline (TBS; 145 mM NaCl, 10 mM Tris-HCl, pH 7,4). La suspensión de eritrocitos fue diluida con TBS hasta que alcanzar un valor de absorbancia de 0.100 a 600 nm, y la lectura de los valores de absorbancia fueron determinados en un lector de microplacas MultiScan FC (Thermo Scientific). La pérdida de turbidez fue relacionada cuantitativamente con la actividad hemolítica. Se realizó un control negativo utilizando RBC sin la presencia del extracto; y un control positivo utilizando RBC con la actinoporina esticolisina II (STII) de la anémona marina Stichodactyla helianthus[33], [35].
Resultados y discusión
Los resultados de la actividad hemolítica (HA) del extracto crudo de la anémona marina A. pallida se muestran en la Figura 1. Las diferentes concentraciones ensayadas del extracto no mostraron HA contra las RBC, sin embargo la absorbancia fue incrementando en función del tiempo, e incrementa a mayor concentración de proteínas del extracto. El control positivo de StII de la anémona S. helianthus se puede observar en la Figura 2, donde es claro un incremento inicial de la absorbancia, seguido de un decaimiento de su valor, producto de la lisis de las RBC. En el caso del aumento en los valores de absorbancia del del extracto crudo, es un comportamiento que está relacionado con el aumento en el volumen de los eritrocitos, sugiriendo que los componentes del extracto presentan ciertas cargas particulares que al acercarse a la membrana, pueden tener como consecuencia la alteración de la distribución de los iones que usualmente difunden a través de ella [36]. El tráfico de iones es gobernado por campos eléctricos, gradientes de concentración y permeabilidades de la membrana no específicas. Esta acción es conocida como el efecto Donnan: iones en el fluido extracelular pueden impulsarla entrada o salida de otros iones a la célula. La única vía para la célula de restablecer el equilibrio osmótico es alterar su volumen hasta que la concentración de iones intracelulares que no difunden sea igual a la concentración de los iones restringidos en el líquido extracelular [37]- [39]. Los resultados obtenidos sugieren que la variación en el volumen de las RBC podría ser causado por la desestabilización de la membrana producto de la interacción con compuestos presentes en el extracto de A. pallida, sin causar la lisis de la célula a las concentraciones ensayadas (concentración sub-lítica).
Existen múltiples reportes de anémonas marinas que presentan neurotoxinas con diferentes interacciones sobre RBC y efectos en la conducción iónica de las membranas. El primer reporte en el veneno de Aiptasia fue descrito por Hessinger y otros [40], quienes identificaron la presencia de una fosfolipasa A, la cual tenía efectos sobre la actividad nerviosa de algunos organismos ensayados. Muscatine y Lenhoff [41] fueron de los primeros en reportar una neurotoxina en A. pallida, la cual causaba la muerte del cangrejo violinista. Marino y otros [42] encontraron citotoxicidad en el veneno de los nematocistos de la anémona marina Aiptasia mutabilis; el nematocisto contenía una o más toxinas con una actividad extremadamente citolítica (0.6 nematocistos/microL inducía necrosis celular). Nesher y otros [43] describieron el aislamiento y caracterización de AdE-1 (un modificador de canal iónico), un péptido nuevo cardiotónico de la anémona marina Aiptasia diaphana. AdE-1 incrementa la amplitud de la contracción del cardiomiocito y disminuye la velocidad de la fase tardía de la contracción de relajación, sin ninguna inducción o contracción espontánea.
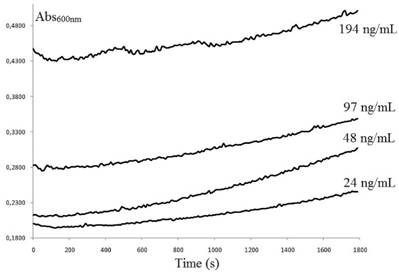
Figura 1 Actividad hemolítica (HA) del extracto crudo (1:2 m/v) de Aiptasia pallida. Las concentraciones de proteína ensayadas fueron 194, 97, 48 and 24 ng/mL.
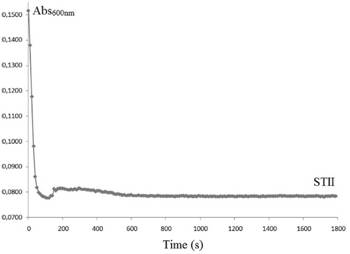
Figura 2 Control positivo de actividad hemolítica (HA) de esticolisina II (STII) de la anémona marina Stichodactyla helianthus. La concentración de proteínas fue de 60 ng/mL.
Los resultados obtenidos en la SDS-PAGE muestran una banda con un peso molecular alrededor de 20 kDa (Figura 3) para esticolisina II de la anémona marina S. helianthus, e igualmente para la nueva actinoporina reportada para A. nigrescens (PII) por Alvarado y otros [26] aparece una banda con un peso molecular alrededor de 20 kDa; característica de la familia de las actinoporinas [24], [44]- [45]. Los extractos de A. pallida no mostraron bandas alrededor de 20 kDa (Figura 3) a ninguna concentración, lo que evidencia la no presencia de actinoporinas en esta anémona. Una banda con un peso molecular alrededor de 30 kDa podría responder a la presencia de proteínas-toxinas tipo III en el extracto, las cuales tienen efectos característicos a los resultados observados en HA [24].
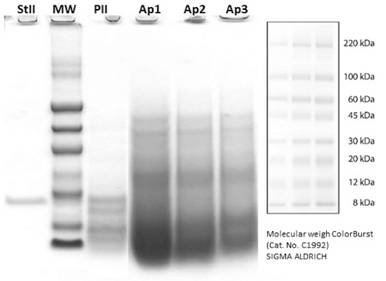
Figura 3 SDS-PAGE (15%) de diferentes concentraciones de extracto crudo de Aiptasia pallida. Bandas: StII: esticolisina II deStichodactyla helianthus, (20 kDa; 0.06 mg/mL); MW: marcador de peso molecular; PII: nueva actinoporina aislada de la anémona marina Anthopleura nigrescens (Alvarado et al., 2014); Ap1: extracto crudo de A. pallida (0.32 mg/mL); Ap2: extracto crudo de A. pallida (0.16 mg/mL); Ap3: extracto crudo de A. pallida (0.08 mg/mL). Las bandas fueron reveladas con Azul Coomassie 0.05% (m/m).
Conclusiones
Se evaluó el extracto crudo de la anémona marina A. pallida de Costa Rica, específicamente para actividad hemolítica. Los resultados mostraron el incremento del valor de absorbancia asociado al aumento de volumen de los eritrocitos en función del tiempo, sin alcanzar la lisis de los mismos a las concentraciones ensayadas, por lo que se consideran concentraciones sub-líticas. También se observa un incremento del valor de absorbancia al aumentar la concentración de proteínas en el extracto, lo que indica que algún o algunos compuestos del extracto interacciona con la membrana, provocando desestabilización en la misma.
El extracto crudo de la anémona A. pallida podría ser una fuente promisoria de proteínas y péptidos activos, los cuales pueden ser aplicados como herramientas biotecnológicas en diferentes áreas de la ciencia [46]. Muchos extractos de anémonas marinas, así como sus venenos siguen demostrando que presentan compuestos con propiedades biológicas interesantes que pueden ser explotados en aplicaciones clínicas en el futuro [47]- [49].














