Introducción
Los nematodos fitófagos se encuentran entre los parásitos que causan más impacto en el rendimiento de plantaciones a nivel mundial. Muchos cultivos de importancia comercial son afectados por nematodos, los cuales, además de parasitar las raíces, predisponen a la planta a infecciones por bacterias, hongos y virus [1].
Costa Rica no es ajena a esta realidad, entre los cultivos de importancia económica afectados por nematodos en el país se encuentran el café, el banano y el tomate; en estos dos últimos el uso de nematicidas sintéticos de uso restringido por su toxicidad, es común [2] [3].
En Latinoamérica Radopholus similis es el nematodo de mayor importancia en la mayoría de las plantaciones comerciales de banano, que junto con otros nematodos, son los responsables del deterioro gradual del sistema radical de las plantas, siendo el segundo problema fitosanitario del cultivo, ya que provocan pérdidas económicas estimadas entre el 10 y 50% [4] [5].
Por otro lado, en el cultivo del tomate el nematodo de mayor importancia en las plantaciones costarricenses es Meloidogyne, varias especies de este nematodo pueden reducir el rendimiento de una plantación hasta en un 68%, afectando la cantidad y calidad de los frutos [6]. La reducción del rendimiento puede causar que los costos de producción superen los ingresos económicos [7].
El café es otro cultivo afectado por varias especies de nematodos, siendo Meloidogyne exigua uno de los más importantes en Centroamérica [8]. Este nematodo produce en plantas susceptibles raíces más cortas, reduciendo el rendimiento hasta en un 55%, además se le atribuye la disminución en el rendimiento de las plantaciones de Río de Janeiro, en Brasil [9].
Como se mencionó anteriormente, en estos cultivos el control de nematodos se realiza con nematicidas sintéticos que son altamente tóxicos, y que por sus efectos en la salud y el ambiente, se ha restringido su uso y en algunos casos han sido removidos del mercado [10] [4].
El desarrollo de alternativas al uso de plaguicidas ha sido una prioridad para los investigadores durante los últimos años. En esta línea, ha habido un creciente reconocimiento de la función de algunos enemigos naturales para combatir los nematodos parásitos de las plantas, entre ellos, el control biológico por medio de hongos nematófagos el cual ha demostrado tener potencial para ser integrado en los programas de manejo [11] [12].
A pesar de haber demostrado su potencial, en las investigaciones sobre el uso de hongos nematófagos se han obtenido resultados variables, y aunque se han realizado numerosas investigaciones, solamente se han estudiado en detalle un reducido grupo de especies, de las cuales muy pocas se han desarrollado como productos para el control biológico [12]. En [13], atribuyen estas limitaciones al escaso conocimiento sobre la biología y ecología de los hongos, que son determinantes para establecer los factores clave que afectan su eficacia como agentes biocontroladores, y proponen realizar más investigación para reducir la falta de información.
En Costa Rica, la diversidad de hongos existente en los ecosistemas naturales y agrícolas del país, es indicadora del potencial para utilizar los nematófagos como medio de control biológico, y la capacidad de cepas de hongos para controlar nematodos ya ha sido demostrada [14] [15].
Por estas razones, el objetivo de la presente investigación fue determinar la capacidad nematófaga de diez cepas de hongos sobre los fitonematodos Meloidogyne exigua, Meloidogyne incognita y Radopholus similis, mediante un ensayo in vitro, los resultados obtenidos serán el punto de partida para la realización de investigaciones posteriores en campo y laboratorio, que permitan el desarrollo de productos eficientes e inocuos para el control de nematodos.
Materiales y Métodos
Selección y reactivación de los hongos
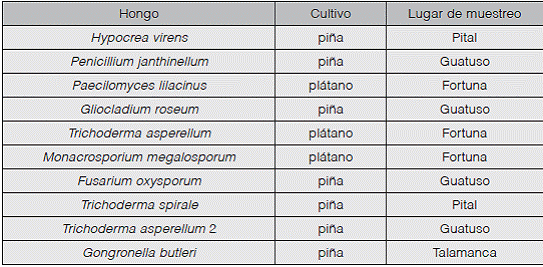
Las cepas de los hongos que fueron objeto de este estudio se aislaron del suelo de plantaciones de piña, plátano y arroz en la Región Huetar Norte, en el año 2010. Las mismas habían sido identificadas a nivel de género por sus características morfológicas y se mantenían almacenadas en aceite mineral.
Una selección de veinte de estas cepas fue reactivada y colocada en medio PDA para su crecimiento y multiplicación según la metodología propuesta por [16]. Se procuró incluir hongos aislados de todos los cultivos, y se evitó incluir cepas que podrían tratarse de duplicados ( hongos aislados de una misma plantación y pertenecientes al mismo género ).
Seguidamente y antes de iniciar los ensayos, un duplicado de cada hongo fue enviado al Laboratorio de Técnicas Moleculares Aplicadas a la Fitoprotección, del Centro de Investigaciones en Protección de Cultivos, de la Universidad de Costa Rica, para confirmar su identidad mediante secuenciación de una región del gen ITS.
Entre las cepas reactivadas, diez fueron seleccionadas para estudiar su patogenicidad sobre los nematodos (Cuadro 1), la selección se realizó tomando en cuenta la diversidad de cultivos y lugares de muestreo de los que provinieran. Además, únicamente se probaron hongos en los que se logró confirmar la identificación morfológica a través de técnicas moleculares.
Establecimiento de poblaciones de nematodos
Previo a la preparación de las pruebas de patogenicidad se establecieron poblaciones puras de Radopholus similis, Meloidogyne incognita y M. exigua. Las poblaciones de R. similis se establecieron en discos estériles de zanahoria (Daucus carota) según la metodología propuesta por [17], los discos de zanahoria con la población inicial fueron proporcionados por el Laboratorio de Nematología de la Corporación Bananera Nacional.
Por otro lado, las poblaciones de M. incognita y M. exigua fueron establecidas en plántulas de tomate y café respectivamente que fueron inoculadas con huevos obtenidos de plantaciones infectadas.
Una vez establecidas las poblaciones, la identidad de las especies fue confirmada por análisis molecular mediante PCR-RFLP, utilizando el protocolo descrito por [18].
Durante la realización de las pruebas de patogenicidad se prepararon suspensiones de nematodos y huevos a partir de las poblaciones establecidas. Los discos de zanahoria se lavaron con agua destilada estéril, y por otro lado, de las raíces de tomate y café fueron extraídos y a la vez desinfectados huevos y juveniles de M. incognita y M.exigua separadamente, con una solución de NaOHCl al 0,5% según la metodología propuesta por [19].
Pruebas de patogenicidad
Las pruebas de patogenicidad se realizaron utilizando la metodología descrita por [14 ]. Platos petri con agar agua fueron inoculados con 200 µl de una solución de esporas (5 000 a 7 500 esporas/µl), que fue distribuida en toda la placa con una espátula de Drigalski.
Los platos Petri se incubaron por cuatro días a 25°C y fotoperiodo de 12 horas. Transcurridas 96 horas, se depositó 0,5 ml de una suspensión conteniendo 150 individuos y 100 huevos del nematodo de interés. Las cajas se incubaron por cuatro días más en oscuridad a 25°C.
Pasado este tiempo se evaluó cada plato petri en un microscopio Olympus BX 51 para verificar la capacidad depredadora de cada aislamiento mediante la presencia de individuos muertos y huevos parasitados, y se calculó el porcentaje de mortalidad en cada repetición.
Para cada hongo y especie de nematodo se prepararon 10 repeticiones. Además se prepararon 5 platos inoculados con el hongo y cinco platos control (sólo con nematodos y huevos ).
Cada prueba fue trabajada de forma individual tanto para cada hongo como para cada especie de nematodo. Todas las pruebas se realizaron de forma independiente por tal razón no se realizaron comparaciones entre ellas.
Basado en resultados obtenidos por otros autores se consideró como hongos con potencial nematófago para controlar M. incognita, M. exigua o R. similis aquellos que cumplieran lo siguiente:
Porcentajes de mortalidad de nematodos significativamente mayores que las de su respectivo testigo, según las pruebas estadísticas.
Porcentaje de mortalidad sobre los nematodos o porcentaje de huevos parasitados mayor a un 50%.
Para determinar diferencias entre el porcentaje de mortalidad del tratamiento y el de su respectivo control, se realizó un análisis de varianza entre objetos de un solo factor.
Resultados y Discusión
Según los criterios establecidos en la metodología, para establecer el potencial nematófago de los hongos, las cepas de H. virens y P. janthinellum no presentaron actividad nematicida contra ninguna de las especies de nematodos (cuadro 2, 3 y 4).
M. megalosporum, T. spirale y T. asperellum 2 presentaron actividad nematicida en las pruebas realizadas contra R. similis y M. exigua. Mientras que G. roseum y F. oxysporum mostraron actividad únicamente en contra de R. similis (Cuadros 2 y 3, Figura 1).
Cuadro 2 Porcentajes de mortalidad estimados de Radopholus similis, en pruebas in vitro, con hongos nematófagos aislados de plantaciones de piña, plátano y arroz en la Región Huetar Norte (Valores con asterisco (*) son significativamente mayores que el testigo (p<0,05).
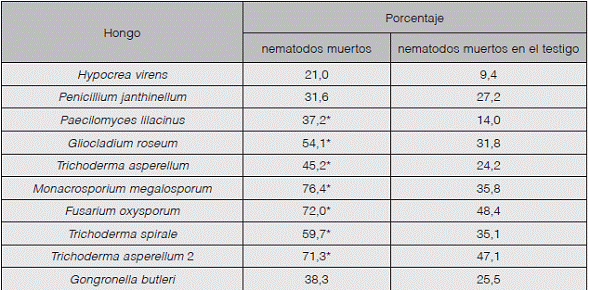
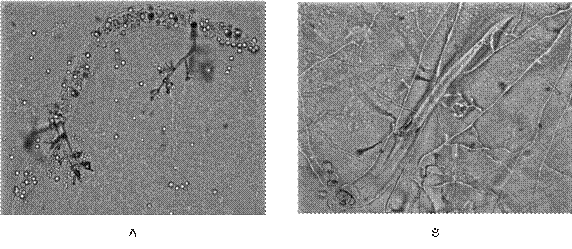
Figura 1: Individuos de Radopholus similis parasitados por aislamientos de Trichoderma asperellum proveniente de una plantación de piña en la localidad de Guatuso (A) y Monacrosporium megalosporum proveniente de una plantación de plátano en la localidad de La Fortuna (B) (Fotos Laboratorio de Nematología, ITCR, San Carlos, 2014).
En las pruebas realizadas contra Radopholus similis, las cepas de Monacrosporium megalosporum, Trichoderma asperellum 2 y Fusarium oxysporum, evaluadas demuestran un potencial para el control de este nematodo con porcentajes de mortalidad mayores al 70%.
Además de M. megalosporum, T. spirale y T. asperellum 2, T. asperellum y G. butleri también mostraron potencial de control en contra de M. exigua, estos dos últimos no mostraron actividad nematicida en las pruebas realizadas con R. similis y M. incognita.
Cuadro 3 Porcentajes de mortalidad estimados de Meloidogyne exigua, en pruebas in vitro, con hongos nematófagos aislados de plantaciones de piña, plátano y arroz en la Región Huetar Norte (Valores con asterisco (*) son significativamente mayores que el testigo (p<0,05).
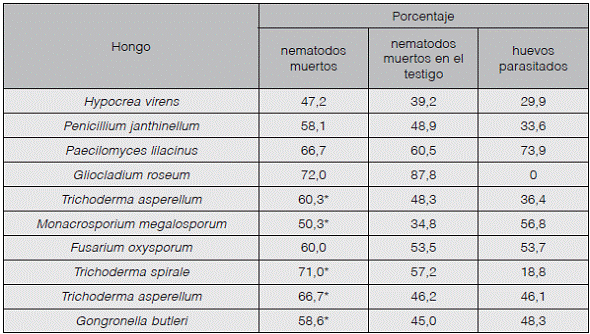
Ninguna de las cepas cumple con lo establecido para considerarla con actividad nematicida contra juveniles de M. incognita, únicamente con T. asperellum 2 se obtuvieron porcentajes de mortalidad significativamente mayores que los del testigo, sin embargo, este porcentaje no alcanza el 50%, es de apenas un 43% (Cuadro 4).
Por otro lado, P lilacinus y F. oxysporum mostraron capacidad para parasitar huevos de las dos especies de Meloidogyne evaluadas. Además, T. asperellum y T spirale parasitaron un porcentaje de huevos de M. incognita mayor al 70%, y M. megalosporum parasitó un 56% de los huevos de M. exigua (Figura 2).
En las pruebas realizadas contra Meloidogyne incognita y M. exigua, es notable el porcentaje de parasitación de huevos observado en las pruebas realizadas con Paecilomyces lilacinus y Trichoderma asperellum, mayores al 80%, además de que se observaron altos porcentajes de mortalidad de juveniles en las pruebas realizadas con Trichoderma spirale, Trichoderma asperellum y Fusarium oxysporum.
Los porcentajes de mortalidad obtenidos en estos ensayos están cercanos a los determinados en ensayos similares. Por ejemplo [20] determinaron porcentajes de parasitación de P. lilacinus sobre masas de huevos de Meloidogyne javanica, entre 45 y 52% después de tres semanas de inoculación.
Cuadro 4 Porcentajes de mortalidad estimados de Meloidogyne incognita, en pruebas in vitro, con hongos nematófagos aislados de plantaciones de piña, plátano y arroz en la Región Huetar Norte (valores con asterisco (*) son significativamente mayores que el testigo (p<0,05).
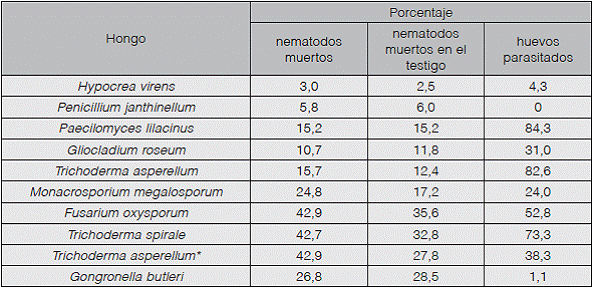
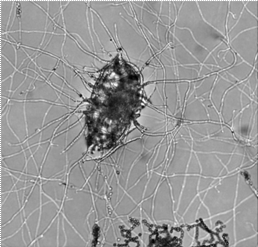
Figura 2: Huevo de Meloidogyne incognita parasitado por un aislamiento de Paecilomyces lilacinus proveniente de una plantación de plátano en la localidad de La Fortuna. (Fotos Laboratorio de Nematología, ITCR, San Carlos, 2014).
[14] también obtuvieron porcentajes de mortalidad-parasitación mayores al 60% con dos cepas de Monacrosporium y Trichoderma, y porcentajes de parasitación de huevos cercanos al 50% con tres diferentes cepas de P. lilacinus, una de F. oxysporum y varias de Trichoderma.
También [21], determinaron porcentajes de parasitación de T. viride y P. lilacinus sobre M. incognita de 60% y 25% respectivamente en pruebas in vitro. Además ambos hongos disminuyeron la eclosión en más de un 40% y P. lilacinus parasitó el 70% de los huevos después de una semana de realizada la inoculación
Todos los hongos estudiados en esta investigación que tienen potencial para el control de nematodos ya han sido reportados como hongos nematófagos por otros autores, a excepción de Gongronella butleri.
Trichoderma ha sido ampliamente estudiado y se reconoce como parasitador de nematodos y otros organismos, siendo un hongo antagonista muy agresivo. Cepas específicas se han utilizado en el control de otros hongos, insectos y además nematodos [22]. Se cree que su capacidad de controlar nematodos se debe a la producción de nematotoxinas, tales metabolitos ya han sido aislados [23] [24].
Monacrosporium es reconocido por ser un hongo que forma trampas que le permiten parasitar nematodos vivos, la formación de trampas es estimulada por condiciones ambientales o compuestos liberados por los nematodos [25], además se ha determinado que también produce proteasas con efecto nematicida [26].
La capacidad de Fusarium oxysporum de parasitar nematodos también se basa en la producción de compuestos nematotóxicos, mismos que ya han sido aislados y probados para el control de diversas especies de nematodos [27] [28]. Además tiene la ventaja de comportarse como un hongo endofítico, por lo que su actividad ya ha sido comprobada contra nematodos endoparásitos [29].
Paecilomyces lilacinus es uno de los hongos más utilizados para control biológico, y ha sido ampliamente estudiado como parasitador de huevos de nematodos [30], su efecto se basa en su capacidad quitinolítica que destruye la quitina en la cubierta de los huevos de los nematodos [31] , además se han aislado compuestos nematicidas de algunas cepas [32].
Gliocladium roseum y Gongronella butleri, son hongos sin actividad nematicida reconocida. De algunas cepas de G. roseum, se han aislado compuestos nematicidas [32] [33]. En el caso de G. butleri se conoce que produce una gran cantidad de quitosano, que se utiliza en agricultura como estimulante del crecimiento y la inmunidad, sin embargo las referencias a su capacidad nematicida son casi nulas [34].
Conclusiones
Entre los hongos evaluados, únicamente las cepas de Hypocrea virens y Penicillium janthinellum no presentaron actividad nematicida en ninguna de las pruebas.
Las cepas evaluadas de Monacrosporium megalosporum, Trichoderma spp., Fusarium oxysporum y Paecilomyces lilacinus, demostraron buen potencial para el control de diferentes estadios de Meloidogyne incognita, M. exigua y Radopholus similis.
Los porcentajes obtenidos de mortalidad y parasitación de huevos, son similares a los apuntados en estudios similares, además se logró determinar causalidad entre la mortalidad y parasitación de los nematodos y la presencia de las cepas evaluadas.
El potencial demostrado por estas cepas para el control de nematodos debe ser probado en posteriores investigaciones en invernadero y campo. Según [30] [26] [35] es indiscutible la importancia de las pruebas in vitro para aislar los factores que pudieran afectar el establecimiento de relaciones de causalidad, pero, una vez establecida tal causalidad es necesario realizar pruebas en el campo, ya que la temperatura, la densidad de inóculo, las fuentes de carbono y otras condiciones afectan directamente la eficiencia de los hongos nematófagos como controladores.
Por otro lado, las pruebas in vitro realizadas aportan importante información, que puede ser utilizada con ayuda de técnicas moleculares, para la obtención de hongos más patogénicos. Como ya lo apuntan otros autores [36], es posible de desarrollar cepas altamente eficientes en el control, y resistentes a diferentes condiciones ambientales, además de identificar los genes relacionados con la patogenicidad que permitan entender mejor los mecanismos moleculares y evolucionarios de la interacción hongos-nematodos.