Introducción
El chayote (Sechium edule) es una cucurbitácea comestible que se explota principalmente por su fruto. La variedad cultivada para la producción y exportación de frutos es la conocida como quelite, que se ha empleado durante muchos años y fue desarrollada por agricultores de la zona de Paraíso, en la provincia de Cartago, Costa Rica. Se caracteriza por producir un chayote sin espinas y sin estrías longitudinales, de superficie lisa, forma aperada y color verde claro (CINPE, 2011).
En Costa Rica existen unas 450 hectáreas (ha) sembradas con este cultivo. El mercado principal de exportación es Estados Unidos y el mercado interno de mayor importancia es el Centro Nacional de Abastecimiento y Distribución de Alimentos (CENADA). Esta hortaliza es la que genera más divisas a nivel nacional (Gamboa, 2005; MAG, 2010).
Las enfermedades y plagas principales que afectan a esta dicotiledónea son la vejiga (Micovellosiella cucurbiticola), la sarna (Phoma cucurbitacerarum), fusariosis (Fusarium oxysporum) y peca blanca (Ascochyta phaseolorum), que es la más relevante (Somá & Núñez, 2013).
A. phaseolorum apareció en las plantaciones de chayote en la década de los 80 y para la de los 90 se convirtió en la plaga de mayor impacto a nivel nacional. Esto afectó las exportaciones, ya que este hongo ataca principalmente las hojas, tallos y peciolos, produciendo lesiones cafés; asimismo, en el fruto se observan lesiones secas de color blanco con un diámetro pequeño, lo que merma la productividad de la plantación y provoca su descarte (Gamboa, 2005, Somá & Núñez, 2013).
Se han tomado medidas para reducir el daño, como aumentar las distancias de siembra y utilizar Benomyl® y Clorotalonil®, especialmente durante la época lluviosa (Gamboa, 2005; Somá & Núñez, 2013).
El objetivo de esta investigación fue lograr el aislamiento e identificación de A. phaseolorum, así como hacer una revisión de su ciclo de vida, lo que permitiría orientar mejor el manejo integral de la enfermedad.
Metodología
El aislamiento in vitro de A. phaseolorum se desarrolla en medio de cultivo agar papa dextrosa acidificado (PDA ac) a una temperatura de 35 °C durante siete días. Para la identificación morfológica es necesaria la observación microscópica y macroscópica del cultivo puro del hongo. Con ello se observan las estructuras morfológicas que lo caracterizan. Aunque esta es una técnica relativamente antigua, ayuda de una manera rápida a la identificación del hongo.
Para la identificación del patógeno de una manera eficaz se utilizaron métodos moleculares, como la técnica de Reacción en Cadena de la Polimerasa (PCR) (Poggi et al, 2009), que puede identificar el organismo con una mayor presión y en un tiempo relativamente corto.
Se visitó la plantación de chayote de V y C Exportaciones, en Ujarrás, Paraíso, Cartago, donde se tomaron muestras del tejido afectado por el patógeno, presuntamente A. phaseolorum. Las muestras se almacenaron en una bolsa y se guardaron fuera del alcance de la luz solar hasta llegar al laboratorio, donde se refrigeraron. Antes de inocularlas en el medio de cultivo se cortaron segmentos de 1 cm2 aproximadamente, de tal manera que el segmento tomara parte tanto del tejido afectado y como del tejido con apariencia sana. Los segmentos se colocaron durante un minuto en cloro, luego dos minutos en alcohol y tres minutos en agua, como método de desinfección.
Una vez desinfectados, los segmentos se colocaron en un medio PDA acidificado, cuatro por placa de Petri, y se incubaron a 35 °C por cinco días. Además se realizó un subcultivo utilizando las colonias con morfología similar a los posibles patógenos causales de la sintomatología observada en la planta, para asegurar la pureza del aislado, y se volvió a incubar por cinco días a 35 °C.
Posteriormente, se realizaron observaciones usando un microscopio óptico, en busca de estructuras características que ayudaran a la identificación morfológica del hongo. Las muestras se tiñeron con azul de lactofenol para obtener un mayor contraste.
Para la identificación molecular se realizó una extracción de ADN genómico de micelios macerados en nitrógeno líquido, utilizando el kit de extracción Power Soil de MOBIO®, y se hizo un PCR usando los cebadores NS1 y GC-FUNG en el ADN extraído.
Resultados
Los resultados muestran que la plantación presenta lesiones foliares circulares de coloración amarillenta en etapas iniciales y café con un halo amarillo en etapas avanzadas, no delimitadas a las áreas intervenales de la hoja. Además, son de apariencia seca y se encuentran en la mayoría de las plantas, existiendo zonas con mayor incidencia de la enfermedad.
Una vez terminado el tiempo de incubación, se obtuvieron colonias de apariencia filamentosa de color blanco en la parte superior, mientras que en la inferior tenían una coloración oscura.
Figura 2 Crecimiento fúngico observado a los cinco días de incubación a 35 ºC, a partir de segmentos de hoja.
Al analizar una muestra del micelio a 40X se observó un micelio septado y esporas características del género Ascomycota.
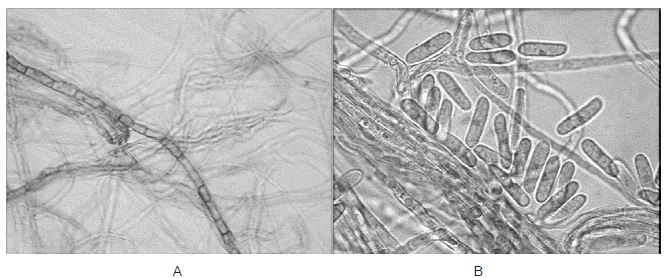
Figura 3 A) Micelio observado en las muestras de hongo a 40X, así como esporas presentes en el cultivo B)
Se amplificó un segmento del ADN aislado a partir de los micelios del hongo, correspondiente a la región codificante para el ARN ribosomal 18S, utilizando los primers GC-FUNG y NS1. Una vez obtenido el segmento amplificado, se procedió a su secuenciación.
Al ingresarse la secuencia de ADN obtenida a la base de datos del National Center for Biotechnology Information (NCBI), se observó que el producto de PCR posee un 99% de similitud con la secuencia 18S reportada para el filo Ascomycota, grupo al que pertenece A. phaseolorum (Boreson, Dillner & Peccia, 2005).
Debido a la poca literatura existente sobre secuencias que permitan la identificación de este patógeno con marcadores moleculares, solo se pudo identificar la división a la que pertenece este hongo.
Discusión
Como se puede apreciar en la Figura 1, las hojas de S. edule presentan lesiones circulares, secas, quebradizas y no delimitadas por el tejido vascular. Por las características anteriores y la coloración café claro de los halos y la presencia de anillos amarillentos, se concluye en primera instancia que el causante de estas lesiones podría ser A. phaseolorum (MAG, 2010; Gamboa, 2005). Esto fue corroborado (Figura 2 y Figura 3) por la presencia de micelio septado y ramificado, así como por conidios con forma bicelular, hialinos y con un solo septo, estructuras características del género Ascochyta y que han sido reportadas por De Souza et al. (1996) y Ames (1997) para A. phaseolorum.
A. phaseolorum es un patógeno que durante la época lluviosa induce la germinación de conidios, con la posterior formación de apresorios y el inicio de la secreción de enzimas para penetrar las células de la epidermis o los estomas. Una vez dentro de la planta, genera micelio y penetra en las otras células, para lo cual utiliza enzimas como poligalacturonasas, pectinasas, lipasas, celulasas, así como otras hidrolasas. Lo anterior permite que el micelio invada el interior de la célula y una mayor movilización en parénquima que esclerénquima; esto provoca que las células vegetales engruesen sus paredes y reduzcan los espacios intercelulares, lo que se podría deber a la secreción por parte del patógeno de reguladores y señales para evitar que las células colapsen y se lisen por la presión ejercida durante el crecimiento del micelio (Vásquez et al., 1976; Ames, 1997).
Con el paso del tiempo, las áreas infectadas empiezan a sufrir alteraciones, como la formación de protoplasmas granulares y cambio de color en el contenido celular, lo que conduce a la muerte celular. Es por eso que al observar las lesiones en las hojas de chayote se puede ver que el patógeno se expande formado círculos concéntricos desde donde germinó el conidio, siendo las áreas amarillentas donde el patógeno está aumentando su micelio en el interior de las células y alimentándose de los nutrientes celulares, mientras que las zonas café claro o pardo corresponden a las células que están sufriendo los cambios mencionados y el área central con tejido necrótico a las células que han colapsado (Vásquez et al., 1976).
Además, durante la invasión el micelio del hongo destruye los elementos traqueales del xilema, como resultado de la etapa ontogénica y la formación de estructuras teratológicas, mientras que las células parenquimáticas que rodean el haz infectado se comprimen y distorsionan, provocando la deposición de sustancias en los espacios intercelulares (Vásquez et al.,1976).
En una etapa posterior se da la fase de reproducción asexual, con la formación de numerosos picnidios inmersos parcialmente en el tejido, los cuales poseen una abertura al exterior mediante un poro u ostiolo en el extremo superior, a través del cual se liberan los conidios, lo que le permite al patógeno dispersarse e invadir otras hojas y tallos de la misma planta o bien de ejemplares cercanos (Ames, 1997, Rishabh & Rohini, 2009).
Entre los mecanismos de defensa de la planta se pueden mencionar el engrosamiento de las capas de las paredes celulares y la producción de los diferentes compuestos que conforman estas paredes (la producción de suberina y el proceso de lignificación aumentan la resistencia al ataque), siendo este último aspecto de gran relevancia para inhibir la germinación, reducir la capacidad de alargamiento de las hifas e impedir la difusión de enzimas y toxinas del hongo al hospedero, así como de agua y nutrientes del hospedero al hongo. Otro mecanismo para dificultar la invasión es la producción de gomas y mucílago. Se ha determinado que el hospedero utiliza una demarcación histológica que le permite limitar la extensión del patógeno y los metabolitos producidos por éste, como es la síntesis de saponinas, enzimas hidrolíticas, pectinasas y la activación de la respuesta hipersensible, proteínas PR, entre otros mecanismos (Gamboa, 2005; Agrios, 2005; Campos & Flores, 2012).
Conclusiones
Por medio del diagnóstico molecular se reveló que el patógeno pertenece a la división Ascomycota, que incluye a A. phaseolorum.
Las estructuras de reproducción del patógeno le permiten diseminarse con facilidad, por lo que es necesario que los productores de chayote implementen un control integrado de plagas, con distancias adecuadas entre las plantas y el uso de fungicidas, a fin de manejar más apropiadamente el cultivo y evitar daños en la planta y sobre todo en el fruto.















