Introducción
La contaminación del recurso hídrico se ha relacionado a nivel mundial con el uso agrícola extensivo de plaguicidas (Anju, Ravi & Bechan, 2010). En Costa Rica, el servicio de agua potable para 6000 personas se vio afectado por la presencia del herbicida bromacil en acuíferos del Caribe (Boeglin, 2010; Ruepert et al., 2005). Ante esto, el Servicio Nacional de Acueductos y Alcantarillados debió solventar la problemática llevando cisternas con agua potable al lugar afectado durante un tiempo indeterminado (Agüero, 2007), lo que implicó un alto costo para la institución. En otras partes del mundo, como Estados Unidos (Pfeuffer, 2011; Zhang et al., 1997), Holanda (Schipper & Vissers, 2008) y España (Hernández et al., 2008) también se han detectado trazas de este pesticida en aguas de potencial consumo humano.
El bromacil se caracteriza por su alta solubilidad en agua, una bioacumulación ligera, alta movilidad ambiental y una vida media en el ambiente de 60 días. La Agencia de Protección Ambiental de Estados Unidos (EPA) lo considera ligeramente tóxico y se han evidenciado efectos crónicos -como daño en los testículos, hígado y tiroides- en animales de laboratorio. En algunos países existen límites máximos recomendados para la presencia de bromacil en las aguas de consumo humano: 90 µg/L en Estados Unidos, 0,1 µg/L en la Unión Europea y 300 µg/L en Australia (Cruz, 2010).
Debido a la importancia de este herbicida como contaminante ambiental, se han realizado estudios con el objetivo de evaluar su degradación, tales como los de Kalyani (Kalyani, 1993) se logró la fotodegradación a partir de la irradiación con luz ultravioleta del 90% de bromacil en una disolución acuosa de 25 mg/L. Por otra parte, su degradación usando métodos biológicos únicamente se ha estudiado en suelo mediante la aplicación de bacterias (Carl, 1973; Rasul & Cortez, 1988), por lo que la biodegradación de este contaminante en agua resulta un proceso innovador.
La biorremediación es una técnica que involucra el uso de microorganismos vivos con el fin de descomponer sustancias químicas presentes en el ambiente (Crawford & Rosenberg, 2013). La biofiltración está relacionada con estos procesos de biorremediación y consiste en el uso de organismos metabólicamente activos, que se fijan en medios de soporte con el fin de tratar aguas de consumo humano, mostrándose como una opción efectiva (Benner et al., 2013;Yu, Shi, Wei, Ye & Shuting, 2009). Esta tecnología se ha estudiado con biofiltros de carbón activado para remover compuestos orgánicos y subproductos de la cloración (Carlson & Amy, 2000; Liao et al., 2015; Norton & LeChevallier, 2000; Young-Song, Yoon-Jin & Sang-ho, 2007).
Aspectos de diseño como la carga hidraúlica (CH) y el tiempo de retención (TR) resultan importantes en la remoción de contaminantes. Carlson y Amy (2000) reportan que la CH no afecta significativamente la remoción de compuestos orgánicos pero el TR sí. Sin embargo, Young-Song et al. (2007) determinaron que existe una mayor eficiencia en la remoción de compuestos orgánicos en biofiltros con bajas CH y altos TR.
En la literatura no existe evidencia de que se hayan utilizado procesos de biofiltración para remover el bromacil de aguas para consumo humano. El objetivo de esta investigación fue evaluar la utilización de una cepa de hongo escogida, ambiental altamente eficiente en un prototipo de biofiltro a escala para la remoción de bromacil en disoluciones de este contaminante en agua. La remoción fue valorada en aspectos como medio de soporte y TR.
Metodología
La investigación se llevó a cabo en el laboratorio de Ingeniería Aplicada de la Carrera de Ingeniería Ambiental y el Centro de Investigación y de Servicios Químicos y Microbiológicos de la Escuela de Química (CEQIATEC) del Tecnológico de Costa Rica (TEC).
Aislamiento y evaluación de un microorganismo para la remoción de bromacil
Se recolectó una muestra de tierra contaminada con plaguicidas de una finca piñera localizada en la zona Sur del país, la cual se mezcló al 10% m/v en agua peptonada.
Se preparó agar recuento estándar y una disolución de bromacil de 800 mg/L en agua destilada estéril. Se inocularon ocho placas de Petri con la solución de tierra y se les vertió 0,10 ml de la disolución del plaguicida. Se probaron dos tratamientos, las primeras cuatro réplicas se mantuvieron a temperatura ambiente y las restantes se incubaron a 35 °C por cinco días.
Luego de la determinación de la resistencia del hongo al plaguicida se traspasó el microorganismo obtenido de los cultivos a un medio sin bromacil para luego identificarlo en el microscopio. Se preparó un medio agar papa dextrosa acidificado y se mantuvo el hongo por pasajes en un medio nuevo cada tres meses.
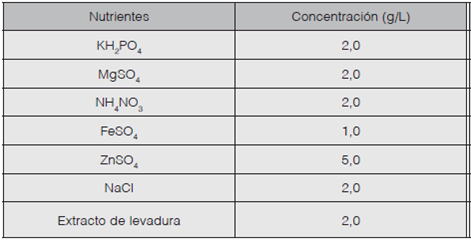
Se preparó un inóculo de esporas en agua esterilizada en un rango de (4,0-8,0) x105 esporas/ mL, las cuales se cultivaron en un caldo enriquecido con los nutrientes descritos en el Cuadro 1. A partir de este se realizaron medios por duplicado con concentraciones de 20,0, 30,0 y 40,0 µg/L de bromacil y se agregó 1,00 mL de inóculo a cada uno.
Se colocaron caldos inoculados con el hongo en una incubadora con agitación a 35 °C y 100 rpm durante tres días, con el objetivo de permitir la formación de pellets. Se tomó una muestra diaria de cada medio y se analizó la variación de la concentración del contaminante.
Selección del medio de soporte
Se realizó la valoración de dos medios, para lo cual se estableció un diseño factorial de 22, cuyos factores eran tipo de esponja (sintética y natural) e inóculo (presencia y ausencia de pellets del hongo) con seis réplicas, siendo la variable de respuesta el porcentaje de remoción de bromacil.
Los tratamientos se prepararon en buretas de 50 mL, llenando un volumen de 23 mL. Para el primer tratamiento se utilizaron (4.23±0.01) g de esponja natural sin inocular, en el segundo se requirieron (6.50±0.01) g de esponja sintética sin inocular. Para el tercero y cuarto tratamiento se utilizaron (4.18±0.01) g de esponja natural y (6.58±0.01) g de esponja sintética, respectivamente, y se adicionaron 46 pellets distribuidos de manera uniforme en cada esponja.
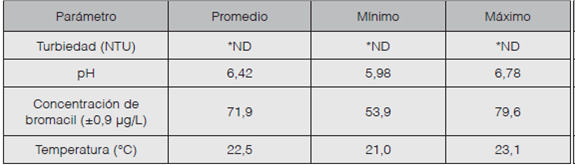
Se llenaron las buretas con el caldo descrito en el cuadro 1 hasta su máxima capacidad y se mantuvieron a temperatura ambiente por catorce días, con el fin de permitir el crecimiento de biomasa. Posteriormente, se pasó agua destilada en la bureta, luego se pasó una disolución con las condiciones descritas en el cuadro 2 y se tomaron seis réplicas para cada tratamiento.
Ensayos en biofiltro de laboratorio
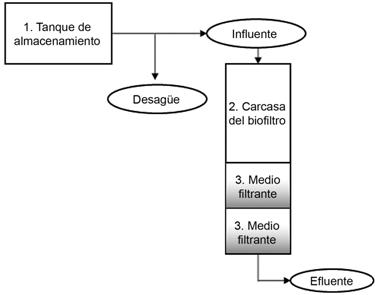
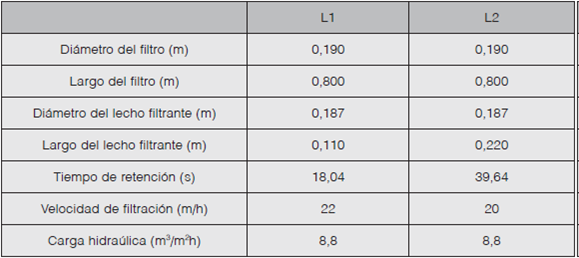
El biofiltro consiste de un tanque de almacenamiento de 20 L, un tubo de desagüe, una carcasa de material acrílico transparente, dos lechos filtrantes distribuidos en recipientes cilíndricos metálicos, válvulas y un dispersor para una distribución de caudal influente constante y homogéneo. En la figura 1 se muestra un esquema de la planta utilizada y en el cuadro 3 los parámetros de diseño asociados a ella.
Se prepararon dos medios filtrantes -L1 y L2- con una relación de volumen 2:1 esponja marina natural inoculada y arena. Para cada medio se utilizaron (61,00±0,01) g y (60,90±0,01) g de esponja, respectivamente; cada esponja se inoculó con pellets y se mantuvo en un recipiente con el caldo descrito en el cuadro 1 hasta su máxima capacidad a temperatura ambiente durante 14 días. La arena utilizada presentó las siguientes características: solubilidad en ácido clorhídrico menor al 5%, tamaño efectivo de 0,5 mm y una gravedad específica de 0,4.
Se pasó un caudal de 0,25 m3/h constante de una disolución con las características del cuadro 2 para cada lecho y se midió el porcentaje de remoción de bromacil, el tiempo de retención y la velocidad de filtración. Se obtuvieron seis réplicas para cada lecho filtrante. En el cuadro 3 se observan algunos parámetros de diseño aplicados en el experimento.
Para determinar la eficiencia del sistema, se llevó a cabo la cuantificación del bromacil mediante un equipo de cromatografía líquida de alta eficiencia (HPLC) marca Agilent Technologies, modelo 1260 Infinity, con un límite de cuantificación de 7.7 µg/L y un límite de detección de 2.3 µg/L. Se utilizó una columna de cromatografía de fase reversa marca Aligent, modelo Eclipse Plus C18, a una temperatura constante de 25 °C. La fase móvil consistió en un flujo de 0,7 mL/min de una disolución de acetonitrilo al 10% y 0,3 mL/min de acetonitrilo grado HPLC. Se inyectaron muestras de 50 µL prefiltradas con membranas de 0.45 µm. Se utilizó un detector de arreglo de diodos a 215 nm de longitud de onda.
Los análisis de turbiedad se efectuaron mediante un turbidímetro portátil marca Orbeco, modelo TB200, y el pH se determinó mediante un pHmetro marca Hanna, modelo HI 98128. Estos análisis se realizaron posteriormente a la preparación de disoluciones.
Para la identificación del hongo del microorganismo se utilizó un microscopio de barrido electrónico marca Hitachi, modelo TM-300 del laboratorio Institucional de Microscopia.
Resultados y discusión
Aislamiento y evaluación de un microorganismo para la remoción de bromacil
Se observó el crecimiento de un solo tipo de hongo a partir del quinto día en las ocho placas cultivadas. Se evidenció que la temperatura fue un factor de poca importancia durante el aislamiento, ya que para ambos tratamientos (con una temperatura ambiente de 17-23 °C y una temperatura constante de 35 °C) aparecieron colonias del hongo simultáneamente al quinto día. Para identificar el hongo se observó un conidióforo ramificado típico del género Penicillium spp., tal y como se muestra en la figura 2.
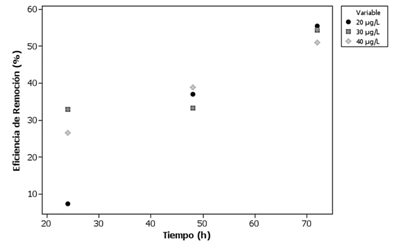
Se evaluó la capacidad de remoción de bromacil por parte del hongo aislado en tres medios acuosos con concentraciones de 20, 30 y 40 µg/L. En la figura 3 se muestra la variación en la eficiencia de remoción respecto al tiempo. Cuando se alcanzaron las 72 horas, se evidenció una degradación superior al 50% del contaminante en el medio, lo cual hizo posible valorar su uso en un biofiltro.
Selección del medio de soporte
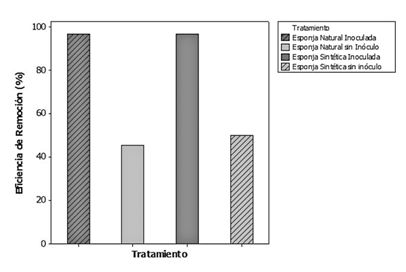
Se evaluaron dos medios de soporte en buretas: esponja marina de origen natural y esponja marina de origen sintético. Ambas esponjas inoculadas removieron entre 95-97% de bromacil al pasar una disolución preparada con las características físicoquímicas presentadas en el cuadro 2; la figura 4 muestra la eficiencia promedio de remoción para cada tratamiento. Se determinó que las esponjas que no fueron inoculadas removieron por simple adsorción en promedio menos del 50% del contaminante. El tiempo de retención en las buretas varió entre 8.50 y 10.25 minutos para la esponja sintética y entre 2.30 y 6.20 minutos para la esponja natural. Estas variaciones se debieron a las condiciones de empaquetamiento presentadas por las buretas.
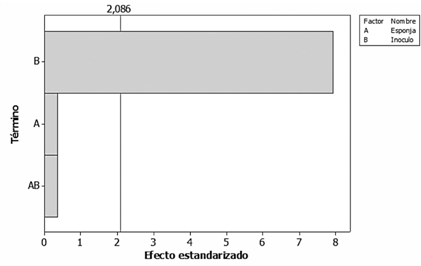
En la figura 5 se muestra el gráfico de Pareto estandarizado con un 95% de confianza para este experimento. Este demuestra que tanto el tipo de esponja como su interacción con el inóculo no producen un efecto significativo en la remoción. Además, se determinó que la presencia del inóculo es el único factor que genera un aumento significativo en la remoción del herbicida.
Ensayos en biofiltro de laboratorio
Se realizaron pruebas de remoción de bromacil en un prototipo de biofiltro para dos lechos filtrantes -L1 y L2- con las características de diseño que se muestran en el cuadro 3. En el primer lecho se determinó una eficiencia de remoción promedio del 80% y para el segundo lecho la eficiencia promedio fue del 81%. Por lo tanto, se comprobó que los tiempos de retención asociados a cada lecho no causaron una variación significativa en la eficiencia de remoción.
Conclusiones
Se demostró que el hongo filamentoso Penicillium spp. es capaz de degradar más del 50% de bromacil de medios acuosos con concentraciones de entre 20.0 y 40.0 µg/L en periodos de 72 horas. Esta degradación resulta rápida al compararse con la vida media del contaminante en el ambiente, pero poco efectiva al utilizarse como sistema de tratamiento en un medio suspendido.
Se determinó que la eficiencia de remoción del contaminante aumenta al fijarse a un medio de soporte y el tiempo requerido es menor al compararse con la remoción producida por el microorganismo suspendido en un caldo.
Se comprobó que el tipo de esponja marina -natural o sintética- tiene poca importancia como medio de soporte en la eficiencia de remoción del plaguicida. Sin embargo, su inoculación es fundamental para el aumento de la eficiencia de remoción.
Durante la experimentación en el prototipo de biofiltro se comprobó que los tiempos de retención y longitudes de los lechos filtrantes utilizados son factores poco significativos en las eficiencias de remoción; lo realmente importante en la eficiencia de remoción es su inoculación o sea el trabajo realizado por el microorganismo.