Introducción
En Costa Rica, hay 43 444 hectáreas destinadas al cultivo de banano, distribuidas en 153 fincas. Los cantones de Matina, Siquirres y Pococí son los que poseen la mayor cantidad de área sembrada, representando el 26, 19 y 17% respectivamente (MAG 2022). Durante el 2019, la producción de banano destinada a la exportación alcanzó 121 millones de cajas, cada una con un peso promedio de 18,14 kg. Este desempeño representó un ingreso de divisas que superó los USD 1004,5 millones en el país (PROCOMER 2020). Además, el sector bananero tuvo un impacto significativo en el empleo, ya que proporcionó trabajo directo a unas 43 000 personas y generó de forma indirecta cerca de 100 000 empleos adicionales (Rojas-Contreras 2021).
Al igual que cualquier sistema productivo, las plantaciones de banano a nivel global enfrentan desafíos asociados con enfermedades y plagas, dado que los nematodos fitoparásitos (NF) son uno de los problemas más significativos. La infestación por nematodos puede causar daños de consideración en las raíces y los cormos de las plantas, lo que conduce a una reducción en el crecimiento y desarrollo de la planta. Este impacto afecta la calidad y la cantidad de frutos (Morales-García 2014, Robinson et al. 1999).
Entre los NF que afectan la producción de banano, Radopholus similis se destaca como la especie más perjudicial a nivel mundial (EPPO 2008). Esta plaga es especialmente problemática en plantaciones comerciales del subgrupo Cavendish ubicadas en regiones tropicales y subtropicales (Cañizares-Monteros 2003). En algunos países, la ocurrencia de nematodos ha causado reducciones de hasta el 50% en el rendimiento, lo que resulta en pérdidas económicas significativas para los pequeños productores (Valencia-Serna et al. 2014).
La estrategia más común para controlar NF en plantaciones de banano es mediante el uso de productos químicos como carbamatos y organofosforados (Gómez et al. 2008). Sin embargo, debido a la búsqueda de alternativas más sostenibles desde el punto de vista ambiental y económico para el manejo integrado de plagas, la investigación se ha centrado en explorar el potencial de diferentes microorganismos para el biocontrol. Este enfoque busca mejorar la eficiencia en el uso de los recursos, disminuir la dependencia de productos químicos sintéticos y reducir el impacto ambiental (Morales-García 2014, Vargas et al. 2017, Cedeño-Franco 2017). En este contexto, el uso de hongos como herramienta de manejo de plagas mediante el desarrollo de bioplaguicidas se ha convertido en una alternativa cada vez más empleada.
Se han identificado más de 700 especies de hongos nematófagos (HN) para el control biológico, entre las cuales existen algunos entomopatógenos eficaces en el control de una amplia variedad de insectos plaga, así como hongos que controlan otros hongos (Espinel-Correal et al. 2018). Los hongos nematófagos según su estrategia de captura, se clasifican en endoparásitos y depredadores (Cole y Kendrick 1981). Los hongos endoparásitos forman estructuras adhesivas o de ingestión (conidios adhesivos o ingeribles) que pueden infectar a los nematodos, o bien, parasitar huevos formando un apresorio (Barrón 1977 y Peraza-Padilla et al. 2011). En cambio, los hongos depredadores, producen una red de hifas extensa en el sitio donde se encuentran, las cuales pueden ser muy simples, como hifas adhesivas septadas, o complejas, como redes adhesivas ramificadas, botones adhesivos, anillos constrictores y no constrictores (Lazcano-Torres et al. 2015).
La evidencia científica respalda la eficacia de la diversidad y el uso de hongos como agentes de control biológico de plagas (Acuña-Segura y Brenes-Madriz 2020). Varias especies de Arthrobotrys como como A. musiformis, A. oligospora, A. robusta, A. superba y A. oviformis han sido utilizadas de forma exitosa en el control de parásitos de rumiantes (Rodríguez-Labastida 2019). Además, se ha documentado que otros hongos resultan altamente efectivos en el combate de NF. Especies como Verticillium chlamydosporium, Trichoderma spp., Purpureocillium spp., F. oxysporum y Monacrosporium spp., han demostrado su eficacia contra Meloidogyne javanica (Fernández-Jiménez et al. 2019, Quevedo et al. 2022).
Si bien diversos microorganismos del suelo pueden ser considerados como controladores biológicos, los géneros Trichoderma y Fusarium destacan como los hongos endofíticos más abundantes en los tejidos internos de raíces de banano (Álvarez-Ortega y Gutiérrez-Miranda 2022). Estos hongos han demostrado potencial como antagonistas de nematodos, ya que han logrado reducciones de hasta el 90% en poblaciones de R. similis en las raíces de plantas de banano que han sido protegidas con estos hongos (Chaves-Méndez 2007).
En un estudio llevado a cabo por Ali et al. (2022) se comprobó el potencial nematicida de varias especies de Trichoderma, donde la más efectiva fue T. harzianum. Esta especie demostró un efecto ovicida y larvicida significativo, alcanzando un 100% de eficacia contra huevos y larvas de segundo estadio (J2s) del nematodo Meloidogyne incognita.
Además, existen algunos aislamientos de Fusarium que son endófitos de plantas asintomáticas, como Fusarium concentricum, que puede producir sustancias promotoras de crecimiento vegetal y funciona como inductor de resistencia o tolerancia a diferentes fitopatógenos (Chinchilla-Salazar et al. 2020). Esta especie de hongo endófito se ha encontrado en musáceas, mostrando actividad benéfica al inducir resistencia en las plantas. Estudios realizados en Uganda por Paparu et al. (2003) y Barrios (2006), observaron un incremento significativo en la biomasa de plantas de banano cultivadas en campo e inoculadas con esta especie de Fusarium.
De acuerdo con Silva-Valenzuela et al. (2020) la interacción entre F. oxysporum, plátano y R. similis permitió que los exudados radicales emanados por las plantas de plátano colonizadas con el hongo endófito redujeran el número de juveniles y adultos de R. similis hasta en un 50%, lo que mejoró la salud y el rendimiento del cultivo.
La eficacia de Purpureocillium lilacinum y en particular, su capacidad para incidir e infectar en las fases iniciales del desarrollo de huevos del nematodo agallador M. enterolobii fueron comprobadas por Silva et al. (2017). En dicha investigación, se observaron porcentajes de parasitismo que oscilaron entre un 57% y un 84% en comparación con los huevos no tratados.
Debido a su ubicación en una región tropical, Costa Rica alberga una amplia diversidad de hongos en sus ecosistemas naturales y agrícolas. Esta riqueza fúngica le confiere un potencial significativo para aprovechar los hongos como una estrategia de control biológico (Varela-Benavides et al. 2017). Por lo anterior, la presente investigación tuvo como objetivo aislar e identificar potenciales hongos nematófagos presentes en muestras de suelo de plantaciones de banano de la Región Huetar Atlántica de Costa Rica.
Materiales y métodos
Recolección de muestras de suelo
Se llevó a cabo una prospección de suelo en seis fincas comerciales y no comerciales de banano en los cantones de Limón, Guácimo, Pococí, Siquirres y Talamanca de la región Huetar Atlántica (Tabla 1). Se utilizó un muestreo al azar, con 25 submuestras en una hectárea por cada finca recolectadas a una profundidad de 0 a 25 cm.
Tabla 1 Características geográficas de los sitios de procedencia de las muestras de suelo analizadas. Región Huetar Atlántica, Costa Rica. 2021.
| Cantón | Localización | Tipode de finca | Coordenadas | Zona de vida* | Altitud (msnm) |
| Limón | Cerere | - | 9°70'82,69” N 82°99'43,65” O | bmh-T | 11 |
| Pococí | El Carmen | Comercial | 10°19'90,28” N 83°47'84,66” O | bmh-P | 20 |
| Siquirres | Duacarí N°2 | - | 10°34'42,15” N 83°62'93,68” O | bmh-P | 37 |
| Guácimo | Tortuguero | - | 10°29'44,23” N 83°37'08,56” O | bmh-T | 16 |
| - | Lomas | No comercial | 10°18'21,62” N 83°29'31,51” O | bmh-T | 15 |
| Talamanca | Bajo Coen | - | 9°55'44,20” N 83°00'51,54” O | bh-T | 94 |
*Según clasificación de Holdridge (Jiménez-Saa1982): bmh-T (Bosque muy Húmedo Tropical), bmh-P (Bosque Húmedo Premontano), bh-T (Bosque Húmedo Tropical).
El suelo se recolectó mediante una pala, evitando alterar la capa superficial de materia orgánica. Luego, se procedió a dividir el suelo en cuartos, hasta obtener una muestra de 1 kg, la cual fue depositada en bolsas de polietileno. Estas bolsas fueron debidamente identificadas con la fecha y ubicación de la recolección, así como las coordenadas geográficas correspondientes. Posteriormente, las muestras se trasportaron en un recipiente herméticamente sellado, hasta el Laboratorio de Nematología de la Universidad Nacional para su procesamiento y análisis correspondiente.
Análisis de textura y pH de las muestras de suelo
Para llevar a cabo el análisis textural, se utilizó la metodología propuesta por Bouyoucos (Núñez-Solís 1996, Maldonado-Paucar 2016). Una vez calculados los porcentajes de partículas de arena, limo y arcilla, se utilizó el diagrama textural del Departamento de Agricultura de los Estados Unidos (USDA) para determinar la textura de cada muestra de suelo (Nesta-Silva y Rodrigues-Nunes 2014). En el caso de medición del pH se realizó según la metodología de López-Aguilar et al. (2002).
Aislamiento y purificación de PHN
Para el aislamiento y purificación de los hongos presentes en las muestras de suelo, se utilizó el método de "espolvoreado en placa" descrito por Barrón (1977) para el aislamiento de PHN. Esta técnica consistió en utilizar entre 0,5 a 1,0 g de suelo de cada muestra recolectada los cuales se colocaron en platos Petri de 9 cm de diámetro que contenían agar-agua (AA). Posteriormente, los platos se incubaron a temperatura ambiente (18-26°C) y con luz natural durante cinco días. Transcurrido ese tiempo, se inició la búsqueda de estructuras tales como hifas, conidios, esporas o nematodos parasitados.
Después de identificar la presencia de estas estructuras, se procedió al aislamiento individual de cada una de ellas. Para ello, se empleó un pincel delgado con un cabello fino en su extremo. Cada estructura hallada fue transferida a placas Petri que contenían medio de cultivo (PDA-Papa Dextrosa Agar) y antibiótico (Tetraciclina al 0,1 % (p/v)] para evitar el crecimiento de bacterias y favorecer el crecimiento micelial (Sánchez-Miranda et al. 2021).
Después de una semana de crecimiento de las estructuras fúngicas mencionadas, se llevó a cabo la fase de purificación y replicación mediante tres repeticiones en platos Petri con PDA y antibiótico hasta obtener cultivos puros. Luego, mediante la técnica de cultivos monospóricos descrita por Nelson et al. (1994), se elaboró una suspensión de conidios de cada hongo en agua destilada estéril a baja concentración. Se extrajo 0,5 ml de esta suspensión y se incorporó a platos Petri con medio con agar-agua (AA), dispersando de manera uniforme mediante un triángulo de Drigalski. Se dejaron reposar los platos durante 24 horas. Pasado ese tiempo, se procedió a observar la germinación de los conidios bajo un estereoscopio. Una vez germinados, se transfirieron a cajas Petri que contenían medio PDA. Se establecieron tres repeticiones de cultivos monospóricos para cada aislamiento (Anama et al. 2021).
Finalmente se utilizó el "método de conservación en aceite mineral estéril" de Little y Gordon (1967) y adaptado por Deshmukh (2003). Este procedimiento consistió en la conservación de los hongos aislados después de su crecimiento en tres viales (repeticiones) de 25 ml, los cuales contenían PDA y aceite mineral. Estos viales se mantuvieron a una temperatura de 4°C, con la finalidad de disminuir la tasa metabólica de los hongos.
Identificación morfológica
Se llevó a cabo la preparación de un montaje para cada cepa, con el fin de caracterizar las estructuras responsables de la dispersión y supervivencia de los hongos aislados. El procedimiento de montaje incluyó el uso de una aguja de disección para realizar un raspado superficial de los hongos en los platos Petri, seguido por la transferencia de estructuras a un portaobjetos. Este proceso se repitió para cada hongo aislado, lo que permitió facilitar la observación y el análisis detallado de estas estructuras.
Posteriormente, se añadió una gota de lactofenol azul como agente de contraste y se colocó un cubreobjetos sobre el montaje. Para la observación y captura de imágenes detalladas de las estructuras de los hongos aislados, se empleó un microscopio Nikon® Eclipse 80i con una ampliación de 100x, conectado a una cámara Nikon® DS-Fi1. Además, se realizó un análisis comparativo de la morfología de cada hongo, recurriendo a las claves de identificación descritas por Cooke y Godfrey (1964) y Barnett y Hunter (1998).
También, se capturaron imágenes de los platos Petri mediante una cámara Canon® EOS Rebel T6 con el objetivo de identificar eventuales diferencias o similitudes en el crecimiento, color y forma de cada aislamiento. Finalmente, todas las fotografías obtenidas fueron editadas mediante el programa Adobe® Photoshop® CS6.
Extracción de ADN e identificación molecular
A partir de cultivos monospóricos de los hongos aislados se hizo extracción de ADN utilizando la metodología propuesta por Hoyos-Carvajal et al. (2008) con algunas modificaciones. Se verificó la calidad y la cantidad de los ADN’s extraídos mediante electroforesis en geles de agarosa al 0,8% (p/v) teñidos con GelRed 1X y sometidos a luz UV. Para la identificación de los aislamientos se amplificaron diferentes regiones del genoma (ITS, factor de elongación de la transcripción 1-alfa y gen de la β-tubulina) mediante PCR (Reacción en Cadena de la Polimerasa). Cada reacción de PCR contenía un volumen total de 25 μl distribuido en 7,25 μl de agua ultrapura, 2,5 μl de DreamTaq buffer 10X, 2,5 μl de dNTPs, 2,5 μl de cada imprimador (10 μM), 0,25 μl de enzima DreamTaq polimerasa y 7,25 μl de ADN.
Para la identificación de los aislamientos del género Trichoderma, se amplificó parcialmente el factor de elongación de la traducción (TEF1-α). Para ello se utilizaron los cebadores EF-728M (5’-CATYGAGAAGTTCGAGAA GG) y EF-2R (5’-GGARGT ACCAGTSATCATGTT) reportados previamente por Todd et al. (2019) y Umaña-Castro et al. (2019).
Para el género Fusarium se emplearon dos pares de cebadores, EF1F (5' ATGGGTAAGGARGACAAGAC) y EF2R (5' GGARGTACCAGTSATCATGTT) que amplifican el TEF1-α junto con el ITS1 (5' TCC GTA GGT GAA CCT GCG G) e ITS4 (5' TCCTCCGCTTATTGATATGC) que amplifican los espaciadores internos transcritos del ADN ribosomal, según los protocolos propuestos por O'Donnell et al. (2008) y Hernández-Medina et al. (2015).
Para los hongos Penicillium sp. y Talaromyces sp., se utilizaron dos pares de cebadores, Bt2a (5' GGT AAC CAA ATC GGT GCT GCT TTC) y Bt2b (5' ACC CTC AGT GTA GTG ACC CTT GGC) que amplifican parcialmente el gen de la β-tubulina, a una temperatura de hibridación de 58°C, y frpb2-5F (5' GAY GAY MGW GAT CAY TTY GG) junto con frpb2-7CR (5' CCC ATR GCT TGY TTR CCC AT) que amplifican una región de la subunidad 2 de la ARN polimerasa, a una temperatura de hibridación de 57°C según lo propuesto por Liu et al. (1999).
En el caso de Purpureocillium lilacinum también se emplearon dos pares de cebadores, Bt2a/Bt2b e ITS4 (5'TCCTCCGCTTATTGATATGC) / ITS5 (5' GGAAGTAAAAGTCGTAACAAGG) reportados por Maldonado-Haro (2019) y Almaraz-Sánchez et al. (2012) bajo las mismas condiciones de termociclado anteriormente descritas para esos cebadores.
Los productos de PCR se evaluaron por medio de electroforesis en geles de agarosa TopVision al 1% teñidos con GelRed 1X y sometidos a luz UV. Posteriormente, se enviaron los productos de PCR obtenidos de todos los hongos aislados a la empresa Macrogen Inc. (Corea del Sur) para su purificación y secuenciación en ambas direcciones mediante el método Sanger (1977).
Una vez obtenidas las secuencias se construyeron secuencias consenso y se editaron utilizando el programa BioEdit Sequence Alignment Editor versión 7.2.5, a partir de las dos hebras (forward y reverse) con respecto al electroferograma obtenido. Finalmente, se compararon las secuencias de ADN obtenidas con accesiones reportadas en el GenBank® por medio de la herramienta BLAST (Basic Local Alignment Search Tool) del NCBI (National Center for Biotechnology Information) para la identificación de especies.
Resultados
Identificación taxonómica y molecular de potenciales hongos nematófagos
Se logró aislar 12 especies de hongos a partir de las muestras suelo obtenidas de los cantones de Limón, Guácimo, Pococí, Siquirres y Talamanca. Las especies de hongos identificadas fueron Trichoderma asperellum, Fusarium oxysporum, F. pseudocircinatum, F. solani, Purpureocillium lilacinum, Penicillium steckii y Talaromyces sp. (Tabla 2). El 50% de los aislamientos fueron del género Fusarium, 25% de Trichoderma y un 8,33% de cada uno de los géneros Penicillium, Purpureocillium y Talaromyces. De los hongos aislados, en la literatura se reporta a T. asperellum, F. oxysporum, F. solani y P. lilacinum como PHN. Cabe destacar que varias de estas especies podrían también desempeñar otras funciones en el suelo, incluyendo actividades fitopatógenas, lo que puede afectar tanto la salud del suelo como la de las plantas. Por lo tanto, es fundamental realizar evaluaciones de estas especies para entender su impacto en el ecosistema y si pueden ser consideradas en prácticas de manejo agrícolas.
Tabla 2 Identificación molecular de potenciales hongos nematófagos aislados de plantaciones comerciales y no comerciales de banano en la Región Huetar Atlántica.
| Cantón | Código | Identificación* | Región del genoma amplificada | Accesión | País de referencia | Referencia |
| Fox1 | Fusarium oxysporum | TEF1-α ITS | MN386726 | Malasia | Kee et al. (2020) | |
| Limón | MT560381 | China | Wang 2020 | |||
| Trich1 | Trichoderma esperellum | TEF1-α | MZ442656 | Paraguay | Florentin 2022 | |
| MZ442656 | Paraguay | Florentin 2022 | ||||
| Trich2 | Trichoderma asperellum | TEF1-α | GU198293 | Perú | Samuels et al. (2015) | |
| MN386726 | Malasia | Kee et al. (2020) | ||||
| Siquirres | Fox2 | Fusarium oxysporum | TEF1-α ITS | OR388100 | México | Valencia-Yah et al. (2023) |
| MN386726 | Malasia | Kee et al. (2020) | ||||
| Fox4 | Fusarium oxysporum | TEF1-α ITS | DQ016213 | Estados Unidos | Stewart et al. (2006) | |
| Talamanca | KY488512 | Brasil | Amatuzzi et al. (2017) | |||
| Pli | Purpurecillium lilacinum | rpb2 β-tubulina | GU980035 | Tailandia | Ridkaew et al. (2012) | |
| MT011003 | Países Bajos | Yang et al. (2020) | ||||
| Pococí | Fps | Fusarium pseudocircinatum | TEF1-α | MZ442656 | Paraguay | Florentin 2022 |
| MN386726 | Malasia | Kee et al. (2020) | ||||
| Trich3 | Trichoderma esperellum | TEF1-α | KU939031 | China | Wang et al. (2018) | |
| KX650039 | Brasil | Cardoso et al. (2021) | ||||
| Fox3 | Fusarium oxysporum | TEF1-α ITS | KY469196 | Canadá | Visagie et al. (2020) | |
| Guácimo | Pst | Penicillium stecki | rpb2 β-tubulina | KX657522 | Estados Unidos | Peterson y Jurjević 2017 |
| MK951834 | Sudáfrica | Visagie y Houbraken 2020 | ||||
| Tal | Talaromyces sp. | rpb2 β-tubulina | KF255484 | Países Bajos | Van Diepeningen et al. (2014) | |
| Fsol | Fusarium solani | TEF1-α ITS | FJ224382 | Puerto Rico | Estévez y Abad 2009 |
*Identificación obtenida utilizando la herramienta en línea BLAST (Basic Local Alignment Search Tool) del NCBI (Centro Nacional de Información Biotecnológica).
Del total de especies aisladas en esta investigación, once fueron identificadas mediante el uso de distintas regiones del genoma (ITS, TEF1-α, rpb2 y β-tubulina, respectivamente). El único aislamiento que no se pudo identificar molecularmente a nivel de especie fue Talaromyces sp. (Tal).
A continuación, se realiza una descripción morfológica y molecular de cada uno de los hongos identificados.
Purpureocillium lilacinum
Se identificó el hongo P. lilacinum en la muestra de suelo recolectada en el cantón de Talamanca. A partir del quinto día de incubación, se observó la formación de micelio en la placa Petri. Dos días después, se observó un desarrollo micelial de 4 cm de diámetro, de color blanco, de consistencia algodonosa y rápida esporulación (Figura 1). En los días siguientes a la esporulación, el hongo adquirió una tonalidad lilácea con un crecimiento expandido.
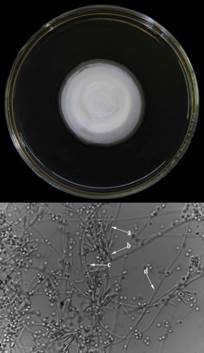
Figura 1 Estructuras de caracterización morfológica y microscópica del hongo Purpureocillium lilacinum en medio PDA, a. Fiálides, b. Conidióforos, c. Conidios y d. Hifas de P. lilacinum (Pli) de Talamanca.
Morfológicamente, se observó la presencia de fiálides abultadas en la base, las cuales se estrechaban hacia las puntas (Figura 1a). En estas estructuras, se observó la presencia de conidios unicelulares con forma globosa (Figura 1b). Los conidióforos de P. lilacinum eran erectos y agrupados formando ramificaciones. Estos conidióforos libres son llamados también verticilados debido a su disposición en verticilos (Figura 1c).
Con base a las secuencias de ADN, P. lilacinum presentó un nivel de homología del 99,7% (303pb/304pb) de la secuencia parcial del gen de la β-tubulina y una cobertura de 100% con respecto a P. lilacinum (KY488512) reportado en Brasil. Además, este mismo aislamiento presentó 100% de homología (560pb/560pb) y cobertura de la región ITS de su ADN ribosomal con P. lilacinum (GU980035) reportado en Tailandia.
Trichoderma asperellum
Los aislamientos de Trichoderma asperellum, Trich1 y Trich2 se obtuvieron a partir de muestras de suelo del cantón de Limón, mientras que el aislamiento Trich3 se aisló de muestras de suelo del cantón de Pococí. Las Figuras 2A, 2B, y 2C ilustran los aislamientos de T. asperellum obtenidos en las distintas localidades que se caracterizaron por presentar colonias con micelio plano y compacto.
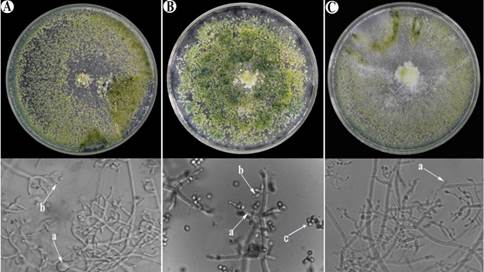
Figura 2 Estructuras de caracterización morfológica y microscópica de especies del hongo Trichoderma en medio PDA. A. a. Clamidosporas y b. Fiálides de T. asperellum (Trich3) de Pococí. B. a. Ramificaciones de conidióforos. b. Fiálides y c. Conidios of T. asperellum (Trich2) de Limón. C. a. Conidios de T. asperellum (Trich1) de Limón.
Estas colonias exhibieron un crecimiento rápido, alcanzando diámetros de 6 a 8 cm en tan solo cinco días, y posteriormente cubrieron por completo la superficie de los medios de cultivo de 9 cm de diámetro.
Inicialmente, el hongo en el plato Petri mostró un color blanco que posteriormente fue adquiriendo una tonalidad verde con una esporulación generalizada. Las colonias presentaron de dos a tres anillos concéntricos bien definidos: uno blanco que correspondió al micelio y otros verdes que representaban los conidios. La pigmentación de los aislamientos varió de una tonalidad verde claro a verde oscuro típico de este género.
Los resultados de las observaciones microscópicas de los aislamientos Trich1, Trich2 y Trich3 revelaron varios rasgos distintivos. Se observaron clamidosporas (Figura 2A.a) en abundancia con una forma globosa. También fiálides dispuestas en grupos de tres (Figura 2B.b) a lo largo del conidióforo el cual presentaba ramificaciones no muy abundantes (Figura 2B.a). Estas fiálides se caracterizaron por ser más anchas en el centro que en la base (Figura 2 A.b) y su ápice presentaba forma curva. Además, estas estructuras presentaban conidios de forma elipsoidal (Figura 2B.c) de coloración verde, dispuestos en grupos de 6.
La secuencia de nucleótidos de los productos amplificados de la región TEF1-α de los aislamientos Trich1 y Trich3 presentaron 100% de cobertura y homología de secuencia, 550pb/550pb y 551pb/551pb respectivamente, con T. asperellum (MZ442656) reportado en Paraguay, mientras que Trich2 mostró sólo 98,2% (546pb/556pb) de similitud con esa misma accesión. Adicionalmente, Trich2 también mostró 100% de similitud (532pb/532pb) con T. asperellum (GU198293) reportado en Perú (Tabla 2).
Fusarium oxysporum, Fusarium solani y Fusarium pseudocircinatum
Los aislamientos de F. oxysporum (Fox1, Fox2, Fox3 y Fox4) se recolectaron de muestras de suelo provenientes de los cantones de Limón, Siquirres, Guácimo y Talamanca. De las muestras obtenidas de Pococí y Guácimo, se identificaron las especies F. pseudocircinatum (Fps) y F. solani (Fsol) respectivamente.
La especie F. oxysporum tuvo un desarrollo micelial algodonoso abundante, de coloración blanquecina los primeros días de crecimiento. Debido al desarrollo de los conidios, cambió a un tono morado (Figura 3).
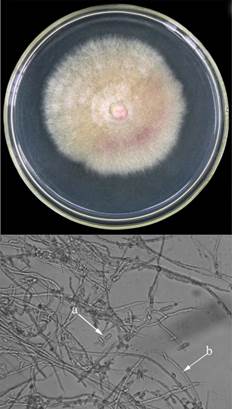
Figura 3 Estructuras de caracterización morfológica y microscópica del hongo F. oxysporum (Fox2) de Siquirres en medio PDA. A. Microconidios y b. Red de hifas.
Este hongo produjo macroconidios y microconidios. Los macroconidios eran hialinos y curvos (Figura 3a), mientras que los microconidios, la mayoría carecían de septos y presentaban una forma ovalada (Figura 3b).
La secuencia de nucleótidos de la región TEF1-α de los aislamientos Fox1, Fox2, Fox3 y Fox4 presentaron 100% de homología de secuencia (500pb/500pb, 654pb/654pb, 654pb/654pb y 661pb/661pb, respectivamente) y cobertura de 100% con F. oxysporum (MN386726) reportado en Malasia. Adicionalmente, el aislamiento Fox1 presentó 100% de cobertura y similitud (499pb/499pb) de la región ITS, con un aislamiento de F. oxysporum (MT560381) reportado en China, así como con otras accesiones del GenBank.
El aislamiento Fox2 presentó 100% de cobertura y similitud (503pb/503pb) de la región ITS con F. oxysporum (OR388100) reportado en México mientras que la región ITS del aislamiento Fox3 presentó 99,81% de homología (539pb/545pb) con un aislamiento de F. oxysporum (KU939031) reportado en China. Además, el aislamiento Fox4 presentó 100% de homología de la región ITS con un aislamiento de F. oxysporum (DQ016213) reportado en Estados Unidos.
En el caso de F. solani (Fsol) procedente de muestras de suelo del cantón de Guácimo, mostró a partir del quinto día de incubación, abundante micelio aéreo, algodonoso y blanco con pigmentación en la base color rojizo (Figura 4).
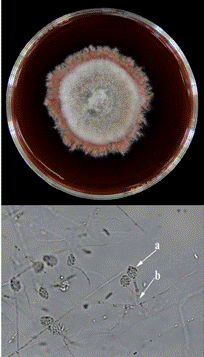
Figura 4 Estructuras de caracterización morfológica y microscópica del hongo F. solani (Fsol) de Guácimo en medio PDA. a. Microconidios y b. Conidióforos.
Asimismo, presentó abundantes microconidios, unicelulares los cuales estaban ubicados en falsas cabezas (Figura 4a) a partir de monofiálides alargadas sobre conidióforos (Figura 4b) no ramificados. Este aislamiento presentó homología de secuencia y cobertura del 100% (688pb/688pb) de la región TEF1-α con F. solani (KF255484) reportado en Los Países Bajos y 100% de homología de la región ITS con F. solani (FJ224382) reportado en Puerto Rico.
Las colonias de F. pseudocircinatum (Fps) provenientes de muestras de suelo de Pococí presentaron micelio algodonoso de color rosado que posteriormente se tornó de color morado principalmente en el centro de la colonia (Figura 5).
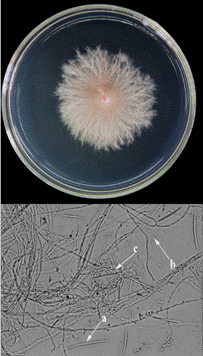
Figura 5 Estructuras de caracterización morfológica y microscópica de especies del hongo F. pseudocircinatum (Fps) de Pococí en medio PDA. a. Macroconidios. b. Microconidios y c. Hifas enrolladas.
Adicionalmente, este hongo presentó escasos macroconidios, alargados, delgados (Figura 5a) con célula apical puntiaguda. También mostró microconidios ovoides y sin septos (Figura 5b), con hifas en forma espiral enrolladas (Figura 5c), característica de gran relevancia taxonómica para la identificación de esta especie. El análisis de secuencias de la región TEF1-α de Fps mostró homología del 99,7% y 100% de cobertura (664pb/666pb) con diferentes secuencias de F. pseudocircinatum, entre ellas MT011003 y MN386745 reportadas en Los Países Bajos y Malasia, respectivamente.
Penicillium steckii
P. steckii (Pst) se aisló de muestras de suelo procedentes del cantón de Guácimo. Este hongo presentó un crecimiento circular de 4 cm y un micelio de color verde a turquesa con bordes blancos (Figura 6). En el lado inferior, la tonalidad fue de color crema. También se caracterizó por presentar conidióforos monoverticilados (Figura 6b) que formaban conidios esféricos en cadena, en una estructura ramificada similar a un pincel (Figura 6d). Además, se observaron tres estructuras llamadas métulas (Figura 6a), con células terminales llamadas fiálides (Figura 6c).
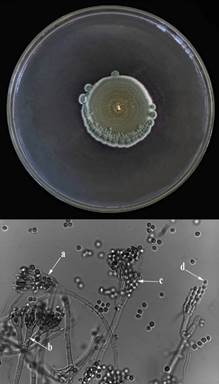
Figura 6 Estructuras de caracterización morfológica y microscópica del hongo Penicillium steckii (Pst) de Guácimo en medio PDA. a. y b. Métulas. c. Fiálides y d. Conidios.
Este hongo presentó homología de secuencia del 99,9% (911pb/912pb) de la región rpb2 con P. steckii (KX650039) reportado en Brasil, mientras que la secuencia parcial del gen de la β-tubulina de este mismo aislamiento, presentó 100 % de homología (442pb/442pb) con P. steckii (KY469196) reportado en Canadá.
Talaromyces sp
Talaromyces sp. (Tal) se aisló de muestras de suelo procedentes del cantón de Guácimo. Este hongo mostró un diámetro de 3 cm a partir del quinto día de incubación, presentó un micelio de color blanco que posteriormente cambió a color amarillo (Figura 7) con una rápida esporulación en pocos días. Sus conidióforos eran largos y cilíndricos, relativamente estrechos (Figura 7c). Además, presentó fiálides unicelulares dispuestas en verticilos no ramificados (Figura 7b) a partir de las cuales se producen conidios de forma elipsoidal (Figura 7a).
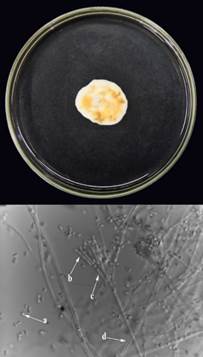
Figura 7 Esctructuras de caracterización morfológica y microscópica del hongo Talaromyces sp. (Tal) de Guácimo en medio PDA. a. Conidios. b. Fiálides. c. Métulas y d. Red de hifas de Talaromyces sp.
La secuencia parcial del gen de la β-tubulina de Talaromyces sp. (Tal) mostró baja cobertura lo que resultó en una homología reducida, donde alcanzó un 96,74% (356pb/368pb) con valores similares a los reportados en Sudáfrica (MK951834) para este mismo hongo. Asimismo, la secuencia parcial del gen de la rpb2 de este mismo aislamiento presentó baja cobertura y homología del 93,97% (950 pb/1011pb), con Talaromyces delawarensis (KX657522) reportado en Estados Unidos, así como con otras especies de Talaromyces.
Relación de pH y textura con la presencia de los hongos nematófagos
Se analizaron seis muestras de suelo provenientes de cinco cantones de la región Huetar Atlántica de Costa Rica, donde se determinó la textura del suelo y los niveles de pH los cuales pueden tener alguna relación con la ocurrencia de PHN. Todas las localidades compartieron características similares en cuanto a la textura del suelo franco, con una mezcla equilibrada entre partículas de arena, limo y arcillas.
Se observó que tanto la localidad de Bajo Coen en el Cantón de Talamanca, como Lomas en el Cantón de Pococí, tienen texturas franco arenosas, es decir, existe presencia significativa de partículas de arena en la textura del suelo. Las demás localidades y cantones mostraron textura franco limosa (Cerere, Limón), franco arcillosa (Tortuguero, Pococí), franco arcillo limosa (El Carmen, Siquirres) y franca (Duacarí N°2, Guácimo). Con respecto a los valores de pH, estuvieron en el rango de 5,8 a 6,5 (Tabla 3).
Tabla 3 Características de suelos según valores de textura y pH de diferentes localidades de la Región Huetar Atlántica de Costa Rica. 2021.
| Cantón | Localización | Textura | Ph |
| Limón | Cerere | Franco limosa. | 6,20 |
| Pococí | Tortuguero | Franco arcillosa. | 6,28 |
| Siquirres | Lomas | Franco arenosa. | 6,39 |
| Guácimo | El Carmen | Franco arcillo limosa. | 5,84 |
| Talamanca | Duacarí N° 2 | Franca. | 6,51 |
Discusión
En el proceso de caracterización molecular no se logró identificar Talaromyces a nivel de especie, ya que se obtuvo bajo porcentaje de cobertura y homología de las secuencias obtenidas (β-tubulina y rpb2) con las de las especies reportadas en el GenBank. Este inconveniente puede atribuirse a la escasa información disponible en la base de datos analizada respecto a este aislamiento. Además, es probable que las regiones amplificadas en este estudio no proporcionaran información específica de este hongo o bien, se trate de una nueva especie no reportada aún.
En lo que respecta a factores antagónicos de algunas especies de hongos identificadas en este estudio, como por ejemplo Trichoderma, se destaca por la producción enzimas como quitinasas, gluconasas, proteasas y células, que tienen la capacidad nematicida y antagónica, demostrada en estudios llevados a cabo por Gezgin et al. (2020), y Lyubenova et al. (2023) y Mesa-Vanegas et al. (2019). Estas enzimas pueden inducir deformaciones y limitar la movilidad de los nematodos (Carranza-González 2014).
El hongo Trichoderma spp. sobresale como uno de los agentes de control biológico más efectivos y utilizados, principalmente por su habilidad micoparasítica (Chaves-García 2006). Esta capacidad radica en que logra adherirse al hospedero y envuelve sus hifas alrededor de él formando un apresorio; estructura con la que logran penetrar las células hospederas y finalmente provoca colapso del hospedero (Todd et al. 2019). También presentan capacidad antagónica contra nematodos (Rojas-Villacorta et al. 2017, Moo-Koh 2018) debido a la producción de metabolitos secundarios (Rivera-Méndez et al. 2018).
Dentro del género Fusarium existen especies saprófitas que actúan como biocontroladores. Por ejemplo, Fusarium solani ha sido evaluado contra huevos y juveniles de Nacobbus aberrans, mostrando un parasitismo del 86% y 90%, respectivamente; sin causar patogenicidad en plantas de chile (Capsicum annuum) (Cortez-Hernández et al. 2019). Otra especie, Fusarium oxysporum, puede inducir resistencia sistémica en la planta hospedera contra diferentes nematodos (Manobanda-Duche 2022) y también estimular la producción de metabolitos que, al igual que Trichoderma, inhiben el desarrollo de nematodos fitoparásitos y fomentan la producción de compuestos de defensa en las plantas contra patógenos (Morales-García 2014, Cortez-Hernández et al. 2019).
Aunque F. pseudocircinatum se reporta en la literatura como un hongo fitopatógeno en varios cultivos, incluido el banano (Iñiguez-Moreno et al. 2022, Tarnowski et al. 2010), resulta crucial comprender su interacción en el suelo con la biodiversidad microbiana y la dinámica de los ecosistemas. Este hongo podría desempeñar un papel significativo en el ciclo de nutrientes y en las interacciones con otras especies de hongos, aspectos microbiológicos que aún no están investigados.
A pesar de que algunas especies de Fusarium actúen favorablemente, es fundamental reconocer que muchas de ellas también son patógenas y pueden causar daños significativos a los cultivos. Esta doble naturaleza, tanto beneficiosa como perjudicial, debe ser cuidadosamente considerada para evitar confusiones y malentendidos en la implementación de estrategias de control biológico.
Algunos hongos como Trichoderma y Fusarium tienen la capacidad de crear “biofilms” o biopelículas en las raíces, las cuales son complejas comunidades creadas por una variedad de microorganismos, entre los cuales se incluyen hongos (Triveni et al. 2012). Estos hongos poseen la capacidad de establecer interacciones simbióticas con las plantas y de formar colonias microbianas. Estas interacciones beneficiosas pueden contribuir al control de patógenos y estimular el crecimiento de las plantas (Poveda-Arias 2018).
Las cinco localidades muestreadas en este estudio presentaron suelos de textura franca, lo cual promueve la retención y disponibilidad de nutrientes para diversos organismos edáficos, incluidos los hongos (Capcha-Ospina 2017, Jiménez-Zappa 2013). Además, el tipo de suelo influye en la composición y función de las especies de hongos, ya que la mayoría se desarrollan mejor en ambientes ácidos (Ferreri 2020). Sin embargo, algunos hongos como Trichoderma sp., Fusarium sp., Rhizopus sp. y Penicillium sp., se pueden encontrar en suelos de textura franco-arenosa, franco arcillosa y arenosa lo cual podría estar asociado principalmente a su función antagónica en el suelo, que incluye la producción de metabolitos inhibitorios y competencia con patógenos (Macías-Echeverri et al. 2019). Las condiciones edáficas y de pH, están estrechamente relacionados con factores ambientales y la cantidad de materia orgánica, los cuales desempeñan un papel fundamental en la distribución y ocurrencia de HN (Gortari et al. 2007).
La presencia de los potenciales hongos nematófagos en este estudio, podría estar relacionada con la notable compatibilidad de estos organismos a suelos con pH ácido. Aunque algunas especies de Trichoderma tienen habilidad de crecer en suelos con un amplio rango de pH, desde 5,5 hasta 8,5 debido a su capacidad de adaptación, sus valores óptimos se sitúan entre 5,5-6,5, lo que sugiere una preferencia por ambientes ligeramente ácidos (Pozo-Enríquez 2020). Esta condición podría explicar la presencia de potenciales hongos nematófagos en condiciones de variabilidad de pH del suelo como los encontrados en este estudio.
En esta investigación, los valores de pH obtenidos concuerdan con el rango óptimo recomendado para el desarrollo de Fusarium spp., el cual se encuentra entre 3,8 a 5,0 (Pérez-Rivera 2014) es decir, con suelos ácidos. Asimismo, los resultados de textura del suelo se relacionan con los requeridos para la ocurrencia de estos hongos, en suelos de textura fina, franco y arenosa. No obstante, la mayoría de las especies de Fusarium, tienen la capacidad adaptarse a diversas condiciones agroambientales como un amplio rango de pH entre 2,0 a 9,0 y en ocasiones pH superiores, debido a que este factor no incide en su desarrollo micelial (López-Courrau et al. 2018). Esta situación podría también explicar la presencia de este hongo en las muestras de suelo con pH ácido en los cantones Limón, Siquirres, Guácimo y Talamanca.
Con respecto al hongo P. lilacinum el cual fue aislado de muestras de suelo del cantón de Talamanca el análisis de pH fue de 5,98. Este hongo presenta una gran tolerancia al pH, debido a que el pH óptimo para su desarrollo es de 2,0 a 10,0 (Manobanda-Duche 2022), por lo que puede adaptarse a diferentes condiciones de suelo.
Conclusiones
Los hallazgos de este estudio proporcionan información valiosa sobre la diversidad y potencial de los hongos nematófagos en el control de plagas y enfermedades en cultivos de banano. Además, destaca la importancia de realizar análisis relacionados al desarrollo de estrategias efectivas para su identificación como las utilizadas en esta investigación y a la implementación y aplicación en programas de manejo integrado de plagas.
La identificación precisa de estos antagonistas mediante diversos criterios establece la base para que investigaciones futuras puedan explorar su potencial como agentes de control de nematodos fitoparásitos, no solo en cultivos de musáceas, sino también en otros sistemas productivos especialmente en países en desarrollo.
Según los resultados, se recomienda, amplificar y secuenciar otras regiones del genoma de Talaromyces sp. y así obtener un estudio genético más completo y detallado que permita la identificación a nivel de especie ya que en las bases de datos de secuencias genéticas no existe suficiente información sobre este aislamiento.
Este estudio resalta la necesidad de realizar investigaciones adicionales sobre los potenciales HN en plantaciones de banano y otros cultivos en la región. Es fundamental llevar a cabo pruebas de patogenicidad para asegurar que algunos de los potenciales HN, no solo sean eficaces en la lucha contra los nematodos, sino que también sean seguros para las plantas hospedadoras. Las perspectivas futuras del uso de HN como agentes de control biológico son muy prometedoras, ya que cada vez se utilizan más en programas de manejo integrado de plagas, debido a la preocupación que existe por los efectos negativos que provocan los pesticidas sintéticos al medio ambiente y a la salud humana.















