Introducción
El compost es el producto final de un proceso bio-oxidativo, donde materiales orgánicos sólidos, frecuentemente con altos porcentajes iniciales de humedad, son transformados en fuente de nutrientes y humus, mientras se libera dióxido de carbono y otros gases según las condiciones que definen la eficiencia del proceso. Al inicio del compostaje los materiales más lábiles son degradados por hongos, bacterias y actinomicetos mesófilos, luego los sustratos más complejos son descompuestos por microorganismos termófilos. En la etapa final del proceso o fase de enfriamiento y maduración ocurre la formación de sustancias húmicas (Baltodano 2002, Soto 2003, Garro 2016, Azim et al. 2018).
El compostaje presenta ventajas desde el punto de vista ambiental, pues permite reducir el volumen y peso de residuos orgánicos y disminuir la cantidad de desechos que son dispuestos en rellenos sanitarios o en otros lugares donde pueden provocar contaminación, a la vez, se logra convertir los materiales residuales en un producto útil para la agricultura (Salas y Ramírez 2001, Soto 2003, PRESOL 2007, Camacho et al. 2014, Sánchez et al. 2019). Azim et al. (2018) señalan que con la intensificación de la producción agrícola existe una pérdida considerable de nutrimentos como N, P y K, cuando los residuos orgánicos no son apropiadamente manejados y dispuestos y proponen el compostaje como una alternativa para tratar tales residuos y restituir materia orgánica a los suelos en la forma de enmiendas orgánicas.
El compost es uno de los abonos orgánicos más comunes, al añadirlo se reportan beneficios como la mejora de la fertilidad química y la disponibilidad de nutrimentos, aumento de la materia orgánica, incremento de las poblaciones de microorganismos benéficos, regulación del pH, mejora de la estructura debido a una mayor agregación y aumento de la porosidad, así como una mejor retención del agua y reducción de la erosión del suelo (Durán y Henríquez 2007, Castro et al. 2009, Castro et al. 2011, Acuña 2015).
Debido a que los microorganismos llevan a cabo la degradación de los sustratos orgánicos, es importante mantener condiciones propicias para el establecimiento y desarrollo de poblaciones naturales o adicionadas, que permiten con ello, que el tiempo de compostaje sea menor y el compost terminado tenga mejores características de calidad física, química y biológica, así como de madurez y/o estabilidad (Baltodano 2002, Uribe 2003, Acuña 2015, Azim et al. 2018, Sánchez et al. 2019).
Para asegurar condiciones óptimas en la producción de abonos orgánicos de calidad se requieren métodos adecuados para evaluar sus características, en este sentido, son el conjunto de propiedades químicas, físicas y microbiológicas las que determinarán la calidad final y el potencial de uso de estos abonos en cultivos agrícolas (Salas y Ramírez 2001, Durán y Henríquez 2007, Garro 2016).
Factores relacionados con la optimización del proceso de compostaje. En el proceso de elaboración de abonos orgánicos ocurren cambios fisicoquímicos y biológicos en los materiales orgánicos, influenciados por la constitución y características de los sustratos y las prácticas de manejo en su elaboración. Estas condiciones deben ser favorables para el establecimiento y nutrición de los microorganismos asociados, así como para brindar las condiciones energéticas requeridas, con el fin de optimizar el proceso (Baltodano 2002, Soto 2003, Acuña 2015, Garro 2016).
Los procesos de mineralización y humificación de los sustratos orgánicos, mediados siempre por microorganismos, determinarán posteriormente la presencia y disponibilidad de nutrimentos en los abonos orgánicos terminados; estos procesos están afectados por factores como la cantidad y diversidad de microorganismos presentes y su actividad, por la humedad, temperatura, así como por la calidad y cantidad de los materiales incorporados (Muñoz 2003, Castro et al. 2009).
En general las condiciones que propician el desarrollo de los microorganismos aeróbicos se relacionan con la presencia de oxígeno, la adecuada humedad y el pH, la superficie de contacto o tamaño de partículas y la disponibilidad de nutrientes, así como con las características de la materia prima, la relación C/N y un apropiado manejo de la temperatura en el proceso de compostaje (Baltodano 2002, Garro 2016).
Una óptima relación C:N ofrece un sustrato energético propicio para el desarrollo de poblaciones microbianas y los procesos complejos de descomposición que estos llevan a cabo. La relación C:N hace referencia a las proporciones de C y N que existen en los materiales iniciales y en el compost terminado. Según Rynk (1992) una relación C:N aceptable para iniciar un proceso se encuentra entre 20:1 y 40:1, mientras Garro (2016) hace referencia a que una relación C:N inicial óptima debe estar entre 25:1 y 35:1.
Es importante mantener la presencia de oxígeno durante el proceso de compostaje, sobre todo en las etapas iniciales, cuando existe gran actividad de microorganismos que lo requieren (Azim et al. 2018). Cuando predominan condiciones de anaerobiosis los microorganismos presentan metabolismos menos eficientes y llevan a cabo procesos de descomposición más lentos. Adicionalmente las condiciones anaeróbicas producen olores desagradables por la producción de ácidos grasos volátiles durante la degradación de azúcares simples, por la generación de amoniaco y sulfitos en los procesos de descomposición de proteínas y por la existencia de compuestos gaseosos fosforados como fosfina (PH3), trihidruro de fósforo e hidruro de fósforo (Restrepo y Hensel 2013). Es posible prevenir la generación de malos olores y la pérdida gaseosa de nutrientes, con oxigenación durante el compostaje (Soto 2003, Soto y Meléndez 2003).
La altura de los montículos de compost puede afectar la disponibilidad y distribución del oxígeno y además se relaciona con la temperatura y la humedad. En general se recomienda mantener hileras con alturas aproximadas de un metro, con un programa de volteos frecuente y consideran los parámetros de presencia de oxígeno, así como de temperatura (Baltodano 2002, Garro 2016).
Una forma de establecer la frecuencia de volteos es mediante la medición de la temperatura, como indicador de la actividad microbiológica. Se recomienda voltear los montículos de compost cuando sea igual a 60oC, sin superar los 65oC (Baltodano 2002). Esto para evitar una afectación de las poblaciones de microorganismos, debido a una eventual exposición a altas temperaturas y una posible merma de la calidad del compost (Baltodano 2002, Soto y Meléndez 2003, Uribe 2003, Tognetti et al. 2005, Azim et al. 2018).
El control de la humedad es también determinante para la elaboración de compost. Debe proveerse suficiente agua para permitir la actividad microbiana, sin propiciar condiciones anaeróbicas o lavado de nutrimentos. El rango óptimo de humedad en el proceso está entre 40 y 65% (Guerrero 2005, Tognetti et al. 2005, Garro 2016). Los volteos frecuentes pueden ayudar a corregir o distribuir la humedad durante el proceso de fabricación de abono (Baltodano 2002).
Evaluación de la calidad del compost. El proceso de compostaje puede tomar de 22 días a 4 meses, según el tipo de materia prima, su tamaño o granulometría, las condiciones de humedad, de temperatura, la frecuencia de los volteos, de las aplicaciones de microorganismos cuando sea el caso y en general según las prácticas de manejo. Algunas de las características de un compost terminado son, un color café oscuro a negruzco con un olor a “tierra de bosque”, no se pueden identificar los residuos o materia prima que lo originaron, no hay presencia de insectos adultos, ni larvas y la temperatura debe ser similar a la ambiental en igualdad de condiciones (Acuña 2015, Azim et al. 2018, Sánchez et al. 2019). Al final del compostaje en la fase maduración, hay formación de sustancias producto de procesos de descomposición y síntesis, reconocidas convencionalmente como húmicas (Baltodano 2002, Meléndez 2003, Soto 2003, Garro 2016, Azim et al. 2018). En este sentido, las sustancias húmicas y los procesos asociados de humificación han sido un tema de intensa investigación. A pesar de ello, el conocimiento sobre la formación natural de las sustancias húmicas es aún limitado y cada vez más revelador (Buscot y Varma 2005, Lehmann y Kleber 2015). Para Buscot y Varma (2005) en términos microbianos y enzimáticos, la descomposición es un proceso complejo de bucle recursivo donde el sustrato selecciona la comunidad microbiana, que produce enzimas que degradan y modifican el sustrato, que a su vez impulsa sucesión comunitaria.
Para el compost obtenido como producto final, es importante considerar la ejecución de análisis pertinentes, respecto a la presencia de elementos y sus concentraciones, determinar y cuantificar las poblaciones de microorganismos de interés, evaluar la madurez, así como inocuidad del producto, todo esto relacionado con el beneficio que pueda representar en la agricultura el empleo del abono orgánico obtenido (Uribe 2003, Durán y Henríquez 2007, Acuña 2015).
Un compost maduro debe poseer una relación C:N superior a 10 y en general inferior a 20 para ser considerado comercialmente aceptable (Soto y Meléndez 2003, Soto 2003, Okumoto 2003, Muñoz 2003, Uribe 2003, Uribe et al. 2014). El término estable hace referencia a un compost que no experimenta descomposición rápida, donde hay disminución de la actividad microbiológica y en el cual los nutrientes son relativamente disponibles (Uribe 2003, Sánchez et al. 2019).
Sánchez et al. (2019) relacionan la madurez de un compost con la ausencia o grado de descomposición de compuestos fitotóxicos y contaminantes, además con la existencia de sustancias promotoras de germinación y crecimiento de plantas. El análisis que evalúa la fitotoxicidad o la promoción de un compost mide, ya sea, la germinación de semillas y/o la elongación de raíces o el crecimiento de plantas en compost solos o en mezcla con suelo y compara los resultados con un tratamiento control (Soto y Meléndez 2003, Uribe 2003).
En relación con las poblaciones microbianas, Lal (2016) hace referencia a que una mayor biodiversidad de microorganismos en los suelos se traduce en una mayor capacidad para la supresión de organismos no deseados. Por ello, los abonos orgánicos maduros, al ser aplicados como enmiendas a los suelos, tienen la capacidad de mejorar la sanidad de los cultivos. En este sentido, Castro et al. (2011) reportan una disminución de las poblaciones del nematodo endoparásito Meloidogyne incognita luego de haber añadido enmiendas orgánicas a plantas de tomate (Lycopersicon esculentum); también Castro et al. (2020) mencionan que el abono orgánico mejoró el rendimiento de plantas de mostaza (Brassica rapa sp. pekinensis) y su respuesta a la afectación por la enfermedad conocida como hernia de las crucíferas causada por Plasmodiophora brassicae. Por su parte Artavia et al. (2010) demostraron que abonos orgánicos de tipo compost y vermicompost poseen una capacidad supresora para Pythium myriotylum. Esta capacidad supresora depende de las materias primas, el tipo de procesamiento, grado de madurez y de la cantidad aplicada de estos abonos (Uribe et al. 2014). En este sentido Hoitink et al. (1997) destacan que el ambiente y condiciones del proceso de compostaje afectan el potencial de biocontrol de organismos patógenos y de supresión de enfermedades, dado que compost inmaduros más bien pueden servir de alimento a organismos considerados patógenos (que también pueden ser saprófitos) y provocar problemas de enfermedades en cultivos agrícolas. No obstante, Bonanomi et al. (2007) indican que abonos orgánicos muy maduros o estables pierden sus propiedades inhibitorias de enfermedades al disminuir la actividad y diversidad de los microorganismos.
Por otro lado, un análisis químico completo permite conocer los contenidos totales de los elementos Ca, Mg, K, P, S, Fe, Cu, Zn, Mn, B, N y C; el valor de pH, la conductividad eléctrica (CE), el % de MO y la relación C:N existentes en las materias primas o el abono evaluado (Soto y Meléndez 2003, Durán y Henríquez 2007). Hace 2 décadas en Latinoamérica se utilizó la medición de contenidos de elementos como factor principal para establecer la calidad de abonos orgánicos (Soto y Meléndez 2003). Recientemente Azim et al. (2018) y Sánchez et al. (2019) proponen una combinación de evaluaciones de diferentes criterios para una mejor estimación de la madurez y/o estabilidad y la calidad en abonos. Los mismos autores mencionan diferentes parámetros que pueden emplearse como referencia del grado de biodegradación de materiales orgánicos, como temperatura, relación C/N, actividad microbiana, el índice de germinación, la CIC, pH, contenido de sales, presencia de nitratos y amonio, entre otros.
Por otra parte, Uribe (2003) señala que los contenidos de Salmonella, Escherichia coli y coliformes fecales son los principales análisis de tipo microbiológico que se realizan para evaluar la inocuidad de los abonos orgánicos. Adicionalmente existen otros análisis para la determinación de potenciales microorganismos patógenos de plantas (Uribe 2003, Uribe y Castro 2008).
El objetivo de la presente investigación fue optimizar la calidad de la producción de abono orgánico tipo compost fabricado comercialmente, por medio de la mejora de las condiciones de elaboración y la adición de diferentes fuentes de inóculo microbiano.
Materiales y métodos
El proceso experimental se realizó en Costa Rica bajo el esquema de mejora continua de la empresa Abonos Vivos S. A., productora de compost desde hace más de una década, localizada en Ochomogo, del distrito San Nicolás del cantón de Cartago y la provincia del mismo nombre, a una altitud de 1580 msnm, con una precipitación en el rango 1500-2000 mm y una temperatura media entre 16-18ºC.
Inicialmente se procedió a determinar aspectos técnicos deficientes en los procedimientos de la empresa, mediante la observación directa, la revisión de registros y manuales de procedimientos (Abonos vivos 2019) y entrevistas informales a los empleados a cargo de las funciones. Posteriormente se plantearon propuestas técnicas de mejora con base en condiciones reportadas como óptimas en la literatura.
Disposición del ensayo experimental. Se utilizaron las materias primas usualmente disponibles en la empresa, las cuales fueron mezcladas para conformar un sustrato básico a partir del cual se construyeron hileras experimentales según los tratamientos evaluados. Para las hileras experimentales se procuró un manejo con condiciones óptimas, además se adicionaron diferentes fuentes de inóculo microbiano. A los abonos orgánicos resultantes de este ensayo se les realizaron análisis químicos, microbiológicos, de estabilidad y madurez, los cuales fueron también comparados con análisis similares realizados al abono comercial de la empresa (testigo comercial).
El sustrato básico consistió en 85% de broza de café húmeda proveniente de distintos beneficios, además se utilizaron 7,5% de residuos sólidos del procesamiento de pipa verde (Cocos nucifera L.) y 7,5% de lodos de plantas de tratamiento de aguas residuales agroindustriales, con base en su volumen y de acuerdo con las cantidades de materias primas disponibles.
En el plantel de la empresa se destinó un espacio de terreno a cielo abierto de 2000 m2 para la disposición del ensayo. Se evaluaron 4 tratamientos con diferentes fuentes de inóculo de microorganismos degradadores de materia orgánica, dosificados según las respectivas recomendaciones técnicas. Adicionalmente, se manejó un tratamiento sin adición de inóculo como testigo absoluto. Cada tratamiento consistió en una única hilera de sustrato básico con 45,6 m3 de volumen inicial, con medidas de 25 m de largo, 2,5 m de ancho y 1,2 m de altura.
Los tratamientos evaluados consistieron en el sustrato básico en condiciones optimizadas de manejo con: 1. Un inóculo microbiano elaborado en la propia empresa a base del producto comercial Serenade de Bayer (con Bacillus subtilis, cepa QST 713), según receta y dosis empleada normalmente en la empresa, con un total de 3 aplicaciones de 200 L cada una respectivamente en las semanas 1, 3 y 8 del proceso, tratamiento denominado Bacilos. 2. Un inóculo microbiano proveniente del producto comercial Degradabiol (biodegradador con cepas Bacillus CIA 200-201-202, Streptomyces CIA 110-101, Saccharomyces CIA 2008 y Trichoderma CIA 100-102) registrado y elaborado por la Universidad de Costa Rica y según dosis recomendada por el proveedor del producto (27 L de producto comercial repartido en 3 aplicaciones respectivamente en las semanas 1, 3 y 7 del proceso de compostaje), denominado Degradabiol. 3. Un inóculo microbiano proveniente del producto comercial Agrecicla (descomponedor biológico con Bacillus, Lactobacillus, Saccharomyces y Streptomyces) según dosis recomendada por el proveedor del producto (2 L de producto comercial repartido en 8 aplicaciones semanales durante las primeras 8 semanas del proceso de compostaje), denominado Agrecicla. 4. Condiciones optimizadas de manejo sin inóculo (testigo absoluto). 5. El abono terminado producto de la línea de producción comercial convencional fue considerado como un testigo comercial de tipo relativo, para comparar diferencias de calidad de los tratamientos con la tecnología tradicional de producción de la empresa.
Los tratamientos evaluados permanecieron 16 semanas en campo abierto; posteriormente, cuando las temperaturas estuvieron por debajo de 40ºC, se trasladó una tercera parte del volumen remanente de cada uno de los tratamientos respectivos a una galera techada para una fase final de curado y secado, por un periodo aproximado de 8 semanas.
En los tratamientos 1-4 la altura de hileras fue ajustada a 120 cm de acuerdo con los alcances de los equipos de la empresa, con la intención de mejorar la disponibilidad y distribución del oxígeno y la humedad, además para facilitar el manejo y lograr una mejor regulación de la temperatura en las hileras (Baltodano 2002, Garro 2016).
Para la línea de producción del testigo comercial se tomaron muestras para análisis químicos y microbiológicos; los resultados obtenidos de los análisis del testigo comercial fueron comparados con los realizados a los otros tratamientos evaluados.
Análisis químicos. Se tomaron muestras para análisis químicos (pH, CE, % MO, Ca, Mg, K, P, S, Fe, Cu, Zn, Mn, B, N, C), en el Laboratorio de Suelos y Foliares del Centro de Investigaciones Agronómicas (LSF-CIA) de la Universidad de Costa Rica.
Para determinar el porcentaje de % MO se empleó la técnica de oxidación con dicromato de K, referida por Henríquez y Cabalceta (1999). Los porcentajes de C y N totales se determinaron con un autoanalizador por combustión seca y a partir de los resultados fueron calculadas las relaciones C:N respectivas.
Luego de una digestión húmeda del abono en HNO3, se determinaron las concentraciones totales de elementos Ca, Mg, K, P y elementos menores con espectrometría de emisión atómica acoplada a plasma (ICP-AES), según reporta el LSF-CIA en los resultados de laboratorio respectivos.
Análisis microbiológicos, de estabilidad y madurez. Al final del proceso de elaboración de compost, se realizaron análisis microbiológicos y se determinaron las poblaciones de hongos, levaduras, actinomicetes, bacterias, lactobacilos, además recuento de fijadores de nitrógeno (FN), de solubilizadores de fósforo (SP) y de inocuidad (presencia de Salmonella y Escherichia coli). La estimación de microorganismos se realizó mediante la técnica de diluciones seriadas y aislamientos microbiológicos y conteos de las unidades formadoras de colonias (UFC) o número más probable (NMP) en los medios específicos (Uribe 2000, Uribe 2003, Uribe y Castro 2008). Para realizar el análisis de las poblaciones de microrganismos los valores obtenidos fueron transformados con Log10 UFC. Se determinó la calidad de los abonos mediante la realización de análisis de estabilidad, al evaluar la cantidad de CO2 producida por unidad de tiempo (tasa respiratoria). También se hicieron análisis de madurez o fitotoxicidad que midieron los porcentajes de germinación de semillas en el compost, además en mezclas del compost respectivo con diferentes cantidades de suelo adicionado, para evaluar posibles variaciones de germinación que puedan atribuirse a fitotoxicidad o promoción del crecimiento. Los análisis microbiológicos fueron llevados a cabo en el Laboratorio de Microbiología Agrícola del Centro de Investigaciones Agronómicas (LMA-CIA) de la Universidad de Costa Rica.
Cada muestra consistió en un 1 kg de material tomado luego de un volteo de la hilera respectiva, para homogenizar los materiales. Cada muestra se constituyó a partir de 15 submuestras recolectadas de forma aleatoria y tomadas a 30 cm de profundidad, a partir de la superficie y hacia el centro de la hilera. Se tomaron 3 muestras por cada uno de los tratamientos.
Para el testigo comercial se tomaron 3 muestras para los análisis químicos y microbiológicos respectivos, constituidas a partir de 15 submuestras recolectadas en forma aleatoria en las hileras del abono comercial de la empresa.
Análisis físicos complementarios. La temperatura (T) de las hileras se midió a los 60 cm de profundidad con un termómetro de la marca Tel-Tru,. Para ello se tomaron 3 mediciones por hilera de forma diaria, en la etapa termófila. La medición de T se utilizó como indicador par el volteo; de forma que cuando la temperatura era de 60oC, sin superar los 65oC, se procedió con el volteo. Para ello se utilizó una máquina volteadora de compost unida a un tractor. Durante la fase mesófila, cuando disminuyeron las temperaturas por debajo de 40oC, las hileras se voltearon al menos una vez por semana para propiciar el ingreso de oxígeno.
Para la medición de los porcentajes de humedad se tomaron 3 muestras por tratamiento con intervalos de 1 semana; para este efecto se tomó y pesó cada muestra fresca de cada uno de los tratamientos y se procedió luego a secarla en un horno a 80ºC; el porcentaje de humedad se calculó mediante la fórmula: %H= (masa del agua/masa del material fresco) x100. Los resultados obtenidos se utilizaron para mantener la humedad de los tratamientos dentro del ámbito 40-65% el cual es considerado como óptimo (Rynk 1992, Guerrero 2005, Tognetti et al. 2005).
El peso inicial de los materiales disponibles en las hileras fue calculado a partir de la relación peso-volumen, donde cada metro cúbico de material inicial fresco representa aproximadamente una tonelada de peso. El peso final se calculó con muestras de 1 L, a las cuales se les midió el peso respectivo con una balanza y posteriormente fueron promediadas. Por su parte el peso seco de los materiales disponibles en las hileras se estimó sustrayendo el porcentaje de humedad del peso total calculado para cada tratamiento.
Luego de una etapa final de curado y secado, cuando los tratamientos se consideraron como abono terminado, con % de humedad en el ámbito 30-44% y luego del último volteo del material, se procedió a cernir los abonos resultantes. Inicialmente se tomó un volumen conocido representativo por tratamiento (1,7 m3 que corresponde con el volumen de la pala del tractor cargador empleado), para pasarlo a través de una zaranda gruesa, con aberturas cuadradas de 12,25 cm2. Posteriormente, el cernido más fino obtenido con la zaranda gruesa fue tamizado nuevamente con una zaranda con aberturas de 5,25 cm2 de área de celda.
Para los materiales más finos obtenidos en estos cernidos se registraron los volúmenes y las cantidades de sacos resultantes con sus pesos. El peso inicial para los volúmenes pasados por la zaranda gruesa (1,7 m3) fue calculado a partir de la relación peso-volumen, para lo cual se tomaron muestras de menor volumen (1 L) a las cuales se les determinó el peso respectivo con una balanza y posteriormente fueron promediadas. Por su parte el peso seco final de los materiales cernidos se estimó sustrayendo el porcentaje de humedad del peso total calculado respectivamente para cada tratamiento.
Análisis estadístico. Para comparar las propiedades químicas, microbiológicas, de estabilidad y madurez de los abonos orgánicos obtenidos con los tratamientos evaluados, así como los resultados de los análisis del testigo comercial, se empleó un método multicriterio, para resumir el resultado de todas las variables estudiadas en un solo valor representativo (Gerez y Grijalva 1976, Azorin y Cuadras 1990, Cayuela 2010, Garbanzo y Navarro 2015).
En total se evaluaron 17 variables químicas, 7 microbiológicas, 2 de inocuidad y 13 de madurez, para un total de 39 variables. Con el método multicriterio utilizado se trasladan todas las variables referidas a calificaciones según la fórmula desarrollada a partir del sistema de toma de decisiones descrito por Gerez y Grijalva (1976), en la forma de una ecuación multicriterio: I.P.=((Ʃ Vi*Xj*Yt) / Max.) * 100. Donde: I.P. = Índice ponderado de todas las variables; Vi = Valor asignado a la variable (ponderación); Xj = Calificación dentro de la variable (valor de posición); Yt = Calificación del capítulo al cual pertenece la variable; Max. = Es la máxima calificación que puede obtener un registro. Los valores Vi, Xj y Yt fueron asignados subjetivamente con base en la importancia relativa de cada una de las variables evaluadas en relación con la calidad del compost, con un marco de referencia fundamentado en revisiones de literatura.
A cada una de las variables se le asignó un valor de ponderación (Vi) de 1 a 5, de acuerdo con la importancia que cada variable tuviera en el contexto del ensayo según el marco de referencia utilizado, se consideró 5 como el valor de mayor importancia. Para cada una de las variables se asignaron además valores de posición (Xj) relacionados con el recorrido entre valores mínimo y máximo (dividido en 3 intervalos) dados para cada variable y de acuerdo con los resultados obtenidos. A su vez las variables fueron agrupadas en 4 capítulos (variables químicas, microbiológicas, de inocuidad y madurez) según su naturaleza y se asignó un valor de ponderación adicional para cada uno de los capítulos (Yt). Se calculó entonces un índice ponderado (I.P.) para cada muestra y posteriormente se obtuvo un I.P. promedio para cada uno de los tratamientos, los cuales permitieron la comparación entre tratamientos, a manera de comparación de porcentajes.
Con los datos de los I.P. se estimó un error proveniente de diferencias entre réplicas, el cual permitió establecer una calificación para los diferentes tratamientos con fines ilustrativos. Con las réplicas se estimó una desviación estándar que admitió el establecimiento de intervalos de confianza cuyos traslapes se emplearon para asignar calificaciones en forma de letra, con homologación del análisis de la diferencia mínima significativa (dms).
Algunas variables que presentaron comportamientos destacables se aislaron de su aporte al modelo multicriterio y se evaluaron con recursos gráficos por medio de comparaciones directas de promedios para fines ilustrativos.
Resultados y discusión
Se determinaron aspectos técnicos deficientes en el proceso comercial relacionados con: altura excesiva de las hileras de compostaje (más de 2 m); ausencia de manejo para propiciar una humedad adecuada y constante; una frecuencia reducida y arbitraria de los volteos; falta de regulación de la temperatura; y empleo de relaciones C/N inadecuadas para iniciar procesos de compostaje. Para realizar el ensayo planteado se propuso, según el marco de referencia teórico, utilizar una altura de 1,20 cm, se tomó en cuenta la altura indicada en la literatura, así como las posibilidades instrumentales de la fabricación comercial, además se mantuvo un manejo de la humedad durante el proceso dentro del ámbito 40-65% y se llevó un programa de volteos frecuentes para propiciar tanto oxigenación como regulación de la temperatura, y como indicador del volteo, una T de 60oC (Baltodano 2002, Okumoto 2003, Soto y Meléndez 2003, Tognetti et al. 2005, Garro 2016). En cuanto a la relación C/N, los materiales utilizados por la empresa, principalmente broza de café, no permitieron ajustar esta relación a una considerada como óptima, de manera tal fue necesario iniciar el proceso de compostaje a partir de un sustrato básico con una relación de 16,1, muy similar al utilizado comercialmente de 15,6.
Evaluación de la calidad del abono orgánico elaborado. Todas las variables químicas evaluadas (Tabla 1) fueron comparadas entre los tratamientos y el testigo comercial con el análisis multicriterio, se destacan aquí algunas por considerarlas relevantes.
Tabla 1 Valores de estabilidad dados al final del proceso de compostaje correspondiente para cada tratamiento.
| Tratamiento | Valor promedio de Estabilidad (mg C-CO2.gSVd-1) | Clasificación |
| Testigo comercial | 2,9 | Estable |
| Testigo absoluto | 0,3 | Muy Estable |
| Bacilos | 1,0 | Muy Estable |
| Agrecicla | 1,1 | Muy Estable |
| Degradabiol | 2,7 | Estable |
Respecto al C (Figuras 1 y 2) el testigo comercial fue el tratamiento que evidenció la mayor merma con 61,64%, sin embargo, todos los tratamientos mostraron mermas en sus contenidos de carbono mayores al 50%. El testigo absoluto mostró el menor % de merma de los contenidos de C, con 51,91%, mientras los otros tratamientos se mantienen en una franja intermedia con valores muy similares de 54,80%, 55,20% y 54,77% respectivamente para los tratamientos Bacilos, Agrecicla y Degradabiol (Figura 2).
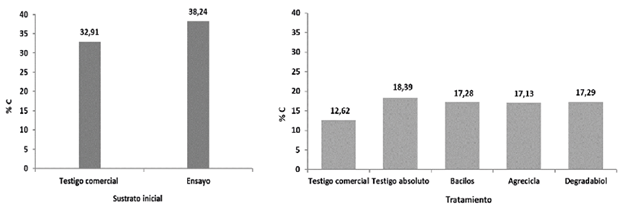
Figura 1 Contenido de carbono (%) reportado al inicio del respectivo proceso de compostaje (izquierda) y los reportados al final del proceso, por cada tratamiento (derecha).
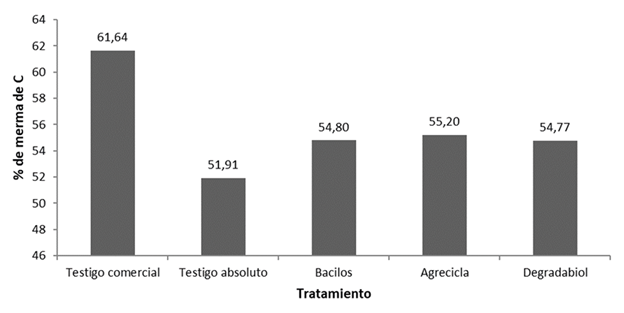
Figura 2 Porcentajes de merma de carbono reportados al final del proceso de compostaje correspondientes a cada tratamiento.
La mayor merma de C obtenida en el testigo comercial puede tener relación con la falta de adecuada oxigenación durante el proceso de compostaje, al no haber volteos lo suficientemente frecuentes y más bien propiciarse condiciones reductoras. En un ambiente anaeróbico, el C en la forma de CO2, es usado como aceptor de electrones por microorganismos específicos (metanógenos), que liberaron CH4 como subproducto, constituyéndose en una salida gaseosa de C, con efecto invernadero (FAO 2017).
Respecto al N (Figuras 3 y 4) se mantuvo la misma tendencia mostrada con el C, el testigo comercial presentó la mayor merma de nitrógeno (40,62%), los tratamientos Bacilos, Agrecicla y Degradabiol mostraron valores en una franja intermedia con valores 27,87%, 28,57% y 27,87% respectivamente, mientras la menor merma de los contenidos de N se encontró en el testigo absoluto con 24,93% (Figura 4).
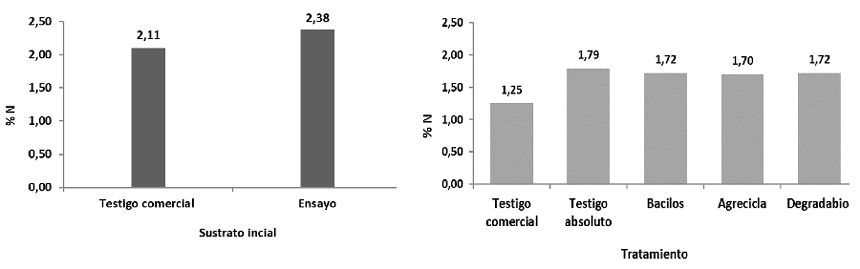
Figura 3 Concentración de nitrógeno (%) reportado al inicio del proceso de compostaje (izquierda) y al final del proceso, por cada tratamiento (derecha).
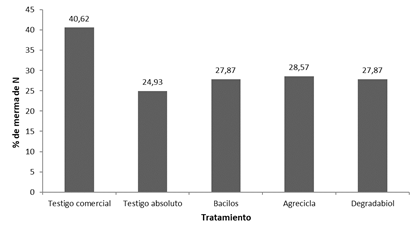
Figura 4 Porcentajes de merma de nitrógeno reportados al final del proceso de compostaje correspondientes a cada tratamiento.
Las mermas encontradas se pueden relacionar con la actividad oxidativa de los microorganismos que llevan a cabo transformaciones de sustancias mediante C, N y otros elementos (Soto 2003, Buscot y Varma 2005). En el compostaje hay liberación de gases como CO2 y NH3, así como compuestos relacionados. Estas salidas, aunque ocurren naturalmente durante el proceso de compostaje, son más significativas cuando no existe el volteo frecuente para propiciar oxigenación, mejorar la distribución de humedad y la regulación de T en las hileras (Soto y Meléndez 2003, Meléndez 2003, Soto 2003, Baltodano 2002, Rynk 1992). En este caso en el manejo del testigo comercial no se realizaron suficientes volteos, ni tampoco hubo otras formas de oxigenación ni de regulación de la humedad.
Por su parte las relaciones C:N finales evaluadas para los abonos de todos los tratamientos y el testigo comercial promediaron 10:1 en todos los casos (Testigo comercial 10,1:1; Testigo absoluto 10,3:1; Bacilos 10,1:1; Agrecicla 10,0:1; Degradabiol 10,1:1). Cabe destacar que ningún tratamiento presentó diferencia significativa en la relación C:N final.
Según Garro (2016) la relación C:N óptima para el producto final de un proceso de compostaje está entre 10-15:1, debido a su aporte energético. Lal (2016) hace referencia a que una relación C:N en el caso de un abono terminado, cercana a 15:1, muestra mayor beneficio, ya que aporta más contenido energético para la actividad de los microorganismos. Las bajas relaciones C:N obtenidas se deben en parte a la también baja relación C:N con la cual se iniciaron los respectivos tratamientos (16,1:1), no obstante, la relación C:N óptima para iniciar un proceso de compostaje se encuentra entre 20:1 y 40:1 (Rynk 1992); es sabido que relaciones C:N muy bajas conllevan a pérdidas de N debido a la falta de estructuras de C que puedan retenerlo (FAO 2017, Soto 2003, Baltodano 2002, Santos et al. 2017).
Al final del proceso de compostaje los tratamientos con mayores contenidos de fósforo (P) fueron los adicionados con inóculos microbianos: Degradabiol, Bacilos y Agrecicla, correspondientes a 0,46; 0,41 y 0,40 de % masa (Figura 5). Por su parte, el testigo absoluto y el comercial mostraron comparativamente menores contenidos finales de P (0,33 y 0,39 de % masa respectivamente), los cuales son además muy similares a los contenidos iniciales de fósforo en estos tratamientos (Figuras 5). Aunque la incertidumbre del análisis no permite establecer diferencias más concluyentes, la tendencia de aumento en las concentraciones de fósforo en los tratamientos con adición de inóculo sugiere que la actividad de los microorganismos adicionados pudo incrementar la concentración final de este elemento, al modificar los sustratos mediante complejos procesos de descomposición como los señalados por Buscot y Varma (2005).
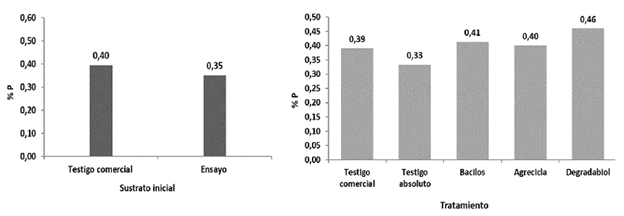
Figura 5 Concentración de fósforo reportado al inicio del respectivo proceso de compostaje (izquierda) y los reportados al final del proceso, por cada tratamiento (derecha).
Adicionalmente, en todos los casos se presentó aumento en la suma de bases (calcio, magnesio y potasio) al comparar los valores iniciales con los finales del proceso de compostaje, tanto para el testigo comercial como para los tratamientos evaluados (Figuras 6 y 7); no obstante, en el testigo comercial y el testigo absoluto se reportan menores aumentos en sus contenidos de sumas de bases en comparación con los tratamientos con inóculos microbianos. El testigo comercial y el testigo absoluto presentan los menores contenidos de suma de bases (Ca, Mg y K) al final del proceso de compostaje con 3,80 y 3,91 de % masa respectivamente, mientras que el tratamiento Agrecicla muestra el mayor contenido de suma de bases con 5,07% masa. El tratamiento Bacilos aparece en segundo lugar con sumas de bases 4,87 y Degradabiol presenta 4,31% masa en la suma final de bases (Figura 7).
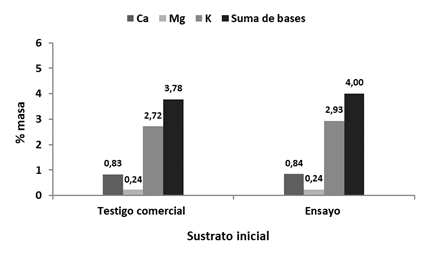
Figura 6 Contenidos de calcio, magnesio, potasio y de suma de bases reportados al inicio del respectivo proceso de compostaje.
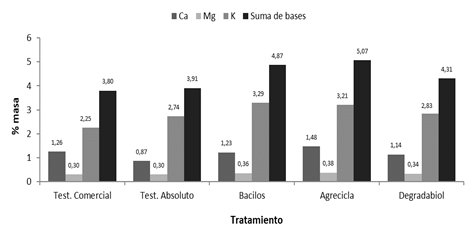
Figura 7 Contenidos de calcio, magnesio, potasio y de suma de bases reportados al final del proceso de compostaje correspondiente a cada tratamiento.
En general, los aumentos observados en las concentraciones de bases tienen relación con las condiciones de descomposición del material orgánico (Meléndez 2003, Muñoz 2003, Castro et al. 2009). En los tratamientos con adición de inóculo se presentaron mayores concentraciones finales de sumas de bases, lo cual sugiere un cambio en la composición relativa de los sustratos originales y la síntesis de nuevos compuestos como producto de los procesos de descomposición y síntesis del material (Buscot y Varma 2005, Santos et al. 2017).
Las concentraciones de elementos menores como (Cu, Mn, Fe, Zn y B), al final de proceso de compostaje, tanto para el testigo comercial como en los tratamientos evaluados, mostraron valores considerados altos para abonos orgánicos. Ansorena (2011) y Torres et al. (2016a) refieren para abonos orgánicos sólidos las concentraciones consideradas óptimas dentro de los ámbitos 1-4 mg.L-1, 2-30 mg.L-1, 10-40 mg.L-1, y 1-10 mg.L-1, respectivamente para los microelementos cobre, manganeso, hierro y zinc. Se hace además referencia a que concentraciones de microelementos muy por encima de ámbitos considerados óptimos pueden provocar toxicidades para el crecimiento de plantas al momento de aplicar tales abonos a suelos agrícolas (Michaud et al. 2008, Ansorena 2011, Binner y Schenk 2013, Hernández et al. 2013, Garro 2016, Torres et al. 2016a). En la presente investigación los valores encontrados en mg.kg-1 para Cu estuvieron entre los 90 y 154, para Mn entre 796 y 1320, para Fe entre 33399 y 51415 y para Zn entre 84 y 134.
Por su parte, los valores promedio de CE obtenidos en los tratamientos son mayores a 8 mS.cm-1 (con excepción del testigo absoluto que mostró un promedio de 4 mS.cm-1). Barral et al. (2014) y Torres et al. (2016b) refieren que valores de CE mayores a 2 mS.cm-1 pueden indicar salinidad en abonos orgánicos. En adición para todos los abonos finales, los promedios de pH medidos (en agua) fueron básicos con valores en el ámbito 9-10.
Respecto a los análisis microbiológicos en todos los tratamientos se detectaron poblaciones de actinomicetes, bacterias y hongos, así como los grupos funcionales fijadores de nitrógeno (FN) y solubilizadores de fósforo (SP). El tratamiento con el inóculo Bacilos presentó la menor cantidad de actinomicetos con un promedio de 6,6 (Log10) UFC.g-1 (Figura 8). Por su parte el tratamiento Degradabiol muestra la mayor cantidad de hongos totales con un promedio de 5,7 (Log10) UFC.g-1. En general se observa que los tratamientos con adición de inóculo microbiano presentan mayores poblaciones de hongos totales, en comparación con el testigo absoluto y el testigo comercial (Figura 8). Es importante mencionar que los hongos presentan un papel destacado en los procesos de humificación (Tortosa et al. 2020).
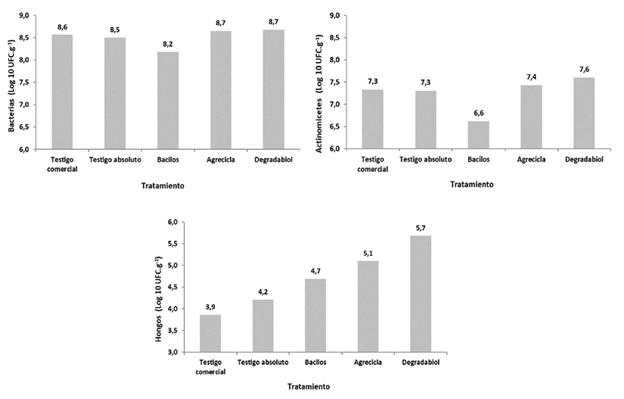
Figura 8 Poblaciones de bacterias, hongos y actinomicetos reportadas al final del proceso de compostaje correspondiente a cada tratamiento.
Todos los tratamientos evaluados mostraron poblaciones de microorganismos FN similares en un ámbito 8,2 - 8,7 (Log10) UFC.g-1 (Figura 9). Con respecto a los SP, el testigo comercial y el testigo absoluto presentaron los valores menores con 3,8 y 4,7 (Log10) UFC.g-1 respectivamente. Las mayores poblaciones de SP se encontraron en los tratamientos adicionados con los inóculos Bacilos, Agrecicla y Degradabiol con promedios de 5,4; 5,3 y 5,2 (Log10) UFC.g-1 respectivamente (Figura 9), este comportamiento coincide con el observado al determinar las concentraciones de P en los diferentes tratamientos (Figura 5).
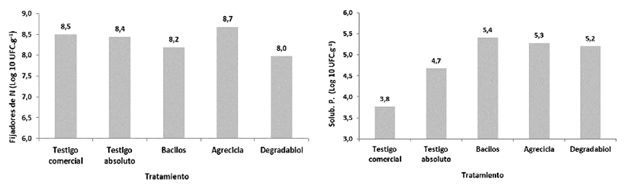
Figura 9 Poblaciones de microorganismos fijadores de N (izquierda) y solubilizadores de P (derecha) reportadas al final del proceso de compostaje correspondiente a cada tratamiento.
Los tratamientos Agrecicla, Bacilos y el testigo absoluto resultaron muy estables con tasas de respiración menores a 2,0 mg C-CO2.gSVd-1, mientras que el tratamiento degradabiol y el testigo comercial se clasificaron como estables (Tabla 1) con valores promedio 2,7 y 2,9 mg CO2.g-1 SV t en su tasa de respiración (Thompson y Leege 1998). Al considerar las tasas de respiración para los abonos con clasificación de estables (Degradabiol y testigo comercial) se considera que en estos hay mayor actividad de microorganismos si se comparan con los considerados muy estables (Sánchez et al. 2019). En cualquier caso, es recomendable ajustar la estabilidad y/o madurez de los abonos orgánicos a las necesidades específicas, según se trate de suelos antes de la siembra, semilleros, cultivos en etapas iniciales o más avanzadas de desarrollo, entre otras condiciones.
Por otra parte, los porcentajes de germinación más altos en general se obtuvieron para las mezclas 25% abono:75% suelo (25:75) y 50% abono:50% suelo (50:50), con valores por encima de 90% tanto para el testigo comercial como para los demás tratamientos evaluados en tales mezclas (Figura 10). Los inferiores porcentajes de germinación en la mezcla 75:25 en comparación con los resultados de las mezclas 25:75 y 50:50, así como los más bajos o nulos porcentajes de germinación en la mezcla 100:0, se pueden relacionar con la presencia en los abonos de sustancias en concentraciones fitotóxicas o inhibidoras de la germinación (Soto y Meléndez 2003, Uribe 2003, Sánchez et al. 2019), también con los altos contenidos de elementos menores (Fe, Cu, Zn, Mn y B) que pueden dar toxicidad para la germinación de plantas (Michaud et al. 2008, Binner y Schenk 2013, Hernández et al. 2013, Garro 2016, Torres et al. 2016a) y además con los valores promedio de conductividad eléctrica (CE) mayores a 8 mS.cm-1 obtenidos en los tratamientos (con excepción del testigo absoluto que mostró un promedio de 4 mS.cm-1) los cuales pueden asociarse con salinidad del abono (Barral et al. 2014, Torres et al. 2016b).
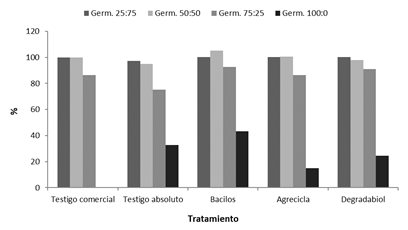
Figura 10 Porcentajes de germinación obtenidos para los abonos compost resultantes de cada tratamiento, respectivamente en mezclas 25% abono:75% suelo (25:75), 50% abono:50% suelo (50:50), 75% abono:25% suelo (75:25) y 100% abono:0% suelo (100:0).
Análisis físicos complementarios. Temperatura. Durante 22 semanas se hicieron mediciones periódicas de temperatura en las hileras de compostaje de los tratamientos respectivos. La temperatura mostró un comportamiento descendente en todos los tratamientos (Figura 11). Durante la semana inicial del ensayo los tratamientos arrancaron con temperaturas en el rango 48-60oC propias de una etapa termofílica; las elevadas temperaturas de inicio se deben a que las materias primas que llegan a la empresa ya llevan varios días de almacenamiento y traslados, de forma que en general han iniciado la etapa termofílica. En las semanas consecutivas se observa una tendencia de progresiva disminución en la temperatura; así a partir de la semana 15 todos los tratamientos mostraron temperaturas por debajo 40oC, mientras que para las semanas 21 y 22 se observaron temperaturas por debajo de 30oC, las cuales se relacionaron con una mayor estabilidad o madurez de los materiales.
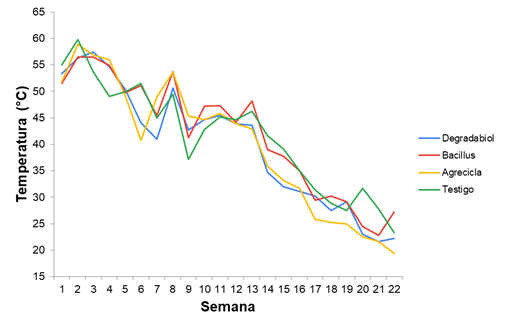
Figura 11 Comportamiento de la temperatura en hileras de compostaje durante 22 semanas de procesamiento.
Cambios de volumen y peso seco. En el periodo en el que los tratamientos permanecieron en campo abierto (16 semanas), en general hubo una reducción en el volumen de las hileras de aproximadamente 65-70% en todos los tratamientos (Figura 12). Todos los tratamientos mostraron pérdidas de peso seco mayores a 33% (Figura 13). El tratamiento Degradabiol presentó el mayor cambio con una pérdida de 50% en su peso seco, mientras que el testigo absoluto mostró la menor pérdida con 34% de disminución de peso seco (Figura 12). Cabe destacar que en los tratamientos con adición de inóculo (Degradabiol, Agrecicla y Bacilos) hubo una mayor disminución de peso seco en comparación con el testigo absoluto, posiblemente en relación con una mayor actividad microbiana. Además, la merma en el volumen y peso seco de las hileras de compostaje está relacionada con los cambios de humedad, así como con las disminuciones de carbono y nitrógeno, entre otros procesos complejos que toman lugar durante el compostaje (Soto 2003, Soto y Meléndez 2003, Buscot y Varma 2005).
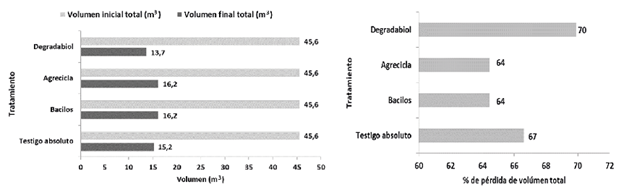
Figura 12 Cambios de volumen en los tratamientos de compostaje (izquierda) y % de pérdida de volumen (derecha) al cabo de 16 semanas del proceso de compostaje a campo abierto.
Rendimiento en el cernido. Un compost con un tamaño de partícula más fino tiene mayor posibilidad de comercializarse con mejores precios, pues además de ser útil como abono o mejorador de suelos, puede también utilizarse como parte de la mezcla en sustratos para preparación de almácigos o de plantas ornamentales y zonas verdes (Soto y Meléndez 2003). Por este motivo el cribado del compost es una práctica comercial común. El tratamiento Degradabiol (Tabla 2) presentó mayor cantidad de material fino, con un 65% del peso seco de la muestra inicial en la zaranda gruesa y en el segundo caso con un 43% del peso seco de la muestra inicial, en la zaranda fina. La granulometría obtenida en los materiales está relacionada con la actividad biológica; en aquellos materiales con menores tamaños de partículas se asume una mayor actividad y por tanto una mayor partición de las partículas iniciales del sustrato.
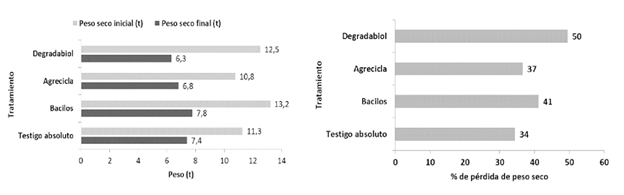
Figura 13 Cambios en el peso seco de los tratamientos de compostaje (izquierda) y % de disminución del peso seco (derecha) al cabo de 16 semanas de proceso de compostaje a campo abierto.
Tabla 2.Pesos obtenidos con el cernido de abonos compost a través de 2 tipos de zarandas.
| - | Testigo ensayo | Bacilos | Agrecicla | Degradabiol | |
| Muestra inicial | Volumen inicial (m3) | 1,70 | 1,70 | 1,70 | 1,70 |
| Peso inicial total (kg) | 949,17 | 1055,42 | 1027,08 | 1048,33 | |
| % Humedad | 44,00 | 39,00 | 30,00 | 33,00 | |
| Peso seco inicial (kg) | 531,53 | 643,80 | 718,96 | 702,38 | |
| Zaranda gruesa (12,25cm2) | Peso total cernido en zaranda 12,25 cm2 (kg) | 531,53 | 643,80 | 718,96 | 702,38 |
| Peso seco de cernido fino (kg) | 269,85 | 248,25 | 400,20 | 455,11 | |
| % Cernido fino de muestra inicial | 50,77 | 38,56 | 55,66 | 64,79 | |
| Peso seco de cernido grueso (kg) | 261,68 | 395,56 | 318,76 | 247,28 | |
| % Cernido grueso de muestra inicial | 49,23 | 61,44 | 44,34 | 35,21 | |
| Zaranda fina (5,25 cm2) | Peso seco total cernido en zaranda 5,25 cm2 (kg) | 269,85 | 248,25 | 400,20 | 455,11 |
| Peso sexo de cernido fino (kg) | 165,97 | 103,26 | 231,22 | 305,02 | |
| % Cernido fino de muestra inicial | 31,22 | 16,04 | 32,16 | 43,43 | |
| Peso seco de cernido grueso (kg) | 103,88 | 104,99 | 168,98 | 150,08| | |
| % Cernido grueso de muestra inicial | 19,54 | 22,52 | 23,50 | 21,37 |
Análisis multicriterio. Las 39 variables evaluadas referidas fueron comparadas entre los tratamientos evaluados y el testigo comercial con un análisis multicriterio, los valores de ponderación Vi y Yt asociados y valores de posición Xj se muestran en las Tablas 3 y 4. El análisis multicriterio permitió resumir el comportamiento de cada tratamiento en un valor o calificación de tipo porcentaje (índice ponderado). En este caso, los porcentajes más altos representan los tratamientos que tienen el mejor conjunto de características de calidad según los resultados obtenidos (Figura 14).
Tabla 3 Total de variables agrupadas en sus correspondientes capítulos, con sus valores de ponderación Vi y Yt asociados, las cuales se evaluaron con un análisis multicriterio para muestras de compost.
| Capítulo variables químicas (Yt =10) | Vi | Capítulo variables microbiológicas (Yt =10) | Vi | Capítulo variables de madurez (Yt =10) | Vi |
| Nitrógeno (% masa) | 5 | Solubilizadores de fósforo (UFC.g-1) | 5 | Estabilidad (mg C-CO2.gSV-1) | 4 |
| Fósforo (% masa) | 5 | Fijadores de nitrógeno (UFC.g-1) | 5 | Germinación en mezcla 25:75 (%) | 3 |
| Calcio (% masa) | 4 | Actinomicetes (UFC.g-1) | 4 | Germinación en mezcla 50:50 (%) | 3 |
| Magnesio (% masa) | 4 | Bacterias (UFC.ml-1) | 4 | Germinación en mezcla 75:25 (%) | 3 |
| Potasio (% masa) | 4 | Hongos (UFC.g-1) | 4 | Germinación en mezcla 100:0 (%) | 3 |
| Suma de bases (% masa) | 4 | Levaduras (UFC.g-1) | 3 | Longitud aérea en mezcla 25:75 (cm) | 3 |
| Azufre (% masa) | 3 | Lactobacilos (UFC.ml-1) | 3 | Longitud aérea en mezcla 50:50 (cm) | 3 |
| Hierro (mg.kg-1) | 3 | - | - | Longitud aérea en mezcla (cm) | 3 |
| Cobre (mg.kg-1) | 3 | - | - | Longitud aérea en mezcla 100:0 (cm) | 3 |
| Zinc (mg.kg-1) | 3 | - | - | Longitud radícula en mezcla 25:75 (cm) | 3 |
| Manganeso (mg.kg-1) | 3 | Capítulo variables de inocuidad | Vi | Longitud radícula en mezcla 50:50 (cm) | 3 |
| Boro (mg.kg-1) | 3 | (Yt =6) | Longitud radícula en mezcla 75:25 (cm) | 3 | |
| Humedad (%) | 1 | Escherichia coli (UFC.g-1) | 4 | Longitud radícula en mezcla 100:0 (cm) | 3 |
| pH (en agua) | 2 | Salmonella (NMP) | 4 | - | - |
| Conductividad eléctrica (mS.cm-1) | 3 | - | - | - | - |
| Contenido de carbono (%) | 5 | - | - | - | - |
| Relación carbono:nitrógeno | 3 | - | - | - | - |
Los más altos contenidos de bases, así como de N, P, S, se asociaron con calificaciones más altas dentro del capítulo de variables químicas. En el caso de los elementos menores (Fe, Cu, Zn, Mn y B), estos en general se encontraron en concentraciones consideradas altas y pueden relacionarse con posibles problemas de toxicidad para el desarrollo de las plantas (Michaud et al. 2008, Ansorena 2011, Binner y Schenk 2013, Hernández et al. 2013, Garro 2016, Torres et al. 2016a). En consecuencia, dentro del análisis multicriterio se optó por asignar calificaciones más altas a los abonos que presentaron menores contenidos de elementos menores. Garro (2016) incluso recomienda evitar aplicar abonos orgánicos con contenidos altos de elementos menores, o al menos reducir las cantidades aplicadas, con la intención de prevenir toxicidades. Los tratamientos con mayores contenidos de los referidos elementos menores tienen entonces menor puntaje dentro de la ponderación del análisis multricriterio.
De manera similar, los menores valores promedio de CE obtenidos en los tratamientos se asociaron a mejores puntajes, en vista que los valores por encima de 2 mS.cm-1 se pueden relacionar con salinidad del abono (Barral et al. 2014, Torres et al. 2016b). En el caso del pH debido a que en todos los casos se obtuvieron valores de pH básicos, se asignaron calificaciones más altas a los tratamientos que presentaron valores de pH más cercanos a la neutralidad.
Dentro del capítulo de variables microbiológicas, las mayores poblaciones de microorganismos (hongos, levaduras, actinomicetes, bacterias, lactobacilos, FN y SP) se asociaron con mayores calificaciones dentro del análisis. De forma inversa y bajo el criterio de inocuidad, la ausencia de Salmonella y Escherichia coli, o los más bajos contenidos de estos, se relacionaron con mejores calificaciones en el análisis.
Tabla 4 Total de variables con sus valores de posición Xj asociados según la ubicación dentro del intervalo de valores mínimo y máximo por cada variable, las cuales se evaluaron con un análisis multicriterio para muestras de compost.
| Variable | Valor Xj intervalo menor | Valor Xj intervalo medio | Valor Xj intervalo mayor |
| N, P, Ca, Mg, K, S, suma de bases (% masa) | 3 | 4 | 5 |
| Hierro, Co, Zn Mg, B (mg.kg-1) | 5 | 4 | 3 |
| Humedad (%) | 4 | 5 | 3 |
| pH (en agua) | 5 | 4 | 3 |
| Conductividad eléctrica (mS/cm) | 5 | 4 | 3 |
| Contenido de carbono (%) | 3 | 4 | 5 |
| Relación carbono:nitrógeno | 3 | 4 | 5 |
| Solubilizadores de fósforo; Fijadores de nitrógeno Actinomicetes, Bacterias, Hongos, Levaduras Lactobacilos (UFC.g-1) | 3 | 4 | 5 |
| Escherichia coli (UFC.g-1); Salmonella (NMP) | 5 | 4 | 3 |
| Estabilidad (mg C-CO2.gSVd-1) | 3 | 4 | 5 |
| Germinación en mezcla 25:75, 50:50, 75:25, 100:0 (%) | 3 | 4 | 5 |
| Longitud aérea en mezcla 25:75, 50:50, 100:0 (cm) | 3 | 4 | 5 |
| Longitud radícula en mezcla 25:75, 50:50, 75:25, 100:0 (cm) | 3 | 4 | 5 |
En relación con la estabilidad de los abonos, se otorgaron calificaciones más altas a los valores resultantes de medición de la estabilidad en el ámbito 2-8 (mg C-CO2.gSVd-1) clasificados como estables (Thompson y Leege 1998), pues se considera que en este ámbito ocurre una mayor actividad de microorganismos en comparación con los clasificados como muy estables (Bonanomi et al. 2007, Sánchez et al. 2019). Aquellos con tasas de respiración por debajo de 2 mg C-CO2.gSVd-1 son clasificados como muy estables y en ellos comparativamente se presenta menor actividad microbiológica, de forma que estos últimos se asociaron a menores calificaciones dentro del análisis multicriterio.
A su vez, al considerar las pruebas de germinación realizadas, los mayores porcentajes así como las mayores longitudes de radícula y parte área, se relacionaron consecuentemente con calificaciones más altas dentro del análisis multicriterio.
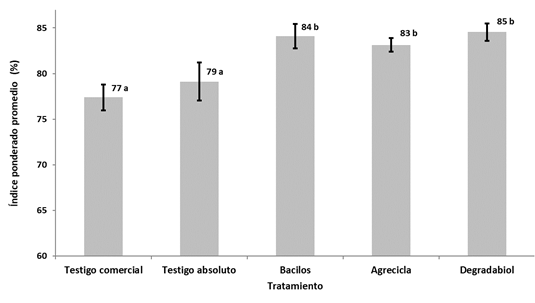
Figura 14 Resultados de análisis multicriterio para la comparación de 5 tratamientos para la elaboración de abonos tipo compost.
El análisis multicriterio permitió estimar 2 intervalos de confianza, designados con las letras a y b (Figura 14). El primer intervalo de confianza (a) incluye al testigo comercial y al testigo absoluto, los cuales obtienen las menores calificaciones de calidad con respectivamente 77% y 79%. Por otra parte, el segundo intervalo (b) abarca los tratamientos Degradabiol, Bacilos y Agrecicla, los cuales obtienen los mayores índices ponderados con 85%, 84% y 83% respectivamente. Estos últimos representan los abonos que muestran mejores características de calidad.
Conclusiones y recomendaciones
El análisis multicriterio mostró que las adiciones de microorganismos, en conjunto con un manejo adecuado de los procesos de compostaje, con prácticas como controles de humedad, T y volteos frecuentes, con una altura de hileras de 120 cm, permiten obtener mejores características de calidad, en comparación con el testigo absoluto y con el testigo comercial. El testigo comercial y el tratamiento bacilos fueron inoculados con el mismo inóculo microbiano, por lo que se puede concluir que la adición del inóculo sin un proceso optimizado de elaboración (testigo comercial) presenta menor beneficio en cuanto a la calidad en la producción del compost.
Se destaca la importancia de mejorar la relación C:N inicial en el proceso de compostaje, por medio de prácticas afines a este objetivo. Se recomienda evaluar la práctica de incorporación de pajas secas producidas en el sitio de operación, para impedir las pérdidas relacionadas con una inadecuada relación C/N. Santos et al. (2017) indican que este tipo de residuos puede equilibrar la relación C/N al aportar carbono extra, además de impedir la pérdida de N.
Un adecuado proceso de compostaje junto con la introducción de inóculos microbianos representa una opción para optimizar el manejo de residuos orgánicos y producir abonos orgánicos de calidad para el uso agrícola.