INTRODUCCIÓN
La producción láctea en Costa Rica ha ido en aumento durante las últimas 3 décadas; en 1980 se produjo 308 millones de kg, para el 2011 aumentó a 953 millones de kg (Elizondo-Salazar y Jiménez-Castro 2014) y en el 2012 se reportaron 1055 millones de kg, que representó el 11,8% del valor agregado agropecuario del país (Madriz 2013). La tendencia de incremento en la producción de leche es un 7% anual y se incrementa año tras año. Ese aumento, aunado a diversas prácticas productivas, hace necesaria la importación de materias primas para la elaboración de los alimentos balanceados utilizados en las fincas, con el fin de mantener estable la producción de leche (Elizondo-Salazar y Jiménez-Castro 2014).
Sin embargo, el aumento en el uso de esos alimentos encarece la producción láctea (Vivas y Carvajal 2004), ya que el precio internacional de los granos es determinante en el costo de los alimentos balanceados, lo cual repercute sobre la rentabilidad de las fincas lecheras, puestoque la mayoría de las explotaciones lecheras del país basan su producción en consumos altos de productos nutritivos.
En los países en desarrollo, las fuentes de proteína para producción animal son de un alto costo (Ramos et al. 2006) y en Costa Rica, la proteína cruda es uno de los nutrientes más costosos en las dietas para ganado de leche (Vargas-Villalobos y Elizondo-Salazar 2015), por lo que es necesario proponer estrategias alimenticias que permitan bajar esos costos sin disminuir la producción de leche. Una alternativa al uso de alimentos balanceados es enriquecer el valor nutricional de los forrajes y subproductos agrícolas, ya utilizados en las dietas de las vacas, a través de procesos fermentativos aeróbicos.
La fermentación en estado sólido (FES) es un proceso biotecnológico utilizado para preservar y desarrollar nuevos alimentos a partir de productos o subproductos agroindustriales ricos en carbohidratos solubles y estructurales, en donde a través del uso de microorganismos, se genera un incremento de biomasa microbiana que aumenta el contenido proteico del material (Moyano 2014, Blandino y Pineda 2015). Este proceso se realiza casi en su totalidad con ausencia de agua libre y generalmente solo se contempla la que contiene el producto a fermentar (Vivas y Carvajal 2004).
La biomasa microbiana se genera en el proceso de fermentación a partir de la microflora epífita (levaduras y bacterias) presente en el sustrato, así pues, su desarrollo se favorece con los azúcares presentes en el material y con el aporte de pequeñas cantidades de urea y sales minerales, lo que mantiene controlados los niveles óptimos de humedad, aireación, pH y temperatura (Vivas y Carvajal 2004, Moyano 2014, Blandino y Pineda 2015).Este procedimiento se ha realizado principalmente sobre la biomasa de la caña de azúcar y del maíz, ya que poseen una buena concentración de carbohidratos no estructurales y dan un gran aporte energético, pero son limitantes en su contenido proteico (López 2008, Castillo et al. 2009).
El presente estudio plantea determinar el pH, la temperatura y la composición química del pasto taiwán (Pennisetumpurpureum), el sorgo negro forrajero (Sorghumalmum) y la cáscara de piña luego del proceso de fermentación en estado sólido,con la finalidad de que puedan servir como una alternativa alimenticia para rumiantes.
MATERIALES Y MÉTODOS
Ubicación
El experimento se llevó a cabo de febrero a agosto del 2018 en la Estación Experimental de Ganado Lechero Alfredo Volio Mata de la Universidad de Costa Rica, ubicada en el Alto de Ochomogo de Cartago a 1542 msnm, con una precipitación media anual de 2050 mm, temperatura media 19,3ºC y humedad relativa media de 84%. El suelo del área es de origen volcánico, clasificado como TypicDistrandepts (Araya-Mora y Boschini-Figueroa 2005).
Los diferentes análisis se realizaron en el Laboratorio de Bromatología de la Estación Experimental de Ganado Lechero Alfredo Volio Mata y en el Centro de Investigación en Nutrición Animal de la Universidad de Costa Rica.
Especies forrajeras utilizadas en el proceso de fermentación
Las especies seleccionadas para la investigación fueron el pasto taiwán(Pennisetumpurpureum cultivar Taiwán) y el sorgo negro forrajero (Sorghumalmum). Ambas especies provinieron de plantaciones establecidas en la Estación Experimental Alfredo Volio Mata, fertilizadas a razón de 250 kg.ha-1año-1 de N.El pasto taiwán se cosechó a los 120 días de edad y el sorgo negro a los60 días.La cáscara de piña picada se obtuvo de una planta procesadoraubicada en Barreal, Heredia.
Preparación del fermentado sólido
Para la preparación de los fermentados en estado sólido, se utilizaron los ingredientes descritos en la Tabla1. La biomasa del pasto taiwán, del sorgo negro o la cáscara de piña,se depositó en una mezcladora de forrajes, en donde se redujoel tamaño de partícula a 2,5 cm y se mezcló conotros ingredientes que aportaran azúcares, nitrógeno no proteico y minerales (Díaz-Plascencia 2006).
Tabla 1 Ingredientes utilizados en base fresca para preparar el fermentado en estado sólido.
| Ingrediente | Cantidad, kg | Inclusión, % |
| Sustrato | 113,1 | 92,3 |
| Melaza de caña de azúcar | 6,1 | 5,0 |
| Urea | 1,8 | 1,5 |
| Sulfato de amonio | 0,9 | 0,7 |
| Mezcla mineral | 0,6 | 0,5 |
| Peso total en húmedo | 122,5 | 100,0 |
Se utilizó como fuente de minerales una mezcla comercial (Tabla 2).
Tabla 2. Composición química del mineral comercial utilizado.
| Compuesto mineral | Cantidad |
| Humedad, max | 10,00 % |
| Calcio, max | 14,40 % |
| Calcio, min | 12,00 % |
| Azufre, min | 3,80 % |
| Fósforo, min | 9,68 % |
| Zinc, min | 4298,50 mg.kg-1 |
| Manganeso, min | 1774,50 mg.kg-1 |
| Cobre, max | 1810,00 mg.kg-1 |
| Hierro, min | 2846,00 mg.kg-1 |
| Flúor, max | 968,00 mg.kg-1 |
| Yodo, min | 89,50 mg.kg-1 |
| Cobalto, min | 66,00 mg.kg-1 |
| Selenio, max | 14,90 mg.kg-1 |
| Sal, min | 8,00 % |
| Sal, max | 8,50 % |
Procedimiento experimental
Para realizar la fermentación en estado sólido (FES), se utilizaron marcos sobre superficies de concreto de 1,0 m2,elaborados con bloques de concreto de 0,20 m de altura, para delimitar y separar cada uno de los tratamientos y de las repeticiones. Cada marco representó una unidad experimental y la distancia entre cada una de ellas fue de 0,50 m. Además, se aseguró una cama de biomasa de 0,15 m dentro de cada marco.
Para el proceso de fermentación, se mezclaron 490 kg en fresco de cada uno de los sustratos con los ingredientes descritos en la Tabla1, una vez mezclado se separaron 4 partes iguales de 122,5 kg (esto representó las réplicas de cada sustrato). Luego sedepositaron en los marcos y se procedió a realizar el proceso de fermentación sobre piso de concreto desinfectado y provisto de sombra. Con el fin de mantener una adecuada distribución del oxígeno y humedad en el sistema, cada 6 horas se volteó el material en los marcos durante las 36 horas que duró el proceso de fermentación(Pastrana 1996, Moyano 2014).
Variables evaluadas
Antes de iniciar el proceso fermentativo, se tomaron 3 muestras de cada sustrato para determinar la composición química inicial.Una vez iniciado el proceso, se tomaron 3 muestras de cada réplica a las 0, 24 y 36 horas de fermentación (Cárdenas et al. 2008),a las que se les determinaron las variables de composición química, el pH y la temperatura.
Composición química
Para todas las muestras, se determinóel contenido de materia seca en una estufa a 105°C, la concentración de proteína cruda y las cenizas por el método Kjeldahl (AOAC 2002). La fibra detergente neutro (FDN), la fibra detergente ácido (FDA) y la lignina se analizaron con el método descrito por Van Soestet al. (1991). La hemicelulosa, celulosa y lignina se determinaron con la metodología descrita por Van Soest y Robertson (1985).
Diseño experimental
Se utilizó un diseño completamente al azar, con 3 sustratos (pastotaiwán, sorgo negro forrajero o cáscara de piña) y 4 réplicas por tratamiento.
Modelo estadístico
El diseño utilizado fue
Y = μ + S + E
Donde:
Y =a respuesta en el sustrato,
μ = a media poblacional de la variable respuesta,
S = a efecto del sustrato,
E = a error experimental.
Análisis estadístico
Se realizó un análisis de varianza y separación de medias con la prueba de rangos múltiples de Tukey, mediante el comando PROC GLM del software StatiticalAnalisysSystem (SAS, versión 9.1 2004).
RESULTADOS Y DISCUSIÓN
Composición química de los sustratos durante el proceso de fermentación
Temperatura y pH de fermentación de los sustratos
Las temperaturas y pH alcanzados en los distintos sustratos durante las 36 horas de fermentación se presentan en la Tabla3.En relación con la temperatura, se encontraron diferencias estadísticas significativas (p<0,05) entre sustratos para los diferentes tiempos de fermentación. A las 0 horas, el pasto taiwán presentó la temperatura más alta, y a las 24 horas de fermentación, la cáscara de piña alcanzó el punto máximo con una temperatura de 42,5°C.
Tabla 3. Temperaturas y pH alcanzados para los diferentes sustratos a los diferentes tiempos (horas) de fermentación.
| Tiempo, h | Pasto taiwán | Sorgo negro forrajero | Cáscara de piña | ||||
| °C | pH | °C | pH | °C | pH | ||
| 0 | 21,3a | 6,16b | 17,0b | 6,09b | 17,8b | 4,28a | |
| 6 | 20,8a | 5,87b | 15,8c | 5,99b | 17,3b | 4,37a | |
| 12 | 29,5a | 4,72a | 15,8c | 5,49b | 21,3b | 4,39a | |
| 18 | 27,8a | 4,73a | 14,5c | 5,24b | 25,3b | 4,34a | |
| 24 | 26,3b | 4,84a | 16,8c | 5,01b | 42,5a | 4,69a | |
| 30 | 26,3b | 4,87a | 15,5c | 4,93a | 33,5a | 6,05b | |
| 36 | 25,5a | 4,93a | 14,3b | 4,81a | 26,5a | 7,71b | |
| abc Letras diferentes para la misma variable en una misma fila indican diferencia significativa (p<0,05). | |||||||
Cárdenas et al. (2008) no encontraron diferencias significativas en temperaturas al fermentar por24 horas bagacillo de caña con 0 o 20% de pulidura de arroz. Dichas personas autoras reportan temperaturas similares a las medidas en este estudio con la cáscara de piña y mayores que las obtenidas en el pasto taiwán y el sorgo negro forrajero.
La temperatura para los 3 sustratos osciló entre 14,3 y 42,5°C. Las temperaturas máximas se obtuvierona las 12 horas con el pasto taiwán y a las 24 horas con la cáscara de piña. Para el sorgo negro forrajero, la temperatura no sobrepasó los 17,0°C en ningún momento.
Alcanzar el punto máximo a las 12 horas, con el pasto taiwán, sugiere que el sustrato no aportó suficientes carbohidratos disponibles para una sincronización con el nitrógeno no proteico, probablemente, debido a que, en la edad de cosecha utilizada en este ensayo (120 días), hay poco contenido celular y mayor pared celular, lo que limita la degradación del material.
Con el sorgo negro forrajero no hubo aumento de temperatura y osciló en un rango de 14 a 18°C, esto podría deberse al alto contenido de humedad y, posiblemente, al bajo contenido de carbohidratos fácilmente disponibles.
Las temperaturas más altas se registraron al utilizar la cáscara de piña como sustrato, ya que brinda un mayor aporte de carbohidratos de fácil fermentación comparada con los otros 2sustratos. Estos son aprovechados de manera más eficiente por los microorganismos durante la fermentación y se genera una mayor producción de biomasa microbial, lo que deriva en generación de calor metabólico y en el aumento de la temperatura (Rodríguez et al. 2001). Además, la consistencia de la cáscara de piña hace que el volteo y la aireación sean menos efectivos para remover el calor.
Aranda et al. (2012) utilizaron tallos limpios de caña de azúcar molidos para realizar un proceso de FES con Vitafert como inóculo y la mayor temperatura de fermentación (45°C) la obtuvieron a las 24 horas, luego disminuyó y a las 48 horas se estabilizó. Blandino y Pineda (2015) también utilizaron tallos limpios de caña de azúcar picados y obtuvieron la temperatura más alta de 38,8°C a las 28 horas de fermentación, luego bajó y se mantuvo constante.
Rodríguez et al. (2006) fermentaron mezclas de caña y camote(50:50) y obtuvieron valores de 25°C a las 0 horas y 40°C a las 24 y 48 horas; valores similares a los obtenidos en el presente estudio, cuando se utilizó cáscara de piña como sustrato. Esto pudiera deberse al uso del camote como fuente amilácea, que genera un efecto similar al producido cuando se utiliza cáscara de piña.Por su parte, Monroy et al. (2006) al fermentar caña con diferentes niveles de inclusión de melaza o pulidura de arroz, obtuvieron valores entre 27,4 a 29,9°C a las 24 horas en los diferentes tratamientos.
Los valores registrados en este estudioexcepto el sorgo negro forrajero,concuerdan con los resultados obtenidos en diversos experimentosde Lezcano y Elías 1992, Lezcano y Martí 1997, Rodríguez et al. 2006),en los que se reportan que el rango óptimo de temperatura para que los microorganismos presenten una alta actividad metabólica y se produzca una fermentación eficiente debe ser entre 30 a 34°C. También, Rodríguez et al. (2006) mencionan que una temperatura menor a 40°C favorece el metabolismo de las bacterias ácido lácticas y de las levaduras, microorganismos necesarios para el proceso fermentativo.
A temperaturas mayores a los 40°C, los microorganismos podrían entrar en estrés térmico y provocar la activación de mecanismos de defensa que pueden disminuir o detener su actividad. Además, sus requerimientos nutricionales se ven afectados y son superiores a temperaturas más altas, debido a inactivación de ciertas enzimas, lo que hace que no puedan sintetizar ciertos metabolitos esenciales para su desarrollo (Rodríguez et al. 2006). También, se podría considerar que haya reducción del valor nutritivo de los sustratos si son sometidos a altas temperaturas por un tiempo prolongado, ya que puede ocurrir la reacción de Maillard, que disminuye la biodisponibilidad de aminoácidos esenciales (Pastoriza 2013).
El incremento en la temperatura se debe a la acumulación de calor como resultado de la alta actividad metabólica de los microorganismos, sobre todo en las zonas internas del sustrato (Pastrana 1996, Rodríguez et al. 2006, Aranda et al. 2012). Esto se ve favorecido por la baja conductividad térmica de los materiales biológicos, el poco contenido de humedad en los sustratos y el desarrollo de microorganismos termófilos,además, se regula por medio de la aireación y el volteo. Cabe destacar que, a una mayor altura de la capa, mayor es la capacidad de aislamiento térmico, lo que impide la disipación del calor metabólico generado y la temperatura es superior (Rodríguez et al. 2006).
pH de fermentación de los sustratos
Los valores de pH obtenidos durante el proceso de fermentación de los sustratos se presentan en la Tabla3. Se encontraron diferencias estadísticamente significativas (p<0,05) para los diferentes sustratos a las diversas horas de fermentación.
Con el pasto taiwán como sustrato, el pH inicial promedio fue de 6,16 y tuvo un descenso abrupto a las 12 horas de fermentación (mismo tiempo en que se registró la máxima temperatura), donde alcanzó un valor promedio de 4,72. Aumentó de forma leve y mantenida hasta las 36 horas con un valor promedio de 4,93. El pH, al utilizar sorgo negro forrajero como sustrato, disminuyó de forma lenta y progresiva a lo largo de todo el proceso fermentativo, con un valor inicial de 6,09;5,01 a las 24 horas y 4,81 al finalizar el tiempo de fermentación.
Resultados similarespresentaronElías et al. (2001),quienes obtuvieron un pH promedio de 4,43 en 24 horas de fermentación, a nivel de laboratorio, con caña solao adicionada con maíz, soya o ambas; además,no obtuvieron diferencias significativas en la caña sola con o sin inóculo.Elías et al. (1990) obtuvieron valores de pH que fluctuaron entre 3,50 y 4,50 en caña mezclada con urea. Por su parte,Cárdenas et al. (2008),al utilizar caña de azúcar con pulidura de arroz, presentaron valores entre 3,8 y 4,7 y Monroy et al. (2006) entre 4,60 a 5,00. Las personas autoras indicaron que la pulidura de arroz tiende a incrementar el pH, debido a que disminuye las cantidades producidas de ácido láctico y acético.
Asimismo, Díaz-Plascencia (2006) realizó la fermentación sobre mezclas de manzana de desecho molida en incubadoras con temperaturas controladas y, a las 24 horas de iniciado el proceso, el pH se encontraba entre 4,40 y 4,60a 36°C. Mientras que Moyano (2014) efectuó FES de papa a temperaturas entre 20 y 30°C por 24 y 48 horas, por lo queobtuvieron un valor inicial de 5,70quedisminuyó a 4,70 y 4,40, respectivamente. También, Peñafiel et al. (2015) utilizaron una mezcla 50:50 de cáscara de maracuyá y banano maduro entero con adición de melaza, yogurt natural y diferentes niveles de suero láctico (0, 5, 10 y 15%) para el proceso de fermentación a nivel de laboratorio y obtuvieron un pH inicial de 5,28 y de 4,30 a las 36 horas.
Por último, Ramos et al. (2006) realizaronprocesos de FES, a nivel de laboratorio, con tallos limpios de caña de azúcar y diferentes niveles de inclusión de varias fuentes energéticas (maíz, sorgo, pulpa de cítricos y pulidura de arroz) y obtuvieron un valor promedio de pH de 5,80 a las 24 horas de fermentación. Ramos et al. (2007), al fermentar a nivel de laboratorio sacchasorgo (caña de azúcar con sorgo) y sacchapulido (caña de azúcar con pulido de arroz) con diferentes cantidades de melaza, tuvieron un promedio de 5,20 a 24 horas, datos ligeramente mayores a los generados en el presente estudio al mismo tiempo de fermentación.
El descenso que normalmente se observa en el pH se puede debera volatilización del nitrógeno amoniacal por el calor generado o a una menor concentración de amoniaco (NH3) en la mezcla, debido a una incorporación más eficiente a las células durante la síntesis proteica (Ramos et al. 2006). Moyano (2014) indica que el nitrógeno amoniacal disminuyó tanto a las 24 como a las 48 horas, a medida que aumentó la temperatura, atribuido a una mayor utilización por parte de los microorganismos a temperaturas más altas, lo que generó el descenso en el pH. Sin embargo, Rodríguez et al. (2001)sugieren que este proceso es más lento que el proceso de hidrólisis, por lo que normalmente hay excedentes de NH3.
Las variaciones de pH están relacionadas con la temperatura (presencia de distintos tipos de levaduras y bacterias), las concentraciones de urea y otras fuentes nitrogenadas utilizadas (Díaz 2006) y la cantidad de ácidos grasos volátiles generados (Moyano 2014, Peñafiel et al. 2015).
La cáscara de piña presentó un comportamiento inverso, con un pH inicial promedio de 4,28que aumentó considerablemente al final del proceso de fermentación,al alcanzar un valor de 7,71 al finalizar el proceso. Resultados similares obtuvieron Aranda et al. (2012) al fermentar tallos limpios de caña de azúcar molidos utilizando un inóculo, donde el pH se incrementó a mayor tiempo de fermentación, inició en 4,91, aumentó a 5,95 a las 24 horas y finalizó en 7,39 a las 48 horas.
Blandino y Pineda (2015) al preparar saccharinaobtuvieron un valor inicial de pH de 5,77,que luego ascendió a 6,90 en 4 horas;posteriormente, decreció hasta 5,63 a las 24 horas y luego subió a 8,70 a las 36 horas. También, Elíaset al. (2009),al realizar FES de caña de azúcar con harina de granos de canavalia por 24 horas, reportaron un pH de 8,40 y de 4,30 para el tratamiento control, donde atribuyen este aumento tan marcadoa la presencia de ureasa en el grano de canavalia, que provoca mayor liberación de amoniaco al hidrolizar la urea.
Además, Rodríguez et al. (2001) y Rodríguez et al. (2006) fermentaron mezclas 50:50 de caña de azúcar y camote a nivel de laboratorio. Ambos documentos coinciden en que, conforme avanza el tiempo de fermentación, se duplica la producción de amoniaco, pues obtuvieron valores de pH de 6,00 y 5,91 a las 0 horas, 7,17 y 5,56 a las 48 horas y, por último, 7,90 y 7,11 a las 96 horas, respectivamente.
El incremento del pHse debe a un aumento en la concentración de amoniaco que supera la producción de ácidos orgánicos por parte de los microorganismos, debido a la hidrólisis de la urea, por medio de la ureasa generada por la actividad de bacterias ureolíticas, que liberan y utilizan el nitrógeno amoniacal como fuente proteica para su desarrollo, el cual es aprovechado también por otras bacterias no ureolíticas (Elías et al. 2001, Ramos et al. 2006, Elías et al. 2009, Aranda et al. 2012). Además, los ácidos grasos volátiles (acético, butírico, láctico y propiónico) generados son incorporados en el protoplasma de los microorganismos como cadenas carbonadas de aminoácidos sintetizados durante el crecimiento microbial (Rodríguez et al. 2001) y también son generados en concentraciones muy bajas, lo que no permite contrarrestar el pH (a través de formación de sales orgánicas) del NH3, que es una base más fuerte (Rodríguez et al. 2001, Sánchez et al. 2007). También un alto contenido de cenizas podría actuar como buffer (Ramos et al. 2006, Ramos et al. 2007).
El comportamiento del pH al utilizar cáscara de piña se puede deber a que al inicio del proceso ya era ácido, lo que podría cambiar la microflora que se genera en las primeras horas de fermentación. Además, es un material con mayor cantidad de azúcares disponibles que el pasto taiwán y el sorgo negro forrajero, por lo que la síntesis celular de los microorganismos es más eficiente, pues consumióuna mayor cantidad de carbohidratos y nitrógeno amoniacal y de forma más rápida durante las primeras 24 horas de fermentación. Luego de este punto, se han consumido la mayoría de carbohidratos, lo cual disminuye la actividad microbial, que a su vez provoca una disminución en la producción de ácidos orgánicos, una mayor liberación de ureasa y un subsecuente aumento en laconcentración de amoniaco (Ramos et al. 2006, Moyano 2014).
El incremento en el pH también se ve afectado por el nivel de inclusión de urea. Elías et al. (1990) utilizaron niveles crecientes de urea en FES de caña y observaron que los tratamientos con mayor porcentaje de urea tenían concentraciones de amoniaco y pH mayores. Rodríguez et al. (2001) también utilizaron niveles crecientes de urea en la FES de caña de azúcar con camote y obtuvieron las mismas conclusiones.
En términos generales, el pH en el presente estudio se mantuvo entre intervalos de 4 a 6, que está dentro del rango adecuado para el crecimiento de los microorganismos en procesos fermentativos, esto concuerda conElías et al. (1990) y Sánchez et al. (2007), quienes proponen rangos entre 3,5 a 6,0 y entre 3,0 a 7,0, respectivamente. Cabe destacar que con un pH muy bajo (menor a 3) el cambio en la membrana celular afecta la entrada de los nutrientes a las células y el rendimiento de producción de biomasa disminuye (Sánchez et al. 2007).
Composición química de los sustratos fermentados
Concentración de materia seca y proteína cruda
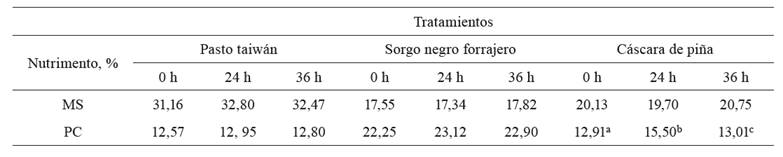
Las concentraciones de MS y PC obtenidas con los distintos sustratos, durante 36 horas de fermentación, se presentan en la Tabla4. Para el caso de MS, no se encontraron diferencias significativas (p>0,05) entre tratamientos a las distintas horas de fermentación.
Tabla 4. Valores obtenidos de los componentes intracelulares en los 3 sustratos inoculados durante el proceso de fermentación.
Resultados similares obtuvieron Elías et al. (2001),quienes, al utilizar caña de azúcar sola o con inóculo a nivel de laboratorio por 24 horas de fermentación, no encontraron diferencias significativas en la concentración de MS (32,53% y 31,69%, respectivamente). Por su parte, Aranda et al. (2012), al fermentar tallos de caña de azúcar utilizando un inóculo denominado Vitafert, no reportaron diferencias entre la MS inicial (32,42%) y a 48 horas (33,54%); sin embargo, a las 72 y 96 horas de fermentación síhubo un aumento significativo (37,76 y 44,89%, respectivamente).
Díaz-Plascencia (2006) realizó una fermentación sobre mezclas de manzana de desecho en incubadoras con temperaturas controladas de 28 y 36°C, y la pérdida de humedad durante la fermentación fue constante a lo largo del proceso. Esto concuerda con Peñafiel et al. (2015), quienes, al utilizar una mezcla de banano y maracuyá obtuvieron valores promedio de MS de 73,65% a las 0 horas y 78,22% a las 36 horas. Asimismo, Moyano (2014), que al efectuar FES de papa a temperaturas entre 20 y 30°C, obtuvo una MS inicial de 17,70% y MS final promedio de 32,40% y 25,00% a 24 y 48 horas, respectivamente.
Con respecto a la concentración de PC, solamente se encontraron diferencias significativas (p<0,05) para la cáscara de piña, que pasó de 40,48% a las 0 h de fermentación a 43,40 a las 24 h y a 33,43 a las 36 h de fermentación.
La concentración máxima de PC,en general, se alcanzó a las 24 horas y disminuyó a las 36 horas. Esto concuerda con lo propuesto porDíaz-Plascencia (2006),quien menciona que 24 horas de fermentación es tiempo suficiente para lograr la máxima síntesis proteica con un pH de 4,4 a 4,6 y temperaturas entre 35 y 36°C.
El incremento hallado en la concentración de proteína en la cáscara de piña puede atribuirse a que se mantuvo un pH dentro de un rango adecuado para el crecimiento de los microorganismos, estos a su vez, hacen uso de la energía disponible en forma de carbohidratos solubles que la cáscara proporciona, utilizada para la retención de amoniaco y, posterior, conversión de NNP en nitrógeno proteico a través de procesos físico-biológicos (Valiño et al. 1994).
Diversos estudios demuestran el aumento en la PC con el transcurso del tiempo durante los procesos de fermentación.Aranda et al. (2012), al fermentar tallos de caña de azúcar con Vitafert, obtuvieron incrementos a las 24 horas desde 2 hasta 5% en el contenido de PC,con respecto a la hora 0, con valores que fluctuaron cerca de 16 a 22% PC. Resultados similares obtuvieron Elías et al. (2001) con los mismos ingredientes y al mismo tiempo de fermentación, pero a nivel de laboratorio (17,22% PC).
También se reportan incrementos proteicos, luego de procesos de FES,al utilizar como sustratos otros materiales distintos a la caña de azúcar, que también son limitantes en proteína y con buen aporte de carbohidratos solubles. Gómez-Garzaet al. (2000) fermentaron desechos de garbanzo yobtuvieron incrementos en PC (22,50% a 25,60%); asimismo,Díaz-Plascencia (2006) fermentó mezclas de manzana de desecho con distintos niveles de urea y harina de soya y obtuvo valores promedio de 42,90% y 46,90% PC a 36°C, y de 61,90% y 69,80% PC a 28°C, ambos a 240 horas de fermentación. Estos resultados son mayores a los reportados en la presente investigación al utilizar cáscara de piña como sustrato, que tiene características similares a la manzana; sin embargo, cabe destacar que dicho estudio se llevó a cabo en incubadoras con temperatura y aireación controlada y por un tiempo de fermentación más prolongado, lo que permite una mayor síntesis de biomasa microbial.
El aumento en la concentración de PC que se ha encontrado en otros estudios se debe ala síntesis de proteína microbialdurante el proceso fermentativo, en donde la microbiota del sustrato y del inóculo desdoblan la urea en amoniaco y transforman el nitrógeno no proteico (NNP) en nitrógeno proteico (NP), pues se incorpora parcialmente al protoplasma celular (Elías et al. 2001, Rodríguez et al. 2006, Aranda et al. 2012); esto es demostrado mediante conteos de levaduras y otras especies microbianas.
Rodríguez et al. (2001) encontraron que las levaduras aumentaron significativamente con el tiempo hasta las 96 horas, ahí alcanzan el punto máximo y luego disminuyen.Además, cuando hay una mayor disponibilidad de NNP se favorece el crecimiento de levaduras, lo que aumenta el contenido de PC (Díaz-Plascencia 2006). Cabe destacar que a las levaduras se les adjudica la actividad ureolítica para aportar amoniaco a la síntesis proteica, mientras que las bacterias actúan sobre la pared celular de las levaduras y producen lisis de estas (Vivas y Carvajal 2004).
Durante este proceso los microorganismos requieren tanto de fuentes de nitrógeno como de carbohidratos solubles para convertir de manera eficiente, a través de reacciones metabólicas, el NNP en NP y generar el aumento de la biomasa microbial (Moyano 2014), es por esto que si hay algún limitante de estos nutrientes se puede afectar la síntesis proteica.
Además, del aumento proteico por la síntesis de biomasa microbiana, los remanentes de NH3,producto de la ureólisis, pueden volatilizarse o pueden quedar retenidos en el producto final según el pH y la temperatura (Ramos et al. 2006, Aranda et al. 2012); esto podría explicar los altos valores de PC obtenidos al utilizar sorgo negroforrajero (35 a 39%) y cáscara de piña (36 a 44%). La alta humedad y la textura de estos sustratos provocaron que menores cantidades de amoniaco se volatilizaran y más bien se retuvo con mayor facilidad en el producto final. Elías et al. (2001) yMoyano (2014) mencionan que el aporte de la urea puede alcanzar casi el 50% del valor final de la PC y hasta un 60% del NNP de la urea podría convertirse en PV.También, en el presente estudio, luego de 24 horas de fermentación, los valores de PC decrecieron en la cáscara de piña.
Componentes de la pared celular y cenizas
La concentración de los diferentes componentes de la pared celular y la concentración de cenizas en los diferentes sustratos se puede apreciar en la Tabla 5. No se encontraron diferencias significativas (p>0,05) para ningún sustrato a las distintas horas de fermentación.
Tabla 5. Valores obtenidos de los componentes intracelulares en los 3 sustratos inoculados durante el proceso de fermentación.
| - | Tratamientos | ||||||||
| - | Pasto taiwán | Sorgo negro forrajero | Cáscara de piña | ||||||
| Nutrimento, % | 0 h | 24 h | 36 h | 0 h | 24 h | 36 h | 0 h | 24 h | 36 h |
| FDN | 67,00 | 68,60 | 67,86 | 52,04 | 55,95 | 55,54 | 53,37 | 55,51 | 56,82 |
| FDA | 51,38 | 51,66 | 52,75 | 40,58 | 42,92 | 42,29 | 27,10 | 28,99 | 30,23 |
| Cenizas | 14,54 | 15,07 | 15,25 | 14,38 | 15,15 | 13,96 | ds | 8,75 | 8,70 |
Pese a que en el presente estudio no se observaron diferencias en los componentes de la pared celular al aumentar el tiempo de fermentación, otros estudios reportan incrementos que se atribuyen a quelos microorganismos utilizan primero los azúcares que se encuentran disponibles en el contenido celular para la síntesis proteica y quedan los carbohidratos más complejos, como almidón, celulosa y hemicelulosa, que requieren de acción enzimática para volverlas azúcares simples; esto hace que el contenido celular se reduzca mientras que las paredes celulares se concentren e incrementen (Rodríguez et al. 2001, Rodríguez et al. 2006, Aranda et al. 2012, Moyano 2014).
Elías et al. (2001) indican que, si hay un aumento en los valores de fibra, la PC y la digestibilidad del material podrían disminuir y afectar la calidad nutricional final del producto, lo que podría limitar su uso en la alimentación de rumiantes.
Con respecto a las cenizas, no se encontraron diferencias significativas (p>0,05) con ningún sustrato entre tratamientos ni a las distintas horas de fermentación. Cabe destacar que microelementos como el fósforo y el azufre, además, de elementos traza y vitaminas del complejo B, son importantes para el metabolismo y crecimiento de los microorganismos durante los procesos de FES (Moyano 2014) y por eso su inclusión en las mezclas.