Introducción
La producción de banano del subgrupo Cavendish es afectada severamente por varias especies de nematodos que parasitan sus raíces. El nematodo barrenador Radopholus similis es el que provoca el mayor daño en producción (Román 1978, Marín et ál. 1998a, Araya y De Waele 2004, Gowen et ál. 2005, Quénéhervé 2009). Las pérdidas económicas provocadas por este nematodo a nivel mundial se estiman en 20% (Marín et ál. 1998b, Sarah 2000), pero en condiciones locales se han detectado pérdidas de 40 a 50% (Murray 1980, Araya 1995).
Actualmente, la única alternativa rentable es la aplicación de nematicidas no fumigantes sobre la superficie del suelo (Araya 2004b), sin embargo, se conoce sus efectos adversos sobre el ambiente y los trabajadores si se utilizan inadecuadamente. Por lo anterior, es necesaria la búsqueda de opciones más amigables con el ambiente que combatan los nematodos y mantengan la productividad de las fincas.
Dentro de las alternativas biológicas para el combate de nematodos, destacan los hongos Trichoderma spp., y Paecilomyces lilacinus.Los hongos del género Trichoderma spp., se han utilizado como biocontroladores de patógenos de plantas. Spiegel y Chet (1998), Sharon et ál. (2001), Siddiqui y Shaukat (2004), Suarez et ál. (2004), Eapen et ál. (2005), Pérez et ál. (2006) y Affokpon et ál. 2011 indican que este hongo tiene propiedades nematicidas.
Sikora y Pocasangre (2004) aislaron cepas de Trichoderma de raíces de banano y mediante evaluaciones en vivero (Pocasangre et ál. 2006) y en condiciones de campo (Menjivar 2005), determinaron que tiene potencial para el combate de R. similis. Este hongo combate nematodos por medio de parasitismo de huevos y larvas al aumentar la actividad de la quitinasa y proteasa (Sharon et ál. 2001, Suárez et ál. 2004, Sahebani y Hadavi 2008) y por la inducción de mecanismos de defensa de la planta que conducen a la resistencia sistémica adquirida (Sahebani y Hadavi 2008).
Paecilomyces lilacinus parasita huevos, juveniles y hembras de nematodos (Kunert et ál. 1987, Dackman et ál. 1989, Park et ál. 2004, Schenck 2004). Desde los estudios de Jatala et ál. (1979) a la fecha (Kiewnick et ál. 2011, Kiewnick y Sikora 2006a y b; Schenck 2004, Romero y Trabanino 2006, Mendoza y Sikora 2009) se ha demostrado el potencial de P. lilacinus para combatir varias especies de nematodos en varios cultivos alrededor del mundo.
En experimentos realizados en Filipinas con nematicida biológico a base del hongo Paecilomyces lilacinus cepa 251se redujeron las poblaciones de R. similis en áreas de renovación sembradas con plantas in vitro (Philip 2005) y en plantaciones comerciales de banano con varios años de establecidas (Luth et ál. 2006, Philip 2007a y b).
Otra opción más amigable con el ambiente que la aplicación de nematicidas sobre la superficie del suelo, es la inyección del nematicida en el pseudotallo. En cítricos y uvas la inyección de oxamil y fenamiphos en el tallo redujeron las poblaciones de Pratylenchus vulnus y P. penetrans (Viglierchio et ál. 1977). Experimentos realizados en plantaciones de banano en Australia (Pattison et ál. 2001, Pattison y Cobon 2003) y en Costa Rica (Araya 1999, Araya 2004a), indican que la inyección de oxamil tiene potencial para el combate de nematodos.
De los nematicidas aprobados para uso en banano en nuestro país, sólo el oxamil (Tyree et ál. 1979, Figueroa y Shillingford 1984, Mugnier 1988) y fenamiphos (Van Gundy y McKenry 1977, McKenry 1981, McKenry 1994) tienen movimiento apoplástico y simplástico, por lo tanto, se podrían inyectar o depositar en el pseudotallo de plantas de banano. No obstante, por el momento en Costa Rica el oxamil es el único autorizado para aplicarse de esta forma. Además, como su formulación es líquida se facilita realizar la labor.
El objetivo de esta investigación fue evaluar el efecto de Trichoderma spp., Paecilomyces lilacinus y la inyección de oxamil en el pseudotallo en el combate de nematodos y la producción de banano (Musa AAA).
Materiales y métodos
Localización del experimento y periodo experimental. El experimento se realizó en una plantación comercial de banano localizada en la Costa Caribe de Costa Rica a 20 msnm.
La plantación se ubica en el cantón de Matina a una latitud norte de 10°11'97" y una longitud oeste de 83°34'50" y tenía más de 10 años de sembrada con el cultivar Grande Naine. El periodo experimental fue de febrero del 2009 a octubre del 2010. Durante este periodo se registró en la estación meteorológica del mismo cantón una precipitación total de 5925 mm, con una media mensual de 282,1 mm, con mínimas y máximas de 39,4 y 652,2 mm por mes, respectivamente. La temperatura ambiental media fue de 25,25°C, con una temperatura mínima promedio de 22,35°C y máxima promedio de 29,54°C. La humedad relativa promedio fue de 92,3%. La temperatura del suelo a 15 cm de profundidad fluctuó de 24 a 28°C durante el periodo de evaluación.
Tipo de suelo. Antes de establecer el experimento se realizó un muestreo de suelos en las diferentes secciones del cable (denominadas boquetes), las cuales se seleccionaron por su aptitud para el cultivo del banano de acuerdo con lo indicado por Jaramillo y Vásquez (1990). El experimento se estableció en un suelo franco arcillo limoso, clasificado como de clase II para el cultivo del banano. Este suelo tenía un pH de 5,69, un contenido de Ca, Mg y K de 24,3; 7,2 y 0,91 cmol(+).l-1, respectivamente, y una acidez extractable de 0,73 cmol(+).l-1.
Tratamientos. Se evaluaron los siguientes tratamientos: 1) Testigo sin aplicación, 2) Paecilomyces lilacinus cepa UNA, 3) Trichoderma asperellum cepa PB17, 4) Trichoderma spp., endófita B23, 5) Inyección de oxamil en el pseudotallo y 6) Rotación de nematicidas químicos. Las cepas o aislamientos de hongos utilizados se seleccionaron en un experimento de vivero (Vargas et ál. 2010).
Procedencia de los hongos. La cepa PB17 de Trichoderma asperellum la suministró el Laboratorio Plantisana Vegetal a través del Dr. Miguel Obregón. Esta cepa se aisló de muestras de suelo. El aislamiento B23 de Trichoderma sp., lo facilitó el Laboratorio de Fitopatología de CORBANA y se aisló de raíces de banano (Aguilar 2002), por lo que es endofítico. La cepa UNA de P. lilacinus la facilitó la sección de Nematología de CORBANA y se aisló de una muestra de suelo. Los hongos se reprodujeron en arroz y se usó la metodología descrita por Salas et ál. (2008).
Aplicación de los tratamientos. En febrero del 2009 se realizó una aplicación generalizada de 3 g i.a. de Furadan 10G (carbofuran, FMC Corporation) por unidad de producción en toda el área experimental. Lo anterior con la finalidad de disminuir el inóculo de nematodos en las raíces. La aplicación de los tratamientos inició en marzo del 2009.
Los tratamientos 2, 3 y 4 se aplicaron disueltos en agua, sobre la superficie del suelo. Dicha aplicación se realizó en un semicírculo de 0-30 cm al frente del hijo de sucesión. La aplicación se realizó cada mes (Cuadro 1) y se hizo con una bomba dosificadora de espalda Carpi de 16L. Se usó una solución de 100 ml, compuesta por la cepa del hongo, 0,5 ml.l-1 de Tween(r) 20 al 0,05% y agua. El inóculo de los hongos se uniformizó para utilizar en cada aplicación 1 * 109 ufc.ml-1 de cada cepa.
El tratamiento 5 se inyectó en el pseudotallo cada 3 meses (Cuadro 1). Se inyectó 1,2 g de oxamil, DuPont sin diluir, que equivale a 5 ml de producto comercial, en las plantas que conformaban la unidad de producción y tenían más de 120 cm de altura, con excepción de aquellas que presentaban inflorescencia o se encontraban cosechadas. La inyección se hizo a 30 cm de la superficie del suelo, con una pistola dosificadora manual "Spot-Gun" con varilla inyectable. En los hijos con una altura entre 60 y 119 cm, con el mismo equipo, se depositó 0,6 g i.a. de oxamil sin diluir, que equivale a 2,5 ml de producto comercial, en la vaina foliar de la cuarta hoja (contadas de arriba hacia abajo).
Cuadro 1: Frecuencia de aplicación de los tratamientos evaluados para el combate de Radopholus similis en una plantación comercial de banano (Musa AAA) cv. Grande Naine.
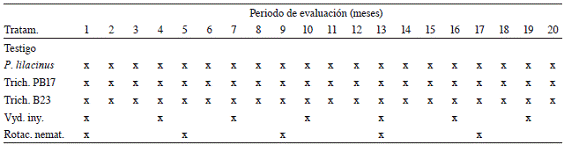
Rotac. nemat.=rotación de nematicidas químicos aplicados sobre la superficie del suelo al frente del hijo de sucesión Nota: Mes 1 corresponde a marzo del 2009. Mes 20 corresponde a octubre del 2010. X= mes en que se aplicó cada tratamiento. Vyd. iny.= Inyección de oxamil en el pseudotallo.
El tratamiento 6 (rotación nematicidas químicos) consistió en alternar las moléculas nematicidas aplicadas sobre la superficie del suelo para prevenir su biodegradación (Moens et ál. 2004). Las moléculas aprobadas para uso en banano se aplicaron cada 4 meses (Cuadro 1), el orden de aplicación y la dosis usada de cada producto fue la siguiente: a) 3 g i.a. Counter(r) 15 GR (terbufos, AMVAC), b) 3 g i.a. Mocap(r) 15 GR (ethoprop, AMVAC), c) 2,4 g i.a. oxamil, DuPont, d) 3 g i.a. Nemacur(r) 15 GR (fenamiphos, AMVAC) y e) 2 g i.a. Rugby(r) 10 GR (cadusafos, FMC Corporation). La dosis de estos productos se distribuyó en un semicírculo de 0-30 cm al frente del hijo de sucesión. Los nematicidas granulados se aplicaron con una bomba dosificadora de espalda de tracción manual (Swissmex(r)). La aplicación de oxamil sobre la superficie del suelo se realizó con una pistola dosificadora manual "Spot-Gun", la cual tenía una boquilla de cono sólido.
Diseño experimental. El diseño experimental fue Bloques Completos al azar con 6 repeticiones por tratamiento. La unidad experimental consistió de una parcela con 75 a 85 unidades productivas de banano (Musa AAA) del cultivar Grande Naine.
Manejo agronómico de la plantación. La plantación tiene un sistema de siembra en tresbolillo, con una densidad promedio de 1700 plantas.ha-1. Además, cuenta con una red de drenajes primarios, secundarios y terciarios para evacuar los excesos de agua cuando se presentan altas precipitaciones. También existen drenajes denominados gavetas dentro de cada boquete. La deshija se realizó cada 8 semanas y se conformó la unidad de producción a madre, hijo y nieto. La apuntala se realizó en plantas de 1-8 días de florecidas y consistió en sujetar con doble cuerda de polipropileno la planta recién florecida a 2 plantas cercanas. El embolse se hizo a los 8 días de emergida la inflorescencia con fundas plásticas impregnadas con clorpirifos (Dursban(r)) o bifentrina (Biflex(r)). El desmane consistió en eliminar la primera mano donde se presentaron juntas las flores masculinas y femeninas (mano falsa), luego sobre ésta mano se eliminaron de 2 a 3 manos por racimo que depende del tamaño del mismo.
El combate de Sigatoka negra (Mycospaherella fijiensis) se realizó por medio de deshoja, despunte, deslaminado y mediante aspersiones foliares que se alternaron con fungicidas sistémicos y protectores en mezcla con agua y aceite agrícola. El combate de arvenses se realizó en forma manual por medio de chapia y se alternó cada 6 a 8 semanas con aplicaciones de glifosato. La fertilización se realizó cada 15-22 días, con aportes aproximados por año de 300-360 kg N, 50-90 P2O5, 400-500 kg K2O, 80-110 kg CaO, 70-100 kg MgO, 20-40 kg S, 5-10 kg Zn y de 1-4 kg B. Durante el periodo experimental se realizaron 2 aplicaciones por año de 500 g carbonato de calcio (CaCO3) por unidad de producción dirigido al frente del hijo de sucesión.
Muestreo de raíces, extracción y estimación del número de nematodos. Para evaluar el peso de raíces por planta y estimar las poblaciones de nematodos se realizaron muestreos de raíces. Se usó la metodología sugerida por la sección de Nematología de CORBANA, la cual se describe a continuación. Mensualmente se colectó una muestra compuesta por las raíces de 4 plantas en cada repetición (parcela). El muestreo se realizó con un palín, con el cual se excavó un hoyo de 15 cm de largo, 15 cm de ancho y 30 cm de profundidad (6.750 cm3 de suelo) al frente del hijo de sucesión con una altura entre 1,2 a 2,0 m. Cada hijo de sucesión se muestreó sólo una vez.
Manualmente se colectaron las raíces y se colocaron en bolsas plásticas debidamente identificadas; luego se trasladaron al Laboratorio de Nematología de CORBANA para los análisis respectivos. Se cuantificó el peso fresco (g) de raíz total, raíz funcional y raíz no funcional. Luego se calculó el porcentaje de raíz funcional.
Posteriormente, se realizó la extracción de nematodos por el método de Taylor y Loegering (1953) a partir de 25 g de raíces funcionales. La suspensión de nematodos se pasó por una serie de tamices de 0,25/0,106/0,025 mm (Nº. 60/140/500) sobrepuestos de arriba hacia abajo, como se describe en Araya (2002). Se contó el número de Radopholus similis, Helicotylenchus spp. Meloidogyne spp., y Pratylenchus spp., y se expresó en nematodos por 100 g de raíces. Además, se consideró como nematodos totales a la suma de estos 4 géneros.
Evaluación de datos de producción. Las variables de producción se evaluaron en el campo cuando personal de la finca realizó la cosecha del área donde se ubicó el experimento. Estos datos se colectaron entre los 15 y 20 meses después de la primera aplicación de los tratamientos y se evaluaron 150 racimos por tratamiento.
La cosecha se realizó aproximadamente 90 días después de embolsados los racimos y se evaluó el peso del racimo con una romana electrónica Crane Scale de 100,0±0,1 kg. Además, se contó el número de manos por racimo y el número de frutos de la segunda mano basal de cada racimo. En el fruto central externo de la segunda mano se midió, con una cinta métrica plástica, la longitud externa (cm) que comprende desde de la unión del pedúnculo con el fruto hasta la prolongación de la pulpa, sin considerar el remanente floral. También en éste fruto se evaluó el diámetro (mm) con un calibrador Best Value(r) 150 mm, modelo H420225. Además, con una cinta métrica se evaluó la circunferencia (cm) de la planta madre a 1,0 m de altura y la altura del hijo (cm) al momento de la cosecha de la planta madre.
Análisis estadístico. El peso de raíces y número de nematodos se sometió a un análisis de varianza, con modelo de diseño de parcela dividida, para lo cual se consideraron los tratamientos como el factor A y las fechas de los muestreos como factor B. Además, se realizaron contrastes entre tratamientos y grupos de tratamientos. Previo al análisis, los datos de R. similis y nematodos totales se transformaron a Log10(x+1). Los datos de producción se sometieron a análisis de varianza y los tratamientos se compararon por contrastes. El análisis estadístico se realizó en el programa SAS, versión 9,1.
Resultados
En el primer muestreo de raíces realizado previo al inicio del experimento se detectaron en promedio 18 644 R. similis y 21 606 nematodos totales por 100 g de raíces. Por lo tanto, se realizó una aplicación generalizada de 30 g de Furadan 10GR en toda el área experimental para disminuir el inóculo de nematodos y favorecer el combate con los hongos aplicados.
No se detectaron diferencias en el peso de raíz total (p=0,0506) ni funcional (p=0,1237) entre las plantas aplicadas con los tratamientos evaluados (Cuadro 2). Las plantas inyectadas con oxamil y las aplicadas con nematicida sobre la superficie del suelo mostraron el mayor porcentaje de raíz funcional (p=0,0058) y el menor número de R. similis (p<0,0001) y nematodos totales (p<0,0001).
Cuadro 2: Peso fresco (g) por planta de raíz total, funcional y número de Radopholus similis y nematodos totales por 100 g de raíces funcionales en plantas de banano (Musa AAA) cv. Grande Naine infectadas con nematodos en una plantación comercial, según el tratamiento aplicado.
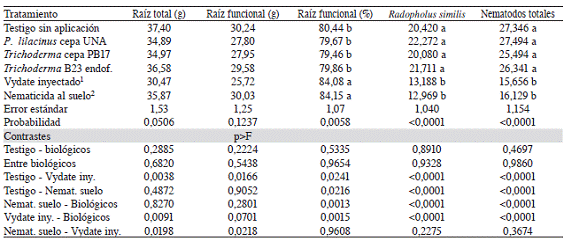
1/ Oxamil inyectado: se inyectó 5,0 ml de oxamil en el pseudotallo de plantas sin florecer cada 90 días. 2/ Nematicida al suelo: se alternó la aplicación de moléculas nematicidas sobre la superficie del suelo cada 120 días. Cada valor es la media + error estándar de 126 observaciones. Cada mes en cada repetición se colectó una muestra compuesta por las raíces de 4 plantas, luego se realizó la extracción y conteo de nematodos. Nematodos totales: suma de R. similis, Helicotylenchus spp., Meloidogyne spp., y Pratylenchus spp. Trichoderma B23 endof: aislamiento endófito. Letras distintas en las columnas indican diferencias significativas según prueba de T (p<0,05).
No se encontraron diferencias (p>0,2224) en el peso de raíces ni en el número de nematodos entre las plantas aplicadas con los productos biológicos y el testigo sin aplicación (Cuadro 2). Las cepas PB17 y B23 de Trichoderma redujeron solamente en 4 y 8%, respectivamente, el número de nematodos totales respecto al testigo, mientras que la cepa UNA de P. lilacinus presentó mayor número de nematodos totales que el testigo, pero sin diferir estadísticamente. Al comparar entre sí las cepas de hongos evaluadas, no se encontraron diferencias (p>0,6820) en ninguna de las variables.
Se encontró mayor (p=0,0241) porcentaje de raíz funcional y se disminuyó (p<0,0001) en 35% el número de R. similis y en 43% el de nematodos totales en las plantas inyectadas con oxamil respecto al testigo. Sin embargo, las plantas inyectadas con oxamil presentaron menor peso de raíz total (p=0,0038) y funcional (p=0,0166) respecto al testigo sin aplicación.
Las plantas aplicadas con la rotación de nematicidas sobre la superficie del suelo mostraron mayor (p=0,0216) porcentaje de raíz funcional y redujeron (p<0,0001) el número de R. similis en 36% y el de nematodos totales en 41% respecto al testigo. Sin embargo, el peso de raíz total y funcional entre estos tratamientos fue similar (p>0,4872).
Se detectó un porcentaje de raíz funcional (p=0,9608), número de R. similis (p=0,2275) y nematodos totales (p=0,3674) similar entre las plantas inyectadas con oxamil y las aplicadas con la rotación de nematicidas sobre la superficie del suelo. No obstante, las plantas aplicadas con la rotación de nematicidas sobre la superficie del suelo mostraron mayor peso de raíz total ( p=0,0198) y funcional (p=0,0218).
Las plantas inyectadas con oxamil y las aplicadas con la rotación de nematicidas sobre la superficie del suelo mostraron mayor (p<0,0015) porcentaje de raíz funcional y menor (p<0,0001) número de R. similis y nematodos totales que las plantas aplicadas con las cepas de hongos evaluadas.
Al analizar los datos de producción (Cuadro 3), las plantas aplicadas con los productos biológicos mostraron mayor peso del racimo (p=0,0375) y circunferencia de la madre (p=0,0402) que las plantas sin aplicación (testigo). Pero al comparar entre sí las plantas aplicadas con las cepas de hongos, no se encontraron diferencias en ninguna de las variables evaluadas (p>0,5838).
Cuadro 3: Variables de producción de plantas de banano (Musa AAA) cv. Grande Naine ubicadas en una plantación comercial, las cuales se aplicaron con productos biológicos y químicos para el combate de nematodos.
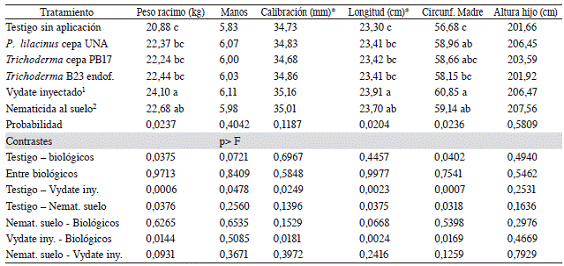
1/Oxamil inyectado: se inyectó 5,0 ml de oxamil en el pseudotallo de plantas sin florecer cada 90 días. 2/ Nematicida al suelo: se alternó la aplicación de moléculas nematicidas sobre la superficie del suelo cada 120 días. Los datos de producción se colectaron entre 15-20 meses después de la primera aplicación de los tratamientos. Se evaluaron de 150 a 200 racimos por tratamiento.*: Se evaluó el fruto central externo de la segunda mano apical. Circunf. Madre: Se evaluó a 1 m de altura. Trichoderma B23 endof: aislamiento endófito. Letras distintas en las columnas indican diferencias significativas según prueba de T (p<0,05).
Se detectó un aumento de 3,2 kg el peso del racimo (p=0,0006) y mayor número de manos (p=0,0478), calibración (p=0,0249), longitud (p=0,0023) del fruto y circunferencia de la madre (p=0,0007) en las plantas inyectadas con oxamil respecto a las plantas sin aplicación, pero no se detectaron diferencias entre las plantas aplicadas con estos tratamientos en la altura del hijo (p=0,2531).
Las plantas aplicadas con la rotación de nematicidas sobre la superficie del suelo aumentaron en 1,8 kg el peso del racimo (p=0,0006) y mostraron mayor longitud del fruto central de la segunda mano (p=0,0023) y circunferencia de la madre (p=0,0007) respecto a las plantas sin aplicación. No obstante, estos tratamientos mostraron similar número de manos (p=0,2560), calibración (p=0,1396) y altura del hijo (p=0,1636).
No se detectaron diferencias (p>0,0931) en ninguna de las variables de producción evaluadas entre las plantas inyectadas con oxamil y las aplicadas con la rotación de nematicidas sobre la superficie del suelo. Sin embargo, las plantas inyectadas con oxamil mostraron 1,4 kg más en el peso del racimo respecto a las aplicadas con nematicida sobre la superficie.
Las plantas inyectadas con oxamil aumentaron en 1,7 kg el peso del racimo (p=0,0144) y mostraron mayor calibración (p=0,0181) y longitud (p=0,0024) del fruto central de la segunda mano y mayor circunferencia de la madre (p=0,0169) respecto a las plantas aplicadas con productos biológicos. Sin embargo, no se detectaron diferencias entre las plantas aplicadas con estos tratamientos en el número de manos (p=0,5085) y en la altura del hijo (p=0,4669).
No se detectaron diferencias (p>0,1529) en ninguna de las variables evaluadas al comparar las plantas aplicadas con la rotación de nematicidas sobre la superficie del suelo y las aplicadas con productos biológicos.
Discusión
El nematodo barrenador R. similis, predominó en este experimento. En el testigo sin aplicación se detectaron en promedio 27 346 nematodos totales por 100 g de raíces y en general R. similis representó del 80 al 84% de la población en los diferentes tratamientos. Por lo anterior, se discute principalmente sobre este género, que es uno de los más difíciles de combatir por ser endoparásito migratorio (Stirling 1991). Estos resultados coinciden con la mayoría de reportes en plantaciones infestadas de nuestro país (Araya 1995, Araya et ál. 2002, Araya y De Waele 2004, Araya 2004a, Araya 2004b, Araya y Moens 2005, Araya et ál. 1995) los cuales indican que R. similis es el más frecuente y abundante.
La presencia de este nematodo se favoreció porque el área donde se estableció el experimento tenía más de 10 años de sembrada con el cultivar Grande Naine, el cual es susceptible (Moens y Araya 2002, Moens et ál. 2003). Además, la plantación se manejó como monocultivo en forma perenne. Como la unidad de producción en banano se conforma de una planta madre, un hijo y un nieto, R. similis y los otros nematodos se diseminaron de las plantas madre infestadas a las nuevas generaciones.
Además, se detectó 5925 mm de precipitación durante el periodo experimental, la cual se distribuyó en todos los meses. Lo anterior provocó que el suelo tuviera una adecuada humedad y temperatura (que fluctuó 24 y 28°C), lo cual es ideal para el desarrollo y reproducción de éste nematodo. Asimismo, el tipo de suelo donde se estableció el experimento fue adecuado para el crecimiento y desarrollo de la planta y del nematodo. Araya y De Waele (2002) indican que al ser R. similis endoparásito y completar todo el ciclo de vida en la raíz, el tipo de suelo no afecta el número de R. similis en las plantas.
No se logró combatir las poblaciones de nematodos en las plantas aplicadas con la cepa UNA de P. lilacinus, con las cepas PB17 y B23 de Trichoderma spp. Esto concuerda con Vargas y Araya (2005, 2009) y Vargas et ál. (2009) quienes aplicaron Trichoderma spp., y P. lilacinus en plantaciones de banano infestadas con R. similis y no lograron combatir a este nematodo.
Los resultados del presente estudio también coinciden con Quénéhervé (2009) quien indica que, en Martinica, aplicaciones de P. lilacinus en plantaciones muy infestadas con R. similis, P. coffeae y M. arenaria, no mostraron ningún efecto sobre las poblaciones de nematodos ni el rendimiento del plátano. Por su parte, Pérez (2004), Fernández et ál. 2005 y Fernández (2006) indican que en Cuba, P. lilacinus es efectivo contra R. similis y Meloidogyne incognita en banano y plátano, principalmente cuando se utiliza como agente preventivo o contra infecciones ligeras.
Además, coincide con Stirling (1991) quien indica que de los grupos de nematodos parásitos de plantas, los más difíciles de combatir con enemigos naturales son los endoparásitos migratorios como R. similis y Pratylenchus spp., porque completan el ciclo de vida dentro de las raíces y en ocasiones se producen varias generaciones sin estar expuestos a los antagonistas que se encuentran en el suelo.
Se reporta que P. lilacinus parasita huevos, juveniles y adultos de nematodos (Kunert et ál. 1987, Dackman et ál. 1989, Park et ál. 2004, Schenck 2004), mientras que Trichoderma spp., reduce las poblaciones de nematodos por parasitismo y por inducción de la resistencia sistémica adquirida (Sharon et ál. 2001, Harman y Shoresh 2007). El hecho que ninguno de estos biocontroladores redujera las poblaciones de R. similis se puede atribuir a que, luego de aplicados los microorganismos, éstos se deben adaptar al ambiente, competir con los microorganismos nativos para establecerse y luego hacer contacto con R. similis que se encuentra dentro de las raíces.
Por otra parte, se descarta que la aplicación generalizada de Furadan 10G en el área experimental, antes de iniciar el experimento, haya afectado el establecimiento de las cepas de Trichoderma spp., y P. lilacinus. Lo anterior porque la vida media de este producto en el suelo es de 50 días y estos hongos se aplicaron mensualmente durante todo el periodo experimental.
Los resultados de esta investigación difieren de lo reportado por Luth et ál. (2006) y Castrillón et ál. (2004) quienes aplicaron P. lilacinus en plantaciones comerciales de banano y plátano, respectivamente, y redujeron significativamente el número de R. similis. También difiere de 2 experimentos realizados en condiciones de campo en Filipinas donde se aplicó nematicida biológico a base del hongo Paecilomyces lilacinus cepa 251 en plantas de banano y se redujo el número de R. similis en 34% (Philip 2007a) y 43% (Philip 2007b). Sin embargo, en estos experimentos la media de R. similis en el testigo sin aplicación fue 2800 y 2873 individuos por 100 g de raíces, respectivamente, valores muy inferiores en comparación a los encontrados en este estudio. En dichos experimentos el nematodo que predominó fue Helicotylenchus spp., el cual representó el 85% (Philip 2007 a) y 94% (Philip 2007 b) de la población total de nematodos, respectivamente.
Varios autores reportan que cepas de Trichoderma spp., Fusarium spp., P. lilacinus, Bacillus spp., y Pseudomonas spp., tienen potencial para el combate de R. similis en plantas de banano reproducidas in vitro y sembradas en macetas con suelo esterilizado (Zum Felde 2002, Meneses 2003, Cañizares 2003, Pocasangre et ál. 2004, Athman 2006, Núñez 2006, Zum Felde et ál. 2006, Chávez 2007, Mendoza y Sikora 2009, Torres 2009). Sin embargo, se han realizado pocos experimentos en condiciones de campo con plantas infectadas con R. similis para evaluar su verdadero potencial en estas condiciones.
En Costa Rica existen 43 031 ha cultivadas con banano para exportación (Sánchez et ál. 2012), de las cuales aproximadamente el 3% del área sembrada se somete a renovación de plantaciones cada año. Por lo tanto, el principal objetivo es encontrar alguna alternativa que logre combatir nematodos en plantaciones infestadas con varios años de sembradas.
La inyección de oxamil en el pseudotallo y la aplicación de nematicida sobre la superficie del suelo fueron los tratamientos más efectivos en reducir la población de fitonematodos. Respecto al testigo sin aplicación, en promedio, estos tratamientos disminuyeron el número de nematodos totales en 43 y 41%, respectivamente. Estos resultados coinciden con los de Pattison et ál. (2001), Pattison y Cobon (2003), Araya (1999, 2004a), Vargas y Araya (2009) quienes redujeron las poblaciones de R. similis con aplicaciones de nematicida inyectado en el pseudotallo. Lo anterior sugiere que el oxamil depositado en el pseudotallo se trasladó por el xilema y floema para realizar el combate de nematodos en las raíces. Esto confirma lo indicado por Tyree et ál. (1979), Figueroa y Shillingford (1984), Mugnier (1988) que este nematicida tiene movimiento apoplástico y simplástico.
La diferencia del presente estudio con el de Pattison et ál. (2001), Pattison y Cobon (2003), Araya (2004a) y Fallas (2009) radica en que además de inyectar el oxamil en el pseudotallo, se depositó 0,6 g i.a. del mismo nematicida en la vaina foliar de la cuarta hoja en hijos con una altura entre 0,6 y 1,2 m. Esto se realizó con el objetivo de reducir el inóculo de nematodos en la unidad de producción. Lo anterior porque Robalino et ál. (1983) indican que se redujeron las poblaciones de nematodos en las raíces al depositar oxamil en la axila de hijos de sucesión.
Además, Pattison y Cobon (2003) indican que existe poca traslocación del oxamil inyectado en el pseudotallo a las raíces de los hijos en formación que aún no se han aplicado. En el caso de Pattison et ál. (2001) y Pattison y Cobon (2003) se inyectaron los pseudotallos de plantas cosechadas, mientras que Araya (2004a) y Fallas (2009) inyectaron hijos con altura superior a 1,0 m. Por tanto, en el presente estudio, las plantas donde se colectaron las muestras de raíces para análisis de nematodos estaban aplicadas con nematicida. Por otra parte, un inconveniente de colocar el oxamil en la vaina foliar es que cuando llueve, ésta se llenaría de agua y el nematicida se podría trasladar a sitios no deseados.
El que las plantas inyectadas con oxamil mostraran menor peso de raíz total y funcional, coincide con estudios realizados por Araya (2004a) quien evaluó el mismo sitio de muestreo y volumen de suelo excavado. Esto se podría atribuir a que las raíces tenían mayor sanidad y fueron más eficientes para absorber agua y nutrientes. Por tanto, la planta emitió menos raíces y esto representó menor gasto de energía, por lo que éste tratamiento mostró el mayor peso del racimo. Sin embargo, para dilucidar esta interrogante, sería necesario evaluar la distribución horizontal y vertical de las raíces en el perfil del suelo en plantas inyectadas con oxamil, aplicadas con nematicida sobre la superficie del suelo y plantas sin aplicación de nematicida.
Otro aspecto de gran relevancia es que, a pesar de que las aplicaciones de nematicida inyectado se realizaron cada 90 días, el gasto de ingrediente activo por año en cada unidad de producción (UP) fue inferior a la aplicación de nematicida sobre la superficie del suelo cada 120 días. Generalmente, en plantaciones que realizan 3 aplicaciones por año de nematicida químico sobre la superficie del suelo, se aplican de 8,0 a 9,0 g i.a. por año en cada UP, que dependen de la rotación de moléculas que se realice. Cuando se inyecta nematicida en el pseudotallo la dosis no es única en cada planta, el volumen de inyección por UP varió de 2,5 a 10,0 ml de oxamil. En promedio se aplicó 6,4 ml de producto comercial por UP, que equivale a 1,54 g i.a. por UP por aplicación y a 6,16 g i.a., por UP por año. Esto significa una disminución de 1,8 a 2,8 g i.a. por año respecto a las aplicaciones sobre la superficie del suelo, lo que representa una reducción de 3,0 a 4,8 kg de i.a. ha-1.año-1.
Respecto a las variables de producción, a pesar de que las plantas aplicadas con las cepas de Trichoderma spp., y P. lilacinus mostraron un número similar de nematodos que las plantas sin aplicación (testigo), éstas aumentaron entre 1,4 y 1,6 kg el peso del racimo y presentaron mayor circunferencia del pseudotallo que las plantas sin aplicación. Esto concuerda con Molina y Figueroa (1988) y Serrano et ál. (2006) quienes indican que plantas con mayor circunferencia producen mayor peso de racimo.
El que se hayan obtenido diferencias significativas en el peso del racimo entre el testigo y las plantas tratadas con P. lilacinus coincide con estudios realizados en Filipinas por Luth et ál. (2006) y Philip (2007a,b). En esos estudios se aplicó nematicida biológico a base del hongo Paecilomyces lilacinus cepa 251 en plantaciones comerciales de banano con varios años de establecidas y se aumentó la producción. Sin embargo, como se mencionó anteriormente, en los experimentos realizados por Philip (2007a,b) el nematodo predominante fue Helicotylenchus spp. En el presente estudio, debido a que no se logró combatir nematodos, es probable que P. lilacinus favoreciera la disponibilidad del fósforo en el suelo (Hernández et ál. 2011) y esto contribuyera a un mayor peso del racimo.
Según Pinochet y Stover (1980), Mitchell (1985) y Aguilar (2002) los hongos Fusarium spp., Cylindrocarpon spp., Cylindrocladium spp., Acremonium spp., Rhizoctonia spp., Penicillium spp., Macrophomina spp., y Pythium spp., parasitan las raíces de banano. Por lo tanto, es probable que las cepas de Trichoderma spp., funcionaran como antagonistas de los hongos patógenos. Aguilar (2002) realizó pruebas de antagonismo en placas Petri con cepas de hongos aisladas de raíces de banano y determinó que Trichoderma spp., evitó el crecimiento de aislamientos de Fusarium spp., Penicillium y Cylindrocladium sp.
Por otra parte, las plantas inyectadas con oxamil mostraron un peso del racimo, número de manos, calibración y longitud del fruto central de la segunda mano, circunferencia de la madre y altura del hijo similar a las plantas aplicadas con nematicida sobre la superficie del suelo. El peso del racimo en las plantas inyectadas con oxamil aumentó en 3,2 kg respecto al testigo sin aplicación. Estos resultados coinciden con experimentos realizados por Araya (1999, 2004a), quien aplicó 2,4 g i.a., y 1,2 g i.a. de oxamil 24SL en el pseudotallo y obtuvo aumentos de 3,4 kg y 2,6 kg en el peso de racimo, respectivamente.
Respecto al testigo sin aplicación, las plantas aplicadas con la rotación de nematicidas sobre la superficie del suelo aumentaron el peso del racimo en 1,8 kg. Este aumento es inferior al logrado con la inyección de oxamil, sin embargo, no difieren estadísticamente. Las aplicaciones de nematicidas químicos no fumigantes sobre la superficie del suelo ha sido la estrategia más aceptada por muchos años (Cubillos et ál. 1980, Murray 1980, Jaramillo y Quirós 1984, Figueroa 1987, Molina y Figueroa 1988, Ramírez y Paniagua 1988, Araya y Cheves 1997a y b, Vargas et ál. 2006), porque reduce las poblaciones de nematodos y aumenta la productividad. Por lo tanto, es muy importante contar con otra alternativa que logre resultados similares.
A pesar de que en el presente estudio se hicieron aplicaciones consecutivas de oxamil inyectado en el pseudotallo, cuando esta estrategia se incluya en el programa de combate de nematodos se sugiere alternar con aplicaciones sobre la superficie del suelo o alternar la inyección en el pseudotallo de diferentes ingredientes activos. Lo anterior porque existe el riesgo de resistencia a nematodos u otras plagas al inyectar continuamente el mismo ingrediente activo. En plantaciones de banano en Australia se redujo las poblaciones de R. similis con la inyección en el pseudotallo de Nemacur 240 CS y Nemacur 400 (Pattison 2014). Por tanto, si se registran dichos productos en nuestro país y se obtienen resultados similares, se podría alternar la inyección de oxamil y una formulación líquida de Nemacur.
Por otra parte, si se incorpora la inyección de oxamil en el pseudotallo dentro del programa comercial de rotación de nematicidas, se aumentaría el intervalo entre aplicaciones de una misma molécula aplicada sobre la superficie del suelo, lo que disminuiría el riesgo su biodegradación. Por tanto, la implementación de la inyección de nematicida en las plantaciones comerciales permitiría aprovechar las ventajas económicas, ambientales y laborales que esta alternativa presenta.
Algunas ventajas que presenta la inyección de nematicida son las siguientes: A) Se disminuye el riesgo de contaminación ambiental y el contacto de los trabajadores con el nematicida al depositar el nematicida dentro del pseudotallo. B) No se ha detectado residuos de oxamil en los frutos de plantas inyectadas en el pseudotallo. C) No habría riesgo de pérdida de eficacia por el lavado del producto en caso de presentarse lluvia después de inyectado el nematicida como sí ocurre con aplicaciones al suelo. D) No requiere que el suelo se encuentre a capacidad de campo para realizar la inyección, como sí lo requieren las aplicaciones sobre la superficie del suelo, donde tanto déficit como excesos de precipitación afectan la eficacia de éstas aplicaciones. E) La presencia de residuos de cosecha o de arvenses en la rodaja no afectan la eficacia de la inyección de nematicida como sí ocurre en las aplicaciones sobre la superficie del suelo. F) Se disminuye la cantidad de ingrediente activo aplicado respecto a aplicaciones sobre la superficie del suelo. Además, aplicaciones recientes de enmiendas cálcicas u orgánicas no afectan la inyección de nematicida.
Por otra parte, algunas desventajas de esta metodología de aplicación son las siguientes. A) En plantaciones infectadas con Moko (Ralstonia solanacearum) o algún otro patógeno que infecte el pseudotallo y se disemine por herramientas, es necesario elaborar un programa de desinfección para prevenir que el equipo de inyección lo disemine. B) En épocas de abundante precipitación se dificulta inyectar el nematicida porque el pseudotallo acumula mayor cantidad de líquidos y la herida provocada por la inyección facilita la salida de los mismos. Asimismo, se dificulta depositar el nematicida en la axila de la hoja porque se encuentra con agua. C) Se debe capacitar al personal que realiza la labor. D) Algunas plantas pueden presentar hojas inferiores con síntomas de fitotoxicidad luego de inyectadas con oxamil y también se han observado plantas muertas cuando la inyección se hace en el centro de la base del pseudotallo. A pesar de que los aspectos A y D no se observaron durante la ejecución del experimento, se conoce de otros casos donde han ocurrido.
Al considerar el aumento en el peso del racimo de 1,5; 1,8 y 3,2 kg obtenido en las plantas aplicadas con productos biológicos, la rotación de nematicidas sobre la superficie del suelo y la inyección de oxamil en el pseudotallo, respectivamente, se obtendría un aumento de aproximadamente 140, 172 y 308 cajas de 19 kg por hectárea lo que generaría un ingreso de $1.074, $1.324 y $2.368, respectivamente. El costo proyectado por hectárea por año de los productos y la aplicación de cada tratamiento fue de aproximadamente $840 para los productos biológicos, $415 para los nematicidas aplicados sobre la superficie del suelo y $470 para la inyección de oxamil. Por lo tanto, el aumento en producción cubriría los costos de estos tratamientos y se obtendría una ganancia de $234 con la aplicación de productos biológicos, $909 con los nematicidas aplicados sobre la superficie del suelo y $1.898 con inyección de oxamil.
Debido a que los hongos evaluados se aplicaron mensualmente y que se invirtió en los productos y en la mano de obra, estos tratamientos fueron los de mayor costo. Uno de los rubros de mayor inversión fue el de mano de obra, debido a que el rendimiento por hectárea se reduce en aproximadamente 60% respecto a las aplicaciones de nematicida químico sobre la superficie del suelo. Además, previamente se debe preparar la suspensión de hongos en agua y trasladar a la plantación aproximadamente 200 L de agua para aplicar una hectárea. Por tanto, al considerar la escasez de mano de obra y la disminución en la rentabilidad del cultivo debido al tipo de cambio del dólar, aunque en otros experimentos se demuestre que logra reducir las poblaciones de nematodos, se debe valorar el costo-beneficio.
En el presente experimento no se logró reducir la población de nematodos luego de realizar una aplicación mensual durante 20 meses con la cepa UNA de P. lilacinus ni con las cepas PB17 y B23 de Trichoderma spp. Esto confirma lo indicado por Stirling (1991) que el combate biológico es una parte del combate pero se deben integrar otras alternativas. Por el momento, los nematicidas químicos juegan un papel importante en el combate de nematodos en plantaciones bananeras, por tanto, futuros experimentos deberían usar la combinación de estas alternativas. Debido a los cambios climáticos ocurridos en los últimos años, en ocasiones el suelo se encuentra más seco o más húmedo de lo normal lo que dificultaría el establecimiento del microorganismo, por lo tanto se sugiere evaluar formas y equipos de aplicación. También se sugiere evaluar si las prácticas de manejo que se realizan en el cultivo como fertilización, fungicidas, herbicidas, nematicidas u otras dificultan el establecimiento y reproducción de los microorganismos. Lo anterior, para analizar las que modificaciones se podrían realizar para favorecer el establecimiento y la reproducción del microorganismo o grupo de microorganismos aplicados y que logren combatir a los nematodos.














