Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Costarricense de Ciencias Médicas
versão impressa ISSN 0253-2948
Rev. costarric. cienc. méd vol.19 no.3-4 San José Dez. 1998
Resumen
Se hace un análisis general de la literatura y del trabajo de los autores sobre microsporidiosis, una parasitosis que se ha puesto en boga a raíz de los problemas de inmunosupresión, especialmente en personas infectadas con el virus del SIDA. Se hace una revisión histórica, se describe básicamente la morfología de los géneros más importantes de los microsporidios y se comentan algunos aspectos de la epidemiología.
Se revisan los cambios patológicos debidos a la infección con estos parásitos, los métodos de diagnóstico más usados, el tratamiento y la prevención contra esta parasitosis.
Se enfatiza sobre el hallazgo por primera vez en Costa Rica y probablemente en Centro América, de casos humanos de infección con Enterocytozoon bieneusi y con el género Nosema.
Palabras claves
Microsporidia, microsporidiosis, Enterocytozoon, Encephalitozoon, Pleistophora, Nosema.
Abstract
Microsporidiosis is a recent and important disease related particularly specially with problems of immunosuppression as is the case in AIDS. The authors mention several studies related with this parasitosis, especially the presentation, for the first time in Costa Rica and probably in Central America, of Enterocytozoon bieneusi or Nosema infestation in human.
Some data dealing with the history of this parasitosis are mentioned, and the morphology of the known genera and species is briefly described. Notes on the epidemiology and transmissión of these organisms, as well as the pathology produced by microsporidial infection are also presented.
The more relevant and useful diagnostic methods, and the known treatment and prevention measures are indicated.
Key words
Microsporidia, microsporidiosis, Enterocytozoon, Encephalitozoon, Pleistophora, Nosema.
Introducción
La aparición de entidades nosológicas fuertemente inmunosupresoras, han influido para que una serie de organismos de vida libre o parásitos de animales vertebrados e invertebrados, tales como los microsporidios sean capaces de invadir al hombre, habituarse a él y finalmente producirle alguna patología importante. Pero no sólo debemos pensar que estas situaciones se producen en individuos inmunodeficientes. Por el contrario, las lesiones oculares causadas por estos parásitos son comunes en individuos sin problema inmunológico. Además ya se han encontrado problemas intestinales debidos a microsporidios en individuos totalmente saludables y sin inmunodeficiencias conocidas (1).
Históricamente los microsporidios comienzan a tener relevancia por un fenómeno de tipo económico. En 1857, Nägeli describe e informa sobre el parásito llamado Nosema bombycis, importante por destruir la larva de la mariposa Bombyx bombyx, o gusano de seda(2). Por la misma época se informa de Nosema apis que también tiene importancia económica por parasitar las abejas productoras de miel. Posteriormente se encuentran microsporidios en muchos otros insectos, vertebrados inferiores, roedores, conejos, etc (3).
El primer caso humano debido a estos organismos fue informado por Matsubayashi et al. (4) y luego varios más fueron encontrados en pacientes con SIDA. Desportes et al. (5) informó por primera vez la presencia del Enterocytozoon bieneusi el cual produce lesiones importantes en el hombre. Posteriormente en los noventas, se informa de otros géneros que se describen más adelante y se reporta el hallazgo de Trachipleistophora hominis (6) en un paciente con SIDA quien padece de una severa miositis. Un resumen histórico se presenta en el Cuadro 1.
| | | |
| 1857 | Nägeli | Nosema bombycis en el gusano de seda |
| 1882 | Balbiani | Crea el orden Microsporidia |
| 1887 | Moniez | Primer caso en vertebrados (Glugea anomala) en quistes subcut. en peces |
| 1903 | Zander | Hallazgo y descripción de Nosema apis |
| 1922 | Wright y Craighead | Microsporidios en conejos |
| 1923 | Levaditi et al | Da el nombre al E. cuniculi de conejos |
| 1962 | Nelson | Confirman a E. cuniculi como microsporidio |
| 1964 | Lainson et al | Idem |
| | ||
| 1959 | Marsubayashi et al. | Primeros hallazgos (Encephalitozoon) |
| 1982 | Gourley | Primeros estudios |
| 1984 | Connor y Neafie | Primeras descripciones |
| 1985 | Desportes et al | Enterocytozoon bieneusi (1a. vez) |
| 1988- y sigs | Cali, Canning, Weber, Bryan, etc. | Hallazgo y descripción de nuevos géneros y especies en el hombre |
Morfología general y ciclo de vida
El ciclo de vida de estos organismos incluye:
La espora: es la forma infectante para los diferentes huéspedes, dentro de los cuales va a liberar el filamento polar que le permite fijarse en los tejidos correspondientes. Sus membranas particulares, la exospora proteínica electrodensa y la endospora quitinosa y electrolúcida la hacen resistente a los factores ambientales. Tiene además un esporoplasto uni o binuclear, dependiendo del género, el cual es inyectado a la célula huésped por el filamento polar que actúa en el proceso por un sistema complejo de membranas llamado polaroplasto lamelar. Este sistema está rodeado de retículo endoplásmico rugoso y ribosomas libres. El filamento polar es un túbulo unido al aparato de anclaje, presenta una constitución espiralada y su número de espiras es importante desde el punto de vista taxonómico.
Merontes: representan la fase vegetativa del parásito, son células muy simples, rodeadas por una sola membrana y que se multiplican por división binaria y por división múltiple. Pueden producirse formas plasmodiales debido a una reproducción nuclear asincrónica con respecto a la división citoplasmática.
Esporontes: los procesos de esporogonía se inician tan pronto como los merontes se rodean de una capa superficial amorfa y se contituyen entonces en los esporontes. Estos crecen y se multiplican por división binaria o múltiple hasta transformarse en los esporoblastos que son los precursores de las esporas. Estas estructuras al ser ingeridas, se fijan al tejido por medio del filamento polar que introduce los ácidos nucleicos y el material citoplasmático al nuevo hospedero (3).
Géneros y especies parasitas del hombre
Enterocytozoon bieneusi
Fue descubierto por Desportes et al. en pacientes VIH positivos que presentaban una diarrea crónica importante (5). Puesto que ésta es la especie más frecuente en los casos de microsporidiosis humana, se describen en detalle las características biológicas y morfológicas particulares, que de acuerdo con Cali & Owen (7) y Weber et al. (3) son:
a) El organismo es monocariota en todos sus estadíos evolutivos.
b) En sus estados tempranos de desarrollo, tiene un núcleo claramente alargado.
c) Las formas proliferativas y esporogónicas son redondeadas, plasmodiales (muchos núcleos), circundadas por una sola membrana y miden alrededor de 6 µm de diámetro.
d) Presenta inclusiones citoplasmáticas electrolúcidas, en varios de sus estados evolutivos y unos discos electrodensos que se forman durante la esporogonía, discos que son precursores del aparato de anclaje y del filamento polar.
e) Uno de sus estados evolutivos, el esporoblasto, se origina de las formas esporogónicas plasmodiales al invaginarse el plasmalema.
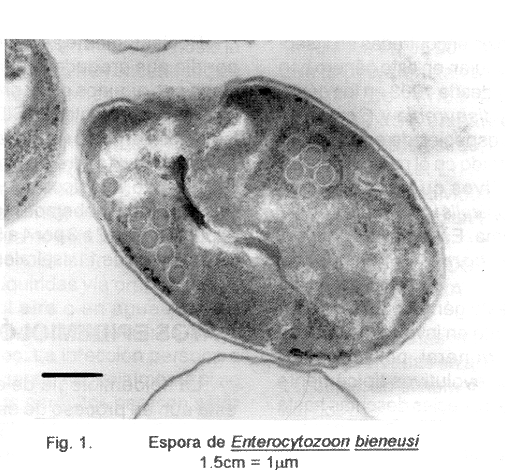
f) Las esporas miden 0.7 a 0.98 por 1.08 a 1.64 µm y su filamento o túbulo polar presenta de 5 a 7 espiras que al microscopio electrónico, se observan en dos grupos o filas opuestas localizadas en un extremo de la espora (Fig. 1).
g) Todos los estados evolutivos del parásito se encuentran, cuando están dentro de la célula (las esporas pueden hallarse libres), en contacto directo con el citoplasma de la célula huésped y no incluídos en vacuolas parasitóforas.
Esta especie se ha encontrado también en epitelios nasal, bronquial y traqueal, además de los ductos biliar y pancreático, vesícula biliar y células no parenquimatosas hepáticas (3).
Género Encephalitozoon. Incluye las especies: E. cuniculi, E. hellem, E. intestinalis (antes Septata intestinalis).
E. cuniculi fue encontrado por Wright y Craighead (8) pero el nombre se lo dieron Levaditi, Nicolau y Schoen (9), confirmado y redescrito por Weiser en 1964 (10).
Esta especie parasita al hombre, roedores, carnívoros, otros primates e inclusive algunas aves. Los tejidos más comúnmente infectados son el cerebral y el muscular; pero también se puede encontrar en macrófagos, células epiteliales, endotelios vasculares y células de los túbulos renales.
Morfológicamente sus esporas se caracterizan por ser monocarióticas, con tamaño de 1.0-1.5 por 2.0-2.5 µm, endosporas gruesas y exosporas delgadas, además de presentar de 6 a 8 vueltas o espirales en su filamento polar. Los merontes son redondos u ovalados y miden de 2 a 6 por 1 a 3 µm. Los esporontes aparecen libres en el centro de una vacuola parasitófora, como sucede con todos los estados evolutivos del género Encephalitozoon y se dividen en dos esporoblastos que finalmente van a madurar dando las esporas.
E. hellem fue descrito por Didier et al (11). Además de los detalles descritos anteriormente para el género, esta especie se caracteriza por presentar esporas que miden 2.0 a 2.5 por 1.0 a 1.5 µm y el filamento polar presenta de 5 a 7 espiras generalmente en filas sencillas localizadas en la periferia de la espora. Ha sido encontrado en macrófagos, células de los epitelios nasal, bronquial, corneal, conjuntival, del tracto urinario y túbulos renales.
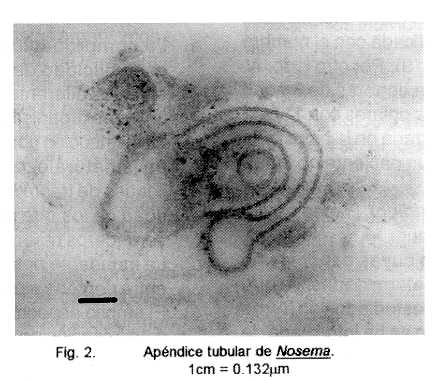
E. intestinalis fue descrito con el nombre de Septata intestinalis por Cali et al. (12) y reclasificado, con base en características genéticas e inmunológicas por Hartskeerl et al (13). Sus células proliferativas se caracterizan por ser uni, bi o tetranucleadas y la esporogonía da origen a 4 esporas. Dentro de la vacuola parasitófora se observan los organismos incluidos en una red fibrilar, dando la idea de que dicha vacuola es septada, lo cual dio origen al primer nombre científico. En los esporontes se observaron originalmente los llamados apéndices tubulares que se originan de la superficie y terminan en una estructura semejante a un bulbo; este apéndice tubular lo hemos observado en el género Nosema por Chinchilla et al. (datos sin publicar. Fig. 2). Las esporas maduras miden 2.0 por 1.2 µm, son uninucleadas y presentan de 4 a 7 (usualmente 5) espirales en el filamento polar. Hasta ahora sólo ha sido diagnosticado en pacientes VIH positivos con diarrea, se han encontrado los parásitos en enterocitos y en macrófagos de la lámina propia (12). También han sido encontrados en fibroblastos y células endoteliales de la lámina propia, células epiteliales de canalículos biliares, árbol bronquial y cavidad nasal, así como en las células de los túbulos renales (12, 14).
Género Pleistophora. Las especies: P. tropicalis, P. simulii, presentan esporas monocarióticas en gran cantidad dentro de la vesícula esporófora cubierta por una membrana gruesa, amorfa, constituidas por las formas plasmodiales merogónicas. La esporogonía produce múltiple número de esporas las cuales se caracterizan por medir 2.8 a 3.2 o 3.4 µm y presentar filamentos polares con 9 a 12 espiras. Las especies de este género son parásitos normales de peces, anfibios y reptiles (6).
Algunas especies encontradas en insectos que antes se incluían en este género han sido reclasificadas desde 1982 en los géneros Vavraia, Polydispyrenia y Cystosporogenes (15). Las especies de este género que se han encontrado en el músculo de pacientes VIH positivos que presentaban miositis, son P. tropicalis y P. simulii (16).
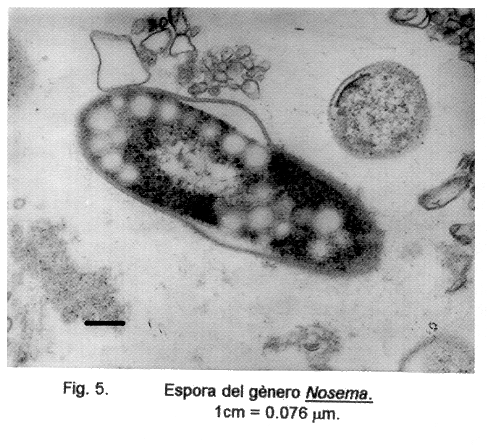
Género Nosema. Especies N. connori, N. ocularum, N. corneum (Vittaforma cornea).
Especies de este género han sido descritas especialmente en invertebrados y se caracterizan, en general, por presentar todos los estadios evolutivos típicamente dicarióticos. De las especies descritas hasta hoy que parasitan al hombre (17), N. connori, encontrada en un niño atímico, presenta esporas que miden 2 a 2.5 por 4 a 4.5 µm de tamaño con filamentos polares con 11 espirales (18). En N. corneum, diagnosticada en el estroma de la córnea de personas aparentemente no inmunosupresas (1), las esporas miden 1 por 3.7 µm y tienen un filamento polar con 6 espiras. Esta especie ha sido reclasificada con el nombre de Vitta-forma cornea (19). Por otro lado, N. ocularum que presentan esporas de 3 por 5 µm de tamaño y túbulos polares con 11 a 12 espiras, ha sido encontrada en la biopsia de una úlcera córnea de un paciente no inmunosupreso (20).
Género Microsporidium. Especies: M. ceylonensis, M. africanum.
Este es un género cuyas especies no han sido claramente determinadas, ya que sus ciclos no han sido estudiados en forma completa. Sin embargo se ha informado de las especies M. ceylonensis y M. africanum que parasitan el.estroma de la córnea de individuos en los cuales no se encontró ningún problema de inmunidad (21, 22). En cuanto a los estados evolutivos de este género, sólo se conoce la morfología de las esporas cuyo tamaño es de 2.5 por 4.5 µm y cuyo filamento presenta de 11 a 13 espirales.
Recientemente se encontró un microsporidio que produce miositis severa, asociada con algunos otros problemas patológicos en un paciente con SIDA, que fue clasificado con el nombre de Trachipleistophora hominis (6). Aparte de gran cantidad de detalles morfológicos que se indican en el trabajo citado, debemos mencionar que las esporas miden 2 a 3 por 4 a 5 µm y presentan un promedio de 11 espirales en su filamento polar.
Datos epidemiológicos
La epidemiología de esta parasitosis está aún en proceso de estudio, especialmente porque su diagnóstico todavía depende fundamentalmente de estudios morfológicos, por lo que las estadísticas que se realizan con base en encuestas, no son del todo confiables. Sin embargo los siguientes aspectos bien conocidos determinan la distribución cosmopolita de esta parasitosis.
- a) La comprobación de la ausencia de especificidad de huésped que existe entre los diferentes géneros y especies de estos organismos.
b) La distribución ubicua de estos parásitos en la naturaleza aumenta las posibilidades de trasmisión, dada la gran cantidad de los que pueden considerarse verdaderos reservorios.
c) La indudable posibilidad de trasmisión entre persona y persona.
d) El amplio espectro clínico que presenta esta infección en el hombre.
En cuanto a la infección en humanos, las esporas resultan ser el estado evolutivo infectante; aunque no está totalmente clara la vía de infección. Existen evidencias de que ellas son adquiridas vía oral del medio ambiente, en el aire o en aguas contaminadas o inclusive por ingestión de insectos contaminados. La infección persona a persona cobra fuerza, especialmente si se analiza que estos parásitos parecen estar presentes en el intestino de los humanos, de los cuales los individuos inmunocompetentes se podrían considerar como importantes reservorios (3, 26). En la trasmisión se ha comprobado el efecto de los aerosoles por medio de algunos estudios experimentales, especialmente en infecciones pulmonares (27). Los problemas oculares podrían deberse a contaminaciones aerógenas y la presencia de estos organismos en la próstata de enfermos con SIDA, además de algunos experimentos de laboratorio realizado con Encephalitozoon, hacen pensar en la trasmisión sexual y trasplacentaria (3).
En cuanto a la prevalencia y distribución geográfica de esta parasitosis, al no ser confiables los datos de seroprevalencia por las razones antes indicadas, la información que se da se basa en el diagnóstico por la observación de las esporas. Con base en ello se concluye que esta parasitosis está presente prácticamente en todo el mundo, exceptuando quizá la Antártida. Las diferencias de prevalencia entre los países podrían estar dadas por las variaciones en los factores de riesgo, pero más probablemente, por la capacidad diagnóstica. Lo que sí es evidente es que un importante número de casos han sido encontrados en pacientes VIH positivos y en personas inmunosuprimidas por otras causas.
De los datos conocidos se desprende que la prevalencia va del 7% en algunos lugares de Africa hasta el 50% en Francia (3). Sin embargo, dadas las diferencias en el muestreo, esta información no es concluyente. En un estudio hecho en Costa Rica en individuos VIH positivos (28) hemos encontrado un 7% de positividad.
Patología, patogénesis y sintomatología
Además de las manifestaciones patológicas observadas en animales de diferentes especies, en el humano se pueden encontrar dos posibilidades: una notable reproducción de los parásitos en los individuos inmunosuprimidos con la correspondiente intensa patología (14, 29) y por otro lado, individuos inmunocompetentes que presentan importantes lesiones debidas a los microsporidios (30, 31). Es necesario anotar que las infecciones intestinales, sólo son severas en individuos con problemas de inmunidad; en los individuos inmunocompetentes las diarreas que se producen pueden ser agudas pero siempre autolimitadas. Por lo tanto, no existen claras evidencias de que microsporidiosis diseminadas ocurran en individuos sin problemas inmunológicos.
Las manifestaciones clínicas en esta parasitosis pueden resumirse en las sintomatologías relacionadas con problemas intestinales, oculares, musculares y sistémicos (30). Las lesiones intestinales especialmente causadas por E. bieneusi (19), pero también presentes en infecciones por especies de los géneros Pleistophora, Microsporidium y Encephalitozoon, se manifiestan como una diarrea crónica acompañada de pérdida de peso, fiebre, anorexia y adelgazamiento probablemente debido a problemas de mala absorción intestinal (1, 5, 19).
Esto último ocurre porque el epitelio intestinal presenta muchas alteraciones, incluyendo, en los casos severos, una degeneración epitelial generalizada. En estos casos, generalmente observados en inmunosuprimidos y muy especialmente en individuos VIH positivos, se produce un desprendimiento de la mucosa la cual va a estar presente en las heces del individuo (32). A la par de estas manifestaciones intestinales, puede observarse también, en el caso de infecciones con E. bieneusi, invasión del parásito en los epitelios de los ductos biliares (3), del árbol respiratorio (33) y del ducto pancreático en donde generalmente no causan lesiones importantes (3).
Las lesiones oculares son producidas especialmente por especies de los géneros Encephalitozoon, Nosema y Microsporidium en individuos con buena salud general, sin inmunodeficiencias, siempre y cuando no se trate de alguna infección diseminada debida a alguna especie del primer género mencionado (34).
Las lesiones observadas son queratoconjuntivitis, úlceras de la córnea, degeneración y necrosis (35, 36). En individuos VIH positivos estas lesiones pueden ser más pronunciadas y se acompañan con infiltrados inflamatorios mixtos de neutrófilos y células mononucleares. Los pacientes pueden presentar eritema conjuntival, disminución de la capacidad visual y fotofobia (35).
Las miositis en la microsporidiosis han sido informadas especialmente en las infecciones con Pleistophora spp y Trachipleistophora hominis. Los signos y síntomas más corrientemente observados son mialgias importantes debidas a la miopatía difusa, asociadas con fiebre, adenopatía generalizada y pérdida de peso (6, 16, 37). Lesiones causadas por Encephalitozoon cuniculi se han encontrado en hígado lo que produce ictericia, fiebre, necrosis hepatocelular, todo lo cual, acompañado de una diarrea severa, produciendo la muerte en al menos un paciente (3).
Infecciones generalizadas en pacientes con SIDA debidas a estos parásitos, también han sido observadas. En efecto, patologías conjuntas muy variadas tales como queratoconjuntivitis, bronquiolitis, sinusitis, nefritis, uretritis, cistitis, prostatitis, hepatitis y peritonitis han sido relacionadas con infecciones por E. hellem (27) E. cuniculi (37) y E. intestinalis (14). También se han observado manifestaciones sistémicas incluyendo el tracto urinario y el sistema respiratorio. En este último se ha observado sinusitis, poliposis nasal con la consecuente obstrucción y descarga nasal mucopurulenta persistente. La muerte puede ocurrir por complicaciones de cualquiera de los sistemas afectados.
Diagnóstico
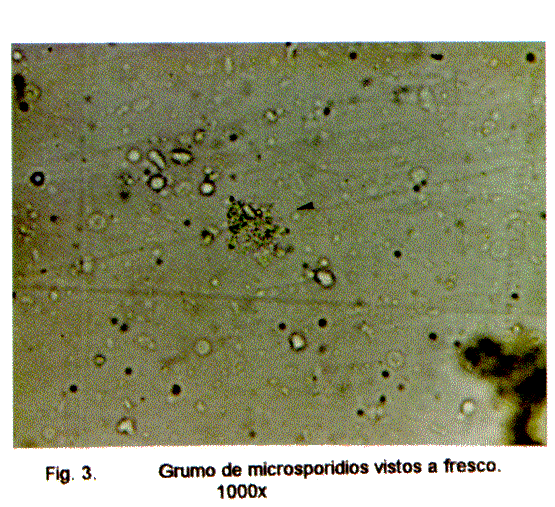
La identificación de estos organismos presenta algunas dificultades porque los elementos de diagnóstico son las esporas cuyo tamaño es muy pequeño. Vistas al fresco es posible sospechar su presencia cuando se encuentran en grumos, pero aisladamente son muy difíciles de ubicar (Fig. 3) En todo caso es necesario realizar tinciones especiales tal como la de Weber et al. (38), la de Ryan et al. (39) y la de Luna et al. (40) que usa el blanco calcofluor fluorocromo.
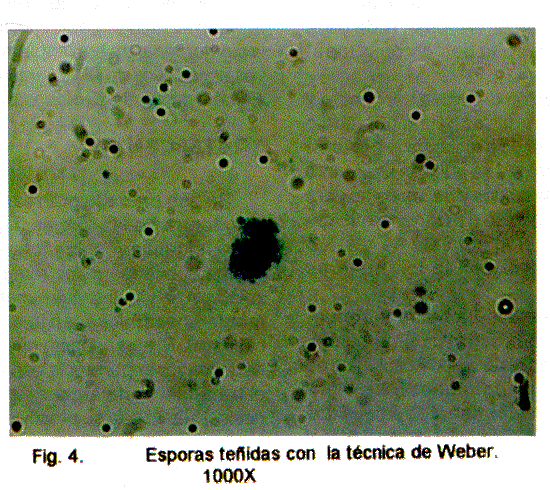
La técnica de Weber es la usada en el Laboratorio de Protozoología para el diagnóstico de estos parásitos en las heces humanas. Esta técnica tiñe las esporas de un color rojo intenso que sobresale del color verde de contraste (Fig. 4).
Ninguna de las técnicas de concentración parecen ser necesarias para el diagnóstico de los microsporidios ya que los pacientes sintomáticos, generalmente presentan gran cantidad de esporas fáciles de encontrar. Estudios histológicos han sido practicados en biopsias y en material de autopsia pero para un diagnóstico confiable deben realizarse tinciones especiales de los tejidos, tales como la de Gram modificada (Brown-Brenn o Brown-Hopps), la de plata de Warthin-Starry o la del "chromotrope" aplicada a tejidos (41).
La identificación definitiva del género y especies sólo puede ser hecha por medio del uso del microscopio electrónico (Figs. 1 y 5). Estas técnicas se pueden usar tanto para muestras de fluidos y heces como para tejidos de todo tipo. Se usa tanto la microscopía de trasmisión como la de rastreo (scanning) y se obtienen los mejores resultados.
Ulitizando la técnica de inmunofluorescencia, han sido usadas pruebas serológicas en el estudio histológico y citológico de muy diversos especímenes (42). Anticuerpos monoclonales han sido producidos para la detección de las esporas en heces y en diferentes fluidos especialmente en el caso de las infecciones por E. bieneusi y Encephalitozoon (43, 44).
Se han hecho estudios serológicos empleando las técnicas del carbono inmunoensayo, ELISA, Western Blot (45) y muy recientemente se han implementado ensayos específicos de PCR para la detección de E.intestinalis y de E. bieneusi en heces (46).
Tratamiento
Se han probado gran cantidad de drogas dentro de las que se incluyen fumagilina, sinefungina, itraconazole, azithromicina, atovaquone, octreotide y albendazole, con resultados muy variables, prácticamente anecdóticos, en la mayoría de los casos (3). El albendazole es al que se le ha dado mayor importancia especialmente en el tratamiento de algunas encefalitozoonosis. Puesto que su efectividad en la enterocitozoonosis no parece ser muy efectiva (47), siendo ésta la infección microsporidial más corriente en el hombre, es necesario la búsqueda de nuevas drogas.
Al respecto, Sharspstone et al (48) han demostrado que la thalidomida es efectiva en aproximadamente el 60% de los casos tratados. Sin embargo, sus efectos teratogénicos limitan su uso.
Medidas preventivas
Debido a que los mecanismos de trasmisión de estos parásitos, así como las fuentes de infección todavía no son muy conocidas, la prevención en las microsporidiosis no se puede establecer claramente. Sin embargo, tomando en cuenta algunos datos que se conocen acerca de la sensibilidad de las esporas al calor y a la congelación (3), se puede sugerir la aplicación de estos medios físicos para evitar infecciones. También por analogía con todas las parasitosis que se adquieren vía oral y por un hecho probado de que los aerosoles son importantes en la diseminación de estos organismos, se puede sugerir el lavado de manos y de hortalizas y frutas que se ingieren sin cocinar. Relacionado con estos mismos hechos, es recomendable para el personal de hospitales que menejen pacientes inmunológicamente deficientes, un estricto control higiénico.
Agradecimientos
Este trabajo fue subvencionado por la Vicerrectoría de Investigación (proyecto # 803-97-262). Los autores agradecen a Ethel Sánchez Chacón y Laura Hernández Chavarria de la Unidad de Microscopía Electrónica, Universidad de Costa Rica.
Referencias
1. Shadduck J A, Meccoli R A, Davis R, Font R L. First isolation of a microsporidian from a human patient. J Infect Dis 1990; 162:773-776. [ Links ]
2. Nägeli K W. Ueber die neue krankheit der Seidenraupe und verwandte organismen. Bot Z 1857; 15:760-761. [ Links ]
3. Weber R, Bryan R T, Schwartz D A, Owen R L. Human microsporidial infections. Clin Microbiol Rev 1994; 7:426-461. [ Links ]
4. Matsubayashi H, Koike T, Mikata T, Hagiwara S. A case of Encephalitozoon-like body infection in man. Arch Pathol 1959; 67:181-187. [ Links ]
5. Desportes I, Le Charpantier Y, Galian A, et al. Ocurrence of a new microsporidian, Enterocytozoon bieneusi n.g., n.sp., in the enterocytes of a human patients with AIDS. J Protozool 1985; 32:250-254. [ Links ]
6. Field A S, Marriott D J, Milleken S T, et al. Myositis associated with a newly described microsporidian, Trachipleistophora hominis, in a patient with AIDS. J Clin Microbiol 1996; 34: 2803-2811. [ Links ]
7. Cali A, Owen R L. Intracellular development of Enterocytozoon, a unique microsporidian found in the intestine of AIDS patients. J Protozool; 1990; 145-155. [ Links ]
8. Wrigth J H, Craighead E M. Infectious motor paralysis in young rabbit. J Exp Med 1992; 36:135-140. [ Links ]
9. Levaditi C, Nicolau S, Schoen R. Lagent etiologique de lencéphalite epizootique du lapin (Encephalitozoon cuniculi). C.R. Soc Biol Paris 1923; 89:984-986. [ Links ]
10. Weiser J. On the taxonomic position of the genus Encephalitozoon Levaditi, Nicolau & Schoen, 1923 (Protozoa, Microsporidia). Parasitology 1964; 54:749-751. [ Links ]
11. Didier E S, Shadduck J A, Didier P J, et al. Studies on ocular microsporidia. J Protozool 1991; 38:635-638. [ Links ]
12. Cali A, Kotler D P, Orenstein J M. Septata intestinalis n.g.; n.sp., an intestinal microsporidian associated with chronic diarrhoea and dissemination in AIDS patient. J Euk Microbiol 1993; 40:101-112. [ Links ]
13. Hartskeerl R A, Schuitema R J, de Wachter R. Secundary structure of the small subunit ribosomal RNA sequence of the microsporidium Encephalitozoon cuniculi: Nucleic acids Res. 1993; 21:1489. [ Links ]
14. Dore G J, Marriott D J, Hing MC, et al. Disseminated microsporidiosis due to Septata intestinalis in nine patients infected with the human immunodeficiency virus: Response to therapy with albendazole. Clin Infect Dis 1995; 21:70-76. [ Links ]
15. Larson R J I. Identification of microsporidian genera (Protozoa, Microspora) a guide with comments on the taxonomy. Arch Protistenkd 1988;136:1-37. [ Links ]
16. Ledford D K, Overman M D, Gonzalo A, et al. Microsporidiosis myositis in a patient with acquired immunodeficiency syndrome. Ann Intern Med 1985; 102:628-630. [ Links ]
17. Cali A. General microsporidian features and recent findings on AIDS isolates. J Protozool 1991; 38: 625-630. [ Links ]
18. Margileth A M, Strano A J, Chandra R, et al. Disseminated nosematosis in an immunologically compromised infant. Arch Pathol 1973; 95:145-150. [ Links ]
19. Croft S L, Williams J, McGowan I. Intestinal microsporidiosis. Semin Gastroint Dis 1977; 8:45-55. [ Links ]
20. Cali A, Meisler D, Lowder C Y, et al. Corneal microsporidosis: Characterization and identification. J Protozool 1991; 38:2155-2175. [ Links ]
21. Ashton N, Wirasinha PA. Encephalitozoonosis (Nosematosis) of the cornea. Br J Ophthalmol 1973; 57: 669-674. [ Links ]
22. Pinnolis M, Egbert P R, Font R L, Winter FC. Nosematosis of the cornea. Arch Ophthalmol 1981; 99:1044-1047. [ Links ]
23. Orenstein J M. Microsporidiosis in the acquired immunodeficiency Syndrome. J Parasitol 1991; 77:843-864. [ Links ]
24. Shadduck J A, Orenstein J M. Comparative Pathology in microsporidiosis. Arch Pathol Lab Med 1993; 117: 1215-1219. [ Links ]
25. Sandford J, Hannermann A, Gelderblom H, et al. Enterocytozoon bieneusi infection in an immunocompetent patient who had acute diarrhea and who was not infected with the human immunodeficiency virus. Clin Infect Dis 1994; 19:514-516. [ Links ]
26. Bryan R T, Weber R. Microsporidia emerging pathogens in immunodeficient persons. Arch Pathol Lab Med 1993;117:1243-1245. [ Links ]
27. Weber R, Kuster H, Visvesvara G, et al. Disseminated microsporidiosis due to Encephalitozoon hellem: Pulmonary colonization, microhematuria and mild conjuntivitis in patient with AIDS. Clin Infect Dis 1993; 17:415-419. [ Links ]
28. Reyes L , Chinchilla M, Frajman M, et al. Presencia de parásitos intestinales en pacientes HIV seropositivos con el primer informe de microsporidiosis humana en Costa Rica. Parasitología al Día 1997; 21:1-2. [ Links ]
29. Orenstein J M, Dieterich D T, Kotler D M. Systematic dissemination by a newly recognized microsporidia species in AIDS. AIDS 1992; 6:1143-1150. [ Links ]
30. Weber R, Bryan R T. Microsporidial infection in immunodeficient and immunocompetent patients. Clin Infect Dis 1994; 19:517-521. [ Links ]
31. Molina J M, Sarfati C, Beauvais B, et al. Intestinal microsporidiosis in human immunodeficiency virus-infected patients with chronic unexplained diarrhea: Prevalence and Clinical and biological features. J infect Dis 1993; 167:217-221. [ Links ]
32. Chinchilla M, Reyes L, Guerrero O M, et al. Enterocytozoon bieneusi (Orden Microsporidia, Familia Enterocytozoonidae) in Costa Rica: Report of the first human case in Central America. Parasitología al Día 1997; 21: 119-122. [ Links ]
33. Weber R, Kuster H, Keller R, et al. Pulmonary and intestinal microsporidiosis in a patient with the acquired immunodeficiency syndrome. Am Rev Respir Dis 1992;146: 1603-1605. [ Links ]
34. Bryan R T, Cali A, Owen R L, Spencer H L. Microsporidia oportunistic pathogens in patients with AIDS. 1991, p. 1-26. In T.Sun (ed.) Progress in Clinical Parasitology. Vol 2. Field and Wood. Philadelphia. [ Links ]
35. Cali A, Meisler D M, Rutherford I, et al. Corneal microsporidiosis in a patient with AIDS. Am J Trop Med Hyg 1991; 44(5):463-468. [ Links ]
36. Chup G L, Alroy J, Adelman LS, et al. Myositis due to Pleistophora (Microsporidia) in a patient with AIDS. Clin Infect Dis 1993; 16:15-21. [ Links ]
37. Mertens R B, Didier E S, Fishbein M C, et al. Encephalitozoon cuniculi microsporidiosis: infection of the brain, heart, kidney, trachea, adrenal glands and urinary bladder in a patient withs AIDS. Mod Pathol 1997; 10: 68-77. [ Links ]
38. Weber R, Bryan R T, Owen R L, et al. Improved light-microscopical detection of microsporidia spores in stool and duodenal aspirates. N Engl J Med 1992; 326:161-166. [ Links ]
39. Ryan N, Sutherland G, Coughlan K, et al. A new trichrome-blue stain for detection of microsporidial species in urine, stool, and nasopharingeal specimens. J Clin Microbiol 1993; 31: 3264-3269. [ Links ]
40. Luna V A, Stewart B K, Bergeron DL, et al. Use of the fluorochrome calcofluor white in the screening of stool specimens for spores of microsporidia. Am J Clin Pathol 1995; 103: 656-659. [ Links ]
41. Connolly G M M, Ellis D S, Williams J E, et al. Use of electron microscopy in examination of faeces and rectal and jejunal biopsy specimens. J Clin Pathol 1991; 44: 313-316. [ Links ]
42. Aldras A M, Orenstein J M, Kotler D P, et al. Detection of microsporidia by indirect immunofluorescence antibody test using polyclonal and monoclonal antibodies. J Clin Microb 1994; 32: 608-612. [ Links ]
43. Zhu X, Wittner M, Tanowitz HB, et al. Small subunit rRNA sequence of Enterocytozoon bieneusi and its potential diagnostic role with use of the polymerase chain reaction. J Infect Dis 1993; 168:1570-1575. [ Links ]
44. Weiss L M, Cali A, Levee E, et al. Diagnosis of Encephalitozoon cuniculi infection by western blot and the use of cross-reactive antigens for the possible detection of microsporidiosis in humans. Am J Trop Med Hyg 1992; 47: 456-462. [ Links ]
45. Hollister W S, Canning E U, Wilcox A. Evidence for widespread ocurrence of antibodies to Encephalitozoon cuniculi (Microspora) in man provided by ELISA and another serological test. Parasitology 1991; 102: 33-43. [ Links ]
46. Ombrouck C, Ciceron L, Biligui S, et al. Specific PCR assay for direct detection of intestinal microsporidia Enterocytozoon bieneusi and Encephalitozoon intestinalis in fecal specimens from human immunodeficiency virus-infected patient. J Clin Microbiol 1977; 35:652-655. [ Links ]
47. Dieterich D T, Lew E A, Kotler D P, et al. Treatment with albendazole for intestinal disease due to Enterocytozoon bieneusi in patients with AIDS. J Infect Dis 1994; 169:178-183. [ Links ]
48. Sharpstone D, Rowbotton A, Francis N, et al. Thalidomide: a novel therapy for microsporidiosis. Gastroenterology 1997; 112:1823-1829. [ Links ]
* Centro de Investigación en Enfermedades Tropicales (CIET), Departamento de Parasitología; Facultad
de Microbiología. Universidad de Costa Rica.
Facultad de Microbiología, Universidad de Costa Rica. San José. Costa Rica. América Central.













