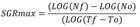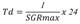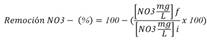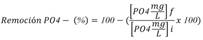Introduction
La industria de la acuicultura ha experimentado un crecimiento constante en las últimas décadas. Según datos de la Organización de las Naciones Unidas para la Agricultura y la Alimentación, en 2020 la producción acuícola mundial alcanzó un récord de 88 millones de toneladas (excluyendo las algas), lo que representa un aumento del 2.1 % respecto al año anterior (Organización de las Naciones Unidas para la Agricultura y la Alimentación, 2020). Entre los productos acuícolas más producidos en todo el mundo se encuentran los peces de agua dulce y salada, los crustáceos, los moluscos y las algas. El desarrollo de la acuicultura en Argentina se ha visto impulsado por la creciente demanda interna de productos acuícolas y por el aumento de las exportaciones. Actualmente, Argentina cultiva y comercializa peces de agua dulce tales como el Pacú (Myleus pacu (Schomburgk & Jardine, 1841)), trucha archoiris (Oncorhynchus mykiss Walbaum, 1792) y minoritariamente recursos acuícolas marinos con fines tanto comestibles como nutracéuticos. En particular, la empresa de base Tecnológica del CONICET EriSea SA (www.promarineantioxidants.com) se dedica a la producción de erizos de mar, de la especie Arbacia dufresnii (Blainville, 1825), mediante acuicultura para la producción de suplementos nutricionales a base de los huevos de las hembras, reconocidos por sus propiedades saludables. El cultivo de erizos ya está establecido en países tales como Chile, Japón, Corea del Sur, España y Francia (Rubilar & Cardozo, 2020) donde son valorados por su carne y su gónada, que es considerada un manjar en muchas culturas gastronómicas.
A pesar de ser emergente, la industria acuícola en Argentina ya enfrenta desafíos significativos como la falta de infraestructura y tecnología adecuada, la falta de financiamiento y apoyo gubernamental, y la competencia con la industria pesquera tradicional. Asimismo, el crecimiento de los sistemas de cultivo acuícolas genera cantidades excesivas de sus efluentes que contienen valores excesivos de compuestos nitrogenados y fosfatados, los cuales si no son debidamente tratados pueden causar en los cuerpos de agua receptores un desbalance químico y biológico producto de este vertido (Onuoha et al., 2012; Rathod, 2014) con efectos en corto, mediano y largo plazo. La eutrofización es una consecuencia de este vertido que involucra una condición tanto física como química debido a un aumento de la concentración de fósforo y nitrógeno presentes en el agua. Esto produce un impacto biológico, favoreciendo el crecimiento desmedido de ciertos microorganismos y causando en consecuencia un desajuste biológico, ecosistémico y orgánico (Chatla et al., 2020). Dentro de los efectos adversos podemos citar la promoción de floraciones algales, alteración del hábitat, la disminución de ciertas especies dado el aporte excesivo y focalizado de contaminantes orgánicos, y riesgos de toxicidad agudos y ambientales tanto a los organismos de cultivo como a las especies silvestres de los cuerpos de agua en donde se descargan los efluentes (Onuoha et al., 2012; Rathod, 2014). Por lo tanto, es fundamental implementar prácticas de manejo adecuadas y sistemas de tratamiento de aguas residuales para reducir los impactos negativos de los efluentes acuícolas en el medio ambiente y garantizar la sostenibilidad de la industria acuícola. Estos desafíos asociados con la sostenibilidad de la acuicultura, como el uso responsable de los recursos naturales, representan un compromiso desde el sector científico y tecnológico, fomentando la innovación y el uso de tecnologías sostenibles y eficientes en la producción acuícola y así garantizar un desarrollo sostenible y responsable de esta industria y de la eficiencia en el tratado de sus efluentes (Chatla et al., 2020).
La fitorremediación es un proceso en el que se utilizan plantas o microorganismos para eliminar contaminantes del medio ambiente. Las microalgas son microorganismos fotosintéticos de origen procariota o eucariota que se han utilizado con éxito en procesos de fitorremediación (Tomaselli, 2004). Estos organismos pueden crecer en agua dulce y marina y en aguas residuales agrícolas, industriales y municipales (Moreno García et al., 2020). Para su crecimiento requieren de una fuente de luz y nutrientes esenciales tales como el nitrógeno y el fósforo (Wen & Chen, 2003; Wu et al., 2022). Las formas inorgánicas de nitrógeno, como el nitrato, son preferidas por las microalgas para su crecimiento. Las microalgas pueden asimilar el nitrógeno inorgánico y reducirlo a amonio antes de incorporarlo a su membrana intracelular como aminoácidos (Wu et al., 2022). En cuanto al fósforo, las microalgas también prefieren las formas inorgánicas para su crecimiento y tienen la capacidad de almacenar el exceso de fosfato en gránulos celulares (Wen & Chen, 2003). Además, las microalgas son altamente adaptables al estrés ambiental y a las condiciones extremas, por ejemplo, salinidad, luz, temperatura, CO2 y metales pesados (Chan et al., 2021). Estos microorganismos en su proceso de crecimiento fijan (captan) dióxido de carbono y liberan oxígeno por fotosíntesis, es por eso que aumentan los niveles de oxígeno en el agua aportando así a la demanda biológica de oxígeno que sostienen las aguas contaminadas (Singhal et al., 2021). Además, las microalgas son la base alimenticia de toda trama trófica, siendo alimento fundamental de todos los organismos acuáticos dado que en su célula contienen carbono celular y demás componentes nutritivos tales como lípidos, proteínas, pigmentos y energía química que necesitan otros organismos en su dieta (Fuhrmann et al., 2021). Su rol biológico, enmarcado en el proceso de fitorremediación, podría pensarse como un modelo ideal de biorrefinería, donde además de utilizar al efluente como un insumo, se está en simultáneo produciendo biomasa microalgal para un posterior uso como alimento y/o la obtención de alguno de sus productos de interés (Nie et al., 2020; Ullmann & Grimm, 2021)
La fitorremediación de efluentes acuícolas es un método efectivo y ecológico para el tratamiento de aguas residuales generadas por la acuicultura, lo que permite reducir los impactos ambientales y mejorar la calidad del agua (Ullmann & Grimm, 2021; Abubakar et al., 2023). De esta forma, los desechos metabólicos de los peces o camarones enriquecen el medio principalmente con nitrógeno, carbono y fósforo y bien pueden ser considerados como un recurso para las microalgas, tomándolos como insumos para la generación de biomasa microalgal al mismo tiempo que se restaura la calidad del agua para su reuso en el cultivo de los peces (Nie et al., 2020; Goswami et al., 2021). Sin embargo, el tiempo de remediación puede variar dependiendo del tipo de efluente, la concentración de nutrientes y los parámetros fisicoquímicos del agua residual. Aunque las microalgas pueden reducir estos contaminantes a niveles seguros para su vertido en el medio ambiente, no siempre logran eliminar completamente el contaminante de interés. No obstante, la fitorremediación con microalgas ha demostrado generar hasta 1 kg de biomasa por metro cúbico de aguas residuales, lo cual es cinco veces mayor que los métodos convencionales tales como vías físicas o químicas.
Por lo tanto, su cultivo en estos medios no solo genera la biomasa microalgal necesaria para su uso como alimento, sino que también utiliza en su proceso un desecho, aportando un servicio que hace al proceso acuícola más sustentable (Goswami et al., 2021; Katiyar et al., 2021; Ullmann & Grimm, 2021).
En particular, el caso de estudio de la acuicultura de erizos de mar de la planta EriSea SA en Argentina, genera efluentes acuícolas que contienen altas concentraciones de compuestos nitrogenados y fosfatados, los cuales son actualmente desecho y pueden tener un impacto negativo en los cuerpos de agua receptores a mediano y largo plazo. Asimismo, en el proceso productivo de erizos de mar, es necesario la producción de microalgas debido a que son el alimento de las etapas tempranas del ciclo de vida, tanto en las larvas planctónicas como bentónicas del erizo y le proveen los nutrientes esenciales para crecer y desarrollarse (Chaar et al., 2021).
El objetivo del presente trabajo es evaluar la eficacia de las microalgas como agentes fitorremediadores del efluente acuícola producido por la cría de reproductores de erizos A. dufresnii. Para esto se usarán 6 microalgas de diferentes grupos funcionales y taxonómicos que se utilizan para la alimentación de larvas del erizo. De esta manera se busca acoplar el proceso de fitorremediación del efluente con la producción microalgal como alimento larvario, donde los compuestos nitrogenados y fosfatados del efluente sean depurados y en simultáneo se genere la biomasa microalgal para ser usada como alimento, buscando así generar un loop productivo sustentable. Se espera aportar así al desarrollo de una acuicultura sustentable desde un concepto de economías circulares. Esto es, tecnologías de tratamiento de efluentes acuícolas más eficientes y económicas que contribuyan al crecimiento responsable de la acuicultura de erizos de mar en Argentina, asegurando su sustentabilidad a largo plazo.
Materiales y métodos
Microalgas del cepario del CESIMAR-CONICET: Para el presente trabajo se utilizaron las microalgas marinas Cylindrotheca closterium (Ehrenberg) Reimann & J. C. Lewin, 1964, Rhodomonas salina (Wislouch) D. R. A. Hill & R.Wetherbee, 1989, Chaetoceros gracilis Schütt, 1895, Tetraselmis suecica (Kylin) Butcher, 1959, Nannochloropsis oculata (Hibberd, 1981) y Navicula sp. pertenecientes al banco de microalgas del CESIMAR-CONICET, Puerto Madryn, Argentina. Tanto R. salina, C. gracilis, T. suecica y N. galvana son microalgas de diferentes taxones pero con hábitos planctónicos, en tanto que Navicula sp. y C. closterium son diatomeas de hábito bentónico. Estas microalgas son según referencias bibliográficas, las microalgas ofertadas como alimento vivo en las etapas tempranas del ciclo de vida de diversos erizos de mar los cuales su cultivo ya fue desarrollado.
Los cultivos unialgales se mantienen en medio F/2 de Guillard (1975) (Tabla 1), monocepa no axénicas, en una cámara bajo condiciones controladas de luz, fotoperiodo 12h:12h luz: oscuridad, temperatura constante de 19 °C y 32 psu de salinidad.
Tabla 1 Receta de medio de cultivo F/2 Guillar. / Table 1. Recipe of F/2 Guillard culture medium.
| Componentes | Solución Stock | Cantidad | Concentración final | |
| 1 | NaNO3 | 75 g/L dH2O | 1 mL | 880 µM |
| 2 | NaH2PO4 •H2O | 5 g/L dH2O | 1 mL | 36 µM |
| 3 | Na2SiO3 • 9H2O | 30 g/L dH2O | 1 mL | 106 µM |
| 4 | Stock de Micronutrientes | |||
| 4.1 | ZnSO4•7H2O | 23 mg/l | 1mL | |
| 4.2 | MnSO4•H2O | 152 mg/l | 0.08 µM | |
| 4.3 | Na2MoO4•2H2O | 7.3 mg/l | 0.9 µM | |
| 4.4 | CoSO4•7H2O | 14 mg/l | 0.03 µM | |
| 4.5 | CuCl2•2H2O | 6.8 mg/l | 0.05 µM | |
| 4.7 | Fe(NH4)2(SO4)2•6H2O | 4.6 g/L | 0.04 µM | |
| 4.8 | Na2EDTA•2H2O | 4.4 g/L | ||
| 5 | Vitamina B12 | 1 mL/L | 1 mL | 11.7 µM |
| 6 | Biotina | 1 mL/L | ||
| 7 | Tiamina | 1 mL/L |
Adaptación al efluente acuícola: El efluente acuícola fue colectado durante recambio y limpieza de bateas de cultivo de los adultos reproductores de A. dufresnii en la planta de acuicultura EriSea SA y transportados en bidones de 20 L en refrigeración hasta el laboratorio. Las características nutritivas y fisicoquímicas del efluente utilizado comprenden: 1.93 mg/l de amonio (NH3), 6.65 mg/l de nitrato (NO3 ), 10.55 mg/l de fosfato (PO4), 33.71 psu de salinidad, 8.59 mg/l de oxígeno disuelto, solutos totales disueltos en 2.23 Kg/L, 756.55 mmhg de presión, 45 838.42 uS/cm de conductividad y 188.85 mV de potencial de oxido reducción.
Las microalgas seleccionadas provenientes del cepario del CESIMAR-CONICET, adaptadas al medio de cultivo F/2 Guillard (Tabla 1) fueron sometidas a un proceso de aclimatación al efluente proveniente de la planta acuícola de erizos de mar. Se utilizó un programa basado en diluciones seriadas en base 10, donde se fue incorporando el 10 % del efluente al medio F/2 cada 96 h (Tabla 2), hasta conseguir que las microalgas logren crecer en un medio compuesto al 100 % por el efluente de la planta completando este proceso al cabo de 28 días. Cabe aclarar que tanto el efluente detallado como el medio de cultivo F/2 , fueron previamente esterilizados mediante autoclave en ciclos de 10 minutos a 121 °C. Y que el efluente modificado, fue reforzado con vitaminas y micronutrientes según la receta de F/2 (Tabla 1).
Tabla 2 Programa de dilución seriada durante el proceso de adaptación microalgal. / Table 2. Schedule of serial dilution during the microalgal adaptation progress.
| Tiempo (en días) | Efluente acuícola | (Medio F/2) |
| 0 | 10 % | 90 % |
| 3 | 20 % | 80 % |
| 6 | 30 % | 70 % |
| 9 | 40 % | 60 % |
| 12 | 50 % | 50 % |
| 15 | 60 % | 40 % |
| 18 | 70 % | 30 % |
| 21 | 80 % | 20 % |
| 25 | 90 % | 10 % |
| 28 | 100 % | 0 % |
Diseño experimental: Se utilizaron las seis microalgas mencionadas, previamente adaptadas al nuevo medio de cultivo basado en el efluente acuícola. Se diseñó un experimento basado en dos tratamientos (efluente y medio de cultivo artificial) para las seis microalgas, y cada unidad experimental constó de tres réplicas. Se pretende evaluar el crecimiento y la capacidad de fitorremediación de todas las microalgas testeadas. Se trabajó en cultivo estanco o batch de 500 ml, haciendo un total de 36 cultivos en simultáneo (Tabla 3).
Tabla 3 Nomenclatura utilizada para cada tratamiento de microalgas cultivadas. / Table 3. Nomenclature used for each experimental treatment of cultured microalgae.
| Microalgas cultivadas | Efluente acuícola | Control (Medio F/2) | |
| Abreviaciones | |||
| Chaetoceros gracilis | CHA-EFLU | CHA-F/2 | |
| Rhodomona salina | RHO-EFLU | RHO-F/2 | |
| Nannochloropsis oculata | NANNO-EFLU | NANNO-F/2 | |
| Tetraselmis suecica | TETRA-EFLU | TETRA-F/2 | |
| Cylindrotheca closterium | CYL-EFLU | CYL-F/2 | |
| Navicula sp. | NAVI-EFLU | NAVI-F/2 | |
Cada tratamiento fue probado por triplicado. / Every treatment was probed with three replicates.
Variables respuesta medidas
Variables de crecimiento: Durante el experimento se tomaron muestras de cada cultivo para el seguimiento del crecimiento microalgal. Se juntaron 2 ml de muestra y se fijó con Lugol al 5 % para conteo de densidad celular mediante cámara de Neubauer. Asimismo, se tomaron muestras al inicio, intermedio y final del experimento para medir la biomasa (g/L) de cada cultivo. Las mismas fueron conservadas frescas en freezer a -20 °C hasta su uso. El método utilizado fue mediante gravimetría, donde se centrifugó en tres ciclos de 5 000 rpm, durante 5 min. El pellet obtenido fue lavado con agua destilada y nuevamente centrifugado por tres ciclos más. El pellet fue secado a estufa 60 °C hasta obtener peso constante.
El crecimiento máximo fue determinado utilizando la diferencia de mínimos cuadrados, con los datos de densidad (células/mL) obtenidas a lo largo del tiempo en la fase exponencial de crecimiento según la siguiente fórmula:
Donde Nf es el número de células/mL en el tiempo f (Tf) y No es el número de células/mL del tiempo inicial (To). SGRmax se expresa en unidades de máximas de divisiones celulares/día (div/día).
El tiempo de duplicación representa el menor tiempo en el cual el crecimiento (duplicación celular) en la fase exponencial de crecimiento microalgal es máxima, y se obtiene de la siguiente fórmula:
Td se expresa en Horas (h).
Variables fisicoquímicas: Se realizaron mediciones cada 48 h de los parámetros fisicoquímicos del cultivo tales como la temperatura (°C), presión (mmHg), porcentaje de oxígeno disuelto (%) y concentración de oxígeno disuelto (mg/l), conductividad (microS/cm), sólidos disueltos totales (g/L), salinidad (ppt), pH y potencial redox (mV) mediante una sonda multiparamétrica HANNA (YSI Pro Plus 6050000).
Variables de fitorremediación: Durante el inicio, intermedio y final del experimento se tomaron 10 mL de muestra que fue conservada en freezer, hasta el momento de las mediciones de NO3 y PO4, las cuales se realizaron con el equipo HANNA HR que mide en las unidades mg/l.
Posteriormente se obtienen los valores de remoción que son la expresión relativa porcentual de los valores de nitratos y fosfatos medidos según las siguientes fórmulas:
Donde f corresponde a la concentración final e i corresponde a la concentración inicial dentro de un periodo de medición.
Resultados
Crecimiento de las microalgas: En términos generales, podemos probar que el crecimiento medido tanto en términos de densidad celular (células/mL) como en biomasa acumulada (g/L), han sido significativamente superiores cuando el cultivo se realizó en el efluente acuícola respecto del medio de cultivo sintético (F/2) para todas las microalgas utilizadas (Tabla 3, Tabla 4, Fig. 1, Fig. 2).
Tabla 4 Crecimiento específico (μ), tiempo de duplicación (Td), máxima biomasa producida, productividad, remoción de NO3 y remoción de PO4 para las seis microalgas testeadas bajo cultivo en medio F/2 y en efluente. / Table 4. Specific growth rate (μ), doubling time (Td), maximum biomass production, productivity, remotion of NO3 and remotion of PO4 of the six microalgae tested under control (F/2) and effluent conditions.
| Microalga | Parámetros | F/2 | Efluente | ||
| Media | Desvío estándar | Media | Desvío estándar | ||
| CHAETO | SGRmax (Div/dia) | 0.668 | 0.19 | 1.021 | 0.0726 |
| Td (h) | 37.81 | 10.287 | 23.588 | 1.707 | |
| Biomasa max (g/L) | 1.533 | 0.358230373 | 2.5 | 0.141421356 | |
| Productividad (g/L/día) | 0.139363636 | 0.032566398 | 0.227272727 | 0.012856487 | |
| Eficacia remoción NO3 (%) | 100 | 0 | 100 | 0 | |
| Eficacia remoción PO4 (%) | 58.29383886 | 0 | 52.60663507 | 1 | |
| CYL | SGRmax (Div/día) | 0.4791 | 0.1322 | 1.186 | 0.1105 |
| Td (h) | 52.397 | 12.513 | 20.3456 | 1.8322 | |
| Biomasa max (g/L) | 1.917 | 0.054580216 | 3.533333333 | 0.838649708 | |
| Productividad (g/L/día) | 0.174272727 | 0.004961838 | 0.321212121 | 0.076240883 | |
| Eficacia remoción NO3 (%) | 100 | 0 | 100 | 0 | |
| Eficacia remoción PO4 (%) | 67.77251185 | 0.8 | 62.09 | ||
| RHO | SGRmax (Div/dia) | 0.5691 | 0,1885 | 1.423 | 0.0738 |
| Td (h) | 45.897 | 17.123 | 16.894 | 0.9 | |
| Biomasa max (g/L) | 1 | 0.409267639 | 3.499966667 | 0.499950001 | |
| Productividad (g/L/día) | 0.090909091 | 0.037206149 | 0.318178788 | 0.04545 | |
| Eficacia remoción NO3 (%) | 100 | 0 | 100 | 0 | |
| Eficacia remoción PO4 (%) | 91.46919431 | 7.7 | 27.01421801 | 1.2 | |
| NANNO | SGRmax (Div/dia) | 0.4785 | 0.229 | 1.778 | 0.3431 |
| Td (h) | 57.032 | 21.594 | 13.843 | 2.6899 | |
| Biomasa max (g/L) | 2.45 | 0.494974747 | 3.9 | 0.282842712 | |
| Productividad (g/L/día) | 0.222727273 | 0.044997704 | 0.354545455 | 0.025712974 | |
| Eficacia remoción NO3 (%) | 100 | 0 | 100 | 0 | |
| Eficacia remoción PO4 (%) | 62.08530806 | 1.2 | 34.5971564 | 1.3 | |
| TETRA | SGRmax (Div/día) | 0.8884 | 0.203 | 1.2086 | 0.0575 |
| Td (h) | 27.97 | 6.343 | 19.8865 | 0.9221 | |
| Biomasa max (g/L) | 1.533333333 | 0.1040833 | 3.896666667 | 0.262741952 | |
| Productividad (g/L/día) | 0.139393939 | 0.009462118 | 0.354242424 | 0.023885632 | |
| Eficacia remoción NO3 (%) | 100 | 0 | 100 | 0 | |
| Eficacia remoción PO4 (%) | 65.87677725 | 0.9 | 50.71090047 | 1.1 | |
| NAVI | SGRmax (Div/día) | 1.264 | 0.2707 | 1.994 | 0.088 |
| Td (h) | 19.539 | 3.919 | 12.051 | 0.534 | |
| Biomasa max (g/L) | 1.3 | 0.173205081 | 4.333333333 | 0.2081666 | |
| Productividad (g/L/día) | 0.118181818 | 0.015745916 | 0.393939394 | 0.018924236 | |
| Eficacia remoción NO3 (%) | 100 | 0 | 100 | 0 | |
| Eficacia remoción PO4 (%) | 62.08530806 | 0.6 | 73.45971564 | 1.2 | |
Valores expresados en media ± desviación estándar (n = 3). / Values are expressed as an average ± standard deviation (n = 3).
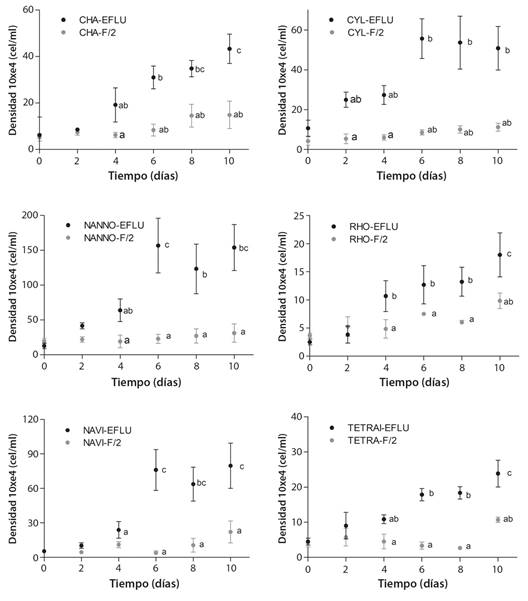
Fig. 1 Densidad celular medida en células por mililitro (cel/ml) durante el experimento de seis microalgas testeadas bajo condiciones de efluente y control. Valores expresados como media ± desviación estándar (n = 3). / Fig. 1. Microalgae density expressed in cells per milliliter (cell/ml) of the six microalgae tested under control and effluent conditions. Values are expressed as an average ± standard deviation (n = 3).
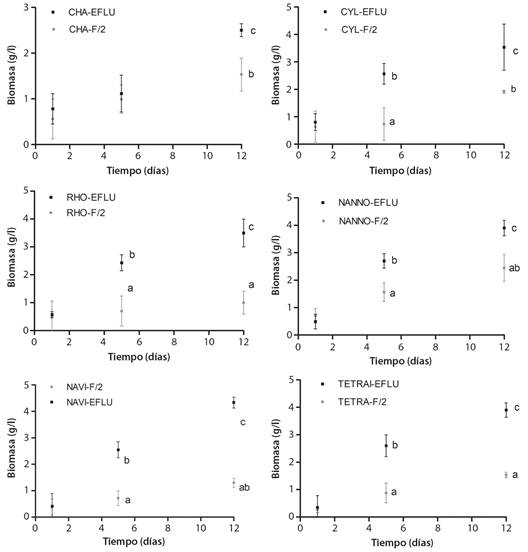
Fig. 2 Biomasa seca (gramos/ día) durante el experimento de seis microalgas testeadas bajo condiciones de efluente y control. Valores expresados como media ± desviación estándar (n = 3). / Fig. 2. Dry biomass expressed of grams per day (gr/d) of the six microalgae tested under control and effluent conditions. Values are expressed as an average ± standard deviation (n = 3).
Cuando se evalúa la densidad celular (células/mL), y considerando que se partió de la misma densidad de cultivo para todos los tratamientos, podemos determinar que la fase exponencial de crecimiento, determinada como la etapa de mayor crecimiento (tasa de división celular) en el tiempo, sucede entre los días 4 y 6 de cultivo para todas las microalgas testeadas tanto en medio de cultivo F/2 como en efluente (Fig. 1, Tabla 4). Sin embargo, tanto Navicula sp. como N. galvana han reflejado los valores significativamente mayores en densidad celular obtenida (Fig. 1). Otra característica general observada para todas las microalgas es que una vez culminada la fase de crecimiento exponencial (posterior a los 6 días de cultivo) no se observan cambios significativos en el crecimiento medido en términos de densidad celular.
Cuando observamos la biomasa (g/L) obtenida de todas las microalgas utilizadas, podemos confirmar que el comportamiento es el mismo, donde las mayores biomasas obtenidas son bajo el cultivo en el efluente acuícola, siendo Navicula sp. y N. galvana, conjuntamente con la microalga T. suecica las que reflejan las mayores producciones tanto en el centro de la fase exponencial de crecimiento (día 5) como en la fase final del experimento denominada fase estacionaria (día 12) (Tabla 3, Tabla 4, Fig. 2).
Remediación de nutrientes por parte de las microalgas: La fitorremediación del efluente acuícola fue lograda con todas las microalgas testeadas (Tabla 5). El nitrato (NO3) del efluente fue removido en un 100 % para todas las microalgas, siendo C. closterium, N. galvana, T. suecica y Navicula sp.las que lograron la remoción total de este componente durante la fase de crecimiento exponencial, es decir antes del día 6 (Tabla 5). Respecto al fosfato (PO4), C. closterium y Navicula sp. fueron las microalgas que más rápidamente removieron el componente (Tabla 4) siendo C. closterium la única que pudo removerlo al 100 %. Las demás microalgas no lograron la remoción total debido a que los valores en el efluente son el triple en cantidad (mg/l) a los que necesitan las microalgas para su crecimiento (Guillard, 1975; Tabla 4).
Tabla 5 Valores de nitrato (NO3) y fosfato (PO4) expresados en media y desvío estándar, junto con el porcentaje (%) de remediación por parte de cada microalga durante los 11 días del experimento. / Table 5. Nitrate (NO3) and phosphate (PO4) values in media, standard deviation, and remediation (%) of each microalgae tested during 11 days of experiment.
| Microalga | Nutriente | día | F/2 | EFLUENTE | ||||
| media | desvío estándar | % remediación | media | desvío estándar | % remediación | |||
| CHA | NO3 | 1 | 7.48 | 0.00 | 0.00 | 6.65 | 1.48 | 0.00 |
| 5 | 0.40 | 0.00 | 94.65 | 0.80 | 1.10 | 87.97 | ||
| 11 | 0.00 | 0.00 | 100.00 | 0.00 | 0.00 | 100.00 | ||
| PO4 | 1 | 3.10 | 0.00 | 0.00 | 10.55 | 0.92 | 0.00 | |
| 5 | 1.90 | 0.00 | 38.71 | 8.90 | 0.30 | 15.64 | ||
| 11 | 0.40 | 0.00 | 87.10 | 5.00 | 1.00 | 52.61 | ||
| CYL | NO3 | 1 | 7.48 | 0.00 | 0.00 | 6.65 | 1.48 | 0.00 |
| 5 | 0.00 | 0.00 | 100.00 | 0.00 | 0.00 | 100.00 | ||
| 11 | 0.00 | 0.00 | 100.00 | 0.00 | 0.00 | 100.00 | ||
| PO4 | 1 | 3.10 | 0.00 | 0.00 | 10.55 | 0.92 | 0.00 | |
| 5 | 2.00 | 1.00 | 35.48 | 9.30 | 0.50 | 11.85 | ||
| 11 | 1.40 | 0.80 | 54.84 | 4.00 | 0.00 | 62.09 | ||
| RHO | NO3 | 1 | 7.48 | 0.00 | 0.0 | 6.65 | 1.48 | 0.00 |
| 5 | 0.20 | 0.60 | 96.99 | 5.10 | 1.10 | 23.31 | ||
| 11 | 0.00 | 0.00 | 100.00 | 0.00 | 0.00 | 100.00 | ||
| PO4 | 1 | 3.10 | 0.00 | 0.00 | 10.55 | 0.92 | 0.00 | |
| 5 | 1.70 | 1.00 | 45.16 | 9.60 | 2.10 | 9.00 | ||
| 11 | 0.90 | 0.80 | 70.97 | 7.70 | 1.20 | 27.01 | ||
| NANNO | NO3 | 1 | 7.48 | 0.00 | 0.00 | 6.65 | 1.48 | 0.00 |
| 5 | 3.50 | 0.00 | 53.20 | 0.00 | 0.00 | 100.00 | ||
| 11 | 0.00 | 0.00 | 100.00 | 0.00 | 0.00 | 100.00 | ||
| PO4 | 1 | 3.10 | 0.00 | 0.00 | 10.55 | 0.92 | 0.00 | |
| 5 | 1.90 | 0.90 | 38.71 | 7.10 | 0.90 | 32.70 | ||
| 11 | 1.00 | 1.20 | 67.74 | 6.90 | 1.30 | 34.60 | ||
| TETRA | NO3 | 1 | 7.48 | 0.00 | 0.00 | 6.65 | 1.48 | 0.00 |
| 5 | 0.00 | 0.00 | 100.00 | 0.00 | 0.00 | 100.00 | ||
| 11 | 0.00 | 0.00 | 100.00 | 0.00 | 0.00 | 100.00 | ||
| PO4 | 1 | 3.10 | 0.00 | 0.00 | 10.55 | 0.92 | 0.00 | |
| 5 | 2.70 | 0.40 | 12.90 | 8.60 | 1.40 | 18.48 | ||
| 11 | 0.60 | 0.90 | 80.65 | 5.20 | 1.10 | 50.71 | ||
| NAVI | NO3 | 1 | 7.48 | 0.00 | 0.00 | 6.65 | 1.48 | 0.00 |
| 5 | 0.00 | 0.00 | 100.00 | 0.00 | 0.00 | 100.00 | ||
| 11 | 0.00 | 0.00 | 100.00 | 0.00 | 0.00 | 100.00 | ||
| PO4 | 1 | 3.10 | 0.00 | 0.00 | 10.55 | 0.92 | 0.00 | |
| 5 | 1.90 | 0.50 | 38.71 | 5.70 | 2.10 | 45.97 | ||
| 11 | 1.00 | 0.60 | 67.74 | 2.80 | 1.20 | 73.46 | ||
Parámetros fisicoquímicos del cultivo: Los parámetros fisicoquímicos monitoreados durante el experimento (cada 48h) temperatura, salinidad y presión atmosférica se han conservado estables. La temperatura medida de cada cultivo tuvo una fluctuación de entre 19.9 y 21.2 °C para todas las unidades experimentales réplicas. La salinidad fluctuó entre 33.59 y 33.72 psu. La presión atmosférica tuvo una fluctuación entre 756 y 762.8 mmHg. Sin embargo, el oxígeno disuelto medido en mg/l mostró valores significativamente superiores en todas las microalgas cultivadas en el tratamiento de efluente (Apéndice 1, Fig. 3). Particularmente, durante los días 4, 5 y 6 de cultivo corresponden a la fase exponencial de crecimiento, donde la tasa de división celular es máxima y conjuntamente a esto se obtienen los valores mayores de O2, siendo este un producto metabólico del crecimiento (Fig. 3). Estos resultados de producción de O2 se condicen con los tratamientos donde mayor crecimiento en términos de biomasa y densidad se obtuvieron.
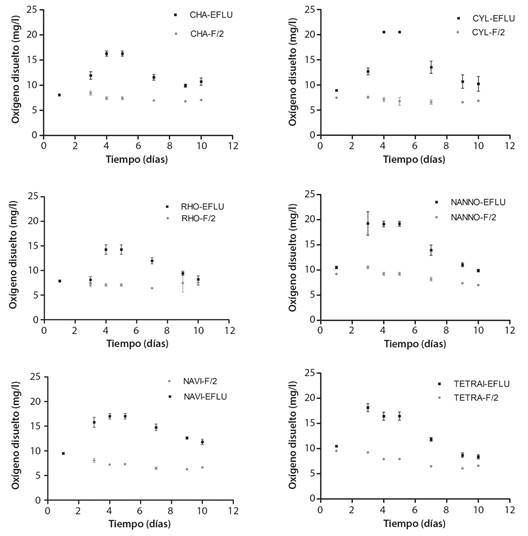
Fig. 3 Oxígeno disuelto expresado en miligramos por litro durante el experimento de seis microalgas testeadas bajo condiciones de efluente y control. Valores expresados como media ± desviación estándar (n = 3). / Fig. 3. Dissolved Oxygen (OD) expressed in miligrams per liter during the experiment of the six microalgae tested under control and effluent conditions. Values are expressed as an average ± standard deviation (n = 3).
Respecto a la variable fisicoquímica pH, el comportamiento fue diferencial para los tratamientos bajo cultivo en efluente acuícola. Si bien todos los tratamientos (efluente y medio de cultivo F/2) comenzaron con valores de pH promediando los 8 puntos, una vez avanzada la fase exponencial de cultivo (a partir del día 4) los valores de pH medidos en todas las microalgas bajo cultivo en efluente arrojaron valores superiores promediando los 10 puntos al finalizar el experimento (Fig. 4).
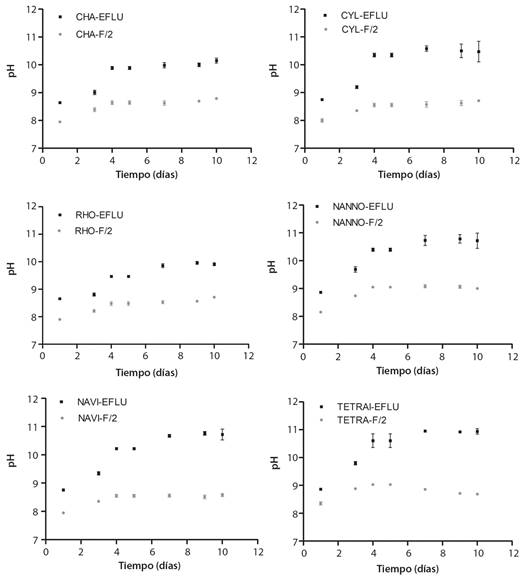
Fig. 4 Valores de pH durante el experimento de seis microalgas testeadas bajo condiciones de efluente y control. Valores expresados como media ± desviación estándar (n = 3). / Fig. 4. Ph during the experiment of the six microalgae tested under control and effluent conditions. Values are expressed as an average ± standard deviation (n = 3).
Los resultados obtenidos en el presente trabajo, evaluados de forma integral considerando tanto la productividad microalgal como los valores de los componentes a remediar (Tabla 4, Tabla 5) aportan conocimiento científico novedoso para el uso de las microalgas como agentes fitorremediadores del efluente acuícola producido por la cría de reproductores de erizos A. dufresnii.
Discusión
El cultivo de microalgas en aguas de descarte o residuales es una propuesta de sustentabilidad enmarcada en el paradigma de economías circulares, donde se busca una doble ventaja. Por un lado, recuperar la calidad del efluente ya sea para su reuso o para su vertido en condiciones dentro del marco regulatorio, y por otro lado generar una biomasa microalgal rica en nutrientes (de Cassia Soares Brandão et al., 2023; Sherwood, 2020; Stegmann et al., 2020; Torekhanova et al., 2023). Numerosos estudios han presentado información relevante en el tratamiento de aguas residuales mediante microalgas, mayoritariamente en efluentes de agua dulce procedentes de la industria de la agricultura y/o de aguas domésticas (de Cassia Soares Brandão et al., 2023; Torekhanova et al., 2023). La microalgas del género Chlorella y Clamydomona son las más utilizadas para la purificación de aguas residuales de estanques de cultivo (Velichkova et al., 2014); sin embargo, recientes estudios han utilizado microalgas marinas para la fitorremediación tales como Nannochlbropsis oculata (Droop 1955) Hibberd 1981 y Tetraselmis chuii Butcher, 1959, las cuales exhiben potencial de acumulación de fósforo y nitrógeno, ambos compuestos presentes en los efluentes líquidos de la acuicultura (Velichkova et al., 2016).
Los resultados del presente estudio apoyan esta corriente de investigación en términos de fitorremediación, dado que muestran que es posible usar el efluente procedente de la acuicultura del erizo de mar A. dufresnii como medio de cultivo para las microalgas seleccionadas, si previamente se aclimatan a este medio. Asimismo, se comprueba que todas las microalgas tuvieron la capacidad de depurar el contenido de nitrato y fosfato presentes, al mismo tiempo que incrementaron su crecimiento en términos de densidad celular y biomasa microalgal, a valores significativamente superiores a los obtenidos mediante el cultivo en el medio artificial (F/2) (Tabla 4, Tabla 5, Apéndice 1).
Evaluando la capacidad remediadora del nitrato, todas las microalgas utilizadas han podido depurar al 100 % (Tabla 4, Tabla 5, Apéndice 1). Considerando que el nitrógeno es un elemento crucial para el crecimiento de las microalgas, necesario para la síntesis de materiales genéticos (ADN y ARN), moléculas de transferencia de energía (ATP y ADP), elementos funcionales (proteínas, péptidos y enzimas) y elementos estructurales (cloroplasto, mitocondrias, etc.) (Wu et al., 2022), no es posible el crecimiento microalgal en su ausencia. A pesar de la reducida presencia de amonio no monitoreado durante el proceso experimental de este trabajo, se considera la hipótesis que fue utilizado como fuente alternativa al nitrato según muestran los perfiles de valores de pH, los cuales arrojan valores estables para el tratamiento de cultivo en medio F/2, con valores promedio de entre 8 y 9 (Fig. 4). Sin embargo, para todas las microalgas estudiadas bajo cultivo en efluente acuícola, los valores de pH fluctuaron más de 2 unidades (de 8 a casi 11; Fig. 4). Esta hipótesis de uso alternativo de amonio como fuente de nitrógeno se basa en que cuando se utiliza amonio como única fuente de nitrógeno, el pH del medio tiende a fluctuar notablemente debido al proceso de asimilación, que en última instancia y en exceso inhibe el crecimiento, además que su uso es energéticamente menos costoso que el uso del nitrato (Wen & Chen, 2003).
Respecto a la remoción de fosfato, todas las microalgas analizadas lograron depurarlo, aunque las diatomeas C. closterium y Navicula sp. obtuvieron los mayores porcentajes (62.09 % y 73.45 % respectivamente, Tabla 5, Apéndice 1). Sin embargo, se observó que el porcentaje de eliminación no fue del 100 %; esto se debe a una cantidad excesiva de fosfato en el medio en comparación con la relación N:P requerida para el crecimiento microalgal (Guillard, 1975). El fósforo (P) es otro nutriente esencial para la síntesis de ácidos nucleicos, la transferencia de energía, los lípidos, las proteínas, los fosfolípidos y el metabolismo de los carbohidratos (Wen & Chen, 2003) y su fórmula inorgánica es la forma preferida para el crecimiento y metabolismo de microalgas (Gumbi et al., 2022; Sutherland & Bramucci, 2022). Estudios demuestran que las microalgas tienen una característica ventajosa respecto de este nutriente dado que pueden almacenar su exceso en gránulos celulares, condición que maximiza así la absorción de fósforo de las aguas residuales que contienen altas concentraciones (Gupta et al., 2019; Lage et al., 2021; Xing et al., 2021). Aun así, el efluente acuícola utilizado en este estudio se encontraba con niveles tres veces superior al proporcionado en la elaboración del medio F/2 (3.10 mg/l F/2 y 10.55 mg/l respecto del efluente, Tabla 5). Los hallazgos del presente estudio sugieren entonces que las microalgas evaluadas no fueron ineficaces en la remediación de fosfato; en cambio, el medio contenía un sobre exceso de este nutriente en relación al contenido de Nitrógeno.
Nuestros resultados adhieren a la bibliografía preexistente que demuestra el rol como agentes fitorremediadores de las microalgas, siendo la más estudiada el género Chlorella sp (Velichkova et al., 2014). Sin embargo, las microalgas Nannochloropsis, Tetraselmis, (Septory & Triyatmo, 2016), S, pirulina (Wuang et al., 2016), Scenedesmus, Ankistrodesmus (Ansari et al., 2017), Chlorococcum, Parachlorella (Liu et al., 2019), Euglena, Chlamydomonas, Oscillatoria, Micractinium y Golenkinia (Rearte et al., 2021) son géneros microalgales también estudiados para su uso como agentes fitorremediadores de aguas reportando resultados efectivos en cuanto a remoción de amoníaco, nitrato, nitrito y DQO de las aguas residuales para construir su estructura celular. Sin embargo, los resultados del presente trabajo arrojan información novedosa de varias microalgas poco probadas en procesos de fitorremediación, como lo son Rhodomona salina, C. gracilis y Navicula sp. Se ha reportado que el género Nannochloropsis a removido el nitrato de 2.27 mg/l a 0.753 mg/l, tanto como el fosfato de 3.56 mg/l a 0.905 mg/l al cabo de 14 días para efluente acuícola de coral (Septory & Triyamo, 2016). El presente trabajo acuerda con lo ya reportado para el género Nannochloropsis, incluso con valores superadores, donde se ha obtenido una remoción del 100 % del nitrato y del 34 % del fosfato (de 10.55 a 6.99 mg/l en 11 días), conjuntamente con la obtención de un significativo incremento de la productividad microalgal. Asimismo, en concordancia y superando la información precedente para el género Tetraselmis (John et al., 2020), quienes reportan valores de remoción de nitrato de 0.96 mg/l a 0.15 mg/l y de fosfato e 3.4 mg/l a 2.6 mg/l al cabo de 10 días, los resultados del presente estudio arrojan datos de remoción de nitrato del 100 % y de fosfato de 10.55 a 5.20 mg/l en 11 días.
Sumado a la capacidad fitorremediadora de las microalgas estudiadas, todas aumentaron su crecimiento en términos de densidad celular, biomasa microalgal y productividad, respecto al medio de cultivo artificial (F/2) utilizado habitualmente en la producción de microalgas de la planta acuícola del erizo de mar (Tabla 4). Las microalgas N. galvana y Navicula sp. fueron las que mayores valores de biomasa reflejaron (Apéndice 1, Fig. 2), lo que condice con valores significativamente superiores en tasas de duplicación (Td) de las 13.8 y 12.1 horas, respectivamente para los cultivos en efluente. Sin embargo, aunque las microalgas C. gracilis, C. closterium, R. salina y T. suecica reflejaron valores de crecimiento menores, en todas ellas también se obtuvieron tasas de crecimiento, biomasa y productividad significativamente más altos que en el cultivo bajo medio artificial (F/2) (Fig. 1, Fig. 2, Apéndice 1). Respecto a la cinética de crecimiento, todas las microalgas manifestaron su mayor tasa denominada SGR (div/día) entre los días 4 y 7 de cultivo. Este periodo de tiempo es considerado el periodo de máximo crecimiento (Fig. 1, Fig. 2), el cual también refleja para todas las algas estudiadas las mayores tasas de oxígeno disuelto en mg/l como producto metabólico del crecimiento (Fig. 3).
Estos resultados de laboratorio, si se mantuvieran a escala productiva, se traduciría en un impacto significativo en la reducción de los costos asociados a la producción microalgal para alimentar a larvas del erizo, cambiando el uso del tipo de medio de cultivo actual (F/2) por el proveniente del descarte. Por lo tanto, no solo se está solucionando un problema de restauración de aguas con su vertido en condiciones más seguras para el medio ambiente, es decir valores de nitratos y fosfatos permitidos por normativa, sino que se está generando una producción de biomasa nutritiva a base de microalgas marinas necesarias para el proceso de producción acuícola especialmente en la alimentación larvaria del erizo. Además, si bien no se hizo una evaluación de costos, la elaboración de un medio de cultivo artificial como lo es el F/2 implica un costo en el proceso productivo de microalgas que podría evitarse y en su reemplazo utilizar el efluente haciendo el proceso más económico. Sumado a esto, y considerando que la mayor tasa de crecimiento (SGR) es donde se obtienen valores significativamente elevados de biomasa microalgal y reducción de ambos componentes a remediar (Fig. 2, Tabla 4), se considera que posterior al día 6 es recomendable la cosecha en términos tanto productivos como económicos, al menos a escala laboratorio de cultivo.
Contextualizando la información obtenida con el concepto de bioeconomía circular, la cual prevé una integración de la utilización sostenible de los recursos, incluidos los desechos, y la valorización de la biomasa de origen natural (Sherwood, 2020; Stegmann et al., 2020), la producción de microalgas en este escenario es posible e incluso ventajosa en términos de biomasa obtenida rica en nutrientes con alto valor en el mercado, remediación de un descarte y reducción de costos asociados al proceso (Chew et al., 2017; Das et al., 2019; Katiyar et al., 2021; Rathod, 2014; Ullmann & Grimm, 2021).
Por lo tanto, los avances en investigación proporcionados en este trabajo ponen de manifiesto que es posible aumentar los estándares de sustentabilidad de la acuicultura del erizo de mar, considerado este como cualquier instancia dentro del proceso productivo que use o reúse un desecho como insumo. Es por esto que, este trabajo prueba que se puede generar un “loop” o bucle circular productivo, aprovechando el descarte del efluente proveniente del cultivo de los reproductores del erizo de mar para la generación de microalgas que servirán de alimento para las larvas de la siguiente cohorte productiva. Sumado a esto, no solo se obtiene beneficio del recurso hídrico que actualmente es descartado, sino que también se reducen costos asociados al proceso productivo microalgal y podría ser una estrategia de fitorremediación que en simultáneo a la reducción del impacto ambiental del vertido del efluente ofrezca un agregado de valor o etiqueta verde en el proceso productivo integral de la empresa EriSea SA (John et al., 2020).
Por lo tanto, se concluye que se puede optimizar el proceso productivo del erizo de mar dentro del paradigma de economías circulares, al menos en la etapa de producción microalgal como alimento para las larvas del erizo, utilizando el desecho de efluente acuícola del lote de reproductores como medio de cultivo. Estos resultados inspiran a seguir escalando el proceso y su validación tecnológica a escala, para fomentar así la expansión de la actividad de acuícola del erizo de mar de forma sustentable, creando un sistema productivo desarrollado sobre un compromiso ambiental y mejorando así los estándares en innovación de la sustentabilidad de la industria.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.
Ver material suplementario











 uBio
uBio