Introducción
El interés por comprender la diversidad de rasgos funcionales ha incrementado considerablemente en los últimos años; siendo una herramienta clave para el desarrollo de estudios ecológicos, biogeográficos y de conservación (Magneville et al., 2022). La diversidad funcional (DF) se define como la variedad de rasgos funcionales presentes en una comunidad, los cuales están directamente relacionados con una función ecológica (Maire et al., 2015; Magneville et al., 2022). Se considera que un atributo funcional es un rasgo o propiedad medible que define el rol y función de una especie dentro del ecosistema (Lueder et al., 2022). A diferencia de la diversidad taxonómica que se basa únicamente en la abundancia relativa de las especies, la diversidad funcional posibilita la comprensión de los procesos que ocurren en una comunidad y son determinantes de su estabilidad y dinámica (Bagousse-Pinguet et al., 2019). Por lo tanto, la diversidad funcional es una faceta que provee información sobre las estrategias de vida de los organismos, dado que incluye algunos componentes fenotípicos de los organismos (Salgado-Negret, 2015).
Las aves son un grupo de vertebrados muy diverso con una amplia variedad de caracteres funcionales (Rengel et al., 2013), lo que les permite contribuir a la integridad y dinámica de los ecosistemas (Morante-Filho & Faria, 2020). Entre las funciones que desempeñan se resalta la dispersión de semillas, polinización y control biológico de plagas (Whelan et al., 2008). Asimismo, se han establecido como un grupo bastante sensible a los cambios del entorno, por lo que pueden indicar fácilmente el estado biológico de un lugar (Maruri et al., 2013). Para Colombia se estiman 1 966 especies de aves (Echeverry-Galvis et al., 2022), entre las cuales, cerca de 800 especies están registradas en el departamento de Tolima, como resultado de la gran diversidad de suelos y climas que comprende esta región (Orozco et al., 2021).
El Tolima se ubica en la región del Alto Magdalena, entre las cordilleras Central y Oriental de los Andes (García-Herrera et al., 2019). Presenta una superficie de 23 582 km2; representado el 2.1 % del territorio nacional (García-Herrera et al., 2019). Cuenta con una temperatura promedio de 24 °C (Gobernación del Tolima, 2020) y 12 zonas de vida, que se distribuyen entre los 300 y 5 000 m.s.n.m., otorgándole una gran diversidad de ecosistemas terrestres y acuáticos (García-Herrera et al., 2019). Sin embargo, en el departamento, el Bosque Seco Tropical (bs-T) representa una de las zonas más degradadas y menos conocidas, lo que resalta la importancia de estudiar su biodiversidad para la formulación de planes de manejo y estrategias de conservación (Losada-Prado & Molina-Martínez, 2011).
En la actualidad, estudiar la influencia de los factores ambientales sobre la diversidad taxonómica y funcional de aves representa gran relevancia en investigaciones ecológicas (Chapman et al., 2018). Su estudio ha sido esencial para predecir posibles respuestas y cambios en la estructura y composición de las comunidades debido a variaciones climáticas (Vaccaro & Bellocq, 2019) o a la alteración del hábitat por intervención antrópica (Jiguet et al., 2007). Estas investigaciones han permitido tomar decisiones adecuadas sobre el manejo de los ecosistemas y a proponer estrategias eficaces de conservación (Bruno et al., 2016), que conduzcan a proteger la gran diversidad de aves que constituyen el sostén de una variedad de servicios ecosistémicos de los que depende la sociedad humana (Andrade, 2011).
Por otra parte, son muy reducidos los estudios de diversidad funcional en aves en el Valle Alto del Magdalena, lo que representa un campo de investigación poco explorado (Castillo-Téllez & Díaz-Varón, 2019). Para el municipio de Armero, en el Centro Universitario Regional del Norte (CURDN) de la Universidad del Tolima; localizado en la zona de vida de bs-T, se han identificado alrededor de 108 especies de aves (Losada-Prado & Molina-Martínez, 2011). Aunque se han realizado investigaciones que se han centrado en aspectos como la estimación de la densidad poblacional de especies de aves de la familia Vireonidae (Pacheco-Vargas & Losada-Prado, 2015) y Thamnophilidae (Gaitán, 2013), así como los ciclos reproductivos y de muda de especies de la familia Thraupidae (Moreno-Palacios et al., 2013), aún no se han llevado a cabo estudios de diversidad funcional de la comunidad de aves. Por esta razón, resulta relevante fomentar el desarrollo de proyectos que aporten a los vacíos de información. En este contexto, el presente estudio tiene como objetivo determinar cambios o patrones en la diversidad taxonómica y funcional de la avifauna del CURDN durante un periodo de ocho años, con el fin de comprender la dinámica de la comunidad de aves en una escala multi-temporal.
Materiales y métodos
Área de estudio: El estudio se llevó a cabo en el Centro Universitario Regional del Norte (CURDN) de la Universidad del Tolima bajo el Programa de Monitoreo de Aves en Bosque Seco, dirigido por Sergio Losada Prado y el Grupo de Investigación en Zoología de esta misma institución. La localidad corresponde a la zona de vida de bosque seco tropical (bs-T) (Holdridge, 1978), ubicado en el municipio de Armero-Guayabal al Noroeste del departamento del Tolima (4°45’25.9” N & 74°52’20.8” W) (Fig. 1).
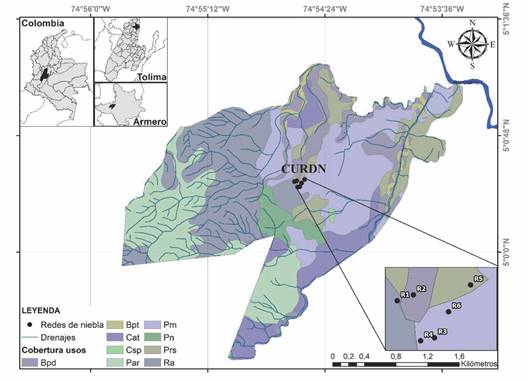
Fig. 1 Localización del Centro Universitario Regional del Norte (CURDN) de la Universidad del Tolima, Armero-Guayabal, zona de vida bosque seco tropical (bs-T). Bpd: bosque protector potencialmente productor, Bpt: bosque protector, Cat: cultivos anuales o transitorios, Csp: cultivos semipermanentes y permanentes, Par: pastos arbolados, Pm: pastos manejados, Pn: pastos naturales, Prs: pastos con rastrojos, Ra: rastrojo. / Fig. 1. Location of the Centro Universitario Regional del Norte (CURDN) of Tolima University, Armero-Guayabal, tropical dry forest. Bpd: protective forest potentially productive, Bpt: protective forest, Cat: annual or transitory crops, Csp: semi-permanent and permanent crops, Par: managed pastures, Pm: pasture management, Pn: natural pastures, Prs: pastures with shrubs, Ra: shrubs.
El área de estudio presenta una temperatura promedio de 28 °C (Sánchez-Guzmán et al., 2018), con una humedad relativa que oscila entre el 55 y el 83 % (Esquivel et al., 2016). Además, cuenta con un régimen pluviométrico bimodal; siendo marzo-mayo y septiembre-noviembre el periodo de lluvias y de diciembre-febrero y junio-agosto el periodo de sequía. El área de estudio abarca una extensión aproximada de 10 ha (Sánchez-Guzmán et al., 2018), que incluye fragmentos de bosque, zonas de cultivo y áreas con vegetación en proceso de regeneración (Vega, 2017).
Recolección de datos: Los datos utilizados en esta investigación fueron proporcionados por el Programa de Monitoreo de Aves en Bosque Seco de la Universidad del Tolima. La fase de campo se llevó a cabo durante los meses de marzo a abril y de septiembre a octubre, entre los años 2010 y 2017. Para la recolección de datos se utilizaron seis redes de niebla (12 x 2.5 m, 36 mm de ojo de malla) durante dos días consecutivos en horarios de 06:00-11:00 y de 15:00-17:30, con un esfuerzo de muestreo de 150 horas/red. Los individuos capturados fueron anillados, medidos y posteriormente liberados. La información registrada para cada uno de ellos correspondió a la identificación de la especie, determinación del sexo y la edad; siguiendo el sistema de clasificación tradicional (juvenil/inmaduro/adulto). Se registraron 14 rasgos morfológicos para cada individuo, los cuales están relacionados con la adquisición de recursos, reproducción, movilidad e intercambio de energía en el ecosistema (Salgado-Negret, 2015). Los datos pluviométricos se obtuvieron a partir de la base de datos del Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM).
Análisis de datos: Se recolectó un total de 2 691 registros de aves. Los análisis se realizaron excluyendo las recapturas para evitar un reconteo de individuos. Estos datos fueron organizados de manera que permitieran determinar cambios en la comunidad de aves a lo largo de los años y en diferentes épocas climáticas (alta y baja precipitación). Para evaluar la diversidad taxonómica alfa a lo largo de los años se usaron los índices de Shannon-Wiener (H), dominancia de Simpson (D), riqueza específica (S) y equidad de Pielou (J’), a través de la librería ‘vegan’ en el programa de R (R Core Team, 2021). A partir de los anteriores índices, se realizó el test de Kruskal-Wallis y de Dunn, con el fin de determinar si existían diferencias estadísticamente significativas entre los resultados obtenidos en los diferentes años evaluados (Dinno, 2015; Kruskal & Wallis, 1952). Para representar los resultados gráficamente se emplearon las librerías ‘ggplot2’, ‘ggpubr’ y ‘FSA’.
Para evaluar cambios en la composición de la comunidad entre los años, se utilizaron las librerías ‘ade4’ y ‘adespatial’ para calcular el índice de similitud de Jaccard; cuyos datos están basados en la presencia/ausencia de las especies y Bray-Curtis; en relación a la abundancia de las especies (Morelli & Verdi, 2014). La diversidad beta taxonómica se descompuso en recambio y anidamiento, siguiendo lo propuesto por Baselga (2010).
Para los análisis de diversidad funcional se utilizaron siete variables cuantitativas (MST1) relacionadas con la alimentación, movilidad, reproducción e intercambio de materia y energía. Estas variables se consideraron características funcionalmente relevantes, que inciden en el crecimiento y supervivencia de los individuos de una comunidad, así como en el funcionamiento del ecosistema (Rincón-Parra et al., 2022).
La diversidad funcional (DF) se calculó por medio de las librerías ‘FD’ y ‘vegan’, junto con las funciones ‘quality_funct_space.R’, ‘plot_funct_space.R’ y ‘multidimFD.R’. Los datos se estandarizaron bajo el método ‘standardize’, con el fin de dar el mismo peso a todos los rasgos (Laliberte & Legendre, 2010). Para obtener las coordenadas del espacio multidimensional de los rasgos de las especies, se realizó el Análisis de Coordenadas Principales (PCoA) a partir de la matriz de distancia funcional (López-Delgado, 2019). Se analizaron los cuatro primeros componentes y se empleó la distancia ‘euclidiana’, debido a que solo se manejaron variables continuas (Maire et al., 2015).
Se estimaron seis índices complementarios para describir cuantitativamente la diversidad alfa funcional entre los años evaluados: riqueza funcional (FRic), especialización funcional (FSpe), originalidad funcional (FOri), divergencia funcional (FDiv), equitatividad funcional (FEve) y dispersión funcional (FDis). FRic es el espacio multidimensional ocupado por todas las especies, indicando la combinación de diferentes rasgos (Leitão et al., 2016). FSpe representa aquel rasgo distintivo sobre los demás atributos funcionales de las especies en el ensamblaje (Leitão et al., 2016). FOri refleja el aislamiento de una especie en el espacio funcional por la presencia de un nuevo rasgo que sobresale dentro de la comunidad (Mouchet et al., 2010). FDiv representa la proporción de la abundancia total de especies con valores de rasgos extremos (Legras et al., 2020). FEve es la distribución equitativa de la abundancia de las especies dentro del espacio funcional (Villéger et al., 2010). FDis se estima a partir de la distancia de las especies al centroide ponderado de los rasgos funcionales de la comunidad (Valdivia et al., 2017).
Utilizando los índices mencionados, se empleó nuevamente el test de Kruskal-Wallis para detectar diferencias estadísticamente significativas entre los rasgos promediados de las especies en los años evaluados (Kruskal & Wallis, 1952). También, se calculó la redundancia funcional (FRed) siguiendo el método propuesto por Pillar et al. (2013). FRed se define como el grado en que una comunidad biológica está compuesta por especies con rasgos funcionales similares. Valores cercanos a cero indican que las especies son funcionalmente diferentes. De lo contrario, si la redundancia es cercana a 1 las especies son funcionalmente idénticas (Maure et al., 2018). Para ello, se estimó el índice de Gini-Simpson menos la entropía cuadrática de Rao, utilizando las librerías ‘FD’ y ‘vegan’.
Para la estimación de la diversidad beta funcional, se usó la función ‘multidimFbetaD.R’ de la librería ‘betapart’. Se descompuso en recambio y anidamiento (Baselga, 2010), con la finalidad de identificar la variación de la composición funcional (Feizabadi et al., 2021) y comprender de manera detallada los procesos y patrones que ocurren dentro de la comunidad a lo largo del tiempo (Wang et al., 2021).
Para tener una visión acerca del efecto de las temporadas de alta y baja precipitación sobre la composición de la comunidad y para establecer diferencias entre los años y épocas climáticas, se utilizó el Escalamiento Multidimensional No Métrico (NMDS) (Pepple et al., 2015). Adicionalmente, para determinar diferencias estadísticamente significativas entre los grupos (años y épocas) teniendo en cuenta la estructura de la comunidad (Somerfield et al., 2021), se utilizó el Análisis de Similitud no paramétrico (ANOSIM) (Chapman & Underwood, 1999). Estos dos análisis se realizaron usando la distancia de Bray-Curtis, con la ayuda de la librería ‘vegan’. Finalmente, para identificar aquellas especies que contribuyen de forma significativa a la diversidad taxonómica beta y denotan una alta disimilitud en la composición de la comunidad, se realizó un análisis de contribuciones locales a la diversidad beta (LCBD) (Hill et al., 2021), usando las librerías ‘vegan’, ‘SoDA’, ‘adegraphics’, ‘ade4’ y la función ‘lcbd.com.R’ en el programa R 4.0.
Resultados
Se registró un total de 2 691 individuos, distribuidos en 127 especies, 31 familias y 12 órdenes, siendo la especie Volatinia jacarina (n = 194), Columbina talpacoti (n = 140) y Sporophila minuta (n = 124) las más abundantes. La familia con mayor número de especies raras o poco frecuentes fue Tyrannidae con nueve especies (MST2). Entre las especies registradas, se encontraron trece migratorias y cuatro endémicas.
Con relación a la diversidad taxonómica alfa, no se obtuvieron diferencias estadísticamente significativas, pero se observó un incremento en la riqueza de especies para el 2013 y una disminución en el 2010 y 2017 (Fig. 2).
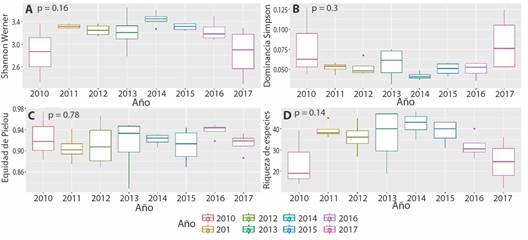
Fig. 2 Comparación de los índices de diversidad alfa taxonómica de la comunidad de aves en Armero-Guayabal. Índices de Shannon-Wiener (H), equidad de Pielou (J’), dominancia de Simpson (D) y riqueza de especies (S). / Fig. 2. Comparison of taxonomic alpha diversity indices for bird community in Armero-Guayabal. Shannon-Wiener index (H), Pielou’s evenness index (J’), Simpson’s dominance index (D) and species richness (S).
El valor de la diversidad beta taxonómica total fue bajo (0.224, 0.230). Según la abundancia de especies, la comunidad de aves está dominada por el recambio de especies, que representó el 62 % de la diversidad beta total. Cuando se consideró la presencia-ausencia, el porcentaje de diversidad beta fue mayor y se debe igualmente a procesos de recambio de especies, representando el 80 % (Tabla 1). Los resultados del LCBD para la diversidad beta indicaron que las especies Catharus ustulatus y Sporophila funerea influyeron significativamente en el cambio de la composición de la comunidad a lo largo de los años evaluados (MST3).
Tabla 1 Porcentaje de recambio y anidamiento de la diversidad beta taxonómica y funcional para la comunidad de aves en Armero-Guayabal. / Table 1. Contributions of turnover and nestedness in taxonomic and functional beta diversity for bird community in Armero-Guayabal.
| Diversidad | Diversidad β total | Recambio | Anidamiento | Porcentaje de recambio | Porcentaje de anidamiento |
| DBJ | 0.22474087 | 0.13977601 | 0.08496485 | 0.62194302 | 0.37805698 |
| DBB | 0.23073297 | 0.18610293 | 0.04463004 | 0.80657278 | 0.19342722 |
| DBF | 0.78385714 | 0.26582857 | 0.51785714 | 0.33912885 | 0.66065245 |
DBJ: diversidad beta taxonómica según el coeficiente de Jaccard, DBB: diversidad beta taxonómica según el coeficiente de Bray-Curtis, DBF: diversidad beta funcional. / DBJ: taxonomic beta diversity according to Jaccard’s coefficient, DBB: taxonomic beta diversity according to Bray-Curtis coefficient, DBF: functional beta diversity.
Por otro lado, se observaron similitudes y diferencias en la composición de especies entre los años evaluados, diferenciando el 2010 y 2017. Los demás años presentaron composiciones similares (Fig. 3). Además, se encontró que la composición de aves difiere significativamente entre los años (ANOSIM: R = 0.16, P = 0.006). En relación al efecto de las épocas de alta y baja precipitación sobre la comunidad taxonómica de aves no hubo diferencias estadísticamente significativas (ANOSIM: R = 0.005, P = 0.501).
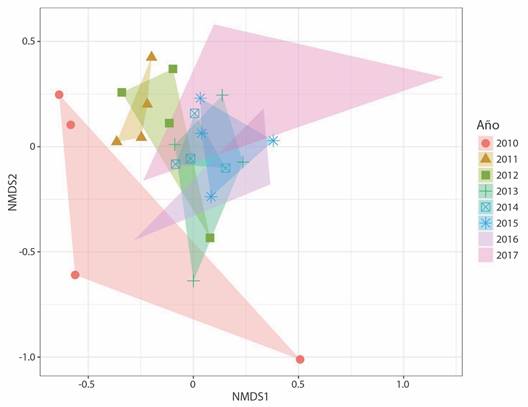
Fig. 3 Escalamiento multidimensional no métrico (NMDS) de la composición de la comunidad de aves en Armero-Guayabal, durante un periodo de ocho años. / Fig. 3. Non-metric multidimensional scaling (NMDS) of bird community composition in Armero-Guayabal, over a period of eight years.
Con relación a la diversidad funcional alfa no se obtuvieron diferencias estadísticamente significativas a lo largo del tiempo de estudio (Tabla 2). En cuanto a la redundancia funcional (FRed), se observaron valores bajos (0.013, 0.111), que no fueron significativamente diferentes entre los años evaluados (P = 0.34).
Tabla 2 Índices de diversidad alfa funcional de la comunidad de aves en Armero-Guayabal. / Table 2. Functional alpha diversity indices for bird community in Armero-Guayabal.
| Índice | x2 | P-value |
| FRic | 11.211 | 0.129 |
| FDiv | 4.12 | 0.765 |
| FEve | 9.699 | 0.206 |
| FDis | 2.737 | 0.908 |
| FSpe | 4.123 | 0.765 |
| FOri | 3.472 | 0.838 |
FRic: riqueza funcional, FDiv: divergencia funcional, FEve: equitatividad funcional, FDis: dispersión funcional, FSpe: especialización funcional, FOri: originalidad funcional. / FRic: functional richness, FDiv: functional divergence, FEve: functional evenness, FDis: functional dispersion, FSpe: functional specialization, FOri: functional originality.
La diversidad beta funcional total fue alta (78 %). El anidamiento fue el proceso que aportó en mayor medida a la estructura de la diversidad funcional (66 %) en comparación con el recambio (33 %) (Tabla 1).
Discusión
En el presente estudio, se destaca la importancia de analizar la diversidad taxonómica y funcional de comunidades de aves a lo largo de un amplio período de estudio. Las investigaciones que abarcan múltiples años son una herramienta eficaz para identificar los cambios en la estructura y dinámica de las comunidades en respuesta a influencias ambientales o antrópicas (Buckley et al., 2021). Estas investigaciones son especialmente relevantes en el monitoreo y conservación de la biodiversidad en áreas poco estudiadas (Leyequién, 2006), como el bosque seco tropical (Bs-T) que representa uno de los ecosistemas más amenazados y menos comprendidos (Losada-Prado & Molina-Martínez, 2011). Además, es importante destacar que esta investigación representa el primer estudio a largo plazo sobre la diversidad funcional de aves en el Valle del Magdalena.
Los resultados obtenidos de los índices de diversidad alfa taxonómica no evidenciaron diferencias estadísticamente significativas durante los años evaluados; indicando que la estructura de la comunidad es constante a través del tiempo. No obstante, se observaron algunas variaciones en estos índices que podrían atribuirse posiblemente a los fenómenos climáticos de La Niña y El Niño ocurridos durante el periodo de estudio. Específicamente en Sudamérica, ocurrieron estos dos fenómenos climáticos; La Niña entre los años 2010 y 2013, y El Niño entre el 2014 y 2017. Investigaciones anteriores han documentado que los fenómenos climáticos mencionados pueden tener efectos significativos en la dinámica poblacional y la estructura comunitaria de las aves (Barrantes & Sandoval, 2019; Wingfield et al., 2018). En este estudio, se registró la mayor diversidad de especies en el 2014, coincidiendo con la transición de La Niña a El Niño.
En este contexto, la variación en la diversidad de aves observada en este estudio podría ser posiblemente consecuencia de cambios en la disponibilidad de recursos, inducidos por los eventos de El Niño y La Niña. Estos fenómenos alteran los patrones de precipitación y la intensidad de la radiación, afectando directamente las fases fenológicas de las plantas (Barrantes & Sandoval, 2019). Se ha encontrado que las condiciones más húmedas y templadas, características de la temporada de El Niño, pueden incrementar la productividad de la vegetación y los recursos alimenticios disponibles para las aves (Duursma et al., 2018). Por ejemplo, estudios han demostrado que la floración y fructificación de las especies de plantas del sotobosque están relacionadas con aumentos en la temperatura y radiación (Kimura et al., 2009). Este incremento en la floración y fructificación de las plantas posiblemente amplía la variedad de recursos alimenticios disponibles, promoviendo así una mayor diversidad de especies de aves.
Por otro lado, se encontró que la diversidad beta taxonómica presentó un valor bajo, lo que indica una similitud en las especies presentes en la comunidad a lo largo de los años. Sin embargo, es importante destacar que la comunidad de aves está dominada por el recambio de especies. Esto implica que, aunque las especies de la comunidad son similares, se producen variaciones sutiles en las especies que se establecen entre los años. Estas variaciones pueden estar influenciadas por factores ambientales, cambios en la disponibilidad de recursos, intensificación del uso del suelo, procesos aleatorios y otras dinámicas ecológicas (Renner & Bates, 2020).
Además, se encontró que el cambio en la composición de la comunidad también está influenciado por procesos migratorios. Por ejemplo, se identificó que especies migratorias como Catharus ustulatus, desempeñan un papel importante en este proceso. Esta especie, conocida como zorzalito de swainson, realiza migraciones latitudinales (Bégin-Marchand et al., 2021) entre los meses de marzo-abril y octubre-diciembre (Naranjo et al., 2012), lo que significa que solo está presente en ciertas temporadas del año. Su presencia durante estas migraciones estacionales puede tener un impacto significativo en la composición de la comunidad de aves. También, se encontró que, la mayoría de las especies que influyen en el cambio de la composición de la comunidad son tráupidos granívoros pertenecientes al género Sporophila (Tobias et al., 2022).
La elevada diversidad beta funcional a lo largo de los años refleja que existe una amplia variedad de especies con diferentes rasgos funcionales. Esta diversidad de rasgos tiene un impacto significativo en la redundancia funcional de la comunidad, lo cual implica que diferentes especies desempeñan roles funcionales únicos y no hay una completa superposición de funciones entre ellas (Maure et al., 2018). En relación a lo anterior, se encontró que los valores de redundancia funcional fueron bajos (es decir, cercanos a cero), lo que sugiere que la comunidad de aves es funcionalmente diversa y diferente a través del tiempo (Maure et al., 2018). De esta manera, la redundancia se destaca como un aspecto importante de la diversidad funcional que requiere ser evaluado para determinar la vulnerabilidad del sistema (Krause et al., 2016). De hecho, se ha encontrado que una baja redundancia funcional suele estar asociada con una capacidad reducida de la comunidad para resistir desequilibrios causados por perturbaciones en su entorno (Biggs et al., 2020).
Los bajos niveles de esta medida funcional aumentan la probabilidad de que extinciones locales puedan afectar las funciones del ecosistema (Pillar et al., 2013). Además, su evaluación en paisajes fragmentados puede determinar los efectos del cambio en el uso del suelo sobre la biodiversidad (Flynn et al., 2009). Estos resultados coinciden con los de Maure et al. (2018), quienes hallaron una baja redundancia funcional en comunidades de aves asociadas a bosques ribereños intervenidos por el hombre, lo que ha impactado negativamente en la estructura y funcionalidad del ecosistema. En contraste, una alta redundancia desempeña un papel fundamental en la preservación de la integridad ecosistémica (Wohl et al., 2004), al promover la coexistencia de diversos nichos dentro del ensamblaje (Pigot et al., 2016). Esta alta redundancia funcional fue identificada por Oliveira & Dos Anjos (2022), al monitorear durante 10 años las comunidades de aves en el área protegida del Bosque Atlántico, ubicado en el sur de Brasil.
Por otra parte, se identificó que la diversidad beta funcional sigue un patrón de anidamiento funcional, lo cual sugiere que a lo largo del tiempo se pueden observar subconjuntos de especies con rasgos funcionales que representan una pequeña porción del espacio funcional ocupado en otros años. Los resultados de la presente investigación coinciden con los de Yang et al. (2022), quienes observaron un patrón de anidamiento funcional al estudiar las comunidades de aves en humedales del norte de China a lo largo de un período de 25 años. Este patrón sugiere una disminución en la variedad de funciones desempeñadas por las aves en estas comunidades, lo cual está asociado a cambios en su composición funcional.
Estudios anteriores han señalado que el anidamiento funcional puede ser resultado de la pérdida de hábitats y la fragmentación del paisaje, lo que resulta en la reducción de rasgos específicos de las especies según la zona en la que se encuentran (Matthews et al., 2015; Yang et al., 2022). La disminución de la diversidad funcional tiene impactos negativos en el funcionamiento de los ecosistemas, al limitar la capacidad de las especies para desempeñar funciones clave. Además, esta disminución incrementa la vulnerabilidad de los ecosistemas frente a perturbaciones y dificulta su capacidad de adaptación y resiliencia (Oliveira & Dos Anjos, 2022).
Diversos estudios (Aldana, 2008; Reina & Giraldo, 2010) han documentado las actividades de ganadería y pastoreo llevadas a cabo en el CURDN, lo que conduce a la degradación de la vegetación y el deterioro de los suelos. Asimismo, se cuenta con un bajo porcentaje de parches de bosques, que están siendo constantemente intervenidos. Esto representa un potencial peligro para muchas especies de aves especialistas asociadas al interior de bosque (Carrara et al., 2015). En consecuencia, estas perturbaciones representan un riesgo para la comunidad de aves, debido a la baja redundancia funcional encontrada.
Los resultados del análisis de la diversidad taxonómica alfa indicaron que la comunidad de aves en el CURDN se mantiene estable a lo largo del tiempo. De otro lado, se observó una baja diversidad taxonómica beta que se atribuye a un proceso de recambio de especies, indicando que son pocas las variaciones que ocurren en la composición de la comunidad durante un periodo de ocho años. Sin embargo, la diversidad funcional reveló hallazgos interesantes en comparación con el análisis taxonómico. Se identificó una alta diversidad funcional beta, lo que refleja una baja redundancia en los atributos de las especies. El análisis de partición de la diversidad beta funcional reveló un patrón de anidamiento funcional, lo que sugiere una pérdida o disminución gradual de rasgos específicos de las especies a medida que transcurren los años. Estos resultados sugieren que alteraciones antropogénicas a escala local podrían estar deteriorando las condiciones del hábitat para ciertas especies de aves. Esto resalta la importancia de considerar tanto la diversidad taxonómica como funcional al analizar la dinámica de las comunidades de aves en un análisis multitemporal, puesto que ambos aspectos proporcionan perspectivas complementarias sobre la dinámica de la comunidad.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.
See supplementary material











 uBio
uBio 


