Introducción
El conocimiento de los factores que afectan la distribución de las especies y su relación con la estructura del hábitat es fundamental para la conservación de la biodiversidad, debido a la relación que existe entre las características fisionómicas de la vegetación y los procesos ecológicos que allí se generan (Atauri & de Lucio, 2001; Bezděk et al., 2006; Lassau et al., 2005). Desde una perspectiva local, la mayoría de los estudios se han enfocado en la relación entre el número de especies animales y los diferentes tipos de cobertura vegetal. No obstante, resulta importante considerar la relevancia ecológica que presenta la estructura del hábitat en la composición y diversidad de las comunidades animales tanto en ambientes naturales como en zonas sometidas a perturbaciones antrópicas (Atauri & de Lucio, 2001; Lassau & Hochuli, 2004; Lassau et al., 2005).
Varias investigaciones han encontrado asociaciones positivas entre la diversidad de especies y la complejidad estructural del hábitat (August, 1983; Bracewell et al., 2018; Lassau et al., 2005; Mena & Medellín, 2017). Estos resultados se encuentran ligados al hecho de que un hábitat más complejo (i.e. mayor desarrollo de los estratos verticales sensuAugust, 1983) y heterogéneo (i.e. variación de la fisionomía horizontal sensuAugust, 1983), ofrece una mayor cantidad de nichos potenciales que la fauna puede explotar, a diferencia de lo que podrían ofrecer hábitats más simples (August, 1983; Atauri & de Lucio, 2001; Lassau et al., 2005).
Los artrópodos son organismos que permiten entender la magnitud de la biodiversidad y evaluar el efecto de la variación estructural, la complejidad y la heterogeneidad de los hábitats (Lassau & Hochuli, 2004; Lassau et al., 2005). De las aproximadamente 751 000 especies conocidas de artrópodos no arácnidos, 180 mil especies son mariposas diurnas y unas 3 877 especies han sido registradas en Colombia (Garwood et al., 2022). Su importancia ecológica es enorme, no sólo por el elevado porcentaje de las especies y biomasa que representan en los ecosistemas, sino también por su funcionalidad, actuando como herbívoros, polinizadores y alimento (Halffter et al., 2001).
Las mariposas son sensibles a cambios de temperatura, microclima, humedad y nivel de luminosidad (Thomas, 2005). Además, por su diversificación y abundancia dentro del ecosistema y por poseer una taxonomía relativamente bien documentada, las mariposas diurnas son usadas constantemente como organismos indicadores (Brown & Freitas, 2000; Fagua et al., 1999; Thomas, 2005; Uehara-Prado & Freitas, 2009). Pueden encontrarse en virtualmente cualquier ecosistema, siendo la alta montaña uno los sistemas menos conocidos en cuanto a su ecología. Durante años, diversos estudios apoyaron la idea de que los ecosistemas de alta montaña representaban comunidades menos complejas, pequeñas y poco diversificadas, relacionado principalmente con la disminución en la diversidad de las especies con la elevación (Blackburn & Gaston, 1996). Sólo recientemente se ha empezado a reconocer la relevancia de la complejidad estructural que presentan los ecosistemas de alta montaña y su efecto sobre las comunidades animales. Más aún, este tipo de ecosistemas ha sido reconocido tan heterogéneo y diverso como los ecosistemas de tierras bajas (Kessler & Kluge, 2008; Pyrcz et al., 2009). Sin embargo, aún son muy pocos los estudios que evalúen el papel de la complejidad estructural del hábitat sobre la diversidad y estructura de comunidades faunísticas en ecosistemas de alta montaña en el Neotrópico. Esto se hace más relevante aún si se considera el rápido deterioro de los bosques andinos (Wright, 2005).
Esta investigación tuvo como objetivo analizar la diversidad de la comunidad de mariposas diurnas en tres tipos de coberturas vegetales (rastrojo, bosque y páramo) y su relación con la complejidad, la heterogeneidad y la estructura del hábitat en ecosistemas de alta montaña en el departamento de Antioquia, Colombia. Esperamos que la diversidad de mariposas varíe a través de las diferentes coberturas vegetales, posiblemente influenciada por la heterogeneidad de recursos, por ejemplo, alimento y cobertura (Rija, 2022) mediada por la estructura del hábitat. En este sentido, esperamos encontrar mayor diversidad en coberturas más complejas (i.e. Bosque y rastrojo), disminuyendo en coberturas menos complejas estructuralmente (i.e. Páramo). Adicionalmente, se espera que la riqueza y abundancia de mariposas responda positivamente a las características del hábitat evaluadas. Nuestra investigación busca resaltar el valor biológico y ecológico de la interfase bosque Andino-Altoandino-páramo, este último limitado exclusivamente al norte de Sudamérica, y que confronta niveles de amenaza significativos para su conservación, considerándose como parte de los ecosistemas de Colombia que se encuentran en Peligro Crítico (Etter et al., 2018). Los procesos de transformación del paisaje, mediados por agentes como la ganadería, la minería, la agricultura extensiva y el cambio climático, amenazan fuertemente la diversidad y sus procesos en las partes altas de los Andes.
Materiales y métodos
Área de estudio: El estudio se llevó a cabo en la cuenca alta del río Chico (6º45’95.9” N & 75º41’45” W), municipio de Belmira, departamento de Antioquia, en el extremo norte de la cordillera Central de los Andes colombianos. Esta zona hace parte de las 34 358.74 hectáreas que conforman la unidad de manejo especial denominada “Sistema de Páramos y Bosques Altoandinos del Noroccidente Medio Antioqueño” (Toro-Murillo & Vanegas-Alzate, 2003; Morales-Rivas et al., 2007). El área de estudio comprende las zonas de vida de bosque muy húmedo montano bajo (bmh-MB), con altitudes que llegan hasta los 3 000 m.s.n.m. y coberturas vegetales correspondientes a bosques altoandinos dominados por robledales mixtos, y de bosque pluvial montano (bp-M), con altitudes superiores a los 3 000 m.s.n.m., reconocido comúnmente como “páramo” o “subpáramo” (Fig. 1). Las temperaturas promedio oscilan entre los 6 y 18 ºC y presenta un promedio anual de lluvias superior a 4 000 mm (Idárraga et al., 2011). Las coberturas vegetales elegidas para esta investigación fueron:
(1) Bosque: Se presenta en elevaciones entre los 2 800 y 3 100 m.s.n.m. y se caracteriza por gran diversidad de plantas nativas siendo las más comunes Quercus humboldtii Bonpl. (Fagaceae), Oreopanax floribundum (Kunth) Decne. & Planch (Araliaceae), varias especies del género Schefflera (Araliaceae), Vallea stipularis L.f. (Elaeocarpaceae), Hyeronima sp. (Phyllantaceae), Palicourea garciae Standl. (Rubiaceae), Hydrangea oerstedii Briq. (Hydrangeaceae) y Turpinia heterophylla (Ruiz & Pav.) Tul. (Staphyleaceae; Toro-Murillo & Vanegas-Alzate, 2003). La vegetación arbórea es de gran porte (~ 25 m) formando un dosel continuo, cerrado y bien desarrollado lo que genera una alta acumulación de humedad.
(2) Rastrojo: Se caracteriza por incluir zonas en regeneración aledañas a los bosques. Se encuentra en elevaciones entre los 2 800 y 2 900 m.s.n.m., con vegetación arbustiva abundante y vegetación arbórea que no alcanza alturas mayores a 15 m. El dosel es más discontinuo y abierto permitiendo una mayor entrada de luz. Las especies vegetales más comunes son: Saurauia ursina Triana & Planch. (Actinidiaceae), Tournefortia fuliginosa Kunth. (Boraginaceae), Vismia guianensis (Aubl.) Pers. (Hypericaceae), Macrocarpaea macrophylla (Kunth) Gilg (Gentianaceae), Lepechinia bullata (Kunth) Epling (Lamiaceae), Miconia resima Naudin, M. theaezans (Bonpl.) Cogn. (Melastomataceae), y Bocconia frutescens L. (Papaveraceae; Toro-Murillo & Vanegas-Alzate, 2003).
(3) Páramo: Se encuentra ubicado entre los 3 100 y 3 300 m.s.n.m. y se caracteriza por presentar un mosaico de áreas abiertas donde predominan especies como Calamagrostis effusa (Kunth) Steud. (Poaceae) y Espeletia occidentalis var. Antioquensis Cuatrec. (Asteraceae), y algunos parches de bosque achaparrado. Otras especies comunes de este tipo de cobertura son Baccharis tricuneata (L.f.) Pers., B. brachylaenoides DC., Diplostephium revolutum S.F. Blake (Asteraceae), Castilleja fissifolia L.f. (Orobanchaceae), Brachyotum sp. (Melastomataceae), Hypericum jaramilloi N. Robson, (Hypericaceae) y Bejaria sp. (Ericaceae; Idárraga et al., 2011; Toro-Murillo & Vanegas-Alzate, 2003). El dosel es abierto y su altura promedio es menor a 5 m.
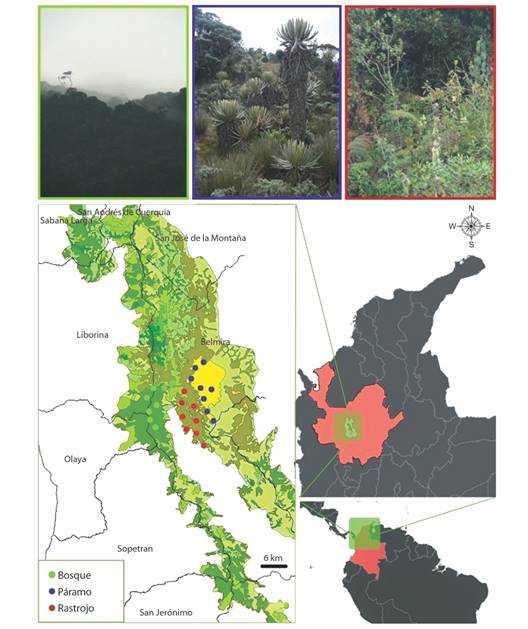
Fig. 1 Área de estudio en la unidad de manejo especial “Sistema de Páramos y Bosques Altoandinos del Noroccidente Medio Antioqueño”, municipio de Belmira, departamento de Antioquia, Colombia. Los puntos representan a los sitios en donde se establecieron las parcelas de vegetación y las trampas Van Someren Rydon para mariposas distribuidos en tres coberturas vegetales. / Fig. 1. Study area in the special management unit “Sistema de Páramos y Bosques Altoandinos del Noroccidente Medio Antioqueño”, Belmira municipality, Antioquia department, Colombia. Dots represent the locations of vegetation plots and Van Someren Rydon traps for butterflies distributed among three vegetation covers.
Muestreo de mariposas: El muestreo se llevó a cabo durante 54 días entre enero y julio de 2012 con un equipo de cuatro personas. Las capturas se realizaron entre las 8:00 h y las 17:00 h, para un total de 1 944 horas de muestreo efectivo en campo. Para la caracterización de la comunidad de mariposas se establecieron cuatro áreas de muestreo entre los 2 800 y 3 300 m.s.n.m., y en cada una se instalaron 14 trampas tipo Van Someren Rydon (VSR) separadas 100 m entre sí, y ubicadas entre 1 y 3 m de altura desde el suelo. Las trampas fueron cebadas con pescado descompuesto y fruta fermentada. El material recolectado fue examinado en el Laboratorio de Biología y Sistemática de Insectos de la Universidad Nacional de Colombia sede Medellín. Los especímenes en su mayoría fueron identificados hasta la categoría taxonómica de especie utilizando claves taxonómicas y material bibliográfico especializado (Butterflies of America Foundation, 2013; DeVries, 1997; Lamas, 2003; Lamas, 2004; Le Crom, 2004; Pulido et al., 2010; Vélez et al., 2009). Para especies taxonómicamente complejas se recurrió a la ayuda de especialistas y a la disección de los órganos genitales de los machos macerando el abdomen en KOH al 10 % y preservando la estructura genital en glicerol (Murillo-Hiller, 2007). Los especímenes se encuentran depositados en el Museo Entomológico Francisco Luis Gallego (MEFLG) de la Universidad Nacional sede Medellín, con los códigos de colección BMC 11033-11999, BMC 13689-13823, BMC 14329-15727 y BMC 16000-17244.
Variables de vegetación: Con el objeto de caracterizar la estructura de la vegetación en las diferentes coberturas, se establecieron ocho parcelas temporales de vegetación en cada cobertura vegetal empleando una trampa VSR como centro de la misma (i.e. 24 parcelas en total). Se empleó la metodología propuesta por James & Shugart (1970) con modificaciones. Cada parcela presentaba una forma circular con un radio de 11.3 m (0.04 ha). Las variables de la vegetación fueron tomadas en el centro y en los cuatro puntos cardinales de cada parcela. Las variables registradas en cada parcela fueron (1) altura de dosel (m); (2) porcentaje de cobertura de dosel usando fotografías hemisféricas tomadas con un lente ojo de pez y analizadas con el programa Gap Light Analyzer (GLA 2.0); (3) índice de ocupación vertical usando una barra de tres metros marcada por secciones de 10 cm. Este índice fue estimado a partir de la fórmula IV = h/10p donde h es igual al total de secciones o hits que presentaban ocupación vegetal dentro de la parcela y p es igual al número de puntos donde se registraron las mediciones; (4) diámetro a la altura del pecho (DAP > 5 cm); (5) densidad arbórea por conteo de las especies de árboles con DAP > 5 cm en el área total de la parcela (m2); (6) densidad arbustiva por conteo de los arbustos presentes en una subparcela circular de 100 m2; (7) porcentaje de ocupación horizontal usando el conteo del número de cuadrantes visibles a una distancia de 10 m de un tablero de 50 x 60 cm divido en 35 cuadrantes blancos y negros del mismo tamaño y (8) porcentaje de cobertura de suelo en cuatro subparcelas de 1 m2.
Diversidad de mariposas: Con base en la información registrada de mariposas, se calcularon los índices de diversidad usando los números efectivos de especies o números de Hill (Hill, 1973; Jost, 2006). En este caso se obtuvieron índices de diversidad de diferente orden qD, donde el exponente q determinó la sensibilidad del índice a las abundancias relativas de las especies, así: la diversidad de orden cero (0D) es insensible a las abundancias y es equivalente a la riqueza de especies, la diversidad de orden 1 (1D) o exponencial de Shannon, incluye a todas las especies con un peso exactamente proporcional a su abundancia, y la diversidad de orden 2 (2D) o inverso de Simpson, sobrevalora las especies comunes (Gotelli & Chao, 2013; Jost, 2006; Moreno et al., 2011). Se calcularon los mismos índices para cada cobertura vegetal, utilizando las mariposas recolectadas en las trampas VSR asociadas a las parcelas temporales de vegetación.
Adicionalmente, se calcularon estimadores no paramétricos de diversidad los cuales consideran como medida de completitud la cobertura de la muestra (Moreno et al., 2011). Para 0D se usó el estimador no paramétrico ACE (Abundance-based Coverage Estimator, por sus siglas en inglés) que presenta un enfoque general al utilizar la información de la frecuencia de especies raras, así como los singletons y doubletons (especies con uno o dos individuos en la muestra, respectivamente). Para 1D se utilizó el estimador sugerido por Chao & Shen (2003), basado en el ajuste de Horvitz-Thompson propuesto para casos donde no se tiene completo conocimiento de la comunidad y que permite corregir el sesgo del sub-muestreo. Finalmente, para 2D se utilizó el estimador MVUE (Minimum Variance Unbiased Estimator, por sus siglas en inglés) el cual corrige sesgos al no variar con el tamaño de la muestra (Gotelli & Chao, 2013; Moreno et al., 2011). Todos los estimadores fueron calculados usando el programa SPADE (Chao & Shen, 2010). Finalmente, se estableció el modelo de distribución de especies que más se ajustara al ensamblaje usando una prueba de chi-quadrado a partir de los datos de abundancia de las especies. Estos análisis se realizaron usando el programa PAST 2.17c (Hammer et al., 2001).
Comunidad de mariposas y estructura de hábitat: Para evaluar el efecto de la estructura de la vegetación (cobertura y altura de dosel, ocupación horizontal, ocupación vertical y cobertura de suelo) sobre la riqueza y abundancia de mariposas, se construyeron modelos de regresión lineal simple. Se empleó un nivel de significancia de α = 0.05 como nivel de aceptación, intervalos de confianza del 95 %, y se evaluó normalidad de las variables independientes.
Se realizó un Análisis de Componentes Principales (ACP) sobre las variables de estructura de vegetación con el fin de obtener una medida de la complejidad (C) y la heterogeneidad (H) de hábitat y tener un mejor entendimiento de la relación entre la diversidad de mariposas y la estructura del hábitat (August, 1983; Malumbres-Olarte et al., 2013; Pérez, 2004). Para esto, se empleó la media de los factores arrojados por el primer componente principal (PC1) para estimar la complejidad del hábitat, ya que estos factores condensan todas las variables originales en una medida de magnitud de tamaño total para cada cobertura. La medida de heterogeneidad, por su parte, se obtuvo a partir de la desviación estándar de estos factores (August, 1983; Pérez, 2004). Los análisis se realizaron utilizando el programa SPSS Statistics Base 17.0 (Pérez, 2004). Finalmente, se realizaron comparaciones entre los índices de complejidad y heterogeneidad frente a los índices de diversidad estimados para cada cobertura (August, 1983).
Resultados
Comunidad de mariposas: Se registraron en total 3 699 individuos pertenecientes a 108 especies, 48 géneros y cinco familias de mariposas. El grupo dominante fue Nymphalidae con 65 especies y dentro de este la subfamilia Satyrinae con la subtribu Pronophilina para la cual se reportaron 48 especies. Le sigue la familia Hesperiidae con 22 especies, Lycaenidae con 12 especies, Pieridae con ocho especies y finalmente Riodinidae con dos especies.
Los análisis de diversidad reportaron para la comunidad total de mariposas índices 1D igual a 30.2 especies efectivas y 2D igual a 15.2 especies efectivas. Por otra parte, los estimadores de diversidad ACE para 0D (124.4 ± 7.5 especies), Chao y Shen (2003) para 1D (30.9 ± 0.8) y MVUE para 2 D (15.2 ± 0.2) sugieren un alcance del muestreo del 87, 98 y 99 %, respectivamente (Tabla 1).
Tabla 1 Diversidad observada y estimada de mariposas diurnas para el área total de estudio y para los tres tipos de coberturas vegetales. / Table 1. Diversity observed and estimated of diurnal butterflies for total study area and for the three vegetation types.
| Observado | Estimado | Cobertura del muestreo | ||||||||
| 0D | 1D | 2D | 0D | ± EE | 1D | ± EE | 2D | ± EE | ||
| Área total | 108 | 30.23 | 15.18 | 124.4 | 7,5 | 30.9 | 0.8 | 15.24 | 0.2 | 0.995 |
| Bosque | 35 | 14.11 | 9.18 | 48.8 | 14.9 | 15.83 | 1.4 | 9.42 | 0.2 | 0.953 |
| Rastrojo | 31 | 19.11 | 10.75 | 39.4 | 5.5 | 25.02 | 3.3 | 11.97 | 0.32 | 0.887 |
| Páramo | 20 | 10.68 | 7.43 | 39.3 | 14.4 | 12.36 | 1.8 | 7.86 | 0.3 | 0.924 |
0D: diversidad de orden 0, 1D: diversidad de orden 1, 2D: diversidad de orden 2, EE: Error Estándar. / 0D: diversity of order 0, 1D: diversity of order 1, 2D: diversity of order 2, EE: Standard error.
El patrón de distribución de las abundancias de las especies para la comunidad de mariposas corresponde a un modelo tipo log-normal (P = 0.74).
Diversidad de mariposas en las coberturas vegetales: Se registraron para las tres coberturas 532 individuos pertenecientes a 52 especies y tres familias. La subtribu Pronophilina presentó la mayor contribución tanto para la riqueza (41 especies, 79 %) como para la abundancia de especies (482 individuos, 91 %).
La riqueza (0D) diferencia el bosque como la cobertura más rica, presentando 35 especies y 317 individuos, seguido por el rastrojo con 31 especies y 97 individuos, y por último el páramo con 20 especies y 118 individuos. La tendencia descrita por 0D cambia cuando se observan los demás índices: aunque para los índices 1D y 2D la cobertura de páramo continuó presentando los valores más bajos de diversidad estimada (1D = 12.4 ± 1.8; 2D = 7.9 ± 0.3), la cobertura rastrojo presentó la mayor diversidad con índices 1D de 25.02 ± 3.3 y 2D 11.97 ± 0.3 especies efectivas, superando a la cobertura bosque que presentó una diversidad 1D de 15.8 ± 1.4 y 2D de 9.4 ± 0.2 especies efectivas (Tabla 1). Finalmente, las tres coberturas vegetales evidenciaron un patrón de abundancias que se ajustó al modelo de tipo log-normal (bosque P = 0.45; rastrojo P = 0.49; páramo P = 0.85).
Estructura del hábitat: El primer componente principal, que explicó el 85 % de la varianza en la estructura del hábitat, correlacionó significativamente con la ocupación vertical (P = 0.97), la densidad arbórea (0.83), la ocupación horizontal (0.75) y la altura de dosel (0.65). Las tres coberturas vegetales se diferenciaron en sus niveles de complejidad y heterogeneidad. La cobertura de páramo fue estructuralmente la más simple y homogénea (Complejidad (C) = -4.98; Heterogeneidad (H) = 1.42), mientras que el rastrojo fue la cobertura más heterogénea con niveles de complejidad intermedia (C = -0.20; H = 3.73). Por su parte, la cobertura bosque fue la más compleja y un índice intermedio de heterogeneidad (C = 5.24; H = 2.38). Se observó una asociación positiva entre la riqueza de especies y la complejidad derivada para cada cobertura, así como entre los índices calculados de diversidad 1D y 2D y la heterogeneidad (Fig. 2).
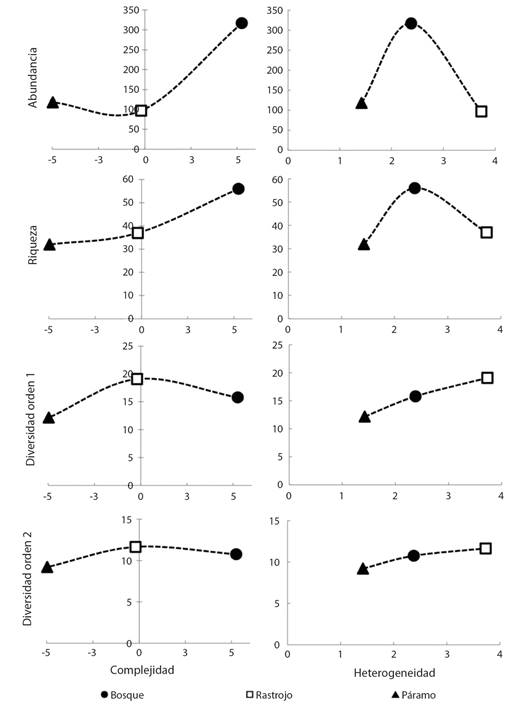
Fig. 2 Asociación entre los índices de complejidad y heterogeneidad para cada cobertura vegetal y la riqueza, abundancia y diversidad de especies de mariposas diurnas. / Fig. 2. Association between complexity and heterogeneity indexes) for each vegetation type and the richness, abundance and diversity of diurnal butterflies.
Relación entre la estructura de la vegetación y la diversidad de mariposas: La riqueza y la abundancia de las especies de mariposas fueron influenciadas significativamente por la estructura de la vegetación. Ambos atributos se asociaron positivamente con el incremento de la cobertura y altura de dosel, la ocupación horizontal y la vertical, y negativamente con la cobertura de suelo (Tabla 2 y Fig. 3).
Tabla 2 Modelos de regresión lineal entre la riqueza y la abundancia de especies de mariposas diurnas y las variables de estructura de vegetación. / Table 2. Linear regression models among the richness and abundance of diurnal butterflies and the vegetation structure variables.
| Variable | n | Riqueza | Abundancia | ||||
| β | Error | P | β | Error | P | ||
| Cobertura de dosel | 24 | 2.69 | 0.95 | 0.01 | 0.35 | 0.17 | 0.05 |
| Altura de dosel | 24 | 0.64 | 0.25 | 0.02 | 0.11 | 0.04 | 0.02 |
| Ocupación horizontal | 24 | 2.27 | 0.90 | 0.02 | 0.39 | 0.15 | 0.02 |
| Ocupación vertical | 24 | 1.53 | 0.58 | 0.008 | 0.25 | 0.10 | 0.02 |
| Cobertura de suelo | 24 | -1.59 | 0.74 | 0.044 | -0.26 | 0.13 | 0.05 |
n: tamaño de la muestra, β: pendiente, P: valor P. / n: sample size, β: slope, P: P value.
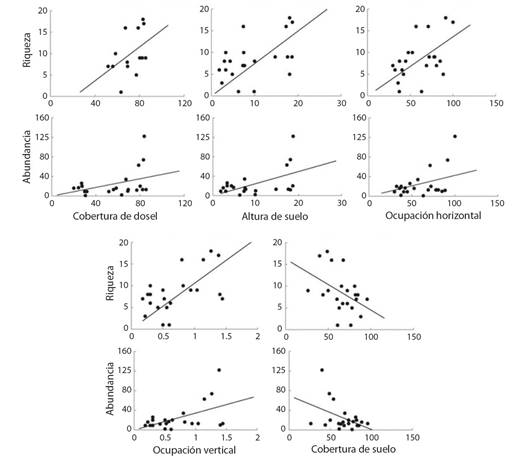
Fig. 3 Regresión entre la riqueza y abundancia de especies de mariposas diurnas y la cobertura y altura de dosel, ocupación vertical y horizontal y la cobertura de suelo. / Fig. 3. Regression between the richness and abundance of diurnal butterflies and canopy cover and height, vertical occupation, horizontal occupation and ground cover.
Discusión
En esta investigación se evaluó cómo la diversidad de mariposas diurnas varió a través de coberturas vegetales contrastantes, y el efecto de las características del hábitat en la riqueza y abundancia de mariposas diurnas en el complejo de páramos y bosques altoandinos en la Cuenca del río Chico. La riqueza y abundancia de mariposas fue diferente entre los diferentes tipos de coberturas, siendo mayor para el rastrojo, con tendencias similares a los encontrados en el área con un mayor esfuerzo de muestreo (Álvarez et al., 2021). Más aún, la riqueza y abundancia tendió a incrementar en sitios con mayor cobertura y altura de dosel y mayor ocupación horizontal y vertical.
El complejo de bosques y páramos en estudio registró la más alta riqueza de especies de mariposas diurnas al compararse con localidades similares ubicadas en el departamento de Antioquia o sobre la cordillera Central y se constituye en un componente clave para la conservación de la diversidad de mariposas alto andinas (Álvarez-Hincapié et al., 2017). Camero & Calderón (2007), García-Perez et al., (2007) y Henao (2006) registran en bosques altoandinos del país ubicados entre los 2 700 y 3 000 m.s.n.m., un total de 23, 50 y 58 especies de mariposas diurnas (Papilionoidea), respectivamente. Lo mismo ocurre cuando se compara la riqueza de especies de grupos representativos de los ecosistemas andinos de alta montaña como los Pronophilina (Satyrinae: Nymphalidae), para los cuales la riqueza registrada para el área de estudio es mayor a la reportada por otros estudios en áreas cercanas (p. ej. 20 especies: Vélez et al., 2009; 38: Marín et al., 2014). Este tipo de información posiciona estos ecosistemas como una de las áreas más importantes para el mantenimiento y conservación de estos grupos de lepidópteros en la región central de la Cordillera Central de Colombia (Marín et al., 2014).
Las diferencias encontradas entre la riqueza (0D) y los índices de diversidad 1D y 2D de mariposas tanto para el área total de estudio como para las diferentes coberturas vegetales, indican que algunas especies fueron muy abundantes y un gran número de ellas raras (Gotelli & Chao, 2013; Moreno et al., 2011). Este patrón, corroborado por el modelo log-normal, puede corresponder a comunidades donde se presenta una repartición diferencial de los recursos debido a la preferencia de nicho por parte de las especies dominantes las cuales, al usar una amplia fracción de los recursos disponibles, disminuyen la heterogeneidad de las comunidades y las medidas de diversidad (Camero & Calderón, 2007; McGill et al., 2007). Además, comunidades que se ajustan a modelos de distribución de tipo log-normal podrían estar bajo la influencia de algún tipo de perturbación (Marín et al., 2014) como el observado en la zona de estudio, la cual ha sido sometida a diferentes actividades extractivas durante más de 200 años incluyendo la explotación maderera, minera y ganadera (Morales-Rivas et al., 2007). Sin embargo, este patrón de distribución de abundancias ha sido ampliamente debatido y algunos autores sugieren que puede deberse principalmente a los protocolos de muestreo (Ferreira & Petrere, 2008; Williamson & Gaston, 2005).
La riqueza y la abundancia de especies de mariposas fueron sensibles tanto a la complejidad y heterogeneidad de las coberturas vegetales, como a los cambios en la estructura de la vegetación. Para el bosque, por ejemplo, se registró un mayor índice de complejidad, asociado posiblemente a un dosel más alto y más cerrado, y una mayor riqueza de mariposas ( 0 D). En esta cobertura se registraron mariposas que presentan preferencias hacia hábitats con alta humedad y temperaturas bajas (p. ej. Steremnia monachella (Weymer), Steroma bega Westwood, y Proboscis propylea (Hewitson)), características observadas en los estratos bajos del bosque que les permite realizar búsqueda activa de alimento o les proporciona un fácil camuflaje (García et al., 2002; Lamas, 2003; Vélez et al., 2009). Resultados similares han sido observados en otros estudios para diferentes tipos de ecosistemas (p. ej. bosques en Tanzania; Rija, 2022). Carrero et al. (2013), registraron para la región nororiental andina de Colombia en bosque húmedo montano bajo (bh-MB), el aumento del número de especies de mariposas en áreas con cobertura y densidad arbórea mayores. Igualmente, Vargas-Zapata et al. (2011) registraron en un bosque seco tropical ubicado en la Sierra Nevada de Santa Marta (Colombia) la mayor riqueza en sitios donde la cobertura arbórea es más densa y se observa una mayor variación en la estratificación vertical. Nuestros resultados aportan, por tanto, a la literatura que resalta la necesidad de conservar hábitats con una alta complejidad estructural, propia de bosques maduros y en buen estado de conservación.
Por otra parte, el rastrojo se diferenció como la cobertura vegetal más heterogénea presentando a su vez la mayor diversidad de mariposas (1D y 2D). Dentro del área de estudio, este tipo de cobertura se caracteriza por presentar etapas sucesionales en regeneración, lo cual promueve una alta variación en la estructura horizontal y la presencia de una alta diversidad de mosaicos de vegetación herbácea y arbustiva. Estas características permiten el aumento de la productividad de este tipo de cobertura al presentar una mayor oferta de recursos alimenticios y, por tanto, llegar a sostener una mayor diversidad de mariposas que se benefician principalmente de plantas de familias como Poaceae, Cyperaceae, Asteraceae y Rosaceae (Carrero et al., 2013; Fagua et al., 1999; Vélez et al., 2009). Diversos autores (p. ej. Uehara-Prado et al., 2007) detectaron patrones similares al encontrar mayores niveles de diversidad de mariposas diurnas en áreas que han estado sometidas a algún tipo de perturbación, lo cual ha resultado consistente con las teorías de la perturbación intermedia y los modelos de equilibro dinámico (Bongers et al., 2009; Svensson et al., 2012). Adicionalmente, tanto los perfiles de diversidad como el modelo de distribución de abundancias de especies muestran al rastrojo como la cobertura más equitativa.
A pesar de que el rastrojo presenta el más alto índice de diversidad 1D, la magnitud del cambio entre los índices 0D, 1D y 2D es mayor y más abrupta para las coberturas de bosque y páramo, lo que sugiere la presencia de un mayor número de especies raras. Esto es relevante dado que resultan ser únicas para estos hábitats, y resalta la importancia de su conservación para el mantenimiento de especies únicas o de rango restringido (Álvarez et al., 2023; Gotelli & Chao, 2013; Jost, 2006; Moreno et al., 2011).
Finalmente, aunque se han documentado relaciones positivas entre la estructura del hábitat y la diversidad faunística, otros estudios han presentado resultados contradictorios en donde ni la complejidad ni la heterogeneidad promueven la riqueza y diversidad de otras especies animales (p. ej. Hill et al., 1995). Es por ello por lo que resulta importante incluir otras variables intrínsecas a cada grupo taxonómico además de los índices de diversidad, como preferencias ecológicas, gremios alimenticios y relaciones filogenéticas, ya que la respuesta que tenga cada grupo modelo depende, en mayor medida, de cómo el organismo percibe la estructura del hábitat y su escala espacial en los diferentes ecosistemas (Tews et al., 2004). Este entendimiento en las relaciones ecológicas entre los diversos tipos de coberturas, el ambiente local y la comunidad faunística en los sistemas de alta montaña, es vital para el manejo y la conservación de especies, particularmente en los escenarios actuales de pérdida y transformación de los hábitats (Chaves et al., 2021). Esta investigación representa uno de los primeros pasos para el reconocimiento no sólo de la diversidad de mariposas sino también de su respuesta a diversos atributos ecológicos y ecosistémicos en la interfase bosque Andino-Altoandino-Páramo. Nuestra investigación resalta la importancia de conservar la heterogeneidad de los hábitats y la estructura vegetal en los ecosistemas de alta montaña andinos para mantener la diversidad y abundancia de las mariposas, resaltando la necesidad de políticas de conservación y manejo que consideren la complejidad y diversidad de estos ecosistemas. En particular, replicar esta investigación en el futuro podría generar información relevante sobre los cambios de esta comunidad de invertebrados y su dinámica en el tiempo, así como su relación con la variabilidad ambiental imperante. Esto representaría un aporte al conocimiento necesario para una mejor gestión y conservación de ecosistemas altamente sensibles y amenazados en Colombia.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


