Introducción
La comunicación acústica representa un comportamiento crucial en los ensamblajes de anuros (Köhler et al., 2017) ya que las especies utilizan una diversidad de vocalizaciones para transmitir información vital en situaciones relacionadas con la reproducción, defensa y agresión (Toledo et al., 2015). El canto de anuncio es la forma más común y distintiva de comunicación entre las especies de anuros. Por lo general, es emitido por los machos con la función principal de atraer hembras. Además, este tipo de vocalización ha sido utilizado ampliamente con propósitos taxonómicos ya que es particular de cada especie (Köhler et al., 2017).
El espacio acústico tiene limitaciones, lo que lleva a la implementación de diversas estrategias para reducir la interferencia en las señales sonoras, esto impacta directamente en la eficacia de la comunicación (Duellman & Pyles, 1983). Las interferencias bioacústicas se clasifican en tres categorías: intraespecífica, relacionada con la competencia por apareamiento o recursos; interespecífica, que implica la competencia por frecuencias y lugares de comunicación en el espacio acústico con otras especies sonoras; y la interferencia del paisaje, como ruidos de la vegetación, fuentes de agua y actividades humanas (Cunnington & Fahrig, 2010). Esta competencia acústica puede entenderse como una forma específica de competencia ecológica, donde las diferencias en los distintos mecanismos para minimizarla, se convierten en estrategias evolutivas o adaptativas (Klump & Langemann, 1995). Esto lo podemos evidenciar en la utilización de diferentes frecuencias, la selección de ambientes específicos para vocalizar, la variación temporal en la actividad acústica y la presencia de patrones distintivos en el canto de cada especie, tanto en términos espectrales como temporales, que permiten a las especies ocupar nichos acústicos distintos, reduciendo la superposición de sus vocalizaciones y evitando interferencias mutuas (Bignotte-Giró et al., 2019). Diversos estudios indican que, dentro de comunidades de anuros, las especies que coexisten tienden a mostrar diferencias significativas y una baja superposición en los parámetros espectrales y temporales de sus cantos (Chek et al., 2003; Garey et al., 2018).
El bosque seco tropical de Colombia, a pesar de su intensa alteración por actividades antropogénicas como la ganadería extensiva y los monocultivos (Pizano et al., 2014), alberga especies de anuros que han logrado sobrevivir a lo largo del tiempo asociadas a cuerpos de agua permanentes y temporales, pastizales, quebradas y potreros (Ortega-Chinchilla et al., 2019). Sin embargo, particularmente en el valle del río Cauca, se ha observado un notable aumento en la pr esencia de anuros invasores, como la rana toro (Lithobates catesbeianus) y el coquí antillano (Eleutherodactylus johnstonei). Estas invasiones han tenido impactos negativos significativos en las especies nativas, no solo a través de la depredación, transmisión de enfermedades y la competencia por recursos (Simberloff, 1996; Schloegel et al., 2010), sino también generando competencia en el uso del espacio acústico y traslape de las vocalizaciones (Barona et al., 2015; Both & Grant, 2012).
La caracterización específica de ensamblajes adquiere una relevancia significativa, ya que investigaciones previas han demostrado que las vocalizaciones de los anuros pueden experimentar alteraciones en su estructura y frecuencia, dependiendo de las presiones y contextos particulares del hábitat (Andreani et al., 2023; Cunnington & Fahrig, 2010;). Además, la identificación de patrones acústicos específicos desempeña un papel crucial en la planificación de áreas protegidas al resaltar la importancia de ciertos lugares para la reproducción y la diversidad de anuros (Domínguez-Vega et al., 2019).
Con el fin de profundizar en la importancia de la comunicación acústica para la interacción entre especies y la estructuración de los ensamblajes de animales, se caracterizó acústicamente un ensamblaje de cinco especies de anuros, conformado por Leptodactylus fragilis, Dendropsophus columbianus, Rhinella horriblis, Pristimantis achatinus y Leucostethus brachistriatus, siendo las especies más representativas del bosque seco tropical del valle del río Cauca, estas especies son de familias diferentes y se espera que sus cantos sean estructuralmente distintos, como se ha observado en estudios previos, donde se ha demostrado que las distancias filogenéticas influyen en la diversidad de las características acústicas (Kaffenberger et al., 2011; Köhler et al. 2017). Por otra parte, un aspecto relevante de este estudio es que el ensamblaje presentó la particularidad de no contar con la presencia de anuros invasores, por lo que representa relevancia al ser uno de los pocos ensamblajes nativos sin la presión sonora de estas especies. Con ese objetivo, en la Hacienda Piedechinche (El Cerrito, Valle del Cauca), se analizaron las características espectrales y temporales de los cantos de anuncio de las especies y se comparó la utilización del espacio acústico en términos de las frecuencias fundamentales de los cantos, además, se obtuvieron las horas y picos de actividad acústica de las mismas. Se espera que todas las especies ocupen un nicho acústico particular que evite el traslape en sus señales sonoras (Bignotte-Giró et al., 2019).
Materiales y métodos
Área de estudio: Este estudio se realizó en La Hacienda Piedechinche y contiene fragmentos de bosque seco tropical localizados en el flanco occidental de la Cordillera central, en el municipio de El Cerrito (Valle del Cauca) a 45 km de la ciudad Santiago de Cali (3°36’55.78’’- 3°38’16.41’’ N & 76°14’29.25’’-76°11’50.31’’ W). Se encuentra a una altura entre los 1 050 y 1 250 m.s.n.m, con una temperatura promedio de 24 º C, y cuenta con un área aproximada de 650 ha, que se distribuyen de la siguiente manera: 309 ha cultivo de caña, 95 ha cultivo de caña orgánica, 40 ha bosque seco tropical, 98 ha potreros, 11 ha museo de la caña de azúcar y 97 ha de reservorios, callejones y zanjones.
Trabajo de campo: El estudio se realizó durante la época lluviosa, de septiembre a noviembre del 2022. Se instalaron cuatro grabadoras de monitoreo acústico pasivo AudioMoth v1.1.0, a un metro de altura y a más de 100 m de distancia entre ellas para evitar solapamiento en las grabaciones (Boullhesen & Akmentins, 2021). Cada grabadora se configuró para grabar un minuto cada 20 minutos durante todo el día. Las señales se grabaron a una tasa de muestreo de 48 kHz con una digitalización de 16 bits por muestra. Los archivos se guardaron en el formato .wav. Para las grabaciones directas de los cantos se realizaron tres salidas de campo de tres días consecutivos en las que se llevaron a cabo recorridos diurnos y nocturnos para localizar individuos vocalizando. Se utilizó el método relevamiento por encuentros visuales (REV) y transectos lineales de audio (Heyer et al., 1994). Los cantos se grabaron a una distancia aproximada de 30 cm del individuo (Köhler et al., 2017) utilizando la grabadora PCM Lineal TASCAM DR-100MKIII sin micrófono adaptado, muestreo de 44.10 Hz y 16 bits por muestra en el patrón estéreo. También, se registró la temperatura corporal de la rana y la temperatura del ambiente con un Termómetro infrarrojo Testo 810.
Análisis de actividad acústica: Todas las grabaciones automáticas obtenidas fueron almacenadas en la plataforma RFCx Arbimon (Rainforest Connection, 2024) y fueron revisadas manualmente para detectar los cantos de las especies del ensamblaje. Con base en los registros acústicos encontrados se construyó un conjunto de entrenamiento de presencia/ausencia para cada especie, el cual requiere cumplir un mínimo de 50 registros positivos y 50 negativos, (Rainforest Connection, 2023). Sin embargo, para obtener una mayor precisión en la identificación se tomaron 200 registros positivos y 200 negativos de cada especie. A partir del conjunto de entrenamiento, se utilizó la función de Random Forest Models (RFMs) de Arbimon para crear un modelo de identificación automático para cada canto, basado en la identificación de la región de interés en el espectrograma (ROIs). Se utilizó el 70 % de las validaciones del conjunto de entrenamiento en “use in fitting” y el 30 % restante en “use in validation” para la validación del modelo, además se usó un ROI por cada especie (Aide et al., 2013).
Comparación de actividad acústica y nivel de solapamiento: A partir de los resultados obtenidos por el modelo Random Forest, se graficó el nivel de solapamiento de actividad acústica, comparando los patrones de actividad entre pares de las especies del ensamblaje, y se obtuvo el coeficiente Dhat4. Este coeficiente es una medida del solapamiento entre patrones de actividad animal y se basa en la cantidad de tiempo que dos animales pasan activos a la misma hora del día. El valor oscila entre 0 y 1, donde 0 representa que no hay solapamiento y 1 que el solapamiento es total. Los análisis se realizaron utilizando el paquete overlap 0.3.4 (Meredith & Maintainer, 2021) del lenguaje de programación R v 4.1.2.
Medición de las variables espectrales y temporales: Para estimar las variables, como se recomienda en Köhler et al. (2017), los cantos se visualizaron y midieron en oscilogramas para analizar las variables temporales y en espectrogramas para analizar las variables espectrales. Todas las variables se expresaron como el promedio ± desviación estándar ( ± SE). Se utilizó el enfoque centrado en notas (definidas como unidades ininterrumpidas de sonido y su totalidad como canto) y los términos y definiciones para los parámetros acústicos definidos por Köhler et al. (2017). Se cuantificaron seis variables de la estructura temporal de los cantos de advertencia de las especies: 1) duración del canto (seg), 2) número de notas, 3) número de tipos de nota 4) número de pulsos, 5) tasa de repetición de los pulsos (pulsos/nota) y 6) tasa de repetición del canto (cantos/min). Se cuantificaron dos variables de la estructura espectral de los cantos de anuncio: 1) frecuencia dominante del canto (Hz) y 2) número de armónicos. También, se realizó un análisis de varianza no paramétrico de Kruskal-Wallis (P < 0.05) para determinar si existen diferencias significativas en las frecuencias dominantes entre los cantos de las especies. Todos los análisis de los cantos se realizaron en el programa Raven Pro v1.5 para Windows (Bioacoustics Research Program, 2011) con un algoritmo Blackman y un tamaño de ventana de 1 024 muestras. La figura del espectrograma de todas las especies se generó a través del paquete de Rstudio Seewave 2.1.4 (Sueur et al., 2008) utilizando los mismos parámetros del análisis de los cantos.
Análisis de los componentes principales de los cantos: Para explorar las diferencias en las variables acústicas entre las especies, se implementó un análisis de los componentes principales (PCA). Para este análisis se utilizaron las seis variables cuantitativas de la estructura temporal y la frecuencia dominante de los cantos, los armónicos no fueron incluidos debido a que podrían verse afectados por ruido de fondo o artefactos técnicos (Köhler et al., 2017).
Resultados
Composición del ensamblaje: Se registró acústicamente un total de cinco especies de anuros nativos del valle geográfico del río Cauca dentro de la zona de influencia de las grabadoras: Dendropsophus columbianus, Leptodactylus fragilis, Leucostethus brachistriatus, Pristimantis achatinus y Rhinella horriblis (Fig. 1). En total, se obtuvieron 38 días efectivos de grabación con 12 756 grabaciones pasivas. En estas se obtuvieron 4 289 registros acústicos de las especies según los modelos de detección automatizada calculados por la plataforma Arbimon RFCx. La especie de mayores registros acústicos fue D. columbianus con un total de 2 188 registros, mientras la de menos registros fue R. horriblis con un total de 317 registros. Además, todas las especies vocalizaron en todos los puntos de muestro.
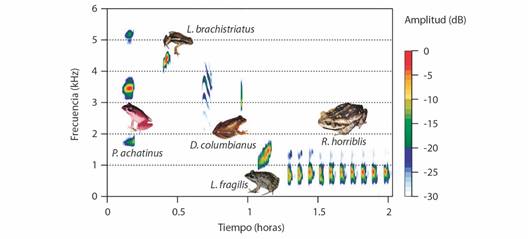
Fig. 1 Espectrogramas del canto de anuncio de las cinco especies del ensamblaje de anuros. El eje x representa el tiempo (seg), y el eje y la frecuencia (kHz). / Fig. 1. Spectrograms of the announcement song of the five species of the anuran assemblage. The x axis represents time (sec), and the y axis represents frequency (kHz).
Actividad acústica: Los registros de actividad acústica de las especies del ensamblaje son principalmente nocturnos (después de las 18:00 h). Sin embargo, la especie L. brachistriatus, al ser un dendrobátido, registró una actividad acústica exclusivamente diurna entre las 5:00 y las 18:00 h con un mayor número de registros a las 16:00 h. La especie D. columbianus fue la única en tener registros durante las 24 h del día, aunque estos aumentaron en la noche y madrugada (entre las 18:00 y 5:00 h) con el mayor número de registros a las 0:00 h. Por otra parte, P. achatinus, L. fragilis y R. horriblis presentaron una actividad acústica más reducida en cuanto al número de horas, siendo los picos de actividad 19:20, 18:00 y 18:20 respectivamente (Fig. 2). Los datos del solapamiento en actividad acústica mostraron que las especies con mayor solapamiento fueron P. achatinus y R. horriblis (Dhat4 = 0.78), seguidas de L. fragilis y R. horriblis (Dhat4 = 0.69). Por otra parte, las especies con menor solapamiento acústico fueron L. brachistriatus y R. horriblis (Dhat4 = 0.075), seguidas de P. achatinus y L. brachistriatus (Dhat4 = 0.09).
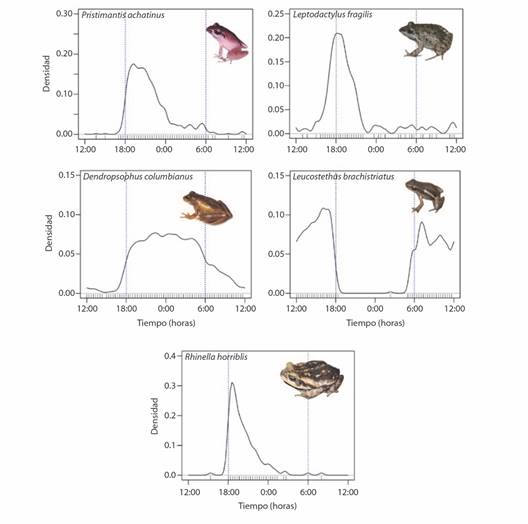
Fig. 2 Actividad acústica diaria de las especies del ensamblaje. El eje y representa la densidad de probabilidad de que las especies canten a una hora del día determinada (x). Las horas del eje x van desde las 12 del mediodía hasta las 12 del día siguiente, siendo las 0:00 (media noche) la mitad del eje. / Fig. 2. Daily acoustic activity of the species in the assemblage. The y axis represents the probability density that species sing at a given time of day (x). The hours on the x axis range from 12 noon to 12 the next day, with 0:00 (midnight) being the middle of the axis.
Parámetros temporales y espectrales: En total se analizaron 65 cantos de P. achatinus (n = 4 individuos), 18 cantos de D. columbianus (n = 4 individuos), 75 cantos de L. brachistriatus (n = 4 individuos), 64 cantos de L. fragilis (n = 3 individuos) y 14 cantos de R. horriblis (n = 3 individuos). En cuanto a los parámetros temporales, la única especie con un canto complejo (más de un tipo de nota) fue D. columbianus, con dos tipos de notas que suenan como “güee-ke” (Agudelo-Valderrama et al., 2014). Las especies que presentaron cantos pulsados fueron R. horriblis (50 ± 28.41 pulsos/nota, tasa de repetición 12.9 ± 0.47 pulsos/seg), D. columbianus solo en la nota 1 (54.14 ± 9.91 pulsos/nota, tasa de repetición 493.50 ± 0.02 pulsos/seg) y L. fragilis (13.49 ± 1.71 pulsos/nota, tasa de repetición 104.9 ± 5.72 pulsos/seg) con modulación en amplitud, mientras que P. achatinus y L. brachistriatus tuvieron cantos tonales. La especie con mayor duración del canto fue R. horriblis (4.41 ± 1.73 seg), seguida de D. columbianus (0.37 ± 0.07 seg), L. fragilis (0.29 ± 0.06 seg), P. achatinus (0.21 ± 0.04) y L. brachistriatus (0.11 ± 0.02 seg). La tasa de repetición de canto fue alta en las especies L. brachistriatus (142.02 ± 19.02 cantos/min) y P. achatinus (141.07 ± 7.33 cantos/min), seguida de L. fragilis (60.03 ± 4.61 cantos/min), respecto a R. horriblis (9.87 ± 7.63 cantos/min) y D. columbianus (9.68 ± 3.98 cantos/min) que fue mucho más baja. En cuanto a los parámetros espectrales, la prueba Kruskal-Wallis indicó que las frecuencias dominantes de los cantos de las especies son significativamente diferentes (g.l. = 4, P < 2.2e-16). L. brachistriatus presentó la frecuencia dominante más alta (4 468.57 ± 174.55 Hz), seguida de P. achatinus (3 474.05 ± 59.01 Hz) y D. columbianus (2 993.85 ± 817.31 Hz nota 1 y 2 723.84 ± 161.43 Hz nota 2), mientras que L. fragilis (1 423.70 ± 77.60) y R. horriblis (776.90 ± 34.75 Hz) presentaron las más bajas. D. columbianus tuvo el mayor número de armónicos (9.29 ± 5.89, en la nota 1), seguida de R. horriblis (2.35 ± 0.49) y P. achatinus que tuvo dos armónicos en las frecuencias 1 751.36 ± 55.17 Hz y 5 224 ± 74.9 Hz. No se registraron armónicos para las especies L. fragilis y L. brachistriatus.
Análisis de los componentes principales de los cantos: El PCA de los cantos indicó que el 86.2 % de la varianza está explicada por los dos primeros componentes principales, con el primero explicando el 58.6 % y el segundo el 27.6 % de la varianza total. La variable que presentó mayor aporte a la variación contenida en el primer componente principal del PCA fue el número de pulsos por nota siendo 20.37 %, lo que indica que existe gran variabilidad en esta propiedad entre las especies del ensamblaje. Adicionalmente, la variable que aportó mayor varianza al segundo componente fue la duración del canto con 28.34 %, lo que implica que estos son factores significativos para caracterizar la variabilidad acústica entre diferentes especies o individuos (Tabla 1).
Discusión
Se encontraron cinco especies en el ensamblaje de anuros del sitio de estudio. De acuerdo a los resultados obtenidos, las especies presentaron un alto solapamiento en actividad, pero grandes diferencias estructurales en sus cantos. Esto es congruente con hallazgos encontrados en estudios similares donde las especies con parámetros acústicos diferentes tienden a superponerse en sus nichos temporales y/o espaciales, lo que sugiere una posible adaptación para evitar la interferencia acústica (Guerra et al., 2020; Schwartz & Wells, 1983). En el ensamblaje estudiado, cada especie exhibe un canto distintivo que la define y la diferencia de las demás (Fig. 1), estos mostraron una gran variación en sus parámetros espectrales y temporales, lo que se hipotetizaba al tratarse de especies de familias diferentes.
Al analizar los datos de los diferentes parámetros acústicos de la Tabla 1 se puede apreciar que hay componentes que presentan mayor variación que otros. Dentro de los parámetros temporales, el número de pulsos por nota y la duración del canto, son caracteres que muestran los porcentajes de variación más altos. Esto sugiere que las especies de anuros exhiben una notable diversidad en sus patrones de comunicación acústica, la cual podría estar vinculada a la adaptación a entornos específicos, condiciones ambientales cambiantes o estrategias individuales de comunicación (Baquero-Rivadeneira, 2012). Las especies con mayor variación intraespecífica en su canto fueron R. horriblis y D. columbianus. Estas presentaron una gran variación en el número de pulsos por nota (50 ± 28.41 pulsos/nota) y (54.14 ± 9.91 pulsos/nota) respectivamente, y en la tasa de repetición del canto (9.87 ± 7.63 cantos/min) y (9.68 ± 3.98 cantos/min) respectivamente. Hallazgos similares se observaron en poblaciones de la especie Melanophryniscus rubriventris, donde la duración del canto representó el componente que aportó en mayor proporción a la varianza, posiblemente asociado a factores ambientales como la temperatura (Ferrari & Vaira, 2008).
Las cinco especies del ensamblaje difieren entre ellas en la frecuencia dominante, uno de los parámetros más significativos en los ensamblajes de anuros debido a la cantidad de información que aporta (Gerhardt & Schwartz, 2001). Los resultados evidencian que los cantos presentan una frecuencia dominante distinta (Kruskal-Wallis, P < 2.2e-16), sugiriendo que la ausencia de traslape en la frecuencia dominante permite una comunicación eficiente entre cada especie.
Las diferencias notorias en los cantos de anuncio, evidencian la existencia de una partición en el espacio acústico dentro de la comunidad estudiada, por lo que no muestran interferencia acústica entre sus vocalizaciones. Este hallazgo sugiere que, cuando las especies comparten sitios y horas de actividad vocal, la variación en los parámetros del canto sirve como un mecanismo para prevenir o reducir la interferencia acústica, permitiendo así el reconocimiento entre especies. La única especie que no comparte horario de actividad acústica con las demás es L. brachistriatus, cuyo comportamiento es diurno y característico de la familia Dendrobatidae.
La variabilidad en los cantos dentro de la comunidad puede explicarse mediante la hipótesis del nicho acústico (Krause, 1993), que indica que los anuros de este ensamblaje comparten el paisaje acústico sin superposición de nichos. Esta constatación refuerza la relevancia de los cantos como un mecanismo de aislamiento que minimiza la competencia acústica. Los cantos, siendo el principal medio que las hembras utilizan para seleccionar al macho con el que se aparearán, destacan su importancia en el proceso reproductivo (Köhler et al., 2017; Toledo et al., 2015). Sin embargo, es crucial resaltar que las especies objeto de estudio exhiben notables diferencias tanto en su taxonomía como en su ecología. Por ende, las disparidades acústicas observadas se encuentran intrínsecamente vinculadas a las particularidades de sus historias naturales, y podría indicar que no se dan necesariamente por competencia acústica en este ensamblaje particular (Odom et al., 2021). No obstante, la partición del nicho acústico sí les permite coexistir y comunicarse sin generar un traslape en sus señales.
Por otra parte, particularmente para la población estudiada de P. achatinus se encontraron algunas diferencias con la descripción original del canto. El canto fue descrito con individuos de Ecuador en la provincia de Carchi, cerca al borde de Colombia en 1983, fue descrito como un canto nasal tipo kree que puede variar de manera individual, presentando series cortas de 3 a 6 notas, con una frecuencia dominante de entre 3 000-3 400 Hz y de tres a cinco armónicos entre 2 600-3 600 Hz (Lynch & Myers, 1983). En los cantos analizados para esta población de la cordillera central de Colombia se encontró que hay una variación en algunos parámetros, pues los individuos vocalizaban a una sola nota, con una frecuencia dominante de 3 474.05 ± 59.01 Hz y únicamente dos armónicos en las frecuencias 1 751.36 ± 55.17 Hz y 5 224 ± 74.9 Hz, que difieren con la estructura del canto original. Actualmente no se encuentran más descripciones acústicas de esta especie para esta región en Colombia, y si bien, los cantos de los anuros pueden presentar variaciones geográficas (Baraquet et al., 2007), se sugiere investigar estas diferencias con la posibilidad de tratarse de un complejo de especies.
El objetivo de este estudio fue caracterizar un ensamblaje acústico del bosque seco tropical del valle del río Cauca, mediante el análisis de la estructura y los patrones de actividad de los cantos de anuncio de las especies. Con este conocimiento se puede tener una idea de cómo las especies interactúan y se adaptan a su entorno acústico natural. La identificación de los patrones de actividad acústica puede revelar información sobre las horas específicas de estas especies para la reproducción. Asimismo, la ausencia de intervenciones en el entorno acústico permite establecer una línea base de referencia para evaluar futuros cambios. Si se produce alguna alteración en el patrón de actividad acústica o en las vocalizaciones, podría indicar cambios en la población de anuros, posibles amenazas ambientales o alteraciones en el hábitat como intervenciones antropogénicas o la introducción de anuros invasores, y así efectuar acciones de conservación de la diversidad. También, es crucial destacar que los resultados obtenidos en este estudio están intrínsecamente ligados al grupo específico de las especies estudiadas y a la escala temporal y espacial en la que se llevó a cabo la investigación, variaciones en estos parámetros podrían conducir a resultados diferentes.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


