Introducción
En la región de la Orinoquía colombiana, los diferentes usos de suelo, principalmente ganadería, han promovido la pérdida parcial o total de la vegetación ribereña (Osorio-Ramírez et al., 2015). Estos impactos generan la alteración de las características fisicoquímicas del agua, la pérdida de hábitat y, consecuentemente, influyen en la calidad del agua (Corbi et al., 2013; Melo et al., 2017; Uieda et al., 2017) y afectan significativamente la diversidad de las comunidades acuáticas (Bauernfeind & Moog, 2000).
La creciente transformación de los ecosistemas naturales y la pérdida de integridad de los recursos hídricos ha motivado diferentes investigaciones relacionadas con estrategias de evaluación de la calidad ambiental, entre ellas la utilización de bioindicadores (Perevochtchikova, 2013). En este contexto, los macroinvertebrados acuáticos se emplean como indicadores de la calidad del agua, debido a la capacidad de respuesta a diferentes tipos de impactos (Hodkinson & Jackson, 2005; Miranda, 1987; Roldán-Pérez, 2016; Springer, 2010). Dentro de éstos, los efemerópteros se consideran como uno de los principales indicadores biológicos de la integridad ecológica en ríos y arroyos (Gutiérrez & Reinoso-Flórez, 2010). El estudio de estos organismos a nivel de género y especies se ha sugerido en diferentes investigaciones, ya que puede ser más eficiente para la detección de perturbaciones sutiles o puntuales (Hodkinson & Jackson, 2005; Miranda, 1987; Prat et al., 2009; Springer, 2010). En el continente americano, una de las familias más representativas del orden Ephemeroptera es Leptohyphidae (Hoyos et al., 2014); sin embargo, estudios del grupo como bioindicador a nivel de género o especie son escasos (Arimoro & Muller, 2010).
El río Quenane-Quenanito, ubicado en la el piedemonte de la Orinoquia colombiana, se destaca por sus características ambientales particulares, como escasa pendiente y periodos hidrológicos contrastantes. En época seca (diciembre a marzo) experimenta una alta presión, consecuencia de diferentes actividades antrópicas (turismo, actividades agropecuarias y algunas relacionadas con la producción de hidrocarburos), pues nace en inmediaciones de la ciudad de Villavicencio (Meta, Colombia). Adicionalmente, su caudal disminuye hasta desaparecer superficialmente (Osorio-Ramírez et al., 2015; Vargas-Pineda et al., 2020).
Dado que Leptohyphidae tiene potencial para la evaluación de la calidad del agua, se requiere adelantar estudios encaminados a conocer aspectos biológicos y ecológicos en corrientes del piedemonte llanero. Por lo anterior, se planteó como pregunta de investigación: ¿cuál es la composición y estructura del ensamblaje de la familia Leptohyphidae en el río Quenane-Quenanito (Meta-Colombia), en dos periodos hidrológicos contrastantes? Por consiguiente, la hipótesis planteada fue: la diversidad de la familia Leptohyphidae cambia de acuerdo con las características ecológicas y ambientales de los diferentes tramos del río; así, aquellos con mayor alteración de las variables fisicoquímicas tendrán menor diversidad alfa y mayor diversidad beta, debido al recambio, entre los diferentes tramos.
Materiales y métodos
Área de estudio: el río Quenane-Quenanito es tributario directo del río Negro que desemboca en el río Metica (Osorio-Ramírez et al., 2015). El río Negro nace al occidente del municipio de Villavicencio en la vereda La Concepción, donde confluyen pequeñas quebradas de la zona montañosa (Díaz-Guarnizo & Daza-Díaz, 2009). La cuenca del río Quenane-Quenanito comprende parte de la zona noroccidental del departamento del Meta, desde el municipio de Villavicencio hasta las terrazas del municipio de Puerto López. Nace en la Base de la Fuerza Aérea de Apiay (375 m.s.n.m.) en la vereda Apiay y tributa al río Negro (200 m.s.n.m.) en la vereda Pachaquiaro en el municipio de Puerto López (Meta) (Fig. 1). A lo largo de la cuenca se desarrollan diferentes actividades antrópicas; así, en la zona alta y media prevalece el turismo y en la zona baja actividades agropecuarias y aquellas asociadas a la producción de hidrocarburos (Osorio-Ramírez et al., 2015) (Tabla 1).
Tabla 1 Estaciones de muestreo establecidas, coordenadas, altura y actividad antrópica asociada. / Table 1. Stablished sampling stations, coordinates, height and associated anthropogenic activity.
| Estación | Nombre de la estación | Altura (m.s.n.m) | Longitud | Latitud | Actividad antrópica asociada |
| CQ1 | Predios del SENA | 329 | 4°04’2.64” N | 73°30’28.06” W | “Punto de referencia”. Vertimientos puntuales de algunas viviendas. |
| CQ2 | Sector La Reforma II | 345 | 4°04’28.3” N | 73°28’25.30” W | Turismo. En el sector se presentaron eventos de filtración de crudo (2012). Se capta agua para cultivos varios. |
| CQ3 | Santa Helena | 298 | 4°04’50.44” N | 73°25’32.53” W | Turismo |
| CQ4 | Finca Villa Esperanza | 280 | 4°04’33.08” N | 73°22’34.48” W | Vertimientos de asentamientos humanos y de lodos asociadas a actividades de explotación de hidrocarburos de la estación Apiay (clausurado en el 2013). En el sector captan agua para piscicultura. |
| CQ5 | El Naranjal vía Puerto Colombia | 228 | 4°02’45.95” N | 73°15’2.42” W | Vertimientos difusos de cultivos de cítricos, arroz, entre otros. |
| CQ6 | Desembocadura al río Negro | 205 | 4°02’23.52” N | 73°10’33.42” W | Ganadería - cultivos. Trasvase de cauce del río Pachaquiaro (en el perímetro del canal hay criaderos de cerdos). |
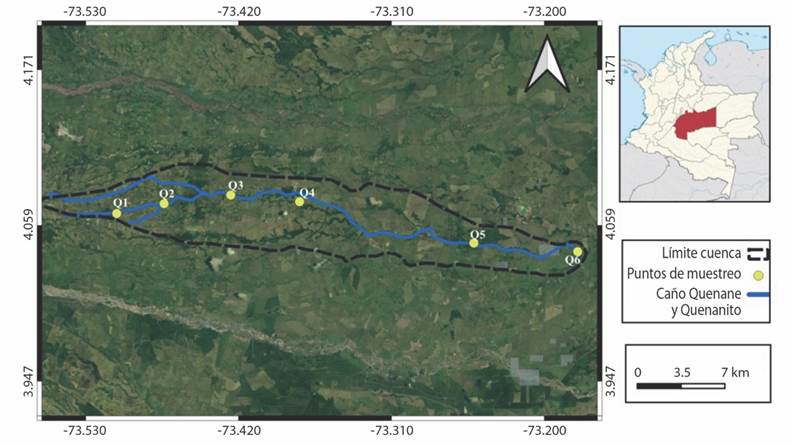
Fig. 1 Ubicación geográfica y zonificación de las estaciones de muestreo (puntos amarillos) del río Quenane-Quenanito. Fig. 1. Geographical location and zonification of sampling stations (yellow dots) of the Quenane-Quenanito river.
Material biológico y variables fisicoquímicas: el material biológico y las variables fisicoquímicas, se recolectaron y midieron, en el proyecto “Identificación de alternativas de manejo ambiental de los ríos Guayuriba y Ocoa y Quenane-Quenanito de la cuenca alta del río Meta, basado en estrategias educativas, investigativas y de proyección social”, del convenio marco de colaboración No. 5211592 suscrito entre la Universidad de los Llanos y la Empresa Colombiana de Petróleos S.A. (Ecopetrol). Las muestras se recolectaron en diciembre de 2014 (transición a sequía o periodo hidrológico de aguas descendentes) y febrero de 2015 (sequía o periodo hidrológico de aguas bajas). Las variables fisicoquímicas medidas in situ fueron: pH (unidades de pH), oxígeno disuelto (mg/l O2), porcentaje de saturación de oxígeno (% OD) temperatura del agua (º C), conductividad eléctrica (μS/cm) y caudal (m3/s); ex situ se midieron 13 variables por un laboratorio acreditado por el Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM): sólidos disueltos totales (ppm SDT ), turbidez (UNT), bicarbonatos (mg/l HCO3), amonio (mg/l NH4), nitrógeno total (mg/l), fósforo total (mg/l), sulfatos (mg/l SO4), demanda bioquímica de oxígeno (mg/l DBO5), demanda química de oxígeno (mg/l DQO), fenoles (mg/l), surfactantes (mg/l tensoactivos aniónicos), hierro (mg/l Fe) y coliformes fecales (NMP/100 ml).
La recolección de muestras biológicas se realizó en una franja de 100 metros de longitud en cada estación (seis en total) (Fig. 1), la cual representó los tipos de hábitats más frecuentes en la corriente. Los especímenes se capturaron con una red Surber (250 µm, 900 cm2) sumergida sobre el área seleccionada en contracorriente (Roldán, 1988), y se removió el sustrato (piedras, hojarasca, macrófitas acuáticas) durante tres minutos. Se tomó un total de siete muestras por estación y se fijaron y conservaron en alcohol etílico (70 %). La determinación de los especímenes se realizó con base en las claves taxonómicas de Domínguez et al. (2006), Domínguez et al. (2009) y Salles et al. (2018). Las ninfas que no se lograron identificar se nombraron como morfoespecies, debido a que estaban en estado inmaduro y no se observaban las características necesarias para llegar a especie o se requería el adulto (como en Traverhyphes). El material biológico se depositó en la colección de macroinvertebrados acuáticos del Museo de Historia Natural Unillanos (MHNU-MA).
Análisis de datos: para analizar la diversidad alfa de Leptohyphidae a nivel espacial y temporal se empleó el número efectivo de especies propuesto por Jost (2006). Se usaron las medidas de riqueza (q0), diversidad de Shannon-Wiener (q1) y dominancia de Simpson (q2) calculadas a partir del paquete iNext (Hsieh et al., 2016). Para diversidad beta se usó el enfoque de Baselga (2010), y Baselga & Orme (2012), que asume que la diversidad beta total (βBC) es la sumatoria de la variación balanceada de la abundancia (βBC.BAL) y el gradiente de abundancia (βBC.GRA); se calcularon a partir del índice de similitud de Bray-Curtis, con el paquete betapart (Baselga et al., 2018). Se realizó un Análisis de Redundancia (RDA) para determinar las relaciones entre las variables fisicoquímicas y el componente biótico con los paquetes vegan (Oksanen et al., 2018), y adespatial (Dray et al., 2019); previamente se realizó un Análisis de Correspondencia Sin tendencia (DCA) que arrojó que la longitud del primer eje de ordenación era inferior a tres (< 3) por lo que se seleccionó un análisis de gradiente directo (Lepš & Šmilauer, 2003). Los datos biológicos fueron sometidos a una estandarización de Hellinger (Peres-Neto et al., 2006), y los fisicoquímicos fueron estandarizados a “z-cores” (Guisande et al., 2011). Para la selección de las variables más importantes se empleó el procedimiento “forward selection” (Blanchet et al., 2008). Con el fin de obtener mayor soporte en las posibles relaciones entre los ejemplares de la familia Leptohyphidae y las variables ambientales, se aplicó un Modelo Lineal Generalizado (GLM), cuya variable de respuesta fue la abundancia de las morfoespecies, utilizando el paquete MuMIn (Burnham & Anderson, 2002) y la selección de modelos mediante el Criterio de Información de Akaike (AICc) (Martínez et al., 2008). Dentro de las variables ambientales se incluyeron el índice de calidad del agua (ICA) calculado a partir de cinco variables (DQO, % OD, conductividad eléctrica, pH y relación nitrógeno total/fósforo total) (Instituto de Hidrología, Meteorología y Estudios Ambientales, 2011), el ICOTRO y el ICOMO de acuerdo con lo propuesto por Ramírez et al. (1997). Todos los paquetes se corrieron en software RStudio (RStudio Team, 2016).
Resultados
Composición taxonómica de la familia Leptohyphidae en el arroyo Quenane-Quenanito: se obtuvo un total de 369 ejemplares pertenecientes a cuatro géneros; el más abundante fue Tricorythopsis (95.12 %) y el menos abundante Tricorythodes (1.08 %) (Tabla 2). Se identificaron 2 especies: Amanahyphes saguassu (primer registro para el país de un género que se creía únicamente amazónico) y Tricorythopsis rondoniensis; también 5 morfoespecies de Tricorythopsis, y una de Tricorythodes, Traverhyphes y Amanahyphes, respectivamente.
Tabla 2 Leptohyphidae del río Quenane-Quenanito en dos periodos hidrológicos contrastantes (transición a sequía y sequía). / Table 2. Letohyphidae of the Quenane-Quenanito river in two contrasting hydrological periods (transition to drought and drought).
| Género | Especie | Abundancia relativa (%) |
| Amanahyphes (2.71 %) | Amanahyphes saguassu (Salles & Molineri, 2006) | 0.54 |
| Amanahyphes sp. (Salles & Molineri, 2006) | 2.17 | |
| Traverhyphes (1.35 %) | Traverhyphes sp. (Molineri, 2001) | 1.35 |
| Tricorythodes (1.08 %) | Tricorythodes sp. (Ulmer, 1920) | 1.08 |
| Tricorythopsis (95.12 %) | Tricorythopsis rondoniensis (Dias et al., 2009) | 0.54 |
| Tricorythopsis sp. 1(En descripción) | 44.17 | |
| Tricorythopsis sp. 2 (En descripción) | 45.26 | |
| Tricorythopsis sp. 3 (Traver, 1958) | 4.06 | |
| Tricorythopsis sp. 4 (Traver, 1958) | 0.27 | |
| Tricorythopsis sp. 5 (Traver, 1958) | 0.27 |
Diversidad del ensamblaje de la familia Leptohyphidae: en el periodo hidrológico de sequía se registró el mayor número de ejemplares (259), mientras que en la transición a sequía se registraron 110. Las estaciones que registraron mayor abundancia fueron CQ6 y CQ5 (con 156 y 135 ejemplares, respectivamente), representada principalmente por Tricorythopsis sp.1 y Tricorythopsis sp. 2; la menor abundancia se evidenció en CQ2 y CQ4 (25 y 23 ejemplares respectivamente). Es necesario señalar que no se registró ningún Leptohyphidae en la estación CQ1 en los dos periodos hidrológicos, ni en la estación CQ2 en transición a sequía (Tabla 3).
Tabla 3 Distribución, riqueza y abundancia de las especies de Leptohyphidae en el río Quenane-Quenanito en dos periodos hidrológicos contrastantes. / Table 3. Distribution, richness and abundance of the Leptohyphidae species in the Quenane-Quenanito river in two contrasting hydrological periods.
| Especies | Estaciones de muestreo | ||||||||||
| CQ2 | CQ3 | CQ4 | CQ5 | CQ6 | |||||||
| Ad | Ab | Ad | Ab | Ad | Ab | Ad | Ab | Ad | Ab | ||
| Amanahyphes saguassu | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Amanahyphes sp. | 0 | 8 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | |
| Traverhyphes sp. | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 2 | 0 | 2 | |
| Tricorythodes sp. | 0 | 0 | 2 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | |
| Tricorythopsis rondoniensis | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Tricorythopsis sp. 1 | 0 | 0 | 7 | 12 | 2 | 6 | 28 | 42 | 2 | 64 | |
| Tricorythopsis sp. 2 | 0 | 13 | 0 | 0 | 4 | 7 | 51 | 6 | 0 | 86 | |
| Tricorythopsis sp. 3 | 0 | 2 | 4 | 3 | 0 | 0 | 4 | 0 | 2 | 0 | |
| Tricorythopsis sp. 4 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | |
| Tricorythopsis sp. 5 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | |
Ad = transición a sequía; Ab = sequía.
A nivel espacial, en cada periodo hidrológico no hubo diferencia significativa en la diversidad alfa. Al contrastar los índices entre periodos hidrológicos se evidenció que en sequía en la estación CQ2 se registró la mayor riqueza (q0) y dominancia (q2); mientras que en transición a sequía no se registró ningún ejemplar en esta estación, y CQ4 reportó mayor número efectivo de especies (Fig. 2A, Fig. 2B).
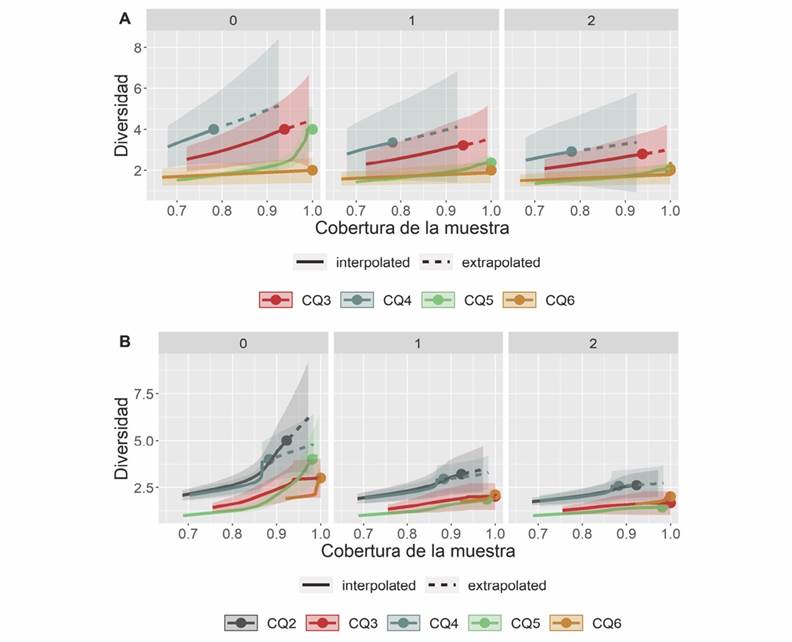
Fig. 2 Diversidad alfa espacial de Leptohyphidae a lo largo del río Quenane-Quenanito en dos periodos hidrológicos A. Transición a sequía y B. Sequía. Fig. 2. Spatial alpha diversity of Leptohyphidae along the Quenane-Quenanito river in two hydrological periods A. Transition to drought and B. drought.
Análisis de diversidad beta: la diversidad beta total para cada periodo hidrológico fue alta (en transición a sequía βBC = 0.86, en sequía βBC = 0.80), lo cual señala que existe un recambio alto en el ensamblaje de taxones a nivel espacial en ambos periodos hidrológicos. En transición a sequía el principal responsable de la disimilitud fue el gradiente de abundancia (βBC.GRA = 0.50); en sequía tanto la variación balanceada como el gradiente de abundancia determinaron el recambio de especies (βBC.BAL = 0.43 y βBC.GRA = 0.38).
En cuanto al análisis de agrupamiento pareado, en el periodo transición a sequía se evidenció, según la variación balanceada de la abundancia, que las estaciones CQ3 y CQ6 se agruparon con un valor de disimilitud de cero (βBC.BAL = 0), es decir que comparten las mismas especies; por el contrario la estación CQ4 registró la mayor disimilitud (βBC.BAL = 0.5) (Fig. 3A, Fig. 3B). Por otra parte, en el gradiente de abundancia las estaciones con menor disimilitud fueron CQ3 y CQ4 (βBC.GRA = 0.10), junto a CQ6; la estación CQ5 se separó considerablemente de este grupo (βBC.GRA = 0.90). En el periodo hidrológico de sequía, según la variación balanceada, las estaciones CQ4, CQ5 y CQ6 fueron similares en composición (βBC.BAL > 0.133), mientras que CQ2 se diferenció notablemente de las demás (βBC.BAL = 0.81). Por otra parte, el dendrograma de gradiente de abundancia evidencia tres agrupaciones diferenciadas: las estaciones CQ2-CQ5 (βBC.GRA = 0.082), las estaciones CQ3-CQ4 (βBC.GRA = 0.0129), y la estación CQ6 como entidad solitaria (βBC.GRA = 0.49) (Fig. 4A, Fig. 4B).
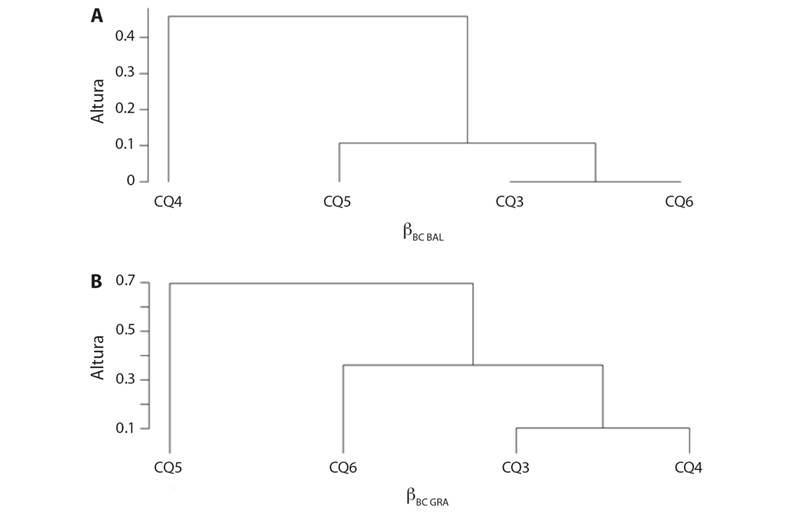
Fig. 3 Diagrama de disimilitud de la diversidad beta de Leptohyphidae en el río Quenane-Quenanito en el periodo hidrológico de transición a sequía. A. Según la variación balanceada de la abundancia. B. Según el gradiente de la abundancia. Fig. 3. Dissimilarity diagram of the beta diversity of the Leptohyphidae in the Quenane-Quenanito river in the hydrological period of transition to drought A. according to the balanced abundance variation and B. to the abundance gradient.
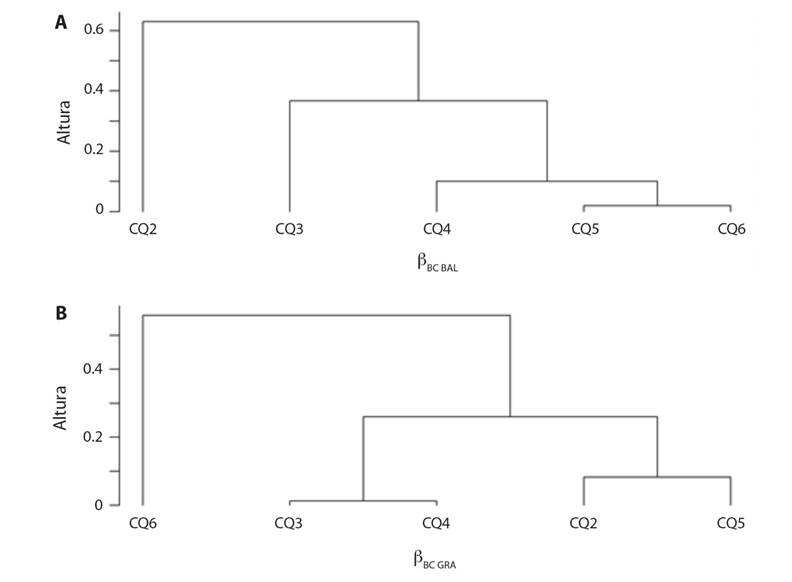
Fig. 4 Diagrama de disimilitud de la diversidad beta de Leptohyphidae en el río Quenane-Quenanito en el periodo hidrológico de sequía. A. Según la variación balanceada de la abundancia. B. Según el gradiente de la abundancia. Fig. 4. Dissimilarity diagram of the beta diversity of Leptohyphidae in the Quenane-Quenanito river in the hydrological period of drought A. according to the balanced abundance variation and B. to the abundance gradient.
Relación entre variables fisicoquímicas con el ensamblaje de la familia Leptohyphidae: El RDA explicó el 37 % de la variación entre las matrices de datos biológicos y de variables ambientales, pero no hubo una variable que explicara significativamente esta variación (P > 0.05). En la transición a sequía, la turbidez fue importante en el establecimiento de Tricorythopsis sp. 3; el pH y la conductividad jugaron este mismo papel en sequía, siendo importantes para Tricorythopsis sp. 2. El oxígeno disuelto parece una variable importante a considerar para Tricorythopsis sp.1 en sequía (Fig. 5).
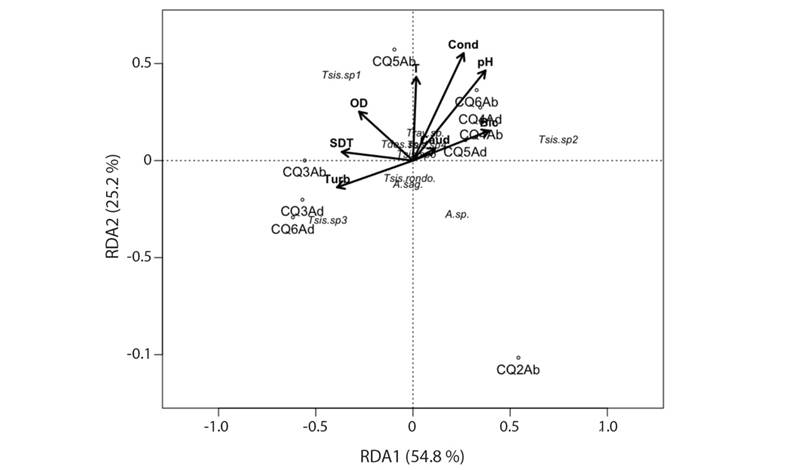
Fig. 5 Diagrama de ordenación RDA de la comunidad de Leptohyphidae con respecto a las variables fisicoquímicas, estaciones de muestreo y periodos hidrológicos contrastantes en el arroyo Quenane-Quenanito. Ab = sequía; Ad = transición a sequía; Turb = turbidez; SDT = sólidos disueltos totales; OD = oxígeno disuelto; T = temperatura; Cond = conductividad; Caud = Caudal; Bic = bicarbonatos. Fig. 5. RDA sorting diagram of the Leptohyphidae community in respect to the physicochemical variables, sampling stations and contrasting hydrological periods in the Quenane-Quenanito river. Ab = drought; Ad = transition to drought; Turb = turbidity; SDT = total dissolved solids; OD = Dissolved oxygen; T = temperature; Cond = conductivity; Caud = flow; Bic = bicarbonates.
Ahora bien, el análisis GLM se logró aplicar a las morfoespecies Tricorythopsis sp. 1 y Tricorythopsis sp. 2, y a la familia en general; los demás taxones no se incluyeron en los análisis debido a su baja abundancia. En la Tabla 4 se observan los modelos más parsimoniosos para cada grupo taxonómico con su respectivo AICc, y el coeficiente de determinación (r2). El modelo correspondiente a la familia Leptohyphidae presentó el mayor valor de AICc y explicó el 58 % de la varianza, muy similar al modelo de Tricorythopsis sp. 1, que explicó el 60 %; en el caso de Tricorythopsis sp. 2 presentó el valor más bajo de r2, con 45 % (Tabla 4).
Tabla 4 Modelos GLM con el mejor ajuste según el criterio AICc y el Coeficiente de determinación (r2). Table 4. GLM models with the criterion for best fit AICc and the determination coefficient (r2).
| Grupo taxonónomico | Modelo | AICc | r2 |
| Leptohyphidae | Abundancia≈ Bic+Fe+ICA+SDT | 312.9 | 0.58 |
| Tricorythopsis sp. 1 | Abundancia≈ DQO+ICA+ICOMO+pH | 172.8 | 0.60 |
| Tricorythopsis sp. 2 | Abundancia≈ Bic+Fe+ICA+SDT+pH | 149.9 | 0.45 |
Bic = Bicarbonatos mg/l CaCO3, Fe = Fenoles mg/l, ICA = Índice de Calidad de Agua, SDT = Sólidos disueltos totales mg/l, DQO = Demanda Química de Oxígeno mg/l O2, ICOMO = Índice de Contaminación por Materia Orgánica. / Bic = Bicarbonates mg/l CaCO3, Fe = Phenols mg/l, ICA = Water quality Index, SDT = Total dissolved solids mg/l, DQO = Chemical Oxygen demand mg/l O2, ICOMO = Contamination for Organic Matter Index.
Discusión
Para Colombia hay reportados hasta el momento nueve géneros de la Familia Leptohyphidae (Dias et al., 2021; Salles et al., 2020), cuatro de los cuales fueron registrados en este estudio: Amanahyphes, Traverhyphes, Tricorythodes y Tricorythopsis; estos corresponden al 44.4 % de los géneros registrados para Colombia. Es de resaltar que este es un número alto de taxones para una corriente tan pequeña, con características ambientales particulares como una escasa pendiente y periodos hidrológicos contrastantes (lluvia y sequía fuerte); también experimenta una alta presión debido a la extracción para la producción agrícola en época seca (diciembre a marzo), de forma que su caudal disminuye hasta desaparecer en la mayoría de su recorrido (Osorio-Ramírez et al., 2015; Vargas-Pineda et al., 2020).
A nivel espacial, en cada periodo hidrológico no hubo diferencias significativas en la diversidad alfa. Sin embargo, las estaciones CQ5 y CQ6 presentaron la diversidad más baja y las abundancias más altas, correspondientes a las morfoespecies Tricorythopsis sp.1 y Tricorythopsis sp. 2. Esto puede ser producto de las condiciones ambientales y del tipo de actividad antrópica que allí se desarrolla (ganadería y cultivos), pues la diversidad de insectos acuáticos en sitios con influencia agrícola es mayor con respecto a sitios urbanizados (Martins et al., 2017), dada la mayor transformación que genera el crecimiento poblacional urbano (Domínguez et al., 2009; Moore & Palmer, 2005).
Teniendo en cuenta que el género Tricorythopsis se clasifica dentro del gremio “raspadores” (Palmer et al., 1993), un factor relevante para su establecimiento es la disponibilidad de alimento. La capacidad de colonización de los sustratos por parte de estos organismos se incrementa con una mayor disponibilidad de perifiton, cuyo metabolismo fotosintético y crecimiento celular son favorecidos por la disminución de caudal, un pH básico (altas concentraciones de carbonatos y bicarbonatos) que facilite la disponibilidad de nutrientes, y por la conductividad y temperatura altas (Anzola & Rondón, 2005; Roldán & Ramírez, 2008; Salles et al., 2003; Stevenson et al., 1996). En las dos estaciones mencionadas (CQ5 y CQ6) se presentaron las condiciones ideales para el desarrollo de perifiton, tales como los caudales más bajos, la mayor concentración de bicarbonatos, un pH ligeramente ácido y los valores más altos de conductividad; por lo tanto, es probable que en estas estaciones se encuentre una mayor cantidad de perifiton, lo que favorecería el establecimiento de estas morfoespecies de efemerópteros.
Otros factores para tener en cuenta son sus ciclos de vida o su tolerancia a las perturbaciones y la oferta de nutrientes o refugios, como es el caso de la estación CQ5, en donde hubo presencia de macrofitas acuáticas que los invertebrados pueden usar para estos fines. Algunos autores han documentado que la densidad de efemerópteros aumenta en presencia de estas plantas, incluso en zonas con gran impacto antropogénico (Domínguez et al., 2009; Melo et al., 2017; Roldán & Ramírez, 2008).
Por otra parte, la estación CQ4 está afectada por vertimientos de asentamientos humanos y disminución de caudal para uso del recurso en piscicultura. En esta estación se evidenció uno de los valores más altos de caudal en la época de transición a sequía (aportado por la alta precipitación en semanas anteriores), un pH ligeramente ácido y la disminución en la conductividad con respecto al valor registrado en la temporada de sequía (MS1), todo lo cual podría reducir la biomasa del perifiton (Montoya & Ramírez, 2007). Lo anterior genera condiciones drásticas para el establecimiento de organismos acuáticos, pues las urbanizaciones los afectan negativamente, con la consecuente reducción en la riqueza y el aumento en la abundancia de las especies tolerantes a estas alteraciones (Melo et al., 2017; Uieda et al., 2017). En esta estación se reportó la diversidad más alta en el periodo hidrológico de transición a sequía, una baja abundancia de las morfoespecies Tricorythopsis sp. 1 y sp2 y la presencia de los géneros Amanahyphes, Traverhyphes y Tricorythodes. Esto se puede atribuir a dos factores: la disminución de las poblaciones dominantes que posibilita la colonización de otras especies más resistentes (Usme et al., 2013) y las condiciones ambientales directas e indirectas, como el cambio en el uso del suelo, que pueden empeorar la calidad del agua, dado que la densidad poblacional humana va en rápido aumento (Osorio-Ramírez et al., 2015) con la urbanización.
La estación CQ2 se caracteriza porque alrededor se desarrolla actividad turística y se capta el agua para los cultivos, acciones que impactan drásticamente la estructura física del cauce y conllevan al empobrecimiento de la calidad del agua, lo cual se refleja en la disminución de la oferta y variedad de microhábitats, así como en la abundancia de los organismos (Osorio-Ramírez et al., 2015). El establecimiento de cultivos genera principalmente remoción de la vegetación de ribera, lo que promueve la erosión de las orillas y el incremento de la temperatura, y así un aumento en la sedimentación de los cuerpos de agua (Corbi et al., 2013). Sumado a esto, la aplicación de herbicidas y fertilizantes necesarios para el desarrollo de los cultivos aumenta las concentraciones de nitrógeno, fósforo y potasio, que a su vez favorecen la actividad de los microorganismos, lo que genera una disminución en las concentraciones de oxígeno disuelto (Melo et al., 2017). Aunque actualmente no se registran vertimientos industriales en el río Quenane-Quenanito y las actividades petroleras se enfocan únicamente en la captación de agua (Vargas-Pineda et al., 2020), es importante realizar el seguimiento de los organismos bentónicos, pues en estudios realizados en ríos afectados por derrames de hidrocarburos en Estados Unidos se encontró que las especies de Ephemeroptera estuvieron ausentes hasta nueve meses después de ocurrido un derrame (Crunkilton & Duchrow,1990).
En la temporada de sequía se observó la diversidad más alta en la estación CQ2. Posiblemente la disminución de los impactos antrópicos debido a la urbanización en CQ1, la presencia de rápidos alternados con remansos, los neumatóforos de Mauritia flexuosa L.f 1782 (moriche) en la orilla y la hojarasca proveniente de la vegetación ribereña cercana al cauce, permiten una mayor oferta de microhábitats y alimento, que favorecen la colonización de una gran variedad de taxones (Ferreira et al., 2021). Adicionalmente, en los trópicos se ha evidenciado que la familia Leptohyphidae tiene una gran capacidad de recuperación a los impactos, con varias especies capaces de sobrevivir a diferentes alteraciones en los ecosistemas acuáticos (Lafuente et al., 2019). Por otra parte, en la fase de transición a sequía no se registró ningún ejemplar, pues posiblemente las condiciones fisicoquímicas no fueron favorables, dado que los niveles de turbidez y SDT fueron altos y el pH fue ligeramente ácido.
No se reportaron organismos en las estaciones CQ1 en los dos periodos hidrológicos, ni en el sitio CQ2 en la época de transición a sequía. Esto puede deberse posiblemente a dos factores: primero, la reducción de caudal en la temporada de sequía (periodo hidrológico de aguas bajas) (Osorio-Ramírez et al., 2015) que limita la conectividad longitudinal del cuerpo de agua y genera pequeñas islas o remansos, condiciones que no favorecen la presencia de organismos que prefieren aguas corrientes (Flowers & De la Rosa, 2010); segundo, el impacto de vertimientos puntuales domésticos, pues la urbanización es uno de las principales actividades que se desarrollan en el nacimiento del arroyo. La urbanización influye en la riqueza y en la diversidad de estos organismos, pues al remover la vegetación ribereña también se remueve el filtro de la zona de transición que regula la descarga y flujo de agua que controla la entrada de sedimentos y contaminantes. Esto transforma parcial o completamente las características naturales de los ecosistemas acuáticos y reduce la biodiversidad (Moore & Palmer, 2005; Prat et al., 2009; Uieda et al., 2017).
La diversidad beta total para cada periodo hidrológico fue alta (βBC > 0.80), por lo cual existe un recambio alto en el ensamblaje de los taxones a nivel espacial en ambos periodos hidrológicos. Así, fue posible visualizar que la diversidad beta en la fase de transición a sequía se debió principalmente al gradiente de abundancia (βBC.GRA = 0.50), es decir, hubo variación en la abundancia de las morfoespecies entre las estaciones. Así, el ensamblaje de Leptohyphidae de las estaciones CQ4 y CQ6 corresponde a subconjuntos de la estación CQ3. En esta última se realizan actividades exclusivamente de turismo, a diferencia de CQ4 y CQ6 donde hay asentamientos humanos, ganadería y captación de agua para cultivos y piscicultura, actividades que explican la pérdida de especies a raíz de las diferentes transformaciones que generan en los ecosistemas acuáticos (Corbi et al., 2013; Melo et al., 2017; Uieda et al., 2017).
En la temporada de sequía la variación balanceada y el gradiente de abundancia fueron responsables de la diversidad beta total en el río Quenane-Quenanito. Así, se agruparon las estaciones CQ5 y CQ6, las que registraron mayor número de ejemplares, con el dominio de Tricorythopsis sp. 1 y Tricorythopsis sp. 2. Estos sitios se separaron del punto CQ2, donde hubo un menor número de ejemplares y una mayor riqueza. Así, la ganancia y pérdida de ejemplares entre estaciones parece ser consecuencia de las diferencias entre los filtros ambientales y, posiblemente, por la competencia entre especies (Leprieur et al., 2011). Las estaciones CQ5 y CQ6 se encuentran en la zona baja del arroyo, que hace parte de la zona geológica de los Llanos Orientales (Alonso et al., 2012), y comparten las actividades antrópicas correspondientes a cultivos y ganadería, las cuales pueden generar condiciones que favorecen el establecimiento de especies tolerantes a estas perturbaciones y el desplazamiento de aquellas con mayor sensibilidad (Moore & Palmer, 2005; Uieda et al., 2017). Por otra parte, es posible que las agrupaciones encontradas estuviesen determinadas por la proximidad que hay entre los sitios de muestreo, como lo propone Whittaker (1956), pues la similitud de dos puntos de muestreo aumenta cuando la distancia disminuye entre ellos.
El RDA no detectó ninguna variable que explicara significativamente la variación entre la composición biótica y las variables ambientales; adicionalmente, el R2 no fue lo suficientemente alto (0.45-0.60). En futuras investigaciones se debe incorporar un mayor número de variables ambientales, así como las respuestas funcionales que los organismos puedan presentar. Sin embargo, este estudio presenta una primera aproximación al entendimiento de la relación entre los taxones de Leptohyphidae y las variables físicas y químicas en una corriente neotropical de la Orinoquia colombiana; así, se registró un alto número de organismos de Tricorythopsis sp. 1 relacionado con un oxígeno disuelto más elevado en la estación CQ5; por su parte, la turbidez mostró una relación positiva con la abundancia de Tricorythopsis sp.3 en las estaciones CQ3 y CQ6 en la época de transición a sequía. Estos resultados son preliminares, dado que existe un vacío de información ecológica específica de estos taxones, por lo cual es necesario tener un mayor número de datos ambientales y de registros de abundancia de estas especies en corrientes del piedemonte llanero colombiano.
De acuerdo con los modelos GLM, la abundancia de la familia Leptohyphidae y de Tricorythopsis sp. 2 estuvo influenciada por los bicarbonatos, el hierro, los fenoles, el índice de calidad del agua (ICA), los sólidos disueltos totales, el ICOMO y el pH (en el caso de Tricorythopsis sp. 2). Al contrastar estos resultados con la matriz de datos de las variables ambientales (MS1), se evidenció que las mayores abundancias se reportaron en la estación CQ6, donde igualmente se registraron los valores más elevados de bicarbonatos y de pH (6.43). Además, se encontró un valor alto de fenoles, posiblemente causado por la utilización de pesticidas y fertilizantes asociados a la actividad ganadera y a diferentes cultivos que liberan este tipo de compuestos (Bustamante et al., 2019), lo que favorece el establecimiento de las comunidades perifíticas que, a su vez, podrían influir en el aumento de esta morfoespecie (Anzola & Rondón, 2005; Roldán & Ramírez, 2008; Salles et al., 2003; Stevenson et al., 1996).
Con respecto a la abundancia de Tricorythopsis sp. 1, el modelo incluyó variables (Tabla 4) que están relacionadas directamente con la contaminación por materia orgánica. Las estaciones CQ2 y CQ4 mostraron valores altos del ICOMO y de DQO y un pH ácido, condiciones posiblemente relacionadas con la baja abundancia Tricorythopsis sp. 1. Al analizar las actividades antrópicas asociadas a estas estaciones, se encontraron principalmente impactos de vertimientos humanos y de cultivos, actividades que limitan la diversidad de hábitats y favorecen el deterioro de la calidad del agua (Flowers & De la Rosa, 2010; Melo et al., 2017; Uieda et al., 2017). Por el contrario, la estación CQ6 presentó un pH cercano a la neutralidad, altas temperaturas y la presencia de bicarbonatos, factores aparentemente asociados con una abundancia alta de esta morfoespecie. Esto es congruente con lo discutido anteriormente sobre la relación de este género con las condiciones que favorecen el establecimiento de las comunidades de microorganismos productores, como el perifiton (Salles et al., 2003; Stevenson et al., 1996). Así mismo, se registró un valor del ICA que cataloga al sitio como condiciones regulares, lo que parece evidenciar una posible tolerancia del género Tricorythopsis a un detrimento de la calidad del agua, situación que no se había registrado para esta familia, la cual generalmente se considera indicadora de buena o excelente calidad del agua (Domínguez et al., 2006).
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.
Ver material suplementario











 uBio
uBio 


