Introducción
Gmelina arborea Roxb. ex Sm. es un árbol maderable de la familia Lamiaceae. Su distribución natural comprende países como India, Bangladesh, Sri Lanka, Myanmar, Tailandia, China, Laos, Camboya e Indonesia. Debido a su importancia en la industria forestal y medicinal, la melina se cultivó en muchas regiones tropicales de países de Latinoamérica como Brasil, Costa Rica, Honduras, Panamá, Venezuela, México y Colombia (Warrier et al., 2021).
En las regiones tropicales de América, Costa Rica es el país con mayor experiencia en la selección y mejoramiento genético de G. arborea. Desde las primeras plantaciones establecidas en la década del sesenta para la selección fenotípica de características comerciales, el establecimiento posterior de rodales y huertos semilleros para la venta de semilla seleccionada, hasta la obtención de clones de árboles “plus”, la investigación y desarrollo en melina se ha convertido en un eje de vanguardia dentro del sector forestal (Araya, 2005; Ávila-Arias et al., 2016; Dvorak, 2004; Morales, 2004).
La melina es la segunda especie más cultivada desde el 2004 en Costa Rica y es la especie forestal que produce más tarimas para el embalaje de los principales productos de exportación del país (ONF, 2022). A pesar de ello, desde el 2015 hay una tendencia de reducción sistemática de plantaciones de alta calidad. Las variaciones intraespecíficas inter e intrapoblacionales en cuanto a la densidad de la madera generan una crisis de renovación sustentable (Ávila-Arias et al., 2015; Dvorak, 2004) y una menor expectativa para el uso de la madera en mercados más especializados del sector construcción, exportación o mueblería.
En la actualidad, existe una necesidad por conocer la edad ontogenética de los clones de melina de alto valor comercial, pues la capacidad de multiplicación disminuye cuando la propagación se realiza a partir de segmentos de plantas maduras. Está ampliamente documentado que las tecnologías y estrategias empleadas en el cultivo in vitro permiten el rejuvenecimiento de materiales fisiológicamente maduros (Read & Bavougian, 2013). Generalmente, las estrategias morfológicas para identificar cambios de desarrollo atribuidos a la ontogenia necesitan el valor potencial de respuesta en la madurez. Evidentemente, en plantas leñosas se necesitan herramientas más rápidas y confiables para evaluar los estados de desarrollo. Fernandez-Lorenzo et al. (1999), caracterizaron estadios juveniles y adultos de árboles con el análisis cromatográfico y espectrofotométrico de polifenoles con relativa rapidez y sencillez.
Los compuestos fenólicos, incluidas las ligninas, están presentes en todas las plantas superiores y cumplen diversas funciones durante el crecimiento y desarrollo de las plantas. Los cambios en los contenidos de estos compuestos están relacionados con el estado de diferenciación (Amoo et al., 2012; Rencoret et al., 2011), control genético, las condiciones ambientales (Covelo & Gallardo, 2001) y la capacidad de secuestrar especies reactivas de oxígeno (ERO) en presencia de factores de estrés (Liu et al., 2018). Por lo tanto, además de su función como marcador bioquímico de la edad, la concentración de fenoles en los tejidos vegetales es un buen indicador para predecir el grado de tolerancia al estrés en las plantas (Sharma et al., 2019).
Es difícil determinar los patrones de síntesis de metabolitos secundarios en plantas, incluidos los compuestos fenólicos, pues existen factores genéticos, ontogenéticos, morfogenéticos y ambientales que ocasionan fluctuaciones en los contenidos. En este sentido, Pérez-Ochoa et al. (2022) mencionan que los fenoles, flavonoides y terpenos cambian con la edad de la planta y que en algunos casos los contenidos aumentan en dependencia de los estados generativos (floración/fructificación) en comparación con los estados vegetativos. Por esos motivos, no sólo es importante determinar el contenido total de los metabolitos secundarios, sino también, su composición en cada etapa de desarrollo (Koricheva & Barton, 2012).
Meta análisis de las investigaciones que han evaluado los cambios en la producción de metabolitos secundarios en plantas relacionados con la ontogenia y la estacionalidad, revelaron que las concentraciones constitutivas de todos los tipos de estos compuestos aumentan significativamente desde la etapa de plántula hasta la madurez, tanto en plantas herbáceas como leñosas (Koricheva & Barton, 2012). En relación con los cambios ontogenéticos en la inducción de metabolitos secundarios por herbivoría, la mayoría de los estudios se han realizado en hierbas juveniles y plantas herbáceas; éstas han mostrado un aumento significativo en comparación con las plantas maduras. Según los mismos autores, el único estudio que investigó la relación entre la edad ontogenética y la inducción de metabolitos secundarios por herbivoría en plantas leñosas demostró que las plantas maduras acumulan más metabolitos que las juveniles.
En especies leñosas, se han propuesto varias hipótesis para predecir los efectos del ambiente y la disponibilidad de recursos en la regulación y producción de metabolitos secundarios. Las dos hipótesis más aceptadas: equilibrio carbono-nutriente (ECN) y equilibrio crecimiento-diferenciación (CD) (Covelo & Gallardo, 2001) no predicen la asignación de carbono durante la fotosíntesis (nivel de jerarquía bajo), debido a que la proporción asignada para el metabolismo secundario está en función del excedente producido en niveles de jerarquía altos (Koricheva et al., 1998). Por su parte, el modelo de competencia proteica basado en los controles de la biosíntesis de proteínas y fenoles se basa en los orígenes metabólicos de la ruta que regula el flujo de carbono y la asignación de componentes secundarios basados en carbono, los destinos alternativos de los precursores de la ruta y los mecanismos reguladores bioquímicos, por lo cual, se considera el modelo más adecuado para predecir la asignación de fenoles foliares en plantas superiores terrestres (Jones & Hartley, 1999).
Aunque las plantas de forma natural producen compuestos fenólicos, la evaluación de la expresión en ambientes in vitro dependerá de los factores ambientales presentes en condiciones heterótrofas. Debido a la breve fase estacionaria de las plantas cultivadas in vitro, la producción de metabolitos secundarios presenta muy bajos rendimientos, por ejemplo: se inhibe la acción enzimática normalmente presente en plantas maduras (Dias et al., 2016). No obstante, existen numerosos estudios donde se obtienen compuestos fenólicos a través del cultivo in vitro al mantener la capacidad de sintetizar compuestos de plantas ex vitro. Sin embargo, según Dubravina et al. (2005), en la mayoría de los casos el nivel de acumulación de estos compuestos es menor en comparación con plantas ex vitro, aparentemente por la acumulación de cambios genéticos y bioquímicos en las células de los cultivos in vitro.
Durante el cultivo in vitro, debido al control estricto de los ambientes fisicoquímicos, se eliminan presiones externas como cambios drásticos de luz, temperatura, humedad, herbivoría, competencia por nutrientes, entre otros; motivo por el cual, se esperan niveles bajos de expresión de compuestos fenólicos debido a la poca o nula variación de los agentes que ocasionan estrés oxidativo. Sin embargo, esta hipótesis no se ha evaluado en melina y es de suma importancia la generación de información para determinar si el cultivo de tejidos puede ocasionar o no un estrés oxidativo que pueda ocasionar problemas durante la revigorización de las plantas en comparación con plantas ex vitro de diferentes edades.
Por lo tanto, el objetivo de la investigación fue evaluar cómo influye la edad en el contenido de fenoles y ligninas en hojas, pecíolos, tallos y raíces de clones de G. arborea. Los resultados obtenidos en esta investigación representan el primer trabajo en melina que informa acerca de los contenidos de metabolitos secundarios como marcadores de la ontogenia.
Materiales y métodos
Material vegetal: Los experimentos se realizaron en el Laboratorio de Fitoquímica de la Universidad Nacional (LAFIT-UNA). Las muestras vegetales de año y medio, cuatro, siete y 20 años usadas en este estudio se obtuvieron de plantaciones de melina ubicadas en el Centro Agronómico Tropical de Investigación y Enseñanza (CATIE) (coordenadas geográficas aproximadas 9°53’32.2” N & 83°39’4.4” W). Las vitroplantas provenientes de la fase de multiplicación se obtuvieron del proyecto ¨Biofábrica para el rejuvenecimiento y reproducción masiva de material seleccionado de Melina (Gmelina arborea Roxb.) para el sector forestal costarricense (0576-19)¨, adscrito al Instituto de Investigación y Servicios Forestales de la UNA (INISEFOR-UNA). El muestreo de las plantas ex vitro fue realizado los meses de marzo y abril del 2021. Las muestras de hojas compuestas se transportaron en nitrógeno líquido hasta el laboratorio donde fueron liofilizadas durante 24 h y posteriormente almacenadas en congelación (-20 °C).
Extracción de fenoles: Para el proceso de extracción y cuantificación de fenoles se utilizó la metodología propuesta por Gurr et al. (1992). Las hojas liofilizadas se molieron y se tamizaron hasta obtener tamaños de partícula menores a 1 mm. Se pesaron 75 mg de muestras secas y se depositaron en viales de rosca cilíndricos. A cada muestra se le agregó 3 ml de metanol. La mezcla se agitó vigorosamente durante 5 s antes de realizar un baño por sonicación a 40 °C durante 5 min. Los tubos se centrifugaron a 3 500 rpm durante 5 min. El procedimiento se repitió tres veces y se aforó con el mismo disolvente a 10 ml de extracto.
Cuantificación de fenoles: La cuantificación de los fenoles se realizó por triplicado en un lector de microplacas (BioTek Synergy™ HT, California, USA) para microplaca de 96 pocillos se evaluó la absorbancia de las muestras. A 30 µl del extracto se le agregaron 200 µl de agua destilada y 15 µl de reactivo de Folin-Ciocalteu. Posteriormente, se le adicionaron 50 µl de Na2CO3 15 %. Las absorbancias se midieron a una longitud de onda de 755 nm. El contenido de compuestos fenólicos solubles se expresó como los miligramos equivalentes de ácido gálico por gramo de muestra seca (mg EAG * g-1 MS).
Extracción de ligninas: Para la extracción y cuantificación de las ligninas se utilizó la metodología de Stafford (1960). Se tomaron 75 mg de muestras secas sin clorofila y se depositaron en viales de rosca cilíndricos. La primera extracción se realizó con 2 ml de dietil éter durante dos min para luego centrifugar a 2 000 g por 5 min. El sobrenadante se decantó y el precipitado se lavó con 5 ml de agua destilada. Se volvió a centrifugar y nuevamente se descartó el sobrenadante. Este procedimiento se realizó por duplicado. Luego, se realizó una extracción alcalina al precipitado con 2 ml de NaOH 0.5N entre 70-80 °C por 14 h. Posteriormente, en frío, se agregó 100 µl de HCI 2N y se ajustó el pH a 7 o 8 con NaOH. Una vez ajustado el pH se aforó a un volumen de 3 ml con agua destilada. La mezcla se centrifugó a 2 000 g por 5 min y se colectó el sobrenadante. A 2 ml del extracto se le agregó 2 ml de tampón de fosfato de sodio 0.1 M, pH 7.0. A la otra alícuota de los 2 ml del extracto se le agregó 2 ml de NaOH 0.1N (pH 12.3). Finalmente, se midió la absorbancia a 245 y 350 nm en un espectrofotómetro (Thermo Fisher, Evolution™ 350 UV-VIS, Massachusetts, USA).
Cuantificación de ligninas: El contenido total de ligninas se calculó de la siguiente manera:
Ligninas = (Abs pH7 245 nm - Abs pH12 350 nm) / E. guaiacol * FG * MM guaiacol * FD * VB/m
Donde:
E. guaiacol (absortividad molar) = 4 100
FG = 1000 (g a mg)
MM guaiacol (masa molecular) = 124.14 g/mol
FD (factor de dilución)
VB (volumen de balón)
m (masa en gramos)
El contenido de ligninas se expresó como los miligramos equivalentes de lignina por gramo de muestra seca (mg lignina * g-1 MS).
Todas las mediciones se realizaron por triplicado y todos los datos se expresaron como valores promedio ± desviación estándar.
Todos los análisis estadísticos se realizaron con el software estadístico R 3.5.1 (R Core Team, 2019). Las comparaciones múltiples de los valores medios de los contenidos fenólicos y de ligninas se realizaron con el paquete Multcomp en R (Hothorn et al., 2008).
Resultados
La presente investigación describe los resultados del contenido de fenoles totales solubles (FTS) y ligninas presentes en hojas, peciolos, tallos y raíces de clones de melina de cinco edades diferentes: plantas in vitro y plantas de año y medio, cuatro, siete y 20 años. Se demostró que todas las partes de la planta analizadas contienen compuestos fenólicos y ligninas independientemente de su edad.
En términos generales, los extractos de hojas tienen un contenido mayor de FTS y de ligninas en comparación con los extractos de peciolos, tallos y raíces para todas las edades (Fig. 1, Fig. 2, Fig. 3, Fig. 4).
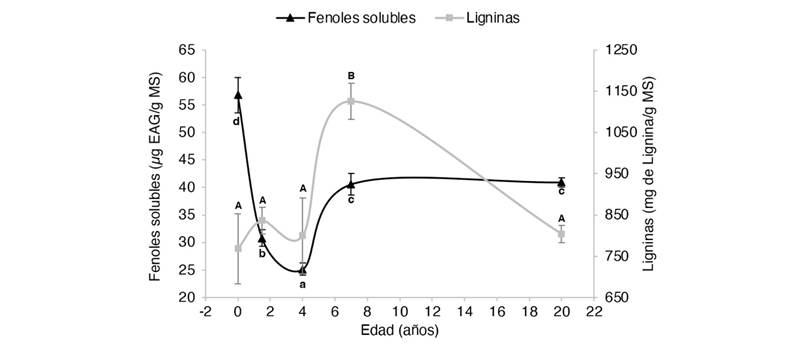
Fig. 1 Concentración de fenoles totales solubles y ligninas en hojas de Gmelina arborea en función de su edad. MS: muestra seca. EAG: equivalentes de ácido gálico. Letras minúsculas y mayúsculas diferentes significan que hay diferencias significativas (P < 0.05) entre los contenidos de fenoles y ligninas, respectivamente. / Fig. 1. Concentration of total soluble phenols and lignins in leaves of Gmelina arborea as a function of age. DM: dry sample. EAG: gallic acid equivalents. Different lowercase and uppercase letters mean that there are significant differences (P < 0.05) between phenol and lignin contents, respectively.
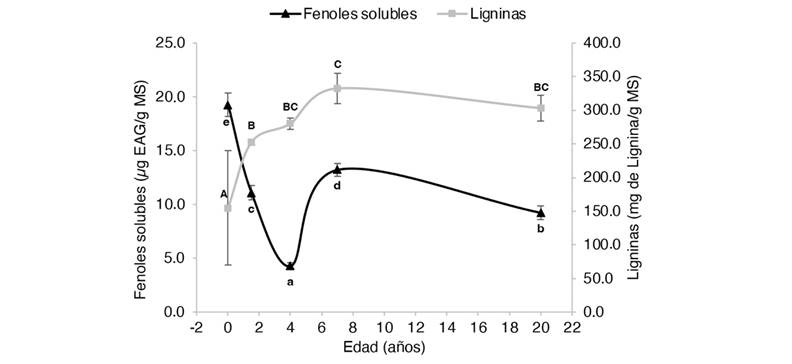
Fig. 2 Concentración de fenoles totales solubles y ligninas en peciolos de Gmelina arborea en función de su edad. MS: muestra seca. EAG: equivalentes de ácido gálico. Letras minúsculas y mayúsculas diferentes significan que hay diferencias significativas (P < 0.05) entre los contenidos de fenoles y ligninas, respectivamente. / Fig. 2. Concentration of total soluble phenols and lignins in petioles of Gmelina arborea as a function of age. DM: dry sample. EAG: gallic acid equivalents. Different lowercase and uppercase letters mean that there are significant differences (P < 0.05) between phenol and lignin contents, respectively.
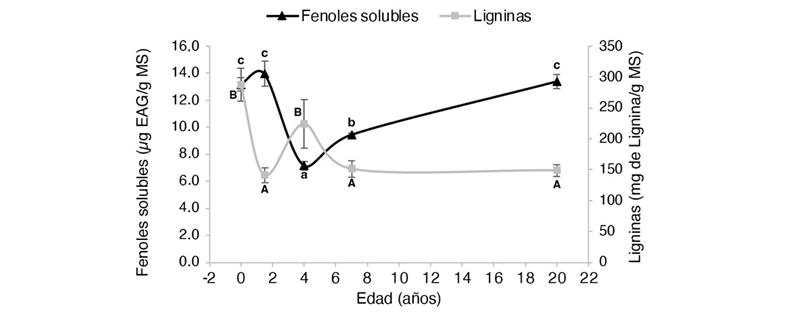
Fig. 3 Concentración de fenoles totales solubles y ligninas en tallos de Gmelina arborea en función de su edad. MS: muestra seca. EAG: equivalentes de ácido gálico. Letras minúsculas y mayúsculas diferentes significan que hay diferencias significativas (P < 0.05) entre los contenidos de fenoles y ligninas, respectivamente. / Fig. 3. Concentration of total soluble phenols and lignins in Gmelina arborea stems as a function of age. DM: dry sample. EAG: gallic acid equivalents. Different lowercase and uppercase letters mean that there are significant differences (P < 0.05) between phenol and lignin contents, respectively.
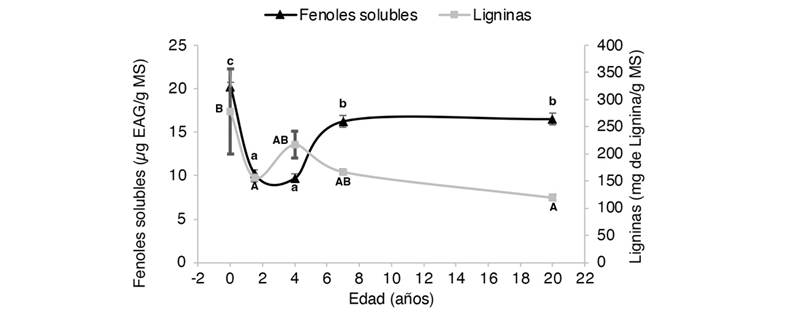
Fig. 4 Concentración de fenoles totales solubles y ligninas en raíces de Gmelina arborea en función de su edad. MS: muestra seca. EAG: equivalentes de ácido gálico. Letras minúsculas y mayúsculas diferentes significan que hay diferencias significativas (P < 0.05) entre los contenidos de fenoles y ligninas, respectivamente. / Fig. 4. Concentration of total soluble phenols and lignins in roots of Gmelina arborea as a function of age. DM: dry sample. EAG: gallic acid equivalents. Different lowercase and uppercase letters mean that there are significant differences (P < 0.05) between phenol and lignin contents, respectively.
Los extractos obtenidos de las plantas in vitro presentaron las mayores concentraciones de FTS, con excepción de los extractos fenólicos obtenidos de los tallos de los árboles de año y medio y los mayores a 20 años, donde se presentaron valores promedio más altos, pero sin diferencias estadísticamente significativas (P > 0.05) (Fig. 3). En todos los casos, los valores promedio más bajos se obtuvieron en los árboles de cuatro años. Independientemente de la edad, los extractos de todas las partes de las plantas incrementan el contenido de FTS sin llegar a los valores obtenidos por las plantas in vitro. Sin embargo, el patrón de respuesta del contenido fenólico varía entre las diferentes partes de la planta una vez alcanzado los siete años. En cuanto a las hojas, la concentración promedio obtenida para los árboles de siete y 20 años fue de 40 ± 1 μg EAG/ g MS (P < 0.05) (Fig. 1). Tendencia similar se presentó en las raíces con valores promedio de 16 ± 0.6 μg EAG/ g MS (P < 0.05) (Fig. 4). No obstante, para estas mismas edades los extractos de peciolos y tallos muestran un contenido de fenoles con una tendencia descendente (de 13 ± 0.6 a 9 ± 0.6 μg EAG/ g MS; P < 0.05) y ascendente (de 9 ± 0.1 a 13 ± 0.5 μg EAG/ g MS; P < 0.05), respectivamente (Fig. 1, Fig. 2).
En relación con las ligninas, los extractos foliares obtuvieron los mayores contenidos en comparación con todas las partes de la planta, independientemente de la edad. Los extractos de hojas, y en menor medida los extractos de los peciolos mostraron una relación de U invertida (Fig. 1, Fig. 2). En el caso de las hojas, las plantas más jóvenes presentaron los valores promedio más bajos (768 mg ± 49 lignina g-1 MS), aunque estadísticamente no significativos con los árboles de año y medio; siete y 20 años (P > 0.05). La mayor concentración de ligninas (1126 ± 42 mg lignina g-1 MS) se obtuvo a los siete años (P < 0.05), después de lo cual, las plantas más longevas disminuyeron el contenido fenólico a valores similares a las plantas in vitro (805 ± 21 mg lignina g-1 MS) (Fig. 1).
En el caso de los peciolos, el patrón de respuesta fue muy similar a las hojas, con los promedios significativamente más bajos para las plantas in vitro (155 ± 14 mg lignina g-1 MS) y los más altos para las plantas de siete años (332 ± 22 mg lignina g-1 MS; P < 0.05). No obstante, la disminución observada de las ligninas en los árboles más viejos fue menos pronunciada que en las hojas, pues la diferencia promedio en comparación con los árboles de siete años no fue significativa, pero con las plantas más jóvenes la diferencia fue el doble (de 155 ± 14 a 303 ± 7mg lignina g-1 MS; P < 0.05).
Los patrones observados de los contenidos de ligninas obtenidos en tallos y raíces fueron muy similares. Las plantas in vitro obtuvieron los extractos con los mayores contenidos (288 ± 27 y 278 ± 79 mg lignina g-1 MS, respectivamente). Los valores promedio más bajos de la investigación se obtuvieron en los tallos de los árboles de año y medio (141 ± 12 mg lignina g-1 MS), aunque las diferencias no fueron significativas con los árboles de siete y 20 años. Las raíces de los árboles más longevos presentaron los contenidos de lignina más bajos (120 ± 5 mg lignina g-1 MS), pero estadísticamente sólo tuvo diferencias significativas con las plantas in vitro. A los cuatro años, los tallos y las raíces aumentaron el contenido de las ligninas, pero el incremento solo fue significativo en los tallos (224 ± 40 y 218 ± 25 mg lignina g-1 MS, respectivamente). La tendencia en el contenido de ligninas disminuye conforme el árbol aumenta la edad. En el caso de los tallos de los árboles de siete y 20 años, los valores promedio fueron 151 ± 13 y 149 ± 9 mg lignina g-1 MS, mientras en las raíces la reducción fue de 167 ± 4 a 120 ± 5 mg lignina g-1 MS, respectivamente (P > 0.05).
Discusión
Los resultados muestran la evaluación de un único periodo del ciclo de vida de un conjunto de plantas de diferentes edades. En plantas longevas, como los árboles, se puede tener un gradiente complejo de tejidos en diferentes etapas ontogenéticas de desarrollo (Koricheva & Barton, 2012). Por tanto, las diferencias en los contenidos de fenoles entre los segmentos evaluados de las plantas in vitro e in vivo se deben a las diferentes condiciones de crecimiento y etapas específicas del desarrollo de la planta.
Es importante destacar que los estudios de largo plazo acerca de la distribución de los metabolitos secundarios en plantas son escasos, y según Wam et al. (2017), los patrones son inconsistentes y poco claros. La mayoría de los estudios acerca de la inducción de metabolitos secundarios en plantas leñosas se llevan a cabo en plántulas, probablemente por razones prácticas, lo cual limita los datos para los estados maduros (Koricheva & Barton, 2012).
La información en la literatura en relación con la presencia de fenoles y ligninas en dependencia de las etapas de desarrollo es contradictoria. Aunque existen investigaciones que concluyen que las plantas in vitro presentan menores rendimientos en la producción de metabolitos secundarios en comparación con las plantas de campo (Dias et al., 2016; Dubravina et al., 2005), muchos estudios han demostrado que las condiciones específicas de la micropropagación estimulan la producción de compuestos fenólicos al modificar el metabolismo primario. Particularmente, los nutrientes y las hormonas influyen en la expresión de genes implicados en la biosíntesis de metabolitos secundarios (Debnath & Goyali, 2020; Gupta et al., 2017; Liu et al., 2018). Incluso, hay evidencia de una mejora en los metabolitos secundarios de materiales micropropagados de plantas, tejidos o células en comparación con las plantas cultivadas en el campo (Gupta et al., 2017).
Según Isah et al. (2018), los bajos rendimientos obtenidos de metabolitos secundarios en condición in vitro es por la alta utilización del carbono exógeno del medio de cultivo para el metabolismo primario. La demanda total de proteínas en condiciones no in vitro, y por tanto, su síntesis, está relacionada con las demandas proteicas vinculadas al crecimiento, fijación de carbono y homeóstasis (Jones & Hartley, 1999). Pero, en condiciones in vitro, el crecimiento y fijación de carbono no ocurre por fotosíntesis, sino a través de fotomorfogénesis, un proceso de desarrollo heterotrófico mediado por luz y fuentes de carbono exógenas.
Según el modelo de competición proteica propuesto por Jones y Hartley en 1999, existe una disputa bioquímica por la fenilalanina, que es la molécula precursora de la síntesis de proteínas y fenoles. La hipótesis postula que cuando las tasas de síntesis proteicas son altas, las tasas de síntesis fenólicas deben ser bajas y viceversa. En condiciones naturales, las concentraciones de fenoles tienden a ser bajas durante la fase de desarrollo juvenil porque las demandas de proteínas totales son más altas durante estos periodos (Koricheva & Barton, 2012). De la misma forma, en condiciones de laboratorio no se esperan altas concentraciones porque la acumulación in vitro de grandes cantidades de metabolitos secundarios requiere un nivel específico de diferenciación celular (Amoo et al., 2012). La mayor cantidad de fenoles obtenidos en esta investigación para la condición in vitro (Fig. 1, Fig. 2, Fig. 3, Fig. 4), aún en condiciones con gran cantidad de sacarosa, reflejan inconsistencias en relación con la competencia entre proteínas y fenoles por la utilización de fenilalanina para sus respectivas síntesis.
Aun así, la investigación considera que el modelo de competición proteico puede explicar los resultados obtenidos, lo cual se confirma con los estudios en mutantes de papa donde la interrupción de la primera enzima involucrada en la síntesis de fenilalanina y tirosina (corismato mutasa) disminuye no solo la fenilalanina, sino también, las ligninas y los compuestos fenólicos (Verpoorte & Alfermann, 2000). Como la distribución de la fenilalanina para la síntesis proteica o fenólica está determinada por el balance de la demanda (Jones & Hartley, 1999), se interpreta que la demanda o competencia de fenilalanina para la síntesis proteica -si ocurrió-, no impidió el suministro del aminoácido para incrementar la síntesis de fenoles en condiciones in vitro (Fig. 1). Como la fotosíntesis es opcional en condiciones de heterotrofia (Ahlert et al., 2003), la alta cantidad de sacarosa promueve la síntesis proteica de una forma donde los genes de la fotosíntesis autotrófica no se utilizan. Básicamente, los genes implicados en la síntesis proteica durante el cultivo in vitro se pueden eliminar sin afectar la viabilidad celular y el desarrollo de la planta (Ahlert et al., 2003).
Debido a la relación que existe entre los niveles de especies reactivas de oxígeno con el incremento en el contenido de compuestos fenólicos, se podría argumentar que los procedimientos de micropropagación ocasionaron una afectación de magnitudes superiores al estrés que sufren las plantas en condiciones de campo, lo cual se reflejó en los contenidos de fenoles de las plantas in vitro, cuyos valores fueron superiores para todas las edades y para todas las partes evaluadas (con excepción de los tallos para los árboles de año y medio) (Fig. 3).
Existen investigaciones en las cuales se mencionan que los altos niveles de compuestos fenólicos en las plantas micropropagadas se deben a la capacidad de secuestrar peróxido de hidrógeno (H2O2) (Liu et al., 2018). Si lo anterior se llegara a confirmar en G. arborea, es necesario evaluar las estrategias de micropropagación específicas para la especie, pues las plantas al estar estresadas producen especies reactivas de oxígeno que tienen que contrarrestarse con el aumento de fenoles. La presencia de plantas con fenotipos diferentes en el mismo medio de cultivo puede ser el resultado de plantas hiperhidratadas o un “envejecimiento” ocasionado por la pérdida de competencia morfogenética en cultivos in vitro a largo plazo (Fig. 5) (Valledor et al., 2007). Es una hipótesis que debe evaluarse en otro estudio, pero que indica la necesidad de utilizar y/o complementar otros marcadores para concluir el efecto del cultivo in vitro en el estrés de las plantas.

Fig. 5 Plantas in vitro de Gmelina arborea A. Fenotipos con posible hiperhidratación. B. Fenotipos normales. Imágenes propias de la investigación. / Fig. 5. In vitro plants of Gmelina arborea A. Phenotypes with possible hyperhydration. B. Normal phenotypes. Own images of the research.
Las respuestas obtenidas del contenido de fenoles en los árboles de siete y 20 años en comparación con las plantas de año y medio pueden explicarse por las diferentes condiciones ecológico-ambientales que alteran de forma diferente la biosíntesis de los metabolitos secundarios. Puesto que, las plantaciones forestales se encontraban bajo el mismo fotoperiodo y temperatura, el aumento en el contenido de fenoles se puede explicar por la salinidad del suelo, la fertilización nitrogenada y fosfatada, así como, por los distintos niveles de déficit hídrico entre plantaciones (Pérez-Ochoa et al., 2022).
En lo que se refiere a los contenidos de fenoles en plantas de campo, la mayoría de los estudios se han realizado sobre la química foliar (Koricheva & Barton, 2012). Los resultados obtenidos muestran tendencias similares con la investigación de Lim et al. (2017), donde las hojas de Macaranga pruinosa tuvieron contenidos fenólicos totales mayores que tallos y raíces. Los autores indican que la temporada tiene un efecto en los valores promedios obtenidos en hojas de M. pruinosa. Otro resultado que concuerda con esta investigación fue el publicado por Dutta y Ray (2020), quiénes obtuvieron mayores fenoles totales en los extractos metanólicos de las hojas en comparación con el tallo. Por su parte, las conclusiones de Filová (2014), indican que las raíces in vivo son las que producen los mayores rendimientos de metabolitos secundarios debido a la variedad de estrés ambiental a las que están expuestas.
La melina tiene una diversidad de fitoquímicos bioactivos con comprobada importancia etnofarmacológica (Warrier et al., 2021). La obtención in vitro de fenoles y ligninas sin el uso de elicitores, son resultados prometedores en el campo de la fitoquímica forestal, pues existen plantas que no producen o producen muy pocos compuestos en condiciones de cultivo de tejidos (Verpoorte et al., 2002).
Otro aspecto que pudo influir en los contenidos de fenoles y ligninas es el proceso de secado, particularmente las muestras de los tejidos in vitro. El estrés ocasionado por el daño mecánico y la desecación generan alteraciones bioquímicas en las células y tejidos previo al secado, la cual es una fase sensible porque, en dependencia del proceso, varía la concentración de los contenidos fenólicos de las muestras (Kittibunchakul et al., 2022).
Los patrones obtenidos de la concentración de ligninas muestran una tendencia opuesta a lo indicado en la literatura. Debido a que la deposición de lignina es una de las etapas finales de la diferenciación de las células del xilema y tiene lugar principalmente durante el engrosamiento secundario de la pared celular (Rencoret et al., 2011), se esperaba, al menos para la variable tallo, una fuerte correlación positiva (entre más edad más lignina), pero los árboles más longevos para todas las partes de la planta mostraron los valores más bajos de estos polímeros (Fig. 1, Fig. 2, Fig. 3, Fig. 4). Para árboles de Eucalyptus globulus se demostró que el contenido de ligninas totales aumenta de un 16 % en plantas de un mes hasta un 25 % en planta de 9 años (Rencoret et al., 2011).
Además de los enfoques bioquímicos, es necesario complementar los estudios con datos epigenéticos. En algunas especies de árboles, los niveles de metilación de ADN son mayores en plantas adultas en comparación con plantas juveniles (Bräutigam et al., 2013; Fraga et al., 2002; Valledor et al., 2010). Durante la madurez aumenta la metilación de novo debido al proceso de diferenciación (Valledor et al., 2007; Valledor et al., 2010). Este trabajo constituye el primer eslabón para el diseño de experimentos más robustos que puedan dar perspectivas del funcionamiento bioquímico en cultivos in vitro y ex vitro de árboles tropicales.
A pesar de ser los primeros datos que evalúan la relación entre la ontogenia y las condiciones de crecimiento de plantas clonales de melina, se requieren acciones para mejorar el alcance de los resultados, entre estas se destacan: la optimización de los muestreos in situ, debido a las diferencias significativas en las concentraciones de fenoles y ligninas de hojas de diferente tamaño tomadas de la misma rama y altura del árbol (datos no mostrados), la falta de medición de las proteínas totales que podrían ayudar a explicar el compromiso bioquímico central del modelo de competición proteica, la evaluación en condiciones in vitro de un mismo clon en diferentes ambientes (heterotróficos, mixotróficos y autotróficos) para comprender mejor la dinámica de la distribución de la fenilalanina durante la síntesis proteica y fenólica en especies forestales.
Es la primera investigación que evalúa el contenido de compuestos fenólicos y ligninas presentes en diferentes tejidos de una especie forestal de edades diferentes, por lo cual, son los primeros valores de referencia acerca del compromiso bioquímico para la síntesis fenólica según la edad y el gradiente morfoanatómico de crecimiento específico. Las diferencias halladas en relación con estos metabolitos durante todas las fases de crecimiento es información valiosa para la determinación de índices bioquímicos relacionados con los tiempos de aprovechamiento óptimo en el cultivo clonal de especies forestales.
El estudio propone que los resultados obtenidos en condiciones de heterotrofia están relacionados con el modelo de competición proteico, debido a la absorción de sacarosa para la síntesis proteica sin afectar la demanda (por competencia) de fenilalanina para la síntesis fenólica. La presencia de mayor contenido de fenoles en las plantas in vitro y los altos contenidos de ligninas en esta condición para los tallos y raíces genera interrogantes en relación con la edad fisiológica y ontogenética de las plantas in vitro en comparación con plantas de campo. Por tanto, se recomienda una caracterización fitoquímica en cada etapa de desarrollo junto con el uso de marcadores morfológicos, fisiológicos y moleculares para explicar si los procesos del cultivo in vitro permiten revigorizar materiales selectos en comparación con otros estados de desarrollo ontogenético.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


