Introducción
Los Geadephaga son el grupo terrestre del suborden Adephaga (Coleoptera), y está compuesto por las familias Carabidae, Cicindelidae y Trachypachidae (Maddison et al., 2009), sus especies son depredadoras y se encuentran en una gran variedad de microhábitats (Lövei & Sunderland, 1996). En Colombia, Geadephaga está representado por al menos 725 especies de 146 géneros, en ausencia de Trachypachidae, que no se distribuye en el neotrópico (Arenas-Clavijo et al., 2022). Pese a que estos escarabajos se encuentran en todo el país, la información disponible sobre su distribución es poco detallada. Este fenómeno se atribuye a la calidad de la información geográfica en el momento en que se describió la mayoría de las especies (segunda mitad del siglo XIX), y al submuestreo (Arenas-Clavijo et al., 2022). A su vez, una buena porción de los trabajos realizados sobre aspectos ecológicos de los Geadephaga en Colombia proviene de ecosistemas relacionados con el bosque seco tropical (Arenas-Clavijo & Chacón de Ulloa, 2016; Ariza et al., 2021; Uribe & Vallejo, 2013).
El bosque seco tropical (Bs-T) es un bioma forestal de tierras bajas (< 1 000 m.s.n.m.), donde hay un alto estrés hídrico determinado por las bajas precipitaciones anuales (Pizano & García, 2014) marcado por un período muy seco (< 100 mm/mes) (Ruiz Linares & Fandiño Orozco, 2009) y un período lluvioso (700-2 000 mm/mes) (Rodríguez et al., 2012; Sánchez-Azofeifa et al., 2005). La temperatura diaria oscila entre 25.0 y 35.0 °C, por tanto, las comunidades biológicas están sometidas a una continua presión, que es incluso mayor cuando se tiene en cuenta la transformación del hábitat proveniente de actividades de origen antrópico (Janzen, 1988).
La alta presión sobre el Bs-T lo convierte en uno de los ecosistemas más amenazados del planeta (Pizano & García, 2014), por lo que su conservación es prioritaria (González et al., 2014). Basados en el mapa de coberturas de los ecosistemas propuesto por Etter et al., (2008), García et al., (2014) asumen que la cobertura original de este ecosistema era de más de 8 800 000 ha.; sin embargo, actualmente está representado por pequeños remanentes ubicados en territorios transformados que apenas alcanzan las 717 226 ha.. El Bs-T se distribuye en las regiones de los valles biogeográficos del Cauca y Magdalena, Norandina y la región Caribe (Ruiz Vega & Saab, 2020); esta última presenta la mayor representatividad del bioma en el país (García et al., 2014).
Dado el creciente interés por conservar el Bs-T, es necesario desarrollar estrategias de monitoreo con organismos que permitan visualizar eficazmente los efectos de la transformación/reducción de las áreas boscosas, que sean fáciles de recolectar y cuyas abundancias permitan establecer comparaciones estadísticamente robustas (Cortés-Calderón et al., 2021; Noriega et al., 2020). Los invertebrados son candidatos apropiados para cumplir estos objetivos, gracias a su pequeño tamaño, sensibilidad a las condiciones ambientales locales y tiempos de generación relativamente cortos (Gerlach et al., 2013).
En Colombia, el uso de artrópodos en estudios ecológicos en el Bs-T se encuentra centrado mayormente en mariposas (Márquez & Martínez-Hernández, 2020), hormigas (Achury et al., 2008; Camargo-Vanegas & Guerrero, 2020), escarabajos coprófagos (Martínez-Hernández, Cañas et al., 2010; Martínez-Hernández et al., 2012), y arañas (Quijano-Cuervo et al., 2019). Sin embargo, los estudios en otros grupos con hábitos terrestres, como los Geadephaga, son menos frecuentes (Arenas-Clavijo & Chacón de Ulloa, 2016; Arenas et al., 2013; García-Suabita et al., 2019). A su vez, para proponer un uso coherente de los Geadephaga como organismos que responden a la transformación del bosque seco tropical, es necesario comprender la respuesta de sus poblaciones frente a factores de mayor escala, en los que se circunscribe la transformación del hábitat, como la variación climática.
En el contexto local, los Geadephaga han sido utilizados para evaluar los cambios estacionales y aspectos fisonómicos del Bs-T (e.g. cobertura dosel, temperaturas del suelo, etc.), a través de la variación de sus atributos (e.g. la diversidad) (Ariza et al., 2021); así como las consecuencias de la fragmentación debido a la instauración de cultivos, plantaciones forestales y pastizales para la ganadería (Arenas-Clavijo & Chacón de Ulloa, 2016; Ariza et al., 2021; Camero, 2003; García-Suabita et al., 2019), sin embargo, poco se conoce sobre la variación espaciotemporal de este grupo en el Bs-T.
De esta manera, se hipotetizó que la diversidad de Geadephaga tiene una variación espaciotemporal influenciada por las variables ambientales dentro de cada bosque y por la variabilidad climática (i.e. período seco y período lluvioso). Se espera que su diversidad sea mayor durante el período lluvioso, y en áreas donde la cobertura de dosel y la humedad relativa del suelo sea mayor. Por lo tanto, este estudio evalúa la variación espaciotemporal de la diversidad de Geadephaga en dos fragmentos de bosque seco en el Caribe colombiano, y su relación con las variables edáficas (temperatura y humedad del suelo) y condiciones ambientales (cobertura del dosel, temperatura y humedad relativa) durante el periodo seco y lluvioso.
Materiales y métodos
Área de estudio: Se estudiaron dos fragmentos de bosque seco en el Caribe colombiano: Reserva Campesina La Montaña (RCM) y Reserva La Flecha (RLF), localizados en los departamentos de Atlántico y Bolívar, respectivamente (Fig. 1). La RCM tiene 47 ha. de extensión y está ubicada a (10º46’08.8” N & 75°02’26.0” W), a una altitud entre 170 y 250 msnm. Su período lluvioso es bimodal (abril-junio y agosto-noviembre) (Martínez-Hernández et al., 2012), tiene precipitaciones entre 100 y 580 mm/mes, temperatura media anual de 27.6 °C y humedad relativa media que varía entre los meses octubre-noviembre (62 %) y enero-febrero (53 %) (Martínez-Hernández, García-Atencia et al., 2010). La RLF tiene 149 ha. de extensión y está ubicada en los Montes de María, a 09°51’09.74” N y 75°10’32.32” W, con una altitud que va de 320 a 500 msnm. Tiene un período lluvioso bimodal (mayo-junio y septiembre-noviembre), precipitación media anual de 1 500 mm; temperatura y humedad relativa anual entre 26.0 y 75 %, respectivamente.
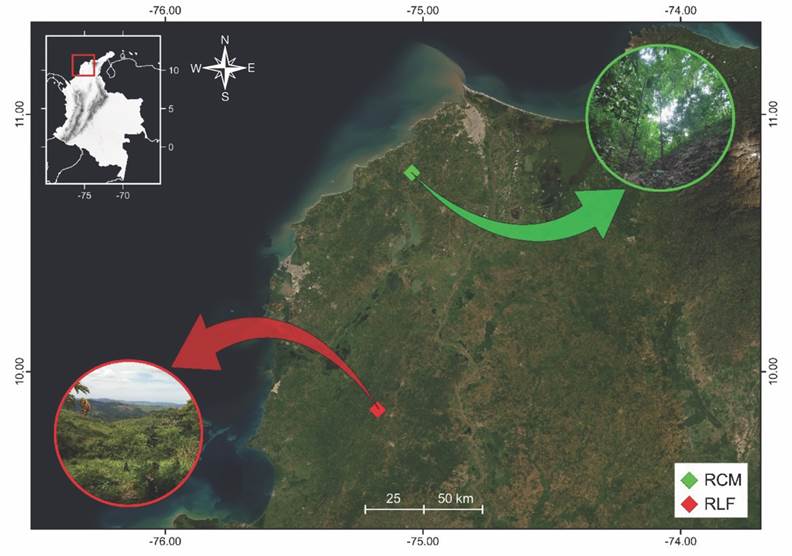
Fig. 1 Localización de los fragmentos de bosque seco en el Caribe colombiano. Reserva La Flecha (RLF) y Reserva Campesina La Montaña (RCM). / Fig. 1. Localization of both dry forest fragments in the Caribbean of Colombia. Reserva La Flecha (RLF) and Reserva Campesina La Montaña (RCM).
Tanto RCM como RLF están rodeadas de cultivos temporales y perennes. En las reservas se realizan actividades como ganadería, tala, extracción y quema de especies vegetales, que han contribuido a la reducción de los remanentes de bosque aledaños, por lo que se consideran como áreas con prioridad de conservación (Pizano & García, 2014).
Diseño y métodos de captura: Los muestreos se realizaron entre febrero y junio de 2018. Por cada fragmento se realizaron cuatro sesiones de muestreo: dos en período seco y dos en lluvioso; cada uno con una duración de cuatro días y cuatro noches. En cada fragmento se marcaron cuatro parcelas de 50 × 50 m distanciadas 350 m entre sí, en las que se instalaron trampas de luz de 800 lúmenes de potencia: dos parcelas con trampas de luz blanca tipo LED y dos con luz UV, para un total de cuatro trampas/sesión de muestreo. Cada trampa de luz tenía un recipiente plástico recolector de 20 l, lleno a 1/3 de su capacidad con una solución de alcohol del 70 %, sal y un poco de detergente. Las trampas operaron por 12 horas, desde las 18:30 hasta las 6:30 del siguiente día, durante los cuatro días de cada sesión de muestreo.
Adicionalmente, en el vértice de cada parcela, se capturaron los Geadephaga de la siguiente manera: captura manual, que consistió en la revisión de hojas, troncos, cortezas, hojarasca y rocas durante 10 minutos por vértice (40 minutos/parcela/día) (640 min/muestreo); cernido de hojarasca, con la cual se recolectaron y tamizaron 10 l de hojarasca por punto o vértice (40 l por parcela) con la ayuda de un tamizador Winkler de 30 cm de diámetro, con un tamiz de 1 cm2 de amplitud de celda; perturbación de follaje, donde se realizaron 20 agitaciones por vértice (80 agitaciones/parcela) (Arteaga et al., 2014); y cuatro trampas de caída ubicadas en cada vértice de la parcela, que consistieron en recipientes de 0.95 l enterrados a ras del suelo, llenos en 1/3 de su volumen con una solución compuesta por alcohol (70 %), jabón líquido, sal y agua, con actividad por 48 horas/sesión de muestreo. Los recipientes se cubrieron con platos de poliestireno expandido sostenidos por estacas de madera a diez centímetros sobre el suelo para evitar evaporación excesiva y/o inundación.
Variables ambientales: En cada fragmento se tomaron las medidas de la temperatura ambiental (°C) y la humedad relativa (%) con un registrador de datos electrónico marca Extech RHT10 (FLIR Systems, Inc., Wilsonville, Oregon, U.S.), ubicado en el centro de cada parcela, registrando datos cada 30 minutos durante cuatro días. En el caso de las variables edáficas, se tomaron las medidas de la temperatura del suelo con un termómetro de suelo marca Extech 39 240 (FLIR Systems, Inc., Wilsonville, Oregon, U.S.), y la humedad con un higrómetro de suelo marca Extech MO750 (FLIR Systems, Inc., Wilsonville, Oregon, U.S.) a una profundidad de 20 cm (1).
La cobertura del dosel se cuantificó con un densitómetro esférico de espejo convexo dividido en 24 cuadros, siguiendo el protocolo de Valdez-Lazalde et al., (2006). Asimismo, se cuantificó el porcentaje de cobertura de hojarasca usando un cuadrante de 1 m2, con subdivisiones de 10 cm, modificado de Agosti & Alonso, (2000), midiendo cuatro veces en cada vértice por parcela. La altura de la hojarasca se midió tomando tres medidas con una regla de 30 cm por cada cuadrante y posteriormente promediadas (SMT1).
Identificación de especímenes: Los escarabajos recolectados se preservaron en alcohol al 70 % y se identificaron en el Laboratorio de Ecología y Entomología de la Universidad del Atlántico, utilizando claves taxonómicas para Carabidae (Allen, 1968; Arndt, 1998; Erwin & Henry, 2017; Gidaspow, 1963; Martínez, 2005; Moret, 2003) y Cicindelidae (Vítolo, 2004). Algunos especímenes fueron identificados y/o confirmados hasta la categoría de especie con la ayuda de especialistas en el grupo (Terry L. Erwin-Smithsonian Institution y Danny Shpeley-University of Alberta). El material se depositó en la colección entomológica de la Universidad del Atlántico y en el Museo de Entomología de la Universidad del Valle.
Análisis de datos: La diversidad de Geadephaga se estimó calculando la riqueza (número de especies capturadas) y la abundancia (número de individuos). Se calculó la completitud del muestreo por período y fragmento, basado en el método de Chao & Jost, (2012), con el paquete iNEXT (Chao et al., 2016; Hsieh et al., 2016) en RStudio (RStudio, 2021). Se construyó una curva de rango-abundancia (Feinsinger, 2001; Whittaker, 1965), organizando la abundancia relativa de las especies frente al rango de mayor a menor abundancia (Etchepare et al., 2013) con la función rankabuncomp del paquete BiodiversityR (Kindt, 2022). La distribución de la riqueza de especies de Geadephaga se representó a través de un diagrama de Venn, realizado con la función ggVennDiagram, del paquete ggVennDiagram (Gao et al., 2021). De manera complementaria, se realizó un análisis de interpolación y extrapolación (Chao et al., 2014), utilizando los perfiles de diversidad (números de Hill) en unidades del número efectivo de especies (Hsieh et al., 2016; Jost, 2006): 0 D fue la riqueza de especies, 1 D el exponencial del índice de Shannon (número efectivo de especies abundantes) y 2 D el inverso del índice de Simpson (número efectivo de especies dominantes) (Eichhorn, 2016), usando el paquete iNEXT (Hsieh et al., 2016). Finalmente, los valores de cada orden de diversidad fueron comparados con un intervalo de confianza del 95 % (Moreno et al., 2011).
La variación espaciotemporal de la estructura de la comunidad de Geadephaga se visualizó a través de un análisis de escalamiento multidimensional no métrico (NMDS) basado en el índice de similitud de Bray-Curtis (Bray & Curtis, 1957; Giraldo Mendoza, 2015). Para conocer las relaciones de similitud entre las distancias ecológicas entre períodos climáticos y fragmentos (Faith et al., 1987), se realizó un análisis ANOSIM (Meng et al., 2012; Meng et al., 2013) utilizando los paquetes MASS (Ripley et al., 2013; Venables & Ripley, 2013) y Vegan (Oksanen et al., 2020).
Por otro lado, se realizaron modelos lineales generalizados (GLM) para determinar el efecto de los períodos (seco y lluvioso), los fragmentos (RCM y RLF), las variables ambientales (temperatura, humedad relativa, temperatura y humedad del suelo, cobertura vegetal, altura y cobertura de la hojarasca) sobre la abundancia (N) y la diversidad (0 D, 1 D, 2 D) de Geadephaga. Para el análisis de la abundancia y la riqueza de especies (0 D) se utilizó la función glm del paquete lme4 (Bates et al., 2023), siguiendo una distribución Poisson (Arroyo et al., 2014; Mesa-Fúquen et al., 2021), mientras que para la diversidad en términos de especies comunes (1 D) y dominantes (2 D) se siguió una distribución normal o gaussiana. Con la finalidad de disminuir la colinealidad entre las variables explicativas se realizó un test de correlación de Pearson (Pearson, 1920) para descartar variables redundantes, usando la función cor.test del paquete stats en RStudio. Por lo tanto, solo se usó la cobertura de dosel, la humedad del suelo y la temperatura del suelo (P = 0.52, P = 0.006; R = -0.39, P = 0.049; R = -0.41, P = 0.041, respectivamente) en el modelo final. Por último, se comparó un modelo final por cada variable respuesta frente a un modelo nulo, y se seleccionó el mejor modelo utilizando el criterio de información de Akaike (AIC) (Akaike, 1974).
Resultados
Se capturaron 348 carábidos de 46 morfoespecies (en adelante, especies), y 114 cicindélidos de tres especies. En Carabidae, los géneros Apenes y Lebia presentaron la mayor riqueza de especies (cuatro especies), mientras Clivina y Pachyteles representaron el 16.4 % (57 individuos) y 14.6 % (51 individuos) de la abundancia de la familia, respectivamente. Respecto a los Cicindelidae, el género Tetracha presentó dos especies, que ocuparon el 99.1 % de la abundancia de la familia (113 individuos) (Tabla 1).
La composición y estructura de especies varió entre los fragmentos y períodos climáticos. Algunas especies presentaron mayor abundancia durante el período de lluvias que, posteriormente mostraron un declive en el seco, como Tetracha affinis (Dejean, 1825), Pelecium sulcatum Guérin-Méneville, 1843, Aspidoglossa sp. y Apenes sp.4 (Tabla 1, Fig. 2). Por su parte, en el período seco sólo se observó a Thalpius sp. como especie más representativa en la RLF, mientras que Calleida sp. fue la más abundante en la RCM durante el mismo período. En la RCM, T. affinis contribuyó el 38.8 % de la abundancia, mientras que, en la RLF, P. sulcatum contribuyó con el 21.6 % de la abundancia.
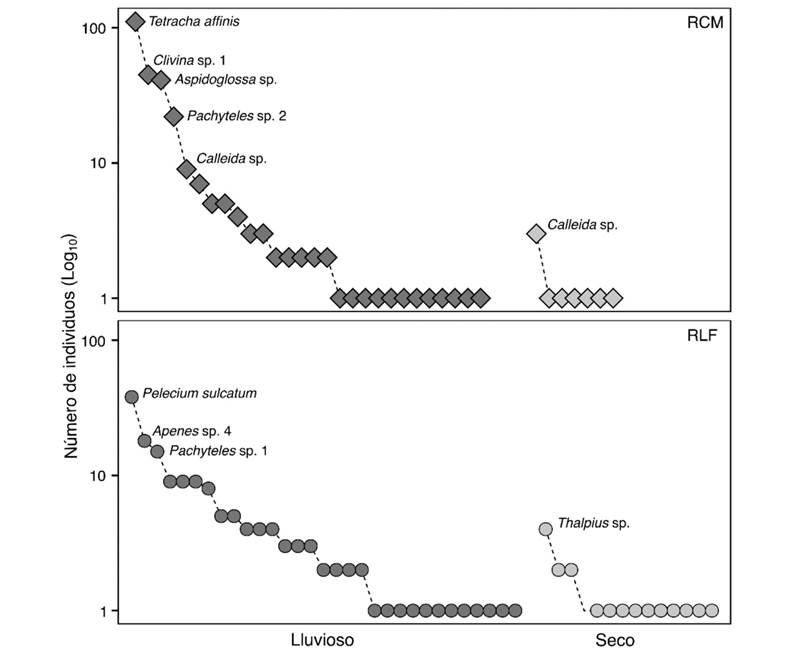
Fig. 2 Curva de rango abundancia de las especies de Geadephaga durante el períodos seco y lluvioso en cada fragmento de bosque. / Fig. 2. Rank-abundance curve of Geadephaga species during dry and rainy season in each forest fragment.
Riqueza y abundancia de Geadephaga: En ambos fragmentos, la riqueza de especies fue más baja durante el período seco, con un aumento significativo durante el período lluvioso. La mayor riqueza se observó en la RLF con 14 ( X = 2 ± 1.12 IC 95 %) y 31 especies (X = 7.4 ± 3.10 IC 95 %) durante el período seco y lluvioso, respectivamente. Entre tanto, en la RCM se registraron los menores valores con siete taxones ( X = 1.3 ± 1.25 IC 95 %) durante el período seco y 28 en el período lluvioso (X = 7 ± 3.63 IC 95 %) (Tabla 1). De acuerdo con los intervalos de confianza con un grado de significancia del 95 %, no se encontraron diferencias en la riqueza de especies al comparar los fragmentos de bosque en un mismo período climático.
Tabla 1 Variación de la abundancia y riqueza de Geadephaga por período (seco y lluvioso) en las localidades de bosque seco tropical en el Caribe colombiano. / Table 1. Variation of the abundance and richness of Geadephaga by season (dry and rainy) in the localities of tropical dry forest from Colombian Caribbean.
| Especies | RLF | RCM | Total | ||
| Seco | Lluvioso | Seco | Lluvioso | ||
| CICINDELIDAE CICINDELINAE (S = 3, N = 114) | |||||
| Cicindelini | |||||
| Odontocheila salvini (Bates, 1874) | 0 | 1 | 0 | 0 | 1 |
| Megacephalini | |||||
| Tetracha affinis (Dejean, 1825) | 0 | 1 | 0 | 111 | 112 |
| Tetracha cribrata (Steinheil, 1875) | 0 | 0 | 0 | 1 | 1 |
| CARABIDAE CARABINAE (S = 1, N = 1) | |||||
| Carabini | |||||
| Calosoma alternans (Fabricius, 1792) | 0 | 0 | 0 | 1 | 1 |
| HARPALINAE (S = 37, N = 193) | |||||
| Calophaeniini | |||||
| Calophaena sp. | 0 | 1 | 0 | 0 | 1 |
| Ctenodactylini | |||||
| Amblycoleus sp. | 0 | 0 | 0 | 2 | 2 |
| Cyclosomini | |||||
| Tetragonoderus cf. undatus (Dejean, 1829) | 0 | 1 | 0 | 0 | 1 |
| Galeritini | |||||
| Galerita aff. stenodera (Chaudoir, 1845) | 0 | 1 | 0 | 0 | 1 |
| Galerita sp. | 0 | 0 | 0 | 1 | 1 |
| Harpalini | |||||
| Amblygnathus suturalis (Putzeys, 1845) | 0 | 0 | 0 | 1 | 1 |
| Athrostictus sp. | 1 | 0 | 0 | 0 | 1 |
| Notiobia sp. | 1 | 0 | 0 | 0 | 1 |
| Selenophorus sp. | 0 | 4 | 0 | 1 | 5 |
| Stenolophus sp. | 1 | 0 | 0 | 0 | 1 |
| Lachnophorini | |||||
| Anchonoderus sp. | 1 | 3 | 0 | 0 | 4 |
| Lebiini | |||||
| Agra sp. 1 | 0 | 1 | 0 | 0 | 1 |
| Agra sp. 2 | 0 | 5 | 0 | 2 | 7 |
| Agra sp. 3 | 1 | 1 | 0 | 0 | 2 |
| Apenes sp. 1 | 0 | 3 | 1 | 2 | 6 |
| Apenes sp. 2 | 0 | 9 | 1 | 0 | 10 |
| Apenes sp. 3 | 0 | 0 | 0 | 1 | 1 |
| Apenes sp. 4 | 0 | 18 | 0 | 0 | 18 |
| Calleida amethystina (Fabricius, 1787) | 0 | 0 | 0 | 5 | 5 |
| Calleida sp. | 1 | 5 | 3 | 9 | 18 |
| Eurycoleus macularius (Chevrolat, 1835) | 0 | 0 | 0 | 1 | 1 |
| Hyboptera auxiliadora (Erwin, 2004) | 1 | 0 | 0 | 0 | 1 |
| Lebia (Chelonodema) erotyloides (Reichardt, 1972) | 1 | 0 | 0 | 0 | 1 |
| Lebia (Chelonodema) sp. | 0 | 2 | 0 | 1 | 3 |
| Lebia sp. 1 | 2 | 2 | 0 | 0 | 4 |
| Lebia sp. 2 | 0 | 0 | 0 | 1 | 1 |
| Loxandrini | |||||
| Loxandrus interruptus (Tschitscherine, 1900) | 0 | 1 | 0 | 0 | 1 |
| Loxandrus tetrastigma (Bates, 1871) | 1 | 8 | 1 | 0 | 10 |
| Loxandrus sp. | 0 | 9 | 1 | 3 | 13 |
| Morionini | |||||
| Morion cyclomus (Chaudoir, 1854) | 0 | 4 | 1 | 2 | 7 |
| Morion simplex (Dejean, 1826) | 0 | 2 | 0 | 4 | 6 |
| Odacanthini | |||||
| Colliuris sp. | 0 | 1 | 0 | 1 | 2 |
| Peleciini | |||||
| Pelecium sulcatum (Guérin-Méneville, 1843) | 0 | 38 | 0 | 3 | 41 |
| Pentagonicini | |||||
| Pentagonica trivittata (Dejean, 1831) | 1 | 0 | 0 | 0 | 1 |
| Pentagonica sp. | 1 | 2 | 0 | 0 | 3 |
| Perigonini | |||||
| Perigona sp. | 0 | 4 | 1 | 2 | 7 |
| Zuphiini | |||||
| Thalpius sp. | 4 | 0 | 0 | 0 | 4 |
| PAUSSINAE (S = 3, N = 53) | |||||
| Ozaenini | |||||
| Pachyteles sp. 1 | 0 | 15 | 0 | 5 | 20 |
| Pachyteles sp. 2 | 0 | 9 | 0 | 22 | 31 |
| Pachyteles sp. 3 | 0 | 1 | 0 | 1 | 2 |
| SCARITINAE (S = 4, N = 99) | |||||
| Clivinini | |||||
| Aspidoglossa sp. | 0 | 0 | 0 | 41 | 41 |
| Clivina sp. 1 | 2 | 3 | 0 | 45 | 50 |
| Clivina sp. 2 | 0 | 0 | 0 | 7 | 7 |
| Schizogenius sp. | 0 | 1 | 0 | 0 | 1 |
| SIAGONINAE (S = 1, N = 2) | |||||
| Siagonini | |||||
| Enceladus gygas (Bonelli, 1813) | 0 | 1 | 0 | 1 | 2 |
| Número de especies | 14 | 31 | 7 | 28 | 49 |
| Número de individuos | 19 | 157 | 9 | 277 | 462 |
| Completitud | 0.8478 | 0.9239 | 0.8551 | 0.9568 | - |
Abreviaturas. Abundancia (N), riqueza de especies (S), Reserva La Flecha (RLF), Reserva Campesina La Montaña (RCM).
La abundancia fue mayor durante el período lluvioso y disminuyó durante el período seco en ambos fragmentos. En el primer caso, el mayor valor de abundancia se observó en la RCM con 277 individuos ( X = 34.7 ± 24.76 IC 95 %), y el menor en la RLF (157). Durante el período seco, no se observó este patrón, puesto que la RLF mostró el mayor valor de abundancia con 19 ( X = 2.4 ± 1.33 IC 95 %), entre tanto que la RCM tuvo menor abundancia con nueve individuos ( X = 1.1 ± 0.86 IC 95 %). A pesar de esto, los fragmentos no presentaron diferencias estadísticas en cada período climático (IC 95 %) (Fig. 3).
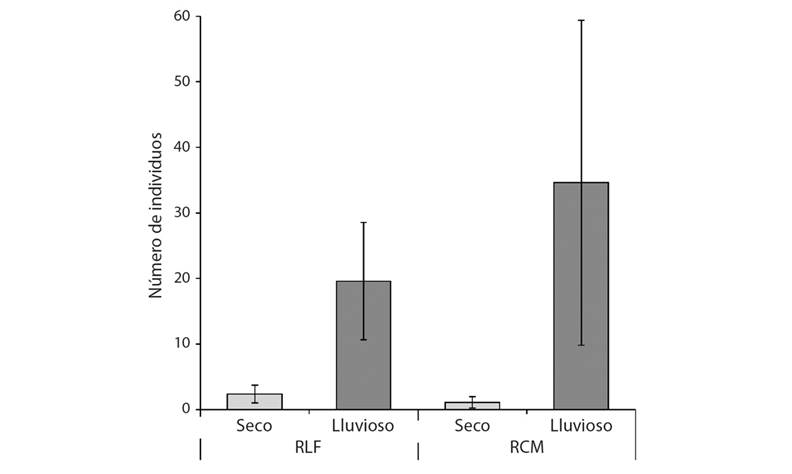
Fig. 3 Variación de los promedios de la abundancia de Geadephaga para ambos fragmentos de bosque seco por períodos climáticos (media ± IC 95 %). Abreviaturas: Reserva La Flecha (RLF) y Reserva Campesina La Montaña (RCM). / Fig. 3. Variation of the average abundance of Geadephaga the two sampling sites of dry forest by climatic season (average ± CI 95 %). Abbreviations: Reserva La Flecha (RLF) and Reserva Campesina La Montaña (RCM).
El período lluvioso presentó mayores valores de completitud frente al seco en ambos fragmentos, donde se registraron valores superiores al 80 %, tanto para períodos climáticos como para fragmentos. Este mismo patrón se observó con los valores de diversidad en todas sus dimensiones (0 D, 1 D y 2 D). En el caso de la diversidad basada en el número efectivo de especies (0 D), se registraron diferencias significativas entre los períodos climáticos dentro de ambos fragmentos. Sin embargo, en términos de especies abundantes (1 D) y dominantes (2 D) se observó una similitud entre los períodos climáticos. En el caso de la diversidad basada en las especies abundantes (1 D), la RLF presentó los mayores valores, principalmente durante el período lluvioso (16.36 ± 1.8), y los más bajos durante el período seco (12.26 ± 6.13), mientras que la RCM mostró una similitud entre sus períodos (lluvioso: 7.97 ± 0.71, seco: 6.24 ± 3.12). Asimismo, la diversidad de orden dos, basada en las especies dominantes (2 D), mostró similitud entre los períodos climáticos y los fragmentos (Fig. 4).
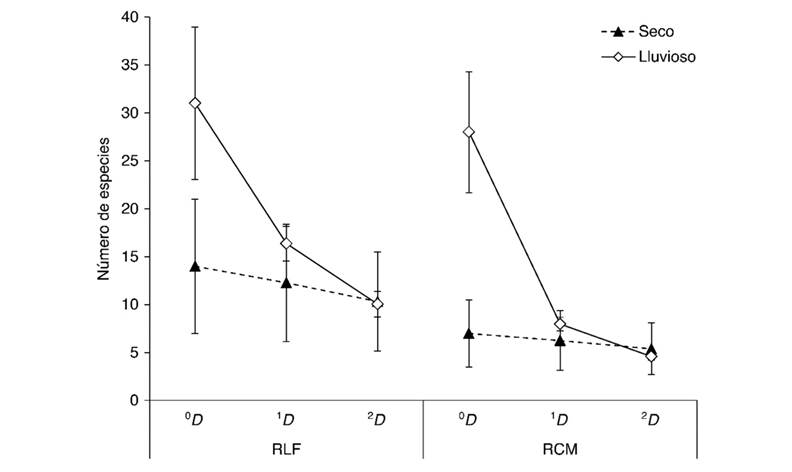
Fig. 4 Variación de la diversidad de Geadephaga para ambos fragmentos por período climático (media ± IC 95 %): número efectivo de especies o riqueza (0 D), número de especies comunes (1 D), número de especies dominantes (2 D). Abreviaturas: Reserva La Flecha (RLF) y Reserva Campesina La Montaña (RCM). / Fig. 4. Variation of the diversity of Geadephaga the two fragments by season (average ± CI 95 %): effective number of species or richness (0 D), number of common species (1 D), number of dominant species (2 D). Abbreviations: Reserva La Flecha (RLF) and Reserva Campesina La Montaña (RCM).
Distribución de la riqueza de especies: Los fragmentos de bosque compartieron un mayor número de especies durante el período lluvioso (17), y solo dos durante el seco. En el caso de la RLF, compartió siete especies entre sus períodos climáticos, y presentó el mayor número de especies exclusivas durante el período seco (7). Por su parte, en la RCM sólo se compartieron cinco especies entre sus períodos climáticos, pero presentó 11 especies exclusivas durante el período lluvioso (Fig. 5).
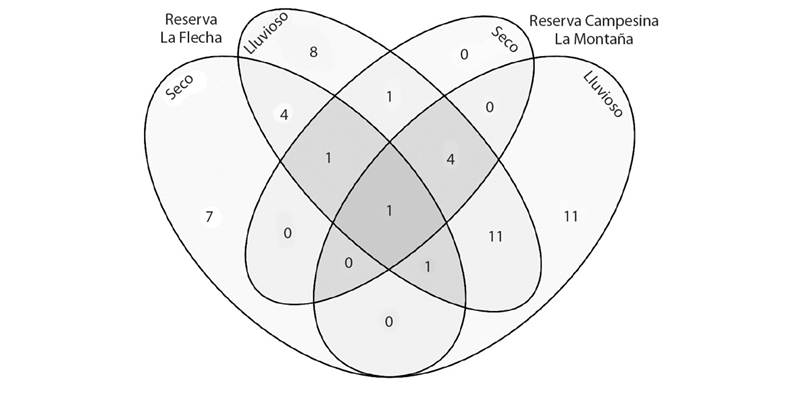
Fig. 5 Distribución de la riqueza de Geadephaga en los períodos climáticos de cada fragmento de bosque. / Fig. 5. Distribution of Geadephaga richness in the climatic seasons of each forest fragment.
Variación espaciotemporal de Geadephaga: El análisis de escalamiento multidimensional no métrico (NMDS) mostró que las comunidades de Geadephaga correspondientes a cada fragmento de bosque se solaparon durante el período lluvioso, mientras que durante el período seco hay un solapamiento parcial (Fig. 6). No obstante, el período seco de la RLF mostró una amplia diferencia con el período lluvioso de la RCM. La prueba ANOSIM mostró que los fragmentos presentaron diferencias entre sus períodos climáticos, pero ambos fragmentos mostraron una alta similitud durante el período seco (Tabla 2). La mayor diferencia entre la composición de las comunidades de Geadephaga se observó entre períodos climáticos para la RLF (R = 0.349, P = 0.003), mientras que entre RLF y RCM no hubo diferencias durante el período seco (R = 0.075, P = 0.254) (Tabla 2).
Tabla 2 Prueba de ANOSIM del Análisis Multidimensional No Métrico sobre las comparaciones entre los fragmentos de bosque seco y los períodos climáticos. / Table 2. ANOSIM test of the non-metric multidimensional scaling analysis on the comparisons between dry forest fragments and seasons.
| Estadístico R | Valor-P | |
| RCM-Se. RCM-Llu | 0.579 | < 0.01 |
| RCM-Se. RLF-Se | 0.075 | NS |
| RCM-Llu. RLF-Llu | 0.375 | < 0.01 |
| RLF-Se. RLF-Llu | 0.349 | < 0.01 |
Abreviaturas. NS: no significativo, RCM: Reserva Campesina la Montaña, RLF: Reserva La Flecha, Se: Período seco, Llu: Período lluvioso.
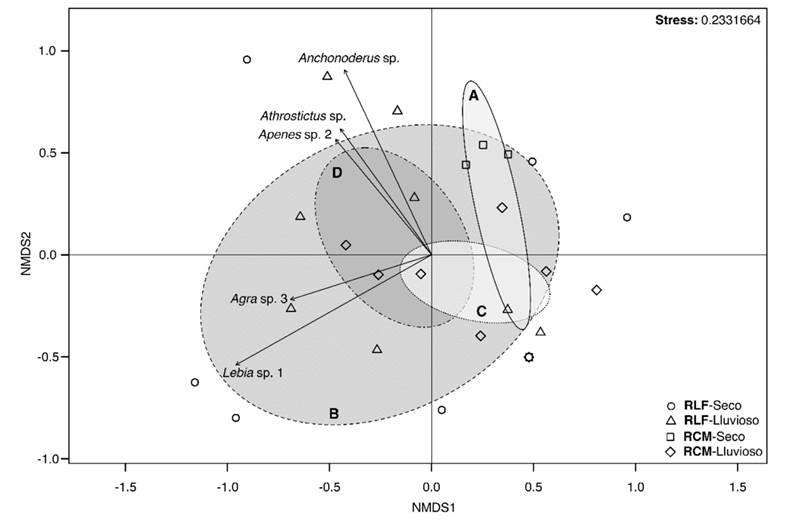
Fig. 6 Agrupamiento de las comunidades de Geadephaga en los fragmentos de bosque, basado en la similitud de Bray-Curtis (elipse 95 %). Período seco (A) y lluvioso (B) de la Reserva La Flecha (RLF), y el período seco (C) y lluvioso (D) de la Reserva Campesina La Montaña (RCM). / Fig. 6. Grouping of Geadephaga communities in forest fragments, based on Bray-Curtis similarity (ellipse 95 %). Dry season (A), and rainy season (B) of the Reserva La Flecha (RLF); and dry season (C) and rainy season (D) of the Reserva Campesina La Montaña (RCM).
Los modelos lineales generalizados mostraron que los períodos climáticos, los fragmentos de bosque seco, la cobertura vegetal, la humedad del suelo y la temperatura del suelo, así como su interacción, presentaron un efecto estadísticamente significativo sobre la abundancia de Geadephaga, que incrementó durante el período lluvioso. Por otro lado, la riqueza de especies de Geadephaga (0 D) aumentó durante el período lluvioso. Sin embargo, estos factores no mostraron efecto sobre la diversidad basada en las especies comunes (1 D) y especies dominantes (2 D) (Tabla 3).
Tabla 3 Prueba ANOVA del modelo lineal generalizado sobre la abundancia y la diversidad (basada en números de Hill) de Geadephaga del bosque seco. / Table 3. ANOVA test of the generalized linear model on abundance and diversity (based on Hill numbers) of Geadephaga in dry forest.
| Variables respuesta | Factor/Variable explicativa | lr x 2 | gl | Valor-P |
|---|---|---|---|---|
| Abundancia | Período climático | 14.0805 | 1 | < 0.001 |
| Período climático*CV | 11.8052 | 1 | < 0.001 | |
| Fragmento*CV | 24.3550 | 1 | < 0.001 | |
| RHs | 24.1782 | 1 | < 0.001 | |
| CV | 8.1749 | 1 | < 0.01 | |
| Fragmento*RHs | 18.6360 | 1 | < 0.05 | |
| Fragmento*Ts | 5.2084 | 1 | < 0.05 | |
| Fragmento | 15.3092 | 1 | NS | |
| 0 D (Riqueza) | Período climático | 5.5417 | 1 | < 0.05 |
| RHs | 2.8727 | 1 | NS | |
| Período climático *Fragmento | 1.2449 | 1 | NS | |
| CV | 0.7584 | 1 | NS | |
| 1 D | Fragmento | 2.82611 | 1 | NS |
| Período climático | 1.62398 | 1 | NS | |
| RHs | 0.79851 | 1 | NS | |
| Período climático *Fragmento | 0.45593 | 1 | NS | |
| 2 D | Fragmento | 1.38980 | 1 | NS |
| Período climático | 1.31665 | 1 | NS | |
| Período climático *Fragmento | 1.04554 | 1 | NS | |
| RHs | 0.57008 | 1 | NS |
Abreviatura: Cobertura vegetal (CV), humedad del suelo (RHs), temperatura del suelo (Ts), razón de verosimilitud (lr x 2), grados de libertad (gl), no significativo (NS).
Discusión
En este trabajo se registraron 31 géneros de Geadephaga pertenecientes a fragmentos de Bs-T del Caribe colombiano: 26 géneros en la Reserva La Flecha (RLF) y 20 géneros en la Reserva Campesina La Montaña (RCM), valores cercanos a lo reportado por Martínez (2005) en el municipio de Zambrano (Bolívar). Asimismo, se reporta por primera vez a los géneros Agra Fabricius, 1801, Eurycoleus Chaudoir, 1848 y Perigona Laporte de Castelnau, 1835 para el Atlántico (Martínez, 2005), y se amplía el rango de distribución de Odontocheila salvini Bates, 1874 dentro del territorio colombiano (Ramírez-Mora, 2008; Vítolo, 2004; Vítolo & Pearson, 2003), llegando a una representación del 7 % de la riqueza total de Geadephaga en Colombia (Martínez, 2005).
Varios estudios sobre el Bs-T en Colombia han reportado la diversidad de Geadephaga, sin embargo, estos no reportan valores de cobertura de muestreo de especies suficiente para llegar a conclusiones precisas, más allá de sugerir que el Bs-T contiene una diversidad poco explorada (Arenas et al., 2015; Ariza et al., 2021; Uribe & Vallejo, 2013). Estos resultados muestran porcentajes de completitud de muestreo superiores al 80 %, con un total de 49 morfoespecies, lo que sugiere una recolección de la mayor porción de la fauna de Geadephaga del área estudiada que, a su vez, casi duplica el valor de especies reportado por Arenas-Clavijo & Chacón de Ulloa (2016) en fragmentos de bosque seco del Valle del Cauca. Por consiguiente, el hallazgo de tal cantidad de morfoespecies tanto en RLF como en RCM resaltan el valor de estos bosques para soportar poblaciones de Geadephaga en el Caribe colombiano.
La variación de la riqueza y abundancia de Geadephaga reportada en el presente estudio, parece obedecer a un patrón estacional, con bajos valores del período seco en ambos fragmentos de bosque. Una reducción del 54 % en la riqueza y del 88 % en la abundancia en la RLF, mientras en la RCM se registró una disminución del 75 % en la riqueza y 97 % de la abundancia respecto al período lluvioso. En el período seco, la humedad del suelo disminuye ostensiblemente en el Bs-T, al igual que la cobertura vegetal (Pizano & García, 2014), y se convierten en un factor que disminuye el desarrollo de las poblaciones de carábidos y cicindélidos (Rainio, 2009). La hojarasca seca limita la disponibilidad de recursos alimenticios y refugio, por lo que es poco atractiva para algunos grupos de insectos detritófagos, como Orthoptera, Collembola y Coleoptera (Martínez-Hernández, García-Atencia et al., 2010), algunos de los cuales son presas de los Geadephaga.
Por su parte, en el período lluvioso se encontró una mayor riqueza de especies, similar a lo reportado por Arenas et al. (2013), donde la riqueza de Geadephaga fue mayor durante el período lluvioso, en una zona cultivada del valle geográfico del río Cauca. Durante este período climático, se incrementa la humedad relativa del suelo, mejorando las condiciones para la postura de huevos y el desarrollo larval (Fierro Tapia et al., 2011). La baja abundancia de los Geadephaga recolectados durante el período seco también podría relacionarse con aspectos de su biología: las pupas de muchas especies de carábidos y cicindélidos entra en diapausa durante el período seco (Lövei & Sunderland, 1996), a la vez que su emergencia suele estar sincronizada con la disponibilidad de alimentos, regulada por la llegada de las lluvias, como sucede con otros escarabajos del Bs-T (García et al., 2021; Hernández-Camargo et al., 2017; Martínez-Hernández, García-Atencia et al., 2010).
En estudios similares se ha reportado la dominancia de una especie de cicindélido en particular dentro de la comunidad de Geadephaga (Arenas-Clavijo & Chacón de Ulloa, 2016; Arenas et al., 2013). Una de las características de estas especies es que abundan en áreas abiertas con una alta incidencia solar como cultivos y potreros (Ariza et al., 2021; Pearson & Cassola, 1992; Rodríguez et al., 1998). Por tanto, la alta abundancia de T. affinis en la RCM durante el período de lluvias no es de extrañar, si se tiene en cuenta que este fragmento de bosque ha sido sometido a una fuerte presión antrópica en las últimas décadas (Martínez-Hernández, García-Atencia et al., 2010).
Por otro lado, se encontró una amplia disimilitud entre las comunidades de Geadephaga dentro de cada fragmento, en función del período climático. A su vez, en el período seco, las comunidades de Geadephaga de ambos fragmentos no fueron diferenciables entre sí, lo cual podría dar cuenta de un efecto normalizador de esta condición climática de gran escala, que conlleva la simplificación de las comunidades de insectos (Arenas-Clavijo & Armbrecht, 2019; García et al., 2021). De igual forma, el manejo de la matriz que rodea los remanentes de bosque puede incrementar los efectos causados por las fluctuaciones climáticas de gran escala; más aún, si se tiene en cuenta que los sitios con menor cobertura vegetal soportan una menor diversidad de Geadephaga (Arenas-Clavijo & Chacón de Ulloa, 2016; Ariza et al., 2021; García-Atencia & Martínez-Hernández, 2015). En conclusión, este trabajo resalta la importancia de los fragmentos de bosque seco tropical del Caribe colombiano para albergar especies de Geadephaga, a la vez que refleja la variación de su diversidad, que está influenciada por la variabilidad climática regional.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.
Ver material suplementario











 uBio
uBio 


