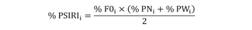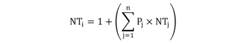Introducción
La doradita Caranx vinctus Jordan & Gilbert, 1882 pertenece a la familia Carangidae y se distribuye en el Pacífico oriental tropical, desde la costa occidental de Baja California, México hasta Perú en aguas costeras y oceánicas (Allen & Robertson, 1978; Robertson & Allen, 2015). Esta especie presenta una importancia económica en pesquerías locales y de sustento, alcanza una talla máxima de 37 cm de longitud total (LT) y, se captura principalmente con redes de enmalle, línea de mano y con arpón (Smith-Vaniz, 1995; Espino-Barr, Cruz, & García, 2003; Gutiérrez-Zavala & Cabrera-Mancilla, 2019).
Las especies pertenecientes al género Caranx son consideradas como depredadores piscívoros, sin embargo, también pueden alimentarse de crustáceos y en menor medida de moluscos y otros invertebrados (Silvano, 2001; Sley, Jarboui, Ghorbel, & Bouain, 2008; Saucedo-Lozano et al. 2012). En algunas especies se ha determinado que la dieta durante la etapa juvenil se basa en el consumo de crustáceos y durante el crecimiento aumenta el consumo de peces hasta la fase adulta (Sley, Jarboui, Ghorbel, & Bouain, 2009).
Además, cabe destacar la importancia que tienen los carangidos como parte de la dieta de grandes depredadores como tiburones, peces pico, dorados y túnidos (Oxenford & Hunte, 1999; Hoffmayer & Parsons, 2003; Júnior, Vooren, & Lessa, 2004; Estupiñan-Montaño, Cedeño-Figueroa, & Galván-Magaña, 2009). Por lo que, su rol como mesodepredadores hace que una gestión sustentable de estos recursos sea esencial para la integridad del ecosistema, ya que al ocupar niveles tróficos intermedios en la cadena trófica permiten la canalización de energía desde los niveles tróficos bajos a los altos y viceversa (Cury et al. 2000), lo que implicaría que, presiones pesqueras fuertes o condiciones ambientales desfavorables hacia estos, podría tener un impacto sobre los demás componentes del ecosistema. Pese a su relativa importancia, no existen estudios detallados, a nivel cuantitativo, sobre su alimentación; al respecto, de la Cruz-Agüero, Arellano Martínez, Cota Gómez, & de la Cruz-Agüero (1997) mencionan que, para Baja California Sur, México, C. vinctus se alimenta principalmente de pequeños peces, crustáceos e invertebrados bentónicos.
En términos generales, los estudios de alimentación representan un elemento importante en el conocimiento de la biología básica de las especies, permitiendo conocer el papel que estas desempeñan a nivel ecológico, el uso del hábitat, la disponibilidad y variación de las especies presa, así como las relaciones intra e interespecíficas entre los diferentes componentes del ecosistema (principalmente competencia y depredación) (Yáñez-Arancibia & Nugent, 1977; Hajisamaea, Choua, &Ibrahim, 2003; Correa, Albrecht, & Hahn, 2011; Ramos, D.M.A., Ferreira, A., dos Santos, N., Cunha, R.E.M.C., & Machado, 2015). Esta información también puede ayudar a la gestión del ecosistema, ya que se puede utilizar para construir modelos tróficos (Dantas, Barletta, Ramos, Lima, & da Costa, 2013) o ser aplicado a estudios de ecología trófica que incluyen cambios espaciales, estacionales y ontogenéticos en la dieta de las especies (Guedes, Araujo, Pessanha, & Milagre, 2015). Dado lo anterior, el presente trabajo tiene como objetivo principal determinar los hábitos alimentarios de C. vinctus, considerando posibles diferencias en cuanto a sexo, madurez sexual y época, así como también su nivel trófico y amplitud del nicho.
Materiales y métodos
Sitio de estudio: Todos los especímenes analizados fueron tomados de las capturas comerciales artesanales que realizan los pescadores en la costa de fondo blando en la Bahía de Acapulco, Guerreo, en el Pacífico oriental tropical de México. Los especímenes fueron capturados mediante el arte de pesca, chinchorro playero, en la sociedad cooperativa Playa las Hamacas. Se recolectaron peces de manera quincenal capturados entre marzo 2017 y abril 2018.
Recolección de datos: A cada espécimen se le tomaron las siguientes medidas: longitud-total (LT) y peso total (W), con precisiones respectivas de 1 mm y 0.01 g.
Los contenidos estomacales fueron recolectados y congelados para posteriormente determinar los diferentes componentes de la dieta de la especie.
Cada componente se identificó hasta el mínimo taxón posible, con la ayuda de claves específicas (Keen, 1958; Mauchline, 1971; Brusca, 1980; Modlin, 1984; Hendrickx & Salgado-Barragán, 1991; Fischer et al., 1995; Allen & Robertson, 1998; García-Madrigal, 2007). Cada componente se pesó con una balanza electrónica de 0.01 g de precisión.
Análisis de datos: Para determinar el número de estómagos necesarios para caracterizar la dieta general y la dieta de las diferentes categorías (sexos, madurez sexual y épocas), se realizaron curvas acumuladas de especies con EstimateS (Colwell, 2016). Estas curvas se construyeron a partir del valor del índice de diversidad de Shannon-Wiener (H’) y el número de estómagos. Dentro del cálculo de las curvas, un coeficiente de variación (CV) igual o inferior a 5 % (0.05) indicó que el número de estómagos fue el adecuado para representar la dieta de acuerdo a trabajos publicados (Jiménez-Valverde & Hortal, 2003; Moreno-Sánchez et al., 2019).
Para cada ítem alimenticio se calculó su índice numérico, índice gravimétrico e índice de aparición (Hynes, 1950; Hyslop, 1980). Para valorar de manera integral la importancia que tiene cada presa en la dieta de C. vinctus se utilizó el Índice de Importancia Relativa Específica de la Presa (% PSIRI), propuesto por Brown, Bizzarro, Cailliet, & Ebert (2012) el cual se expresa de la siguiente manera:
donde % FOi es el porcentaje de la frecuencia de ocurrencia, y expresa las veces en que una presa apareció en la dieta de un depredador con respecto al número total de estómagos que contenían alimento; % PNi =
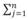 % Nij/ni es el porcentaje de la Abundancia Específica de la Presa en Número de organismos y % PWi =
% Nij/ni es el porcentaje de la Abundancia Específica de la Presa en Número de organismos y % PWi =
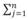 % Wij/ni el porcentaje de la Abundancia Específica de la Presa en peso, en donde: % Nij es la abundancia en número de la categoría de presas i en la muestra de un estomago j, % Wij es el porcentaje de la abundancia en peso de la categoría de presas i en la muestra de un estomago j y ni es el número de estómagos que contiene una presa i. Este índice es aditivo con respecto al nivel taxonómico y permite comparaciones entre estudios.
% Wij/ni el porcentaje de la Abundancia Específica de la Presa en peso, en donde: % Nij es la abundancia en número de la categoría de presas i en la muestra de un estomago j, % Wij es el porcentaje de la abundancia en peso de la categoría de presas i en la muestra de un estomago j y ni es el número de estómagos que contiene una presa i. Este índice es aditivo con respecto al nivel taxonómico y permite comparaciones entre estudios.
La determinación de la amplitud de la dieta se utilizó para evaluar de manera cuantitativa si los organismos presentan un comportamiento generalista (presentan una alimentación variada sin ninguna selección) o especialista (presentan una preferencia por cierta presa). Se utilizó el índice de Levin (Krebs, 1999), cuando Bi se acerca a 0 se considera especialista y cuando se acerca a 1 es generalista.
Para evaluar el traslape de dietas entre sexos (hembra y machos), grado de madurez sexual (juveniles y adultos) y temporada (lluvias y secas) (tutiempo.net, 2019), se utilizó la rutina para superposición del nicho de Morisita-Horn (Horn, 1966; Smith, & Zaret, 1982). El valor de este índice varía entre cero cuando las dietas son completamente distintas y uno, cuando las dietas son idénticas o similares. Se considera un traslape biológico significativo cuando el valor excede a 0.60; y valores menores a 0.60 se considera que no hay traslape (Langton, 1982).
El análisis de una vía de similitud (ANOSIM) con 999 permutaciones, se utilizó para probar la hipótesis nula de que no hay diferencias en la composición de la dieta entre sexos (hembras y machos), madurez sexual (juvenil y adulta) y diferentes estaciones (seca y lluviosa). Los análisis se realizaron utilizando el paquete estadístico PRIMER 6 (Clarke & Warwick, 2001). Para determinar la posición trófica de C. vinctus se utilizó el método propuesto por Cortés (1999), esto es:
Donde Pj es la proporción que cada categoría de presa tiene en la dieta del depredador; y NTj es el nivel trófico de cada categoría de presa j. Los niveles tróficos de presas se obtuvieron de la base de datos del Proyecto Sea Around Us (Pauly, Zeller, & Palomares, 2020).
Resultados
Se recolectaron 278 estómagos de los cuales 268 (96.4 %) presentaron alimento y 10 (3.59 %) se encontraron vacíos. Con respecto al sexo, el 60.24 % fueron hembras y 39.75 % machos. El intervalo de tallas de los organismos analizados fluctuó entre 16 y 27.5 cm LT y el peso total entre 49 y 250 g. Según el CV de la curva de acumulación de presas, el tamaño de muestra fue suficiente para describir la dieta de Caranx vinctus de la muestra general y el tamaño de la muestra por categorías (sexo, madurez sexual y temporada) fueron adecuados para describir la dieta de esta especie (Tabla 1).
TABLA 1 TABLE 1 Tamaño mínimo de muestra de Caranx vinctus de la Bahía de Acapulco, determinado para todas las muestras y por sexo, madurez sexual y época Minimum sample size of Caranx vinctus from Acapulco Bay, Mexico, determined for all samples and by sex, sexual maturity, and season
| Categoría | Ns | Nsm | CV |
| General | 268 | 98 | ≤ 0.05 |
| Hembras | 147 | 76 | ≤ 0.05 |
| Machos | 97 | 90 | ≤ 0.05 |
| Juveniles | 173 | 92 | ≤ 0.05 |
| Adultos | 94 | 83 | ≤ 0.05 |
| Lluvias | 143 | 56 | ≤ 0.05 |
| Secas | 125 | 115 | ≤ 0.05 |
Ns = número de estómagos analizados, Nsm = número mínimo de estómagos por categoría, CV = coeficiente de variación por tamaño de muestra.
Ns = number of stomachs analyzed, Nsm = minimum number of stomachs by category, CV = coefficient of variation for the respective sample size.
El análisis de la dieta permitió identificar 24 ítems presa, clasificados en tres grandes grupos taxonómicos: peces (cuatro ítems), crustáceos (21 items) y moluscos (dos ítems) (Tabla 2).
TABLA 2 TABLE 2 Espectro trófico de Caranx vinctus en la Bahía de Acapulco Trophic spectrum of Caranx vinctus in Acapulco Bay
| Especies presa | % FA | % PN | % N | % PW | % W | % PSIRII | NT |
| Gastropoda | |||||||
| Turritellidae | 4.49 | 33.00 | 1.37 | 30.5 | 3.29 | 1.4 | 2.1 |
| Littorinidae | 3.00 | 8.1 | 1.03 | 8.0 | 2.97 | 0.2 | 2.1 |
| Crustacea | |||||||
| Infraclase Cirripedia | 0.75 | 45.8 | 0.09 | 26.5 | 0.00 | 0.3 | 2.52 |
| Huevo de Copepoda | 2.25 | 97.2 | 0.31 | 91.7 | 0.01 | 2 | 1 |
| Subclase Copepoda | 0.37 | 100 | 0.02 | 100 | 0.00 | 0.37 | 2.2 |
| Squilla sp. | 1.50 | 16.2 | 0.13 | 17.7 | 0.24 | 0.19 | 3.5 |
| Mysidae | |||||||
| Acanthomysis sp. | 1.12 | 100 | 0.67 | 100 | 0.28 | 1.12 | 2.2 |
| Archaeomysis sp. | 6.74 | 84.9 | 9.39 | 84.6 | 16.29 | 5.5 | 2.2 |
| Amphipoda | |||||||
| Amphilochidae | 0.37 | 50 | 0.04 | 50 | 0.00 | 0.2 | 1 |
| Hyperiidae | 1.12 | 35.1 | 1.37 | 38.6 | 0.07 | 0.4 | 2.2 |
| Isopoda | 0.75 | 41.7 | 0.07 | 41.7 | 0.06 | 0.3 | 2.2 |
| Euphausia sp. | 10.49 | 96.8 | 12.26 | 97.2 | 3.07 | 9.8 | 2.2 |
| Decapoda | |||||||
| Larvas mysis | 8.61 | 72.3 | 12.44 | 70.7 | 30.27 | 5.4 | 2.2 |
| Postlarvas | 5.62 | 77.3 | 8.34 | 54 | 2.10 | 2.8 | 2.2 |
| Axiidae sp. | 0.37 | 10 | 0.02 | 2.7 | 0.02 | 0.1 | 2.52 |
| Zoea de Porcellanidae | 9.36 | 75.2 | 5.60 | 67 | 2.89 | 7.7 | 2.2 |
| Megalopa de Porcellanidae | 3.75 | 16.7 | 0.40 | 37.6 | 1.33 | 0.9 | 2.2 |
| Zoea de Portunoidea | 7.12 | 70.3 | 7.53 | 63 | 2.66 | 3.1 | 2.2 |
| Megalopa de Portunidae | 22.85 | 87.1 | 33.45 | 73.9 | 9.73 | 16.51 | 2.2 |
| Actinopterygii | |||||||
| Teleostei | 26.97 | 43.5 | 2.31 | 57.9 | 6.31 | 12.7 | 3.24 |
| Larvas de Teleostei | 2.25 | 37.3 | 0.45 | 42.4 | 0.72 | 0.9 | 2.2 |
| Larva de Scianidae | 1.87 | 61.4 | 0.25 | 76.6 | 3.90 | 1.2 | 2.2 |
| Anchoa ischana | 11.24 | 98.3 | 1.64 | 98.3 | 7.85 | 10.6 | 3.24 |
| MONI | 13.48 | 93.6 | 0.81 | 96.5 | 5.92 | 11.2 | 0 |
Valores porcentuales de los métodos de frecuencia de aparición (FA), abundancia específica de la presa en número (PN), numérico (N), abundancia específica de la presa en peso (PW), gravimétrico (W) índice de importancia relativa específica de la presa (PSIRI) y nivel trófico de la presa (NT). Materia orgánica no identificada (MONI).
Percentages based on frequency of occurrence (FA), prey-specific number (PN), number (N), prey-specific weight (PW), weight (W), prey-specific index of relative importance (PSIRI) and trophic level of each prey category (NT). Unidentified organic matter (MONI).
De acuerdo a la frecuencia de aparición, Teleostei represento el 26.97 %, larvas megalopa de Portunoidae el 22.85 %, materia orgánica no identificada (MONI) 13.48 % y Anchoa ischana (Jordan & Gilbert, 1882) el 11.24 %.
Numéricamente se cuantificaron un total de 4 461 organismos, correspondiendo a las larvas megalopa de Portunoidae el 33.45 %, larvas mysis de Penaeoidea un 12.4 %, Euphausia sp. represento el 12.26 % y el mísido Archaeomysis sp. represento el 9.39 %.
Las presas en los estómagos acumularon un peso de 164.9 g de acuerdo al método gravimétrico, los componentes más importantes fueron en los Crustacea, larvas mysis de Penaeoidea con 30.27 % y Archaeomysis sp. con el 16.29 %, Anchoa ischana el 7.85 % y peces Teleostei representaron el 6.31 %.
En lo que respecta al % PSIRI, se encontró que megalopas de Portunoidae representaron el 16.51 %, seguido de Teleostei con 12.7 %, materia orgánica no identificada (MONI) con el 11.2 %, Anchoa ischana con el 10.6 %. Estos cuatro componentes conformaron el 51.01 %.
Para las hembras se registraron 147 estómagos con alimento, en los cuales, los ítems más importantes fueron: Archaeomysis sp. (20.7 %), larvas megalopa de Portunoidae (20.62 %), larvas mysis de Penaeoidea (17.55 %), Anchoa ischana (6.21 %) y otros Teleostei (5.75 %). Para los machos se registraron 97 estómagos con alimento, se encontró que los ítems más importantes del espectro trófico fueron; larvas mysis de Penaeoidea (30.01 %), otros Crustacea (14.81 %), larvas megalopa de Portunoidae (11.87 %) y Mollusca Gatropoda (7.98 %) (Fig. 1). Se presentaron 24 ejemplares de C. vinctus con los estómagos con alimento, a los cuales no fue posible sexar por su incipiente desarrollo gonádico. Se determinó que la proporción de hembras y machos fue significativamente diferente de 1:1 (X2 = P > 0.05), la proporción fue de 1:0.65.
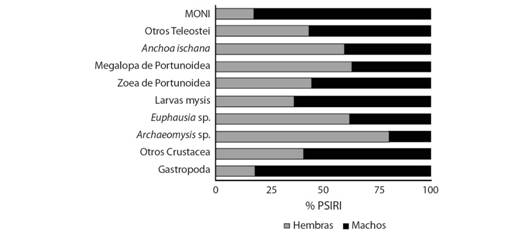
Fig. 1 Fig. 1 Componentes de la dieta de C. vinctus de acuerdo al sexo (% PSIRI). Components of the C. vinctus diet according to sex (% PSIRI).
En el análisis de la alimentación por madurez sexual, los ejemplares juveniles de C. vinctus (n = 173) tuvieron un total de 19 componentes alimentarios. Dónde los más importantes de acuerdo con el % PSIRI fueron: larvas megalopa de Portunoidae (25.02 %) seguido por larvas mysis de Penaeoidea (19.11 %), Archaeomysis sp. (15.34 %) y otros Crustacea (12.85 %), constituyendo el 72.35 % del % PSIRI. Para los ejemplares adultos de C. vinctus (n = 94), se registró un total de 19 recursos tróficos. De los cuales, se consideran los más importantes con base en el % PSIRI a larvas mysis de Penaeoidea (32.67 %) seguido por Euphausia sp. (27.3 %), otros Teleostei (11.23 %) y Anchoa ischana (9.36 %) (Fig. 2).
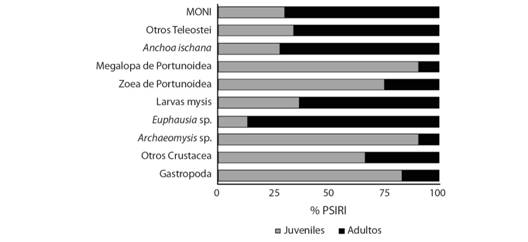
Fig. 2 Fig. 2 Componentes de la dieta de C. vinctus de acuerdo a la madurez sexual (% PSIRI). Components of the C. vinctus diet according to the sexual maturity (% PSIRI).
Para el análisis estacional de los meses muestreados fueron divididos en dos temporadas del año (lluvias y secas). Para la temporada de lluvias se registraron 19 recursos tróficos en C. vinctus, siendo el principal las larvas megalopa de Portunoidae (25.6 %), larvas mysis de Penaeoidea (25.02 %) Archaeomysis sp. (14.81 %) y otros Crustacea (13.53 %), conformando el 78.98 % del índice de importancia relativa específica de la presa en un total de 143 estómagos llenos. Para la época de secas (precipitaciones menores a 15 mm/mes) los ítems más importantes fueron: Euphausia sp. (47.76 %), Anchoa ischana (32.83 %), MONI (6.34 %) y otros Teleostei (5.67 %), conformando el 92.61 % del índice de importancia relativa específica de la presa en un total de 125 estómagos llenos (Fig. 3).
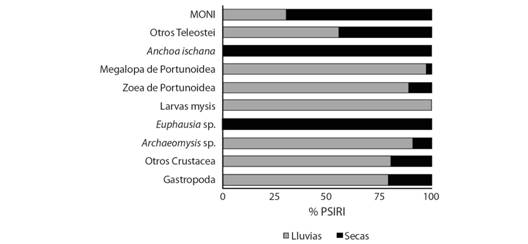
Fig. 3 Fig. 3 Componentes de la dieta de C. vinctus de acuerdo a la época del año (% PSIRI). Components of the C. vinctus diet according to the time of year (% PSIRI).
Al aplicar el índice de Levin se determinó que C. vinctus puede caracterizarse como especialista ya que el valor estimado de amplitud fue bajo (Bi = 0.29) en el espectro trófico general. Por lo cual, se considera como un depredador, con marcadas preferencias hacia algunos ítems (megalopas de Portunoidae, Teleostei y Anchoa ischana). La estrategia especialista se mantuvo en los análisis realizados por categorías (sexo, madurez sexual y temporada) (Tabla 3). De acuerdo al índice de Morisita Horn, se presentó un traslape entre las dietas por sexo (hembras y machos Cλ = 0.84), pero no entre madurez sexual (Juveniles y adultos Cλ = 0.56) y temporadas (Lluvias y secas Cλ = 0.03). La prueba ANOSIM demostró que en todas las combinaciones se registraron diferencias significativas (P < 0.05) (Tabla 4).
TABLA 3 TABLE 3 Amplitud de dieta de C. vinctus de acuerdo al índice de Levin. General, sexo, madurez sexual y época Diet breadth of C. vinctus according to the Levin index. General, sex, sexual maturity and time
| Categoría | Valor | |
| General | 0.29 | |
| Sexo | ||
| Hembras | 0.32 | |
| Machos | 0.34 | |
| Madurez sexual | ||
| Juveniles | 0.34 | |
| Adultos | 0.21 | |
| Época | ||
| Lluvias | 0.28 | |
| Secas | 0.12 | |
TABLA 4 TABLE 4 Estadístico R, valor de P y Similitud en la prueba ANOSIM entre sexos, madurez sexual y temporadas para Caranx vinctus en la Bahía de Acapulco, México R statistic, P-values and Similarity of ANOSIM test between sexes, sexual maturity, and seasons for Caranx vinctus from Acapulco Bay, Mexico
| Grupo | Estadístico global (R) | Nivel de significancia P | Similitud (%) |
| Temporadas (lluvias y secas) | 0.810 | 0.001 | 49.5 |
| Madurez sexual (Juveniles y adultos) | 0.996 | 0.001 | 68.1 |
| Sexos (Hembras y machos) | 0.983 | 0.001 | 83.2 |
De acuerdo con la ecuación de nivel trófico (NT) propuesta por Cortés (1999), se estableció que de manera general C. vinctus es una especie zooplantofaga e ictiófaga (NT = 3.39), para secas (NT = 3.15) y para lluvias (NT = 3.52). Lo que lo clasifica como un consumidor terciario. Este tipo de consumidores se caracterizan por consumir especies de segundo orden en la cadena alimenticia como son las anchoas, algunos crustáceos y zooplancton, es decir, de especies consumidoras de los grupos localizados en niveles inferiores de la cadena trófica.
Discusión
Para C. vinctus, considerando el intervalo de tallas que componen las capturas (16 - 27.5 cm de LT), la pesquería artesanal de la bahía de Acapulco estaría compuesta principalmente de organismos inmaduros, ya que de acuerdo a Lucano-Ramírez, Rivera-Ríos, Ruiz-Ramírez, González-Sansón, y Pérez-Toledo (2016), la talla de primera madurez (L50) es de 26.04 cm para hembras y 23.77 cm para machos. De acuerdo al análisis de los 244 organismos a los cuales se les determino el sexo se estimó que su L50 es de 22 cm LT. Se considera que esta especie al estar en su aprovechamiento máximo presenta madurez temprana, e incluso se encontraron organismos de tallas de 17 cm de LT, con gónada desarrollada, esto posiblemente se debe a que los organismos capturados debido a la presión de pesca aceleran su crecimiento al disminuir la competencia intraespecífica por alimento y por tanto a menor talla alcanzan su madurez sexual (Longhurst & Pauly, 1987).
El índice de importancia relativa (IIR) (Pinkas, Oliphant, & Iverson, 1971) es uno de los índices más utilizados para determinar hábitos alimentarios de una especie, sin embargo en la actualidad se sabe que este índice conlleva desaciertos matemáticos y metodológicos, que pueden derivar en una interpretación errónea de los resultados. En atención a dicha problemática Brown et al. (2012), propusieron el uso del índice de importancia relativa específico de las presas (% PSIRI), mismo que pondera la importancia de cada artículo alimentario únicamente entre los organismos en que se presentó, de esta forma se obtiene mayor precisión de la dieta y se evitan sesgos de sobre o subestimación de presas, contrario a lo que ocurre cuando se opta por el % IIR, ya que pondera la importancia de cada presa con respecto a los estómagos que presentaron contenido (Moreno-Sánchez, et al., 2019).
Los estómagos analizados permitieron identificar 24 ítems alimentarios. Los resultados de este trabajo indican que, en la bahía de Acapulco, Guerrero C. vinctus se alimenta de una gran variedad de presas zooplanctónicas, representadas por crustáceos y huevos y larvas de peces, así como pequeños peces de la familia Engraulidae. Otras especies de la familia Carangidae que también basan su alimentación en crustáceos y peces se han considerado como depredadores especialistas (Roux & Conand, 2000; Sley, Jarboui, Ghorbel, & Bouain, 2008; Flores-Ortega et al., 2010; Sánchez-García et al. 2017).
Los datos de este trabajo coinciden con lo reportado por De la Cruz-Agüero et al. (1997). Según estos autores para Baja California Sur, México, C. vinctus se alimenta principalmente de pequeños peces, crustáceos e invertebrados bentónicos. En la Bahía de Acapulco los peces pequeños estuvieron representados por Anchoa ischana (% PSIRI = 10.6 %), los crustáceos planctónicos principalmente por larvas zoea de Porcellanidae, megalopas de Portunoidae, larvas mysis de Penaeoidea y Euphausia sp. que conformaron el 39.41 % del % PSIRI. Un crustáceo bentónico intersticial fue Archaeomysis sp. que represento el 5.5 % del % PSIRI. Otros invertebrados bentónicos presentes en la dieta de C. vinctus fueron: Turritellidae, Littorinidae, Cirripedia, Squilla sp. y Axiidae sp. que en conjunto conformaron el 2.19 % del % PSIRI. En general para estudios tróficos se debe tomar en cuenta que el grado de diversidad de hábitos alimentarios en peces, deriva de una serie de procesos coevolutivos entre estos y sus presas en respuesta a diferentes condiciones ambientales. Dichos procesos implican amplia gama de adaptaciones a nivel etológico, metabólico y anatómico en orden de un mejor aprovechamiento de los recursos tróficos (Granado-Lorencio, 2002), ya que generalmente seleccionan presas que maximizan la cantidad de energía ganada, en relación al coste energético por captura (Sánchez-Hernández, Servia, Vieira-Lanero, & Cobo, 2013) y siempre tratando de reducir en lo posible la competencia con otras especies por el alimento (Granado-Lorencio, 2002).
Al parecer C. vinctus, forma cardúmenes mixtos, por lo que no hay una segregación por sexos en la alimentación (Cλ = 0.84). Por otro lado, de acuerdo al índice de Morisita Horn hay poco traslape entre la dieta de juveniles y adultos (Cλ = 0.56), este resultado sugiere que en C. vinctus existe un patrón en la utilización de los recursos alimentarios de acuerdo a las distintas clases de talla, como una posible estrategia ecológica para la optimización en el uso de las presas para minimizar la competencia intraespecífica (Schoener, 1971; Cortés & Gruber, 1990; Ruiz-Campos & Cota-Serrano, 1992; Vögler, Milessi, & Quiñones, 2003).
En este análisis el espectro alimentario de C. vinctus exhibió una variación estacional cualitativa y cuantitativa (Lluvias y secas Cλ = 0.03). A lo largo del período de estudio se encontraron diferentes grupos de organismos en el contenido estomacal. Para la temporada de lluvias, C. vinctus se alimentó principalmente de larvas megalopa de Portunoidae (25.6 %) y no apareció en la dieta Euphausia sp., para la época de secas el ítem más importante fue Euphausia sp. (47.76 %), en este periodo estuvieron ausentes larvas mysis de Penaeoidea. La diferencia en la alimentación entre las temporadas de lluvias y secas, está relacionada con variaciones en la disponibilidad del alimento, debido a cambios en la temperatura, nutrientes, movimientos de surgencias locales e interacciones oceánicas dentro de la Bahía de Acapulco (Meave-del Castillo, Zamudio-Resendiz, & Castillo Rivera, 2012; Rojas-Herrera et al., 2012, Fernández-Álamo, Gálvez-Zeferino, Roa-Venicio, & Rojas-Herrera, 2019). En el Mediterráneo, C. rhonchus Geoffroy Saint-Hilaire, 1817 y C. crysos (Mitchill, 1815) presenta diferencias estacionales en su dieta, presentando una mayor incidencia de crustáceos durante otoño-invierno en su dieta, y en verano presenta un aumento en el consumo de peces (Sley et al. 2008, 2009), lo que coincide con este estudio, donde el consumo de crustáceos disminuye en época de secas y aumenta en lluvias. También se observó una mayor incidencia de Anchoa ischana en época de secas, lo cual coincide con lo observado en el Golfo de California (Sánchez-García et al. 2017), en donde Anchoa spp. fue más abundante en la dieta del jurel (C. caninus Günther, 1867) durante la época fría. Además, similarmente a lo reportado por Sánchez-García et al. (2017) en C. vinctus aumenta la diversidad de sus presas en época de secas, principalmente crustáceos.
Para una comparación estadística más rigurosa de la alimentación se empleó en este trabajo el análisis multivariado de similitud (ANOSIM), el cual mostró que los factores (sexo, madurez sexual y temporada) influyeron en el tipo de alimentación de C. vinctus.
El resultado obtenido con el índice de Levin indica que C. vinctus se alimenta de un reducido número de organismos presas, mostrando una amplitud de dieta baja (Bi = 0.29) por lo que se le clasificó como depredador especialista oportunista, pues cambia su dieta de acuerdo a las presas más abundantes en un tiempo y espacio específico. La doradita puede alimentarse de un grupo limitado de organismos aprovechando las presas que están disponibles en el área. Un comportamiento parecido en la dieta especialista se ha observado en otros carangidos como Selar crumenophthalmus (Bloch, 1793), Selene peruviana (Guichenot, 1866) y Caranx caninus (Roux & Conand, 2000; Tripp-Valdez & Arreguín-Sánchez, 2012; Sánchez-García et al., 2017). Cuando existe una abundancia del recurso los depredadores tienen una selección por ciertas presas, es decir, les permite elegir a sus presas, en caso contrario, cuando el recurso es escaso, los depredadores consumen las presas sin ninguna selección (Escobar-Sánchez, Abitia-Cárdenas, & Galván-Magaña, 2006).
Palacios-Salgado (2011) para comunidades de peces de fondos blandos en el Pacifico Oriental Tropical de México en cinco zonas típicas de pesca de camarón, encontró 44 grupos funcionales (incluyendo gremios tróficos y gremios reproductivos) aplicando descriptores estructurales como la composición, la diversidad taxonómica y la afinidad biogeográfica; así como datos asociados a hábitat, como son uso de sistemas estuarinos, posición en la columna de agua y distribución vertical, y descriptores morfológicos como son la forma del pez y de la aleta caudal, entre otros. La doradita C. vinctus fue agrupada con Caranx caballus Günther, 1868, C. caninus, C. otrynter Jordan & Gilbert, 1883 y Scomberomorus sierra Jordan & Starks, 1895. Los atributos que definen a este grupo son, ictiobentívoros, nivel trófico 3.5 - 3.99, especies pelágico neríticas, cuerpo fusiforme, ovíparos con huevos pelágicos, aleta caudal furcada y teleósteos grandes. Estas cinco especies han sido reportadas en Acapulco, Guerrero, México (Palacios-Salgado, Ramírez-Valdez, Rojas-Herrera, Granados-Amores, & Melo-García, 2014) por lo que este grupo funcional está completo en el área de estudio.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio