Los estudios sobre equinodermos de México se iniciaron en 1838, cuando se hicieron breves referencias sobre especímenes recolectados en localidades próximas a las costas mexicanas. Tal es el caso de los primeros trabajos de L. Agassiz y G. valentin, quienes registraron a la galleta de mar Mellita hexapora (Gmelin, 1788) (ahora Leodia sexiesperforata) para las costas de veracruz. Durante el siglo XIX y XX se destacaron las recolectas de equinodermos efectuadas en el territorio mexicano por diversas expediciones extranjeras, tales como las del HMS Challenger, USS Albatross y Allan Hancock Foundation (velero III y Iv), entre otros (Durán, Laguarda-Figueras, Solís-Marín, Buitrón-Sánchez, Gust-Ahearn & Torres-vega, 2005).
México alberga una significativa diversidad de equinodermos y hasta el momento se han reportado 643 especies que habitan el mar territorial, que suponen aproximadamente el 10 % de las especies de equinodermos existentes en el planeta (Solís-Marín et al., 2013). Al ubicarse en una zona tropical con influencia de faunas templadas del hemisferio norte, y entre dos masas de agua como lo son Atlántico centro-occidental y el Pacífico centro-oriental, ayudan a explicar la gran diversidad biológica y ecosistémica que posee. Su extensión oceánica comprende en el Pacífico mexicano, a los golfos de California y Tehuantepec, y las islas oceánicas de Guadalupe y el Archipiélago de Revillagigedo, mientras que en el Atlántico comprende al Golfo de México y al Mar Caribe.
Solís-Marín et al. (2013) reportaron 58 especies de equinoideos irregulares, analizando la fauna de equinodermos en diferentes regiones marinas de México, y donde se propone por primera vez al Golfo de México como la cuenca con mayor diversidad de equinodermos en el país; de este número, 96 especies son asteroideos. Los equinoideos se pueden encontrar en casi todos los hábitats marinos, desde las regiones polares hasta las ecuatoriales, y desde la zona intermareal hasta profundidades mayores a los 7 000 m. Algunas especies presentan una distribución cosmopolita, pero la mayoría están restringidas geográficamente (Smith, 1984).
Las barreras geográficas y los patrones de corrientes oceánicas actúan como moduladores primarios de la distribución de los equinoideos; sin embargo, el factor principal que define la distribución local de los equinoideos irregulares es el substrato (Kier & Grant, 1965; Ebert, 1971; Smith, 1984; Jangoux & Lawrence, 1989). Hay especies de equinoideos que viven en los primeros metros de profundidad, gracias a su adaptación a zonas de alta energía, evitando así la competencia con otras especies; por otro lado, existen muchos grupos que habitan únicamente aguas profundas, principalmente urequínidos y pourtalesidos (Smith, 1984).
Diversos autores han analizado las relaciones entre equinoideos de diferentes regiones para conocer los procesos evolutivos y de dispersión (Marsh & Marshall, 1983; Ghiold & Hoffman, 1986; Thandar, 1989; Ameziane & Roux, 1997; Solís-Marín, 1998). Maluf (1988) realizó un trabajo sobre los equinodermos de la costa americana del Pacífico, en el que mencionó que la riqueza de especies depende principalmente de la heterogeneidad del ambiente. En este sentido, la autora indicó que la costa de Baja California tiene una fauna muy distinta al resto de la costa pacífica americana y que el mayor número de endemismos aparece en Baja California y en la región de Costa Rica-Panamá. Para 1991, Maluf reportó 200 especies de equinodermos para las islas Galápagos, de las cuales 37 pertenecen a la Clase Echinoidea y al menos 30 de éstas se comparten con la biota mexicana. Al analizar todas las clases juntas, Maluf (1991) mencionó que la fauna de las islas Galápagos muestra la mayor similitud con las islas Revillagigedo y en igual medida al Pacífico Este y al Golfo de California, sin embargo, al analizar la clase Echinoidea las islas Revillagigedo presentaron mayor similitud con el Golfo de California. Para el Golfo de México y el Caribe mexicano, actualmente no existen evaluaciones biogeográficas como la anterior, con la excepción hecha por Solís-Marín (1998) en donde reportó que el género Mellita posee siete especies, todas restringidas al Continente Americano, cuatro de ellas habitan en la costa pacífica y dos en la costa atlántica, explicando que los intervalos de distribución de las especies de la familia Mellitidae son relativamente estáticos, de ahí que la explicación de la amplia distribución actual a través de eventos de dispersión, es poco probable.
Recientemente comenzaron una serie de estudios sobre la biogeografía de equinodermos en aguas mexicanas entre los que podemos citar el de Caballero-Ochoa (2011), quien realizó un análisis biogeográfico de la clase Holothuroidea en el Pacífico mexicano, encontrando que la provincia Cortés es la más biodiversa. Ese trabajo menciona que la provincia Panámica en México y hasta Costa Rica es, tal vez, un área transicional que no se ha nombrado desde el punto de vista biogeográfico.
Martín (2012) analizó la biogeografía de la clase Asteroidea en la costa del Atlántico en México y utiliza como unidades geográficas operativas las propuestas por Wilkinson et al. (2010). El cladograma obtenido del análisis de parsimonia de endemismos reconoce tres principales grupos (Mar Caribe, Zona nerítica de veracruz y la Zona nerítica exterior de Campeche y Yucatán), además de encontrar OGU’s que muestran menor afinidad biogeográfica con el resto (Talud del norte del Golfo de México y la cuenca del Golfo de México).
Garcés (2014) hizo un análisis de parsimonia de endemismos para conocer la biogeografía de la clase Ophiuroidea en la costa del Pacífico Mexicano utilizando OGU’s de 1° de latitud, delimitando así seis regiones, mencionando que existe una continuidad dentro de ellas debido quizás al flujo de la corriente de California, la corriente ecuatorial del norte, la contracorriente ecuatorial y la corriente costera de Costa Rica.
El presente trabajo actualiza la lista de los equinoideos irregulares recientes reportados para México en diversas colecciones nacionales e internacionales y reidentifica los ejemplares reportados para corroborar su identidad taxonómica.
Por otro lado, con la información taxonómica actualizada y las coordenadas de recolecta de las especies de equinoideos irregulares de México, se realizó un análisis PAE para generar una hipótesis comprobable de relación de áreas de endemismo de equinoideos irregulares y así describir la distribución de los equinoideos irregulares recientes de México con base en los factores ecológicos de los mares mexicanos.
Materiales y métodos
Revisión taxonómica
Se localizaron los registros de la Cohorte Irregularia Latreille, 1825 (sensuSmith, 1984) albergados en: 1) Colección Nacional de Equinodermos “Ma. Elena Caso Muñoz” del Instituto de Ciencias del Mar y Limnología (ICML), de la Universidad Nacional Autónoma de México (UNAM); 2) Invertebrate Zoology Collection, Smithsonian Museum of Natural History, Washington, D.C., Estados Unidos de América (EUA); 3) Invertebrate Collection, Museum of Comparative Zoology, University of Harvard, Boston, Massachusetts, EUA y 4) Invertebrate Zoology, Peabody Museum, Yale University, New Haven, Connecticut, EUA. Dichos ejemplares se reidentificaron y clasificaron bajo el criterio de Kroh y Smith (2010). Estas especies se ubicaron dentro de las regiones que se obtuvieron del análisis biogeográfico de este trabajo (Fig. 6, A-I) y se integraron en el listado.
Análisis biogeográfico
Se construyeron dos matrices de datos, una para la costa Atlántica y otra para la costa del Pacífico, ya que no comparten especies entre sí. Las especies se colocan en las columnas y las regiones en los renglones; la entrada es “1” si la especie está presente en dicha región o “0” si está ausente (matriz presencia / ausencia); se emplea un área hipotética codificada con ceros para determinar la raíz del cladograma (ROOT). Estas matrices se sometieron a un Análisis de Parsimonia de Endemismos (PAE) en el programa WinClada con NONA por búsqueda Heurística múltiple TBR + TBR (milt * max *).
Las especies integradas en las matrices fueron las resultantes de la revisión taxónómica. Se delimitaron las Unidades Geográficas Operativas (OGU’s por las siglas de Operative Geographic Units) con base en la clasificación de unidades geográficas de la Cooperación Ambiental (Wilkinson et al., 2010) debido a que esta regionalización fue propuesta en tres niveles: I) grandes masas y corrientes de agua, grandes mares encerrados y regiones donde la temperatura de la superficie del mar o de la capa de hielo es similar, II) la división entre la zona nerítica y la oceánica, determinada por una fisiografía a mayor escala (plataforma continental, talud y planicie abisal, así como las grandes fosas o trincheras, cordilleras submarinas y estrechos) y III) las diferencias al interior de la zona nerítica, basadas en variables más significativas a escala local, como las características de la masa de agua, formación del fondo marino a relieve regional y tipo de comunidades biológicas (Wilkinson et al., 2010) (Fig. 1 y 2). Esta regionalización, a diferencia de otras propuestas, considera aspectos ambientales a nivel local que definen la distribución de los equinoideos irregulares, Las OGU’s en las que se registraron por lo que se concluyó que esta regionalización equinoideos irregulares se ingresaron con la nos brindaría un análisis más detallado. misma numeración y nombres con los que fueron publicadas:
13.1.5 Zona estuarina Laguna Madre.
14.1.1 Zona nerítica de veracruz.
14.1.2 Zona nerítica de Tabasco.
14.1.3 Zona nerítica interior de Campeche y Yucatán.
14.1.4 Zona nerítica exterior de Campeche y Yucatán.
14.3 Talud del sur del Golfo de México.
14.4 Cuenca del Golfo de México.
15.1 Plataforma del Caribe mesoamericano.
15.1.1 Zona nerítica de Contoya.
15.1.2 Zona nerítica de Cancún.
15.1.3 Zona nerítica de Sian Ka’an.
15.3 Talud del Caribe mesoamericano.
16.1.1 Zona nerítica de Tehuantepec y Chiapas.
16.1.2 Zona nerítica de Tehuantepec y Oaxaca.
17.1.1 Zona nerítica del Pacífico transicional mexicano.
17.2 Talud del Pacífico transicional mexicano.
17.5 Planicies y montañas marinas del Pacífico transicional mexicano.
17.6.1 Zona nerítica de Revillagigedo.
18.1.1 Zona nerítica del mar de Cortés oriental.
18.1.2 Zona nerítica de Guaymas.
18.1.3 Zona nerítica de Tiburón.
18.1.4 Zona nerítica de Lobo.
18.1.5 Zona nerítica interior del Alto Golfo.
18.1.6 Zona nerítica exterior del Alto Golfo.
18.1.7 Zona nerítica de Baja California Norte.
18.1.8 Zona nerítica de Baja California Sur.
18.1.9 Zona nerítica de Los Cabos en el mar de Cortés.
18.2 Estrechos de las grandes islas del Golfo de California.
18.3 Talud y depresiones del Golfo de California.
18.6 Trinchera mesoamericana.
19.1.1 Zona nerítica de Los Cabos en el Pacífico.
19.1.2 Zona nerítica de El vizcaíno.
19.1.3 Zona nerítica de Ensenada.
19.3 Margen continental de Baja California.
19.4 Planicies y montañas marinas del Pacífico sudcaliforniano
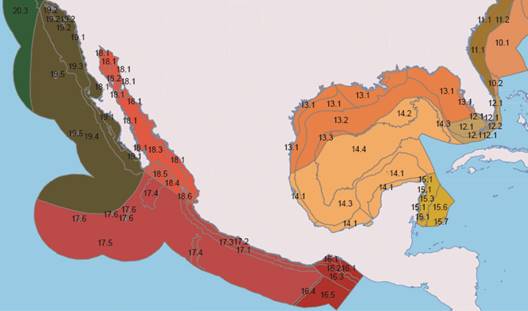
Fig. 1 Regionalización de aguas a los niveles I y II (Wilkinson, 2010). Fig. 1. Regionalization of waters at levels I and II (Wilkinson, 2010).
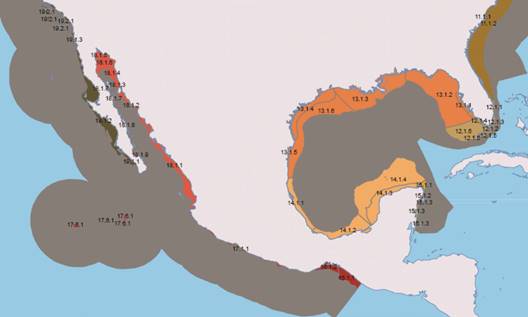
Fig. 2 Regionalización de aguas al nivel III (Wilkinson, 2010). Fig. 2. Regionalization of water to level III (Wilkinson, 2010).
Ambas matrices, de la costa Atlántica y de la costa Pacífica (Cuadros 1 y 2), se sometieron a un análisis de parsimonia de endemismos (PAE) en el programa WinClada (Nixon, 1999) con NONA (Goloboff, 1999) por búsqueda heurística múltiple TBR + TBR (milt * max *). Se usó NONA porque es un software libre y descargable, muy rápido que facilita la comparación de los análisis.
Al terminar la construcción de las matrices de datos, el análisis de la costa Atlántica incluyó 11 regiones y 29 especies, mientras que el de costa Pacífica incluyó 23 regiones y 39 especies.
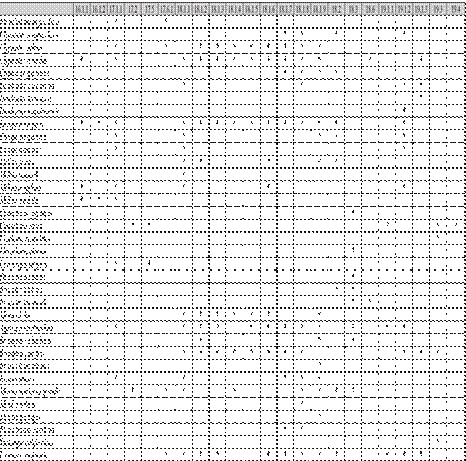
Cuadro 1 Matriz de presencia/ausencia de especies por OGU utilizadas en el análisis PAE de la región del Atlántico Mexicano
| - | 13.1.5 | 14.1.1 | 14.1.2 | 14.1.3 | 14.1.4 | 14.3 | 14.4 | 15.1.1 | 15.1.2 | 15.1.3 | 15..33 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Echinoneus cyclostomus | - | - | - | - | - | - | - | * | * | * | * |
| Cassidulus caribaearum | - | - | - | - | - | - | - | - | * | - | * |
| Conolampas sigsbei | - | - | - | - | * | - | - | - | - | - | * |
| Echinolampas depressa | - | - | - | - | * | - | - | - | - | - | * |
| Clypeaster chesheri | - | - | - | * | * | - | - | - | - | - | - |
| Clypeaster prostratus | - | - | - | - | * | - | - | - | - | - | - |
| Clypeaster ravene/ii | * | * | * | * | * | * | * | * | * | * | - |
| Clypeaster rosaceus | - | - | - | * | * | - | - | - | * | - | - |
| Clypeaster subdepressus | - | - | - | * | * | - | - | * | * | - | - |
| Echinocyamus grandiporus | - | - | - | - | * | - | - | * | * | * | - |
| Echinocyamus macrostomus | - | - | - | - | - | - | - | - | * | * | * |
| Encope aberrans Encope grandis | - | - | - | * | * | * | - | * | - | - | - |
| Encope michelini | - | * | * | * | * | - | - | * | - | - | - |
| Leodia sexiesperforata | - | - | - | - | - | - | - | * | * | * | - |
| Mellita quinquiesperforata | * | * | * | - | - | * | - | - | - | - | - |
| Aceste bellidifera | - | - | * | - | - | - | - | - | - | - | - |
| Hypselaster limicolus | - | * | * | - | * | - | - | - | - | - | - |
| Moira atropos | - | * | * | - | - | - | - | - | - | - | - |
| Schizaster floridiensis | - | - | - | - | - | - | - | - | * | - | - |
| Agassizia excentrica | - | - | - | - | - | - | - | - | - | * | - |
| Paleopneustes tholoformis | - | - | - | - | - | - | - | - | - | - | * |
| Palaeobrissus hilgardi | - | - | - | - | - | - | - | - | - | - | * |
| Brissopsis alta | * | * | * | - | - | * | - | - | - | - | - |
| Brissopsis atlantica | * | * | * | - | * | * | - | - | - | - | * |
| Brissus unicolor | - | * | - | - | * | - | - | - | * | * | - |
| Meoma venlicosa ventricosa | - | - | * | - | * | - | - | - | * | * | - |
| Neopneustes micrasteroides | - | - | - | - | - | - | - | - | - | - | * |
| Plagiobrissus grand is | - | - | * | - | * | - | - | * | * | - | - |
| Rhynobrissus cuneus | - | - | * | - | - | - | - | - | - | - | - |
| Plethotaenia angularis | - | - | - | - | - | - | - | - | - | - | * |
| Plethotaenia spatangoides | - | - | * | - | * | - | - | - | - | - | * |
| Homo/ampasfragilis | - | - | - | - | - | - | - | - | - | * | - |
Debifo a que la distribución de los equinoideos irregulares se define principalmente por factores oceanográficos, este análisis permite conocer qué factores ecológicos son los que determinan mejor dicha distribución.
Resultados
Taxonomía
Se revisaron 9 897 ejemplares pertenecientes a 68 especies, 35 géneros, 17 familias y seis órdenes de equinoideos irregulares recolectados en aguas mexicanas (Cuadro 3); los órdenes más diversos fueron Spatangoida (31 especies), Clypeasteroida (26 especies) y Holasteroida (6 especies). De las 68 especies reportadas, 37 se distribuyen en el Océano Pacífico y 31 en el Océano Atlántico (Tabla 3), ninguna de ellas se encontró en ambas costas.
A continuación se presenta el listado de especies, con letra se muestran las regiones biogeográficas en las que se reportan (Fig. 6, A-I) y con superíndices se mencionan las colecciones donde se encontraron ejemplares de dicha especie.
Cuadro 3 Diversidad de familias, géneros y especies de los seis órdenes de equinoideos irregulares reportados para México
| Órdenes | Familias | Géneros | Especies | Ejemplares |
|---|---|---|---|---|
| Echinoneoida | 1 | 1 | 1 | 41 |
| Cassiduloida | 1 | 2 | 2 | 1384 |
| Echinolampadoida | 1 | 2 | 2 | 48 |
| Clypeasteroida | 4 | 6 | 26 | 5570 |
| Holasteroida | 3 | 5 | 6 | 36 |
| Spatangoida | 7 | 19 | 31 | 2818 |
| 17 | 35 | 68 | 9897 |
Orden Echinoneoida H. L. Clark, 1925
Familia Echinoneidae L. Agassiz & Desor, 1847 Echinoneus cyclostomus Leske, 1778; B, D 1, 2, 3. Orden Cassiduloida Claus, 1880
Familia Cassidulidae L. Agassiz & Desor, 1847
Cassidulus caribaearum Lamarck, 1801; D 1.
Rhyncholampas pacificus (A. Agassiz, 1863); G, H 1, 2, 3, 4.
Orden Echinolampadoida Kroh & Smith, 2010
Familia Echinolampadidae Gray, 1851
Conolampas sigsbei (A. Agassiz, 1878); B, D 1, 2, 3.
Echinolampas depressa Gray, 1851; B, D 1, 2, 3.
Orden Clypeasteroida L. Agassiz, 1835
Familia Clypeasteridae L. Agassiz, 1835 Clypeaster chesheri Serafy, 1970; B 1.
Clypeaster europacificus H. L. Clark, 1914; E, G, H 1, 2, 3.
Clypeaster ochrus H. L. Clark, 1914; E, G, H 1, 2, 3.
Clypeaster prostratus (Ravenel, 1845); B 1.
Clypeaster ravenelii (A. Agassiz, 1869); A, B, C, D 1, 2, 3.
Clypeaster rosaceus (Linnaeus, 1758); B, D 1, 2.
Clypeaster rotundus (A. Agassiz, 1863); E, G, I 1, 2, 3.
Clypeaster speciosus verrill, 1870; E, H 1, 2, 3, 4.
Clypeaster subdepressus (Gray, 1825); B, D 1, 2.
Familia Fibulariidae Gray, 1855
Echinocyamus grandiporus Mortensen, 1907; B, D 2.
Echinocyamus macrostomus Mortensen, 1907; D 2.
Familia Dendrasteridae Lambert, 1900
Dendraster excentricus (Eschscholtz, 1829); E, G 1, 2, 3.
Dendraster terminalis (Grant & Hertlein, 1938); E 3.
Dendraster vizcainoensis Grant & Hertlein, 1938; G 1, 2.
Familia Mellitidae Stephanini, 1912
Encope aberrans Martens, 1867; A, B 1.
Encope grandis L. Agassiz, 1841; E, H 1, 2, 3, 4.
Encope michelini L. Agassiz, 1841; A, B 1, 2, 3.
Encope micropora L. Agassiz, 1841; E, G, H 1, 2, 3, 4.
Encope perspectiva L. Agassiz, 1841; E, G, H 1, 2, 3.
Encope wetmorei A. H. Clark, 1946; E, G 1, 2, 3.
Leodia sexiesperforata (Leske, 1778); B, D 1.
Mellita grantii Mortensen, 1948; G, J 1, 2.
Mellita kanakoffi Durham, 1961; G 1.
Mellita longifissa Michelin, 1858; G, I 1, 2, 3.
Mellita notabilis H. L. Clark, 1947; I 1, 2.
Mellita quinquiesperforata (Leske, 1778); B 1, 2.
Orden Holasteroida Durham & Melville, 1957
Familia Urechinidae Duncan, 1889
Cystechinus giganteus A. Agassiz, 1898; I 2, 3.
Cystechinus loveni (A. Agassiz, 1898); F 2, 3.
Urechinus reticulatus H. L. Clark, 1913; F 2.
Familia Plaexechinidae Mooi & David, 1996 Plexechinus cinctus A. Agassiz, 1898; I 3.
Familia Pourtalesiidae A. Agassiz, 1881
Cystocrepis setigera (A. Agassiz, 1898); F, G 2, 3.
Pourtalesia tanneri A. Agassiz, 1898; I 2, 3.
Orden Spatangoida L. Agassiz, 1840 Familia Schizasteridae Lambert, 1905
Aceste bellidifera Thomson, 1877; A 1.
Brisaster latifrons (A. Agassiz, 1898); H, I 2, 3.
Brisaster townsendi (A. Agassiz, 1898); I 1, 2, 3.
Hypselaster limicolus (A. Agassiz, 1878); A, B 1, 2.
Moira atropos (Lamarck, 1816); A 1.
Moira clotho (Michelin, 1855); E 1, 2, 3.
Schizaster floridiensisKier & Grant, 1965; D 1.
Familia Prenasteridae Lambert, 1905
Agassizia excentrica A. Agassiz, 1869; D 2.
Agassizia scrobiculata valenciennes, 1846; E, F, G, I 1, 2, 3.
Familia Paleopneustidae A. Agassiz, 1904 Paleopneustes tholoformis Chesher, 1968; D 2.
Familia Palaeotropidae Lambert, 1896
Palaeobrissus hilgardi A. Agassiz, 1883; D 2.
Familia Brissidae Gray, 1855
Brissopsis alta Mortensen, 1907; A 1,2.
Brissopsis atlantica Mortensen, 1907; A, B, D 1, 2.
Brissopsis columbaris A. Agassiz, 1898; E, I 1, 2.
Brissopsis pacifica (A. Agassiz, 1898); E, F, G 1, 2, 3.
Brissus latecarinatus (Leske, 1778); E 3.
Brissus obesus verrill, 1867; E, G 1, 2, 3, 4.
Brissus unicolor (Leske, 1778); A, B, D 1, 2.
Meoma ventricosa grandis Gray, 1851; E, F, H, I 1, 2, 3.
Meoma ventricosa ventricosa (Lamarck, 1816); A, B, D 1, 2.
Metalia nobilis verrill, 1867; E 1.
Metalia spatagus (Linnaeus, 1758); E 2, 3.
Neopneustes micrasteroides (Duncan, 1889); D 2.
Plagiobrissus grandis (Gmelin, 1788); A, B, D 1, 2.
Plagiobrissus pacificus H. L. Clark, 1940; E 1.
Rhynobrissus cuneus Cooke, 1957; A 1.
Familia Spatangidae Gray, 1825
Plethotaenia angularis Chesher, 1968; D 2.
Plethotaenia spatangoides (A. Agassiz, 1883); A, B, D 1, 2.
Spatangus californicus H. L. Clark, 1917; F 1, 2.
Familia Loveniidae Lambert, 1905
Homolampas fragilis (A. Agassiz, 1869); D 2.
Lovenia cordiformis A. Agassiz, 1872; E, F, G, H 1, 2, 3.
Biogeografía
Las OGU’s con mayor riqueza específica fueron la 14.1.4.-Zona nerítica exterior de Campeche y Yucatán en el Atlántico (S = 16), 18.1.1.-Zona nerítica del mar de Cortés oriental (S = 15) y 18.1.9.-Zona nerítica de Los Cabos en el mar de Cortés en el Pacífico (S = 15); las menos ricas fueron la 14.4.-Cuenca del Golfo de México en el Atlántico (S = 1) y 19.4.-Planicies y montañas marinas del Pacífico sudcaliforniano (S = 1) (Fig. 3).
El PAE de la costa Atlántica resultó en un cladograma (Fig. 4) en el que se pueden distinguir cuatro biorregiones (Fig. 6). El PAE de la costa Pacífica obtuvo 10 cladogramas igual de parsimoniosos, con los cuales se construyó un cladograma consenso por Majority Fools (Figs. 5 y 6), en el que se distinguen cinco biorregiones:
Costa Occidental del Golfo de México (de Tamaulipas a Tabasco) [14.1.1, 14.1.2, 13.1.5, 14.3]: La costa sur del golfo tiene una plataforma compuesta de un sustrato calcáreo somero, es considerablemente estrecha hacia la parte occidental (Solís et al., 2013). El fondo del Golfo Sur está formado por una mezcla de arenas calcáreas, limo y arcilla, principalmente (Pica, Ponce y Barrón, 1991; Wilkinson et al., 2010). En esta región habitan clypeasteroides (Clypeaster, Encope y Mellita) y spatangoides(Schizasteridae, Brissidae y Spatangidae).
Plataforma del Sur del Golfo de México [14.1.3, 14.1.4, 15.1.1]: se delimita principalmente por la corriente del Lazo y se diferencia por los aportes de agua y materiales terrígenos de los ríos que desembocan en el Golfo de México (Wilkinson et al., 2010). En esta región se reporta a Echinoneus cyclostomus, Conolampas sigsbei, Echinolampas sigsbei, clypeasteroides de los géneros Clypeaster, Echinocyamus, Encope y Leodia, y spatangoides de los géneros Hypselaster, Brissopsis, Brissus, Meoma, Plagiobrissus y Plethotaenia.
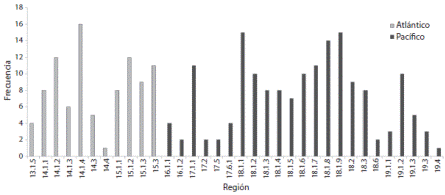
Fig. 3 Riqueza específica de las OGU’s incluídas en el PAE. Fig. 3. Specific richness of OGU’s included in the PAE.
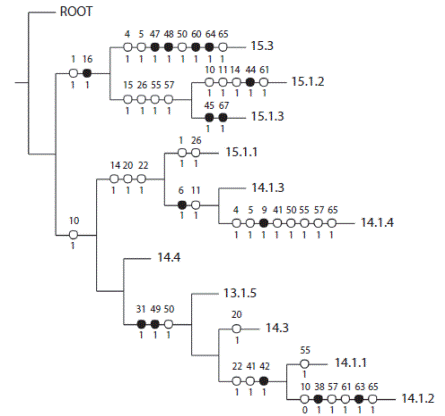
Fig. 4 Cladograma de las regiones marinas de la costa Atlántica de México (L = 57, Ci = 0.56 y Ri = 0.33). = no-homoplasias (sinapomorfías o autapomorfías), = homoplasias (convergencia o paralelismo). Los números sobre los puntos indican el número de caracter (especie) y los números debajo de los círculos indican el estado de carácter (0 ausencia ó 1 presencia). Fig. 4. Cladogram of the marine regions of Mexico Atlantic coast (L = 57, Ci = 0.56 and Ri = 0.33). = non-homoplasies (synapomorphies or autapomorfias), = homoplasies (convergence or parallelism). Numbers on the points indicate the number of character (species) and the numbers below the circles indicate the status of character (0 presence or 1 absence).
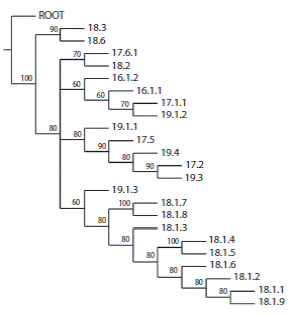
Fig. 5 Cladograma consenso de las regiones marinas de la costa Pacífica de México (L = 81, Ci = 0.44 y Ri = 0.63). Fig. 5. Cladogram consensus of the marine regions of the Pacific coast of Mexico (L = 81, Ci = 0.44 y Ri = 0.63).
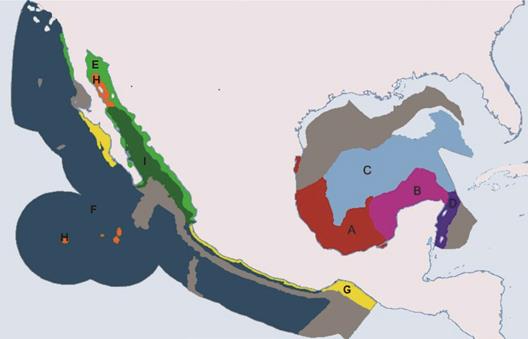
Fig. 6 Principal Association obtained from parsimony analysis of endemic Mexican seas. A: West coast of the Gulf of Mexico (from Tamaulipas to Tabasco); B: platform South of the Gulf of Mexico; C: basin of the Gulf of Mexico; D: neritic zone and slope of the Mesoamerican Caribbean; E: neritic zone of the sea of Cortés; F: The transitional Mexican Pacific slope; H: islands Revillagigedo and the sea of Cortés; I: Mesoamerican trench. Gray regions are those not recorded any kind.
Cuenca del Golfo de México [14.4]: se define principalmente por el tipo de sedimento y la profundidad de la planicie abisal de Sigsbee (aproximadamente 3 600 m) (Pica, Ponce & Barrón, 1991); solo registra la especie Clypeaster ravenelii.
Zona nerítica y talud del Caribe mesoamericano [15.1.2, 15.1.3, 15.3]: es un mar tropical pobre en nutrientes, situado principalmente sobre sedimentos mixtos, con componentes terrígenos. El flujo principal de la corriente del Caribe pasa alrededor de la parte sur de la ecorregión hacia el canal de Yucatán, a través del cual entra al Golfo de México (Pica, Ponce & Barrón, 1991). En esta región se encuentran los géneros Echinoneus, Cassidulus, Conolampas, Echinolampas, clypeasteroides de los géneros Clypeaster, Echinocyamus y Leodia, y spatangoides de las familias Schizasteridae, Prenasteridae, Paleopneustidae, Palaeotropidae, Brissidae, y Spatangidae.
Zona nerítica del mar de Cortés [18.1.1, 18.1.2, 18.1.3, 18.1.4, 18.1.5, 18.1.6, 18.1.7, 18.1.8, 18.1.9, 19.1.3]: se ubica dentro del Golfo de California, que es un mar largo estrecho, parcialmente cerrado y que se extiende a lo largo de más de 9° de latitud. Sus costas varían desde limosas hasta arenosas y rocosas, en su mayor parte con arenas de tamaño mediano (Zárate, 1991). En esta región se registran clypeasteroides de los géneros Clypeaster, Dendraster, Encope y Mellita, además de spatangoides de los géneros Moira, Agassizia, Brissopsis, Brissus, Meoma, Metalia, Plagiobrissus y Lovenia.
Talud del Pacífico transicional mexicano [17.2, 17.5, 19.1.1, 19.3, 19.4]: es una región de productividad elevada, con aguas cálidas y una fauna marina distinta a la que sostienen las corrientes de California y Humboldt. La trinchera mesoamericana tiene una profundidad de entre 4 000 y 5 000 m. La planicie abisal tiene una profundidad de 3 500 a 4 000 m; está marcada por numerosos montes submarinos y por varias fracturas. Esta región comprende un sistema de dorsales en el que están creando nuevo suelo marino (Flamand, 1991; Pacheco, 1991a; Torres, 1991; Zárate, 1991; Wilkinson et al., 2010). Esta región cuenta con registros del Orden Holasteroida (géneros Cystechinus y Urechinus) y del Orden Spatangoida (Agassizia, Brissopsis, Spatangus y Lovenia).
Plataforma del Pacífico transicional mexicano [16.1.1, 16.1.2, 17.1.1, 19.1.2]: incluye la parte mexicana del Pacífico centroamericano y recibe influencia de la corriente de Costa Rica. Se trata de una región de productividad superficial elevada que experimenta una alta variabilidad estacional debido a los afloramientos y que está fuertemente influenciada por la descarga de agua dulce proveniente de lagunas costeras y de sistemas fluviales presentes en las zonas costeras de Chiapas, así como por los vientos provenientes del Golfo de México (Flamand, 1991; Pacheco, 1991a; Pacheco, 1991b; Wilkinson et al., 2010). Cuenta con registros del género cassiduloide Rhyncholampas, de clypeasteroides de los géneros Clypeaster, Dendraster, Encope y Mellita, el género holasteroide Cystocrepis, y los géneros spatangoides Agassizia, Brissopsis, Brissus y Lovenia.
Islas Revillagigedo y del mar de Cortés [17.6.1, 18.2]: comprende aguas someras afectadas estacionalmente por la influencia del extremo sur de la corriente de California, que lo transforma estacionalmente en mar subtropical y la corriente costera de Costa Rica, que fluye a lo largo de la costa de América Central y del territorio continental mexicano para encontrarse con la corriente de California en la porción más septentrional de la ecorregión (Pacheco, 1991a; Torres, 1991). En esta región se ubica un sistema de dorsales (fosas rift) que están creando nuevo suelo marino, como en el archipiélago de Revillagigedo (Flamand, 1991; Wilkinson et al., 2010). En esta zona se registran el género de cassiduloide Rhyncholampas, los géneros de clypeasteroides Clyepaster, Encope y Mellita y los géneros de spatangoides Brisaster, Meoma y Lovenia.
Trinchera Mesoamericana [18.3, 18.6]: se encuentra en la boca del Golfo de California. Esta región se caracteriza por sus cuencas profundas de más de 3000m, por una elevada productividad y por una estructura termohalina muy complicada caracterizada por frentes, remolinos e intrusiones que pueden estar vinculados a la confluencia de tres corrientes distintas. (Cid de León, 1991; Tovilla, 1991; Wilkinson et al., 2010). En ella podemos encontrar a Clypeaster rotundus, los géneros de holasteroides Cystechinus, Plexechinus y Pourtalesia, así como a los géneros de spatangoides Brisaster, Agassizia, Brisopsis y Meoma.
De las regiones biogeográficas obtenidas, la de mayor riqueza específica es la E) Zona nerítica del mar de Cortés (S = 24) y la de menor riqueza específica es la C) Cuenca del Golfo de México (S = 1) (Fig. 7).
Discusión
La revisión de los ejemplares en colecciones biológicas fue fundamental, ya que se llevó a cabo la reidentificación de 1 356 ejemplares de la Colección Nacional de Equinodermos (ICML-UNAM) catalogados como Clypeaster europacificus y reidentificados como C. rotundus; aunque tienen diferencias conspicuas (posición del ano y redondez de la testa).
En el NMNH, Smithsonian, tienen registros de Echinocyamus macrostomus y E. grandiporus para México. La mejor manera de distinguir estas especies es revisando el tamaño relativo de los poros oculares y genitales. E. grandiporus tiene poros oculares tan largos como los genitales, apreciándose un anillo de nueve poros de igual tamaño, mientras que E. macrostomus tiene poros oculares mucho más pequeños que los genitales. Es esencial reconocer esta diferencia, ya que ambas especies habitan la misma región geográfica y pueden confundirse.
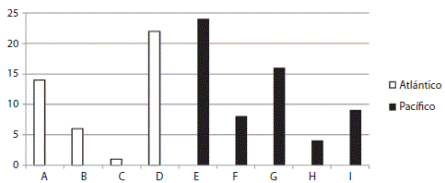
Fig. 7 Specific richness of the biogeographical regions obtained from the PAE. A, S = 14; B, S = 6; C, S = 22; D, S = 22; E, S = 24; F, S = 8; G, S = 16; H, S = 4; I, S = 9.
Existen tres especies del género Dendraster: D. excentricus, D. vizcainoensis y D. terminalis; todas ellas habitan en la costa Pacífica de la Península de Baja California. La característica más significativa que distingue a D. terminalis son los canales alimenticios de la superficie oral que no siguen hasta la superficie aboral. Mientras que aquella que distingue a D. excentricus de D. vizcainoensis es el tamaño de los tubérculos en la superficie aboral, que en la zona interporífera de D. vizcainoensis son particularmente grandes. Se reporta por primera vez la existencia de la especie D. excentricus dentro del Golfo de California (USNM 8989).
En México se encuentran las especies Meoma ventricosa ventricosa en la costa atlántica y M. ventricosa grandis en la costa pacífica. Existen diferencias en caracteres morfológicos que podrían elevar estas subespecies al rango de especies (Solís-Marín et al., 1997, TorresMartínez, Solís-Marín y Laguarda-Figueras, 2008), sin embargo es necesario hacer un estudio más profundo a fin de establecer claramente los límites entre ellas.
Serafy (1979) reportó a “Rhynobrissus” micrasteroides para aguas mexicanas pero esa especie fue designada como la especie tipo del género Neopneustes (N. micrasteroides). Martínez-Melo et al. (2014) reportan a Rhynobrissus cuneus en la costa de veracruz, único reporte afuera de su localidad tipo, en Carolina del Norte, EUA.
De las regiones biogeográficas obtenidas, la de mayor riqueza específica fue la E: Zona nerítica del mar de Cortés, y la de menor riqueza específica fue la C: Cuenca del Golfo de México; es probable que éstas diferencias en riqueza específica entre las dos zonas se deba a la diferencia en el esfuerzo de recolecta llevado a cabo en cada una de las zonas y la diversidad de ambientes presentes en cada una de ellas.
La recolecta de organismos en la cuenca del Golfo de México requiere de embarcaciones mayores que soporten la navegación en aguas lejanas y profundas. Al revisar los mapas de recolectas por campañas oceanográficas en las aguas mexicanas del Golfo de México (Laguarda-Figueras et al., 2005), podemos observar que en la parte central de la cuenca no se ha hecho un esfuerzo de captura tan fuerte como en las otras regiones del golfo (menores de 1 300 m de profundidad). Por el otro lado, el Golfo de California es un sistema subtropical con un intervalo de productividad primaria alto, entre dos o hasta tres veces más productivo que aquellos del Océano Atlántico o Pacífico, ubicados en las mismas latitudes (Torres, 1991). En la costa bajacaliforniana predominan las playas rocosas y acantilados, mientras que en la zona continental prevalecen las zonas areno-lodosas. En la costa oriental de Baja California se encuentran las bahías La Paz y Concepción, ambas de playas arenosas y pendiente suave, mientras que en la costa continental encontramos litoral rocoso desde Bahía Kino hasta el sur de la Bahía de Guaymas, Sonora; desde esta última localidad hasta el estado de Nayarit dominan las playas arenosas (Tapia-Ramírez, 2012).
Comparado con el listado previo de equinoideos del Golfo de México (Durán et al., 2005) en este trabajo se aumentan los reportes de las especies Rhynobrissus cuneus y a Aceste bellidifera para la biorregión A: Costa Occidental del Golfo de México (de Tamaulipas a Tabasco) y Leodia sexiesperforata y Clypeaster prostratus para la biorregión B: Plataforma del Sur del Golfo de México.
Al comparar con el reporte previo para el Caribe Mexicano (Laguarda et al., 2005), en este trabajo se aumentan los reportes de Conolampas sigsbei, Agassizia excentrica, Schizaster floridiensis, Paleobrissus hilgardi, Echinocyamus macrostomus, Plethotaenia spatangoides, Neopneustes micrasteroides, Palaeopneustes tholoformis, Homolampas fragilis y Plethotaenia angularis para la biorregión D: Zona nerítica y talud del Caribe mesoamericano.
Se agregan los registros de Urechinus reticulatus y Cystechinus loveni en la biorregión F: Talud del Pacífico transicional mexicano; Brissus obesus, Cystocrepis setigera, Dendraster mexicanus y D. vizcainoensis en la biorregión G: Plataforma del Pacífico transicional mexicano y, por último, Clypeaster speciosus, Mellita grantii y Brisaster latifrons en la biorregión H: Islas Revillagigedo y del mar Cortés, comparando con el listado de equinoideos del Pacífico Mexicano (Honey et al., 2008),
Se agregan los reportes de Cystechinus giganteus, Plexechinus cinctus y Pourtalesia tanneri para el Golfo de California, además de los ya mencionados en trabajos previos (Solís et al., 2005; Tapia-Ramírez, 2012).
Existen otros trabajos que han utilizado la regionalización de Wilkinson et al. (2010) para describir la distribución de los equinodermos en el Golfo de México (Martín-Cao Romero, 2012) y en el Pacífico mexicano (GarcésSolchaga, 2014). En el trabajo de Martín-Cao Romero (2012) se reconocen tres regiones principales en la distribución de los asteroideos dentro del Golfo de México: Mar Caribe, Zona nerítica de veracruz y la Zona nerítica exterior de Campeche y Yucatán; esas regiones concuerdan con las bioregiones A: Costa Occidental del Golfo de México (de Tamaulipas a Tabasco), B: Plataforma del Sur del Golfo de México y D: Zona nerítica y talud del Caribe mesoamericano obtenidas en este trabajo.
Lo anterior quizá se deba a que ambas clases de equinodermos dependan en mismo grado del tipo de sedimento en el cual se desarrollan. Como ya se mencionó, la distribución local de los equinoideos irregulares depende principalmente de las características del sustrato (Kier & Grant, 1965; Ebert, 1971; Jangoux & Lawrence, 1989; Smith, 1984). También se ha visto una fuerte relación entre la distribución de los asteroideos y el tipo de sedimento; por ejemplo, Luidia clathrata y Luidia lawrencei se distribuyen desde Florida hasta Centroamérica, sin embargo L. clathrata se encuentra en sedimento fino, mientras que L. lawrencei habita sedimento grueso (Lawrence et al., 2013).
Garcés-Solchaga (2014) delimita seis regiones para el Pacífico mexicano con base en los registros de la Clase Ophiuroidea; en dicho análisis menciona que las corrientes oceánicas podrían ser el factor que da continuidad y conectividad a estas regiones; sin embargo en este trabajo no encontramos continuidad en las regiones del Pacífico. La evidencia más clara es la región H: Islas Revillagigedo y del Mar de Cortés; en caso de que las corrientes fueran de los principales factores para explicar la distribución de los organismos en la zona, las Islas del Mar de Cortés se agruparían con la biorregión E: Zona Nerítica del Mar de Cortés, lo cual no sucede (Fig. 6). Lo anterior, ayuda a reforzar la idea de que el factor ambiental más importante que limita la distribución de los equinoideos irregulares es el tipo de sedimento.
Esta es la primera vez que se utilizan a los equinoideos dentro del modelo de Wilkinson et al. (2010) para describir las comunidades de este grupo y su distribución en las aguas territoriales mexicanas.












 uBio
uBio