Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.62 n.1 San José Jan./Mar. 2014
Relaciones suelo-vegetación en una toposecuencia del Escudo Guayanés, Venezuela
Soil-vegetation relationships in a toposequence of the Guayana Shiels, Venezuela
Soil-vegetation relationships in a toposequence of the Guayana Shiels, Venezuela
*Dirección para correspondencia:
Abstract
The Guayana Shield is one of the oldest territories in the planet and has millions of years subjected to leaching and erosion processes that produce oligotrophic soils. This scarcity of nutrients has not avoided the development of high, diverse and magnificent forests, where plants have adaptations to survive these difficult conditions. The aim of this work was to characterize the physical and chemical parameters of the soils in different forest communities of the Imataca Forest Reserve (IFR), to establish some interpretations on their origin, and some relationships between the edaphic components and the inhabitant species. Terrestrial journeys were carried out and two path-ways were traced for the interpretation of forest communities. In each community, three plots (100m x 100m) for the ecological survey were established. In each plot, all trees, palms, and lianas were measured (dbh≥10cm; dbh: diameter at breast height); four 10m x 10m understory sub-plots were evaluated, and a census of all the spermatophyta species (dbh<10cm) was made. Soils were evaluated by means of a trial pit in each community, and a bore in each one understory sub-plot. The obtained data were analyzed by both a detrended and a canonical correspondence analysis. Results from a total of 15 plots allowed us to identify three communities: a forest dominated by Mora excelsa located in a narrow valley with high content of silt; a swamp forest dominated by Catostemma commune in a sandy broad valley, and a forest in clay hills dominated by Alexa imperatricis. Most of the soils had a pH between 3.1 and 4.5. Nutrients were in very low concentrations (N: 0-0.2%; P: 0-14ppm; K: 0-0.3Cmol/kg) and Al in toxicity quantities. We observed that Ca/Al relationship greater than 1 meant a neutralization of the toxic effect of Al. Besides, basal area ranged from 20.4 to 32.3m2/ha; the highest level (top local forest development) corresponded with the C. commune community with a Ca/Al value of 2.5. This research found an adequate relationship between soil and vegetation, as it was able to identify three communities into three distinct soil conditions. Nevertheless, edaphic constraints indicated that high forest cover must be maintained as an essential element for the conservation of these communities.
Key words: oligotrophic soils, soil toxicity, Imataca, tropical forests, ecosystem susceptibility.
Resumen
El Escudo Guayanés es uno de los territorios más antiguos del planeta; tiene millones de años sometido a procesos de lixiviación y erosión que dejan suelos oligotróficos. El objetivo de este trabajo fue hacer la caracterización de los parámetros físicos y químicos de los suelos, en diferentes comunidades boscosas de la Reserva Forestal Imataca, e identificar ciertas relaciones entre los componentes edáficos y las especies que allí se presentan. Se realizó un inventario de todos los individuos mayores a 10cm dap (diámetro a la altura del pecho) en 15 parcelas (1ha); en cada una de esas parcelas se evaluaron cuatro sub-parcelas de sotobosque (100m2) para contabilizar todas las espermatofitas; los suelos se evaluaron mediante una calicata por comunidad y un barreno en cada sub-parcela de sotobosque. La mayoría de los suelos tienen un pH muy ácido (3.1-4.5), los nutrientes están en concentraciones muy bajas (N: 0-0.2%; P: 0-14ppm; K: 0-0.3Cmol/kg) y el Al en concentraciones tóxicas. Esto coincide con otros estudios realizados en esta región, pero en este trabajo se encontró que la relación Ca/Al con valores superiores a 1, lo que implica una neutralización del efecto tóxico del Al y permite un mejor desarrollo de las comunidades boscosas.
Palabras clave: suelos oligotróficos, toxicidad del suelo, Imataca, bosques tropicales, fragilidad de ecosistemas.
Desde hace poco más de un siglo, el trabajo de Flahault & Schöter (citados por Biondi, 2011) reconoce que una asociación es una agrupación vegetal con una determinada composición florística, que presenta una fisionomía uniforme y que se desarrolla en condiciones invariables del sitio. Esta es la base de Teoría Organísmica (Clements, 1916) y de la rama ecológica denominada Fitosociología (Braun-Blanquet, 1979), donde se considera que las comunidades vegetales pueden ser identificadas y clasificadas en un sistema jerárquico. Por otra parte, Gleason (1917) formuló la Hipótesis Individualista, que dio fundamento a la Teoría del Continuo (McIntosh, 1967), que señala la continuidad del ambiente y la distribución también continua de las especies a lo largo de gradientes ambientales; en esta concepción, se destaca la dificultad para diferenciar comunidades y se recomienda ordenar los censos en función de ejes de variación. En cualquiera de los dos enfoques está implícita una íntima relación entre la vegetación y los elementos físicos del medio donde ella se desarrolla.
Estos vínculos han sido estudiados en varios ecosistemas tropicales. Silva & Sarmiento (1976) demostraron, en sabanas de Barinas-Venezuela, que las comunidades dominadas por Axonopus canescens (Nees) Pilg. y A. fissifolius (Raddi) Kuhlm. están asociadas a condiciones de alto contenido de arcilla y alta disponibilidad de agua útil. En las Montañas Luquillo-Puerto Rico, Johnston (1992) señala que los árboles Dacryodes excelsa Vahl y Manilkara bidentata (A. DC.) A. Chev. predominan en suelos secos, con bajas concentraciones de Ca, Mg y bajo pH y en situaciones opuestas domina la palma Prestoea acuminata var. montana (Graham) A.J. Hend. & Galeano. De igual forma Cruz, Batalha, Pivello & Meirelles (2002) indican que, en el sureste de Brasil, Pterodon emarginatus Vogel y Virola sebifera Aubl. están relacionados con altos niveles de bases cambiables, mientras que Myrcia guianensis O. Berg, Didymopanax vinosum (Cham. & Schlchtndl.) Seem y Xylopia aromatica A. St-Hil. se presentan en suelos con altos contenidos de aluminio (Al).
Los nexos entre el suelo y la vegetación no se han investigado en la Reserva Forestal Imataca. Esta ocupa un territorio del Escudo Guayanés que está dominado por rocas de origen Pre-Cámbrico, en su mayoría pertenecientes a la Provincia Roraima en el sur (1 450 - 1 900 millones de años; Gibbs & Barron, 1983), Provincia Pastora en el centro (2 000 - 2 200 millones de años; Menéndez, 1968) y Provincia Imataca en el norte (3 400 a 3 700 millones de años; Montgomery & Hurley, 1978). También posee sedimentos de edad reciente, generados por aluviones del período cuaternario; de acuerdo a la combinación de factores climáticos, geológicos, edáficos y de vegetación, en la Reserva Forestal Imataca se han identificado 18 megaecosistemas y 69 macroecosistemas (MARN-UCV, 2003).
La antigüedad de esta zona implica que ha estado sometida, durante millones de años, a la acción de la meteorización por parte de un clima húmedo tropical. Sin embargo, durante el Pleistoceno hubo fases de clima más seco (Rull, 1991). Según Melfi, Cerri, Fristch, Milton & Formoso (1999), la alternancia de épocas húmedas y secas permitió la reducción, transporte, concentración del Fe y Mn en formas solubles y su precipitación y endurecimiento en concreciones y corazas, situadas originalmente en las posiciones más bajas. Debido a este proceso se observan actualmente algunas concreciones denominadas popularmente como “moco de hierro”. Las fases secas generaron un retroceso de la vegetación que dejó el suelo descubierto y condujo a un proceso de erosión muy intenso. Ocurrió una “inversión del relieve” ya que los terrenos protegidos por los duros mantos de concreciones y corazas, que estaban en las posiciones más bajas, ahora quedaban localizados en los sitios más altos, debido a que las áreas adyacentes se desmantelaban por la erosión (Franco, 1988; Dezzeo & Fölster, 1994). El área en general quedó cubierta por sedimentos coluviales y coluvio aluviales, de uno a varios metros de espesor, con líneas de piedra frecuentes entre horizontes que se depositaron en épocas diferentes. Por lo tanto, los suelos se formaron en los últimos 200 000 a 100 000 años, a partir de un sustrato previamente sometido a procesos de intemperismo, erosión, transporte y deposición. Dichos efectos han continuado y hoy se encuentran suelos ácidos, muy lixiviados, de muy baja CIC y SB% (Jordan, 1982; Fölster, 1986; Franco, 1988; Dezzeo & Fölster, 1994; Fölster, Dezzeo & Priess, 2001).
En varios lugares de la Amazonía y del Escudo Guayanés se ha señalado que la cantidad de nutrientes, en el suelo mineral, no es determinante para generar una diferenciación en los gradientes de la vegetación. La nutrición de las plantas depende estrictamente del ciclo de nutrientes en el ecosistema y la exuberancia de algunos bosques se sostiene por una fertilidad contenida en la biomasa (Mackensen, Tillery-Stevens, Klinge & Fölster, 2000; Dezzeo, Chacón, Sanoja & Picón, 2004; Durán, 2011). El ciclo se mantiene porque actúan mecanismos como una densa capa superficial de raíces, la absorción directa de nutrientes a través de las micorrizas, la retranslocación de nutrientes antes de la abscisión de las hojas y las adaptaciones estructurales en el dosel y la hojarasca, orientadas a reducir las pérdidas por lixiviación (Herrera, Jordan, Klinge & Medina, 1978; Fuentes & Madero, 1996; Herrera, 2000). Por su parte, Schargel & Marvaez (2009) estudiaron suelos de lomeríos y peniplanicies en el Estado Amazonas-Venezuela, coinciden en que son ácidos, tienen bajos contenidos de bases intercambiables y los principales caracteres que generan diferencias entre ellos son el drenaje, la textura, el contenido y distribución de materia orgánica, la presencia de fragmentos gruesos y la profundidad hasta la roca.
El objetivo del presente trabajo fue hacer la caracterización de los parámetros físicos y químicos de los suelos, establecer algunas interpretaciones sobre su origen, en diferentes comunidades forestales de la zona central de la Reserva Forestal Imataca, y determinar las relaciones que puedan existir entre los componentes edáficos y las especies vegetales que allí se encuentran.
Materiales y Métodos
Sitio de estudio: La Reserva Forestal Imataca (RFI) es un área con régimen de administración especial que abarca 3 800 000ha al este de Venezuela. Los sectores de trabajo están ubicados en sitios no intervenidos del Área de Reserva Biológica (ARB) y Compartimiento 10 (C10), de la Unidad C4 de la RFI, entre las coordenadas 07°23’00” - 07°30’30” N - 60°50’00” - 60°55’30” W. La temperatura media es 26°C y la precipitación anual es 1 700mm (MARN-UCV, 2003); el tipo bioclimático es Tropical Pluviestacional, Infratropical Superior, Subhúmedo Inferior (Rivas-Martínez & Rivas- Sáenz, 2006). La fisiografía corresponde a una penillanura entre ligera y medianamente ondulada, donde las lomas poseen desniveles entre 15 y 30m. Según Franco (1988), en posición convexa se presentan suelos desarrollados a partir de sedimentos coluviales, de espesor entre 50 y 150cm, que sepultan el suelo originado in situ; dichos sedimentos se han depositado en dos o tres fases de edad diferente; en la superficie la textura es francosa a gruesa y en los estratos inferiores tiende a ser arcillosa; químicamente son suelos muy pobres, muy ácidos, con baja SB% y CIC. En posición cóncava se desarrollan suelos en las bases de las laderas que reciben flujos superficiales y subsuperficiales; generalmente poseen un estrato coluvio-aluvial de 40-80cm de espesor, franco a franco arcillo arenoso, que yace sobre un material desarrollado in situ de textura más fina; se repite la deficiencia de nutrientes, lo cual aunado al mal drenaje determina la existencia de un bosque bajo a medio. En los valles existen depósitos aluviales y coluvio-aluviales de mediano transporte, de textura gruesa, espesores superiores a 1m y yacentes sobre un material fino desarrollado in situ; la textura fina y la topografía plana (1-2%) generan una dinámica del agua y de los nutrientes típica de un seudogley; también son químicamente pobres. La vegetación de la Unidad C4 se caracteriza por presentar una formación boscosa continua (cobertura mayor de 50%), siempreverde, pluriestratificada y cuyo dosel posee una altura mayor a 15m (Aserradero Hermanos Hernández, 1992). Desde el punto de vista fitogeográfico Berry, Huber & Holst (1995) la identifican como la Provincia Guayana Oriental en la Región Guayana, mientras que Rivas- Martínez, Navarro, Penas & Costa (2011) la clasifican como Provincia Guayanense de la Región Guayana-Orinoquense. En el trabajo de Lozada, Guevara, Hernández, Soriano & Costa (2011a) se ofrecen mayores detalles sobre la vegetación y el total de especies encontradas en la zona evaluada. Considerando el aspecto fitosociológico, en toda la región existe una gran unidad de vegetación dominada por los árboles Pentaclethra macroloba (Willd.) Kuntze. y Carapa guianensis Aubl. (Lozada, Guevara, Soriano & Costa, 2011b).
Diseño de la investigación y procesamiento: En cada una de las áreas seleccionadas (ARB y C10) se trazó una pica de interpretación ecológica a manera de transectas para evaluar la variabilidad geomorfológica, edáfica y vegetal. Se realizó un levantamiento topográfico y se identificaron diferentes comunidades vegetales, de acuerdo a la posición fisiográfica, la altura y la cobertura del bosque. Cada comunidad representa un sector de trabajo y en cada uno de ellos se establecieron tres parcelas para el levantamiento ecológico. Se utilizaron parcelas de 100x100m (1ha) y, dentro de cada una de ellas, cuatro sub-parcelas de sotobosque (100m2c/u) para el inventario de todas las formas de vida de espermatófitas (Fig. 1). En cada parcela se midieron todos los árboles, palmas y lianas con diámetro mayor o igual a 10cm dap (diámetro a la altura del pecho, es decir 1.3m de altura). En las parcelas de sotobosque (identificadas con las letras a, b, c y d, en la Fig. 1) se evaluaron los individuos inferiores a 10cm dap y mayores a 20cm de altura; esto permite considerar individuos con mayor probabilidad de supervivencia, evitando el efecto de la alta mortalidad que ocurre en sitios inundables. Para cada especie, se calculó el IVI (Índice de Valor de Importancia; Curtis & McIntosh, 1951) y el IIA (Índice de Importancia Ampliado; Lozada et al., 2011b). En cada comunidad vegetal se abrió un hoyo (1x1.5x2m) y en cada sub-parcela de sotobosque se hizo un barreno (hasta 1.2m de profundidad) para evaluar el suelo. En el campo se identificó cada horizonte y se evaluó la profundidad y el color (tanto en hoyos como en barrenos). Se tomaron muestras de cada horizonte que fueron secadas al aire y se trituraron, para luego ser pasadas por un tamiz de 2mm con el objeto de separar el esqueleto grueso. Posteriormente, se ejecutaron los siguientes análisis y métodos (Klute, 1986; Sparks et al., 1996): determinación de partículas por tamaño (Bouyoucos); pH (determinación en agua, relación 1:1, método potenciométrico); materia orgánica (MO %, Walkley y Black); nitrógeno total (NT %, Micro - Kjel-dahl); carbono orgánico (Walkley y Black); fósforo (P, método colorimétrico con Vanadato-Molibdato); para el sodio (Na), potasio (K), calcio (Ca), magnesio (Mg) y hierro (Fe) se empleó el espectrofotómetro de absorción atómica, con solución extractora Carolina del Norte; aluminio intercambiable (Al, mediante Cloruro de Potasio). La interpretación de los resultados de suelos se realizó siguiendo a Gilabert, López & Pérez (1990), Kass (1996) y Fernández et al. (2006). Para establecer las interrelaciones entre el suelo y la vegetación se utilizó el programa PC-ORD (McCune & Mefford, 1999) y se aplicaron los métodos Análisis de Correspondencia Linealizado-ACL y Análisis Canónico de Correspondencia-ACC. El Análisis de Correspondencia-AC es un método de análisis indirecto de gradiente que permite extraer los ejes de mayor variación de una matriz, pero la dispersión de las variables a lo largo de esos ejes debe ser máxima, lo que equivale a hacer máxima la correlación canónica entre ambos grupos de variables; las coordenadas que se obtienen pueden considerarse como una estimación del óptimo de la distribución (Gaussiana) de las especies a lo largo de los ejes de variación, es decir la cima de una campana. Sin embargo, en el AC se impone que los ejes sean ortogonales y en consecuencia la nube de puntos presenta una forma arqueada o de herradura; eso se conoce como efecto “Guttman” y dio origen al ACL, donde la nube se corta en segmentos y después de estandarizar cada segmento a media cero y varianza uno, se alinea con los otros segmentos, lo que produce una dilatación de la nube de puntos en la dirección del gradiente que en teoría sea más importante. El ACC es un método de análisis directo de gradiente, ya que detecta patrones de variación en la composición de las comunidades que son explicados por variables ambientales; la construcción del primer eje de ordenamiento implica el ajuste de una distribución simétrica (generalmente gaussiana) a la ubicación de cada especie en el gradiente y con el segundo eje se ajusta una superficie de respuesta gaussiana bivariada para cada especie (Fariñas, 1996).
Resultados
La apertura e interpretación de las transectas indica que se evaluaron posiciones geomorfológicas de cimas (con elevaciones hasta de 30m), laderas y valles. Después de realizada la interpretación ecológica, se identificaron las siguientes comunidades vegetales:
Bosque de valle 1 (bv1): Es un valle estrecho (200m), con un curso de agua conspicuo y con un bosque medio (dosel entre 15 y 25m), denso, siempreverde, dominado por la especie Mora excelsa Benth. Esta especie tiene su óptimo en este tipo de valles y en la parte baja de algunas colinas (con pendientes muy suaves), luego va disminuyendo hacia las partes más elevadas. La dominancia de M. excelsa es notable, a ello contribuye el extraordinario porte de sus árboles (algunos llegan a 35m de altura), su abundancia y alta regeneración; prevalece desde el sotobosque hasta el dosel. Carapa guianensis Aubl. y Pterocarpus officinalis Jacq. comparten el dosel con M. excelsa. En los estratos intermedios las especies más importantes son Brownea coccinea Jacq. e Inga umbellifera (Vahl) DC., que presentan árboles de porte mediano. En esta comunidad es muy resaltante la homogeneidad del sotobosque; probablemente no hay condiciones muy favorables para el establecimiento de otras especies, debido a la abundantísima regeneración de M. excelsa y a la gruesa capa de hojarasca de esta especie, que tal vez impide que otras semillas lleguen al suelo y puedan germinar. Pero, existe una considerable cantidad de individuos de Adiantum petiolatum Desv.; este pequeño helecho también se presenta en otras comunidades, pero con baja abundancia; por lo tanto, parece estar muy bien adaptado a las condiciones particulares de este sector.
Bosque de valle 2 (bv2): Es un valle amplio (400m), sin un curso de agua bien definido, pantanoso (aun en época seca), con un bosque medio (dosel de 15 a 25m de altura), denso, siempreverde, dominado por las especies Catostemma commune Sandwith y Pterocarpus officinalis Jacq., las cuales poseen árboles de gran tamaño, se encuentran en todos los estratos y poseen abundante regeneración. En el dosel están acompañadas frecuentemente por Carapa guianensis Aubl. y Lecythis chartacea O. Berg. Los estratos intermedios e inferiores son bastante heterogéneos, pero destaca la presencia de Euterpe oleracea Mart.; esta palma es frecuente en toda el área de estudio, pero tiene su óptimo en estos sectores de valle. En el sotobosque es muy resaltante la presencia de la hierba Calathea sp. G. Mey.; además de tener muy alta abundancia, posee una gran cobertura que debe representar una fuerte competencia para el establecimiento de la regeneración de otras especies.
Bosque medio de cima (bmc), Bosque medio de ladera (bml) y Bosque bajo de ladera (bbl): De acuerdo a la posición fisiográfica, en el campo se consideró conveniente separar estos sectores. Pero los resultados demuestran que, desde el punto de vista florístico, todos pertenecen a una comunidad donde la especie dominante es Alexa imperatricis (R.H. Schomb.) Baill. La fisiografía corresponde a penillanuras suave y medianamente onduladas donde las pendientes máximas alcanzan a 10%. Son bosques siempreverdes, bajos (dosel inferior a 15m de altura) y medios (dosel entre 15 y 25m de altura). Además de A. imperatricis en el dosel también son muy importantes Protium neglectum Swart, P. decandrum (Aubl.) Marchand, Eschweilera decolorans Sandwith y E. parviflora (Aubl.) Miers. El estrato bajo (entre 7 y 12m) está dominado por árboles pequeños de Paypayrola longifolia Tul., Mabea piriri Aubl. y Duguetia pycnastera Sandwith.
En el cuadro 1 se presentan los resultados de las pruebas realizadas a las muestras de suelos, de los hoyos evaluados, y a continuación se detallan sus características y variabilidad. El patrón general del color, en los suelos de las colinas, es un marrón oscuro en el horizonte superficial (0-10cm), luego marrón o pardo (10-80cm) y más abajo tonos rojizos (80-180cm). En el valle 1 se presenta el color marrón en el sector superior (0-55cm) y luego gris claro (55-130cm). En el valle 2 hay colores grisáceos en todo el perfil, muy oscuro en la superficie (0-30cm) y más claros en los horizontes subyacentes.
Los suelos de las cimas y las laderas en general poseen texturas muy finas, pero el contenido de arcillas aumenta con la profundidad dentro del perfil. En el valle 1 la textura es franco arcillosa; este valle es estrecho, allí los drenajes forman cauces bien definidos, de unos 6m de ancho y con paredes laterales de hasta 2m de altura. En el valle 2 el suelo es franco arenoso, con arenas finas; este valle es amplio, no hay un cauce definido; los levantamientos se realizaron en la época más seca y aun así se observaron frecuentes encharcamientos; también hay micro-suros, que es un microrelieve con pequeñas elevaciones del suelo y canales.
La mayoría de las muestras analizadas son extremadamente ácidas (pH<4.5) y los cationes ácidos están en elevadas concentraciones. En general la relación Ca/Al es inferior a 1, pero en las colinas hay una cierta tendencia a que este parámetro disminuya en los horizontes más profundos; sin embargo, el bv2 y el bbl tienen los valores más altos de relación Ca/Al.
En general, el contenido de fósforo es bajo (6-12ppm) a muy bajo (<5ppm) y hay una clara tendencia a disminuir en los horizontes más profundos. Las cantidades de nitrógeno, carbono orgánico y materia orgánica disminuyen con la profundidad dentro del perfil. En general el contenido de N es bajo (0.05-0.20%) a muy bajo (<0.05%). Los valores de C se consideran muy bajos a medios. La relación C/N tiene los valores más altos en el bv2, muy elevados en posición de cima y de ladera y los más bajos en el bv1. En general, las concentraciones de los cationes básicos intercambiables son bajas; sin embargo, debe resaltarse que el valle 2 (bv2) y el bosque bajo de ladera (bbl) presentan valores más elevados de Ca. El hierro tiene altas concentraciones en todos los horizontes analizados y una cierta tendencia a disminuir en los estratos más profundos.
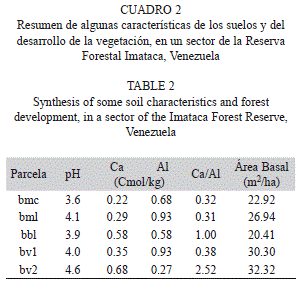
Como resumen podría señalarse que en general el pH es muy ácido, pero en el bosque de valle 2 (bv2) el calcio (Ca) alcanza la mayor concentración y el aluminio (Al) la menor. Con ello, la relación Ca/Al es bastante favorable (2.52) y ello se refleja en que esta comunidad presenta el mejor desarrollo, expresado con un área basal de 32.3m2/ha (Cuadro 2).
El ordenamiento de las comunidades se realizó mediante un Análisis de Correspondencia Linealizado (ACL), utilizando la composición florística. La figura 2 corresponde a un ACL ejecutado para las 60 parcelas de sotobos-que y considerando las 196 especies registradas en dichos levantamientos. Se utilizó el Índice de Sørensen, como medida de similitud, y se obtuvo un 75% en la varianza acumulada explicada por los ejes 1 y 2. Las parcelas del valle 2 (bv2) tienden a estar agrupadas en la parte superior izquierda del gráfico, las del valle 1 (bv1) a la derecha y todas las de cima y ladera (bmc, bml y bbl) están juntas en el sector inferior izquierdo.
Posteriormente se realizó un Análisis Canónico de Correspondencia (ACC), utilizando de manera conjunta la composición florística y los resultados de los análisis de suelos, para obtener un ordenamiento de las parcelas y de las especies. Se seleccionaron las 30 especies y las dos variables edáficas con mayor peso en la construcción de los ejes, se utilizó el Índice de Sørensen como medida de distancia y se obtuvo un ACC con un 79% de varianza acumulada explicada por los ejes 1 y 2. El ordenamiento de las parcelas (Fig. 3) muestra sus relaciones florísticas y tendencias generales sobre las características edáficas de cada sector. El valle 1 posee altos niveles de limo (L), las parcelas de las colinas (bmc, bml y bbl) están en sitios con altos contenidos de arcilla (A) y el valle 2 se presenta en posiciones opuestas a los dos grupos anteriores.
El ordenamiento de las especies de acuerdo a los parámetros edáficos muestra el siguiente arreglo (se indican los códigos que identifican a las especies en la Fig. 4): en las áreas con mayor cantidad de arcilla (A) se encuentran las especies Mabea piriri Aubl. (Mabpir), Eschweilera grata Sandwith (Escgra), E. decolorans Sandwith (Escdec), Cheiloclinium hippocrateoides (Peyr.) A.C. Sm. (Chehip), Inga ingoides (Rich.) Willd. (Inging), A. imperatricis (Alexim), Tetragastris panamensis (Engl.) Kuntze (Tetpan), Paypayrola longifolia Tul. (Paylon), Bauhinia scalasimiae Sandw. (Bausca), Brosimum alicastrum Sw. (Broali), Duguetia pycnastera Sandwith. (Dugpyc), Clavija lancifolia Desf. (Clalan), Peltogyne pubescens Benth. (Pelpub), Pentaclethra macroloba (Willd.) Kuntze. (Penmac), Faramea torquata Müll.Arg. (Fartor), Protium neglectum Swart (Proneg), Bactris maraja Mart. (Bacmar), Machaerium quinata (Aubl.) Sandwith (Macqui) y Rinorea riana Kuntze (Rinria). Las parcelas con altos valores de limo (L) están dominadas por M. excelsa (Morexc), Adiantum petiolatum Desv. (Adipet) y Petrea aspera Turcz. (Petasp). En los suelos con menores contenidos de arcilla (A) y limo (L) se encontraron Unonopsis glaucopetala R. E. Fr. (Unogla), Brownea latifolia Jacq. (Brolat), Ischnosiphon arouma (Aubl.) Körn. (Ischar), C. guianensis (Cargui), Protium decandrum (Aubl.) Marchand (Prodec), Calathea sp. G. Mey (Caltsp), P. officinalis (Pteoff) y C. commune (Catcom).
Discusión
En líneas generales puede establecerse que los resultados de este trabajo son semejantes a otros obtenidos en ecosistemas del Escudo Guayanés y de Amazonas, que serán señalados a continuación. Los colores oscuros de los sustratos están asociados a la presencia de materia orgánica y los colores grises a procesos de gleización; lo último ocurre en terrenos con largos períodos de inundación o de alto nivel freático donde se han perdido los óxidos de Fe (Franco, 1988).
La alta precipitación y la fisiografía generan un intenso lavado vertical de las arcillas, que se hacen más abundantes en los horizontes profundos de las cimas y colinas; Lugo (2006), Schargel & Marvaez (2009) encontraron resultados similares en suelos con posiciones fisiográficas equivalentes. La evaluación del régimen de inundación está fuera de los alcances de este trabajo; sin embargo, se estima que en el valle 1 el agua se mantiene en el cauce la mayor parte del tiempo y si ocurren inundaciones son temporales y de poca profundidad; adicionalmente, las colinas adyacentes no deben aportar altas cantidades de arcilla, porque allí el movimiento de estas partículas es vertical dentro del perfil; es probable que las pequeñas inundaciones contribuyan a lavar parte del material fino del valle 1 y la textura tiende a ser limosa. La textura encontrada en el valle 2 es favorable para el drenaje, por lo tanto debe haber un estrato arcilloso a mayor profundidad que produce el encharcamiento en época seca; en época de lluvias se presume que ocurre una prolongada inundación, con agua que se desplaza horizontalmente a una velocidad que permite el lavado de arcillas y limos. En cuanto a los micro-suros del valle 2, tal vez se deben a una erosión reticular y/o la actividad de las lombrices (Schargel, 2005). La Relación Limo/Arcilla confirma lo indicado por Costa, M. Rosas, De Souza, F. Rosas & De Almeida (2012), ya que los mayores valores fueron encontrados en las áreas de la topo-secuencia que reciben sedimentos de origen aluvial (bv1 y bv2) y que tienen el menor grado de pedogénesis.
El pH bajo es la consecuencia del intenso lavado de las bases (Na, K, Ca y Mg) y el aumento de H y Al, generado por una precipitación intensa que ha actuado durante millones de años; estas características han sido ampliamente difundidas para esta región. Pero el lavado es más intenso en los horizontes superficiales, con ello existe una tendencia a que el pH aumente con la profundidad y esto coincide con resultados de Schargel & Marvaez (2009). El aluminio (Al) tiene efectos tóxicos en las plantas; la primera consecuencia es un daño en la membrana plasmática y posteriormente se afecta la elongación celular (Fölster & Dezzeo, 1994; Gunsé, Garzón & Barceló, 2003). Las plantas pueden enfrentar este problema mediante la producción de exudados que favorecen a la rizósfera (Dakora & Phillips, 2002) y la asociación con hongos resistentes para formar micorrizas que auspician la absorción de nutrientes (Cardoso & Kuyper, 2006). También se ha señalado que numerosas especies de la familia Vochysiaceae, muy importante en el área estudiada (Lozada et al., 2011a), presentan acumulación de Al en los cloroplastos, el xilema o la epidermis, sin mostrar daños aparentes debido a la toxicidad (Miranda de Andrade et al., 2011). Otro elemento que genera toxicidad es el hierro (Fe), sus elevadas concentraciones en los horizontes superficiales quizá se deben a la aireación en estos estratos, eso favorece los procesos de oxidación y con ello este elemento se libera y pasa a la solución del suelo. Para el arroz, los niveles tóxicos ya se han reportado en suelos ácidos arcillosos y suelos de valle que reciben flujos de las pendientes adyacentes; el Fe++ llega a las hojas, causa una producción elevada de radicales que generan daños irreversibles en los componentes celulares estructurales y conducen a una acumulación de polifenoles oxidados (Thompson & Ledge, 1987; Yamauchi & Peng, 1993; Becker & Asch, 2005).
Con respecto a las bajas concentraciones de fósforo (P), Jordan (1982) estima que la meteorización de la roca no contribuye sustancialmente con las reservas de este elemento; el mismo proviene de la atmósfera y, con pequeñas fluctuaciones anuales, los ingresos y las salidas están balanceados en ecosistemas estables. En todo caso, el fósforo pudiera no estar disponible para las plantas debido a su inmovilización por Al y Fe. El fósforo está principalmente almacenado en la biomasa viva; al descomponerse la materia orgánica, el fósforo es inmediatamente re-asimilado por los organismos edáficos y prácticamente no llega a la solución del suelo. Este es el efecto de la eficiencia en el ciclaje de nutrientes; si ocurre una destrucción del ecosistema y se altera ese ciclo, el fósforo es uno de los elementos limitantes para el desarrollo de la vegetación (Herrera et al., 1978; García-Montiel et al., 2000; Chacón & Dezzeo, 2004). Los contenidos de fósforo encontrados en este trabajo son ligeramente superiores a los reportados por Dezzeo et al. (2004) y Lugo (2006), pero están dentro de la escala de valores señalada por Costa et al. (2012).
El nitrógeno (N) y carbono orgánico (C) son elementos vinculados a la materia orgánica, por ello su abundancia disminuye con la profundidad (Lugo, 2006; Schargel & Marvaez, 2009). En todo caso, el contenido de N es bajo (0.05-0.20%) a muy bajo (<0.05%) en casi todos los horizontes y es similar a lo reportado para distintos ecosistemas de Amazonas y de Gran Sabana. Los valores de C se consideran muy bajos a medios, pero son inferiores que los de Gran Sabana y superiores a los de Amazonas (Mackensen et al., 2000; Fölster et al., 2001; Dezzeo et al., 2004). Para el gradiente analizado, se considera que la acidez en las colinas y la condición de anaerobiosis del valle 2 (mencionadas con anterioridad) producen una deficiente tasa de descomposición de hojarasca, que genera un aumento de la materia orgánica y del carbono orgánico en esas posiciones, lo cual también fue reportado en ecosistemas amazónicos (Costa et al., 2012). De igual forma, la relación C/N es una medida de la tasa de descomposición de la materia orgánica (MO); si este valor es alto existe una baja mine-ralización de MO. Esta situación se presenta en los suelos de cima y ladera, ya que el efecto de la acidez en suelos oligotróficos puede ser perjudicial para los organismos descomponedores (Dezzeo & Fölster, 1994). De manera similar, el valle 2 presenta los valores más elevados de C/N; a pesar de tener una textura ideal, la inundación en estos terrenos genera una pobre aireación que disminuye la actividad microbiana; Lugo (2006) encontró valores similares en vegas inundables de la Reserva Forestal Sipapo. En el valle 1 existen valores bajos (7-9) a medios (10-12) para C/N; esto es el reflejo de una condición favorable para la descomposición de la materia orgánica: suelos francos y con inundaciones muy temporales.
De los cationes básicos intercambiables conviene destacar al calcio (Ca), sus niveles son bajos en todas las muestras. Se han reportado resultados similares en otros sectores del Escudo Guayanés (Cuevas & Medina, 1983; Fölster & Huber, 1984; Fölster et al., 2001). Diversos estudios han determinado que, para el Ca, se considera un bajo nivel las concentraciones inferiores a 4Cmol/kg (Gilabert et al., 1990; Kass, 1996; Fernández et al., 2006; Lugo, 2006; Schargel & Marvaez, 2009). Pero en el bv2 se presentan concentraciones más elevadas de este elemento; se estima que las especies C. commune y P. officinalis (dominantes en esa comunidad) podrían absorber parte del Ca disponible en el perfil, incorporarlo a sus tejidos vegetales y a través de la hojarasca depositarlo en la superficie. Esta suposición sobre el “bombeo de Ca” ya se ha verificado en especies como Fagus sylvatica L. (Berger, Swoboda, Prohaska & Glatzel, 2006) y Tectona grandis L.f. (Boley, Drew & Andrus, 2009). De acuerdo a un estudio realizado en Nigeria, Pterocarpus mildbraedii Harms fue reportada como una de las especies con más alto contenido de Ca en las hojas (hasta 56.1mg/100mg; según Dike, 2010). Por otra parte, el mapa de Schruben et al. (1997) muestra unos pequeños diques de diabasa, en las nacientes de los cauces que drenan hacia las parcelas bv2, y este tipo de roca puede ser una fuente importante de Ca (Acosta, Martínez-Martínez, Faza & Arocena, 2011; H. Castellanos, com. pers., 23 de noviembre, 2011); aunque el afloramiento de la diabasa es lejano a las parcelas, pudiera ocurrir que este tipo de roca esté presente en estratos profundos del suelo bajo el sector analizado. Así mismo, se ha interpretado que el bbl sufrió una perturbación que generó la caída de una gran cantidad de árboles (Lozada, 2008); de acuerdo a la teoría del “pulso de nutrientes” (Vitousek & Denslow, 1986), las cantidades superiores de Ca en este lugar pudieron ser aportadas por esta biomasa; se considera que se requieren estudios más detallados para comprobar esta teoría en la zona evaluada. En todo caso, el Ca neutraliza la acción negativa del Al; por ello la relación Ca/Al es una medida del grado de toxicidad por Al; si Ca/Al es menor que 1 ocurren daños al sistema radical (Cronan & Grigal, 1995; Fölster et al., 2001). Aunque no fue medido, se observó en el campo una acumulación de raíces en los estratos superficiales, tal vez debido a la disminución de la relación Ca/Al con la profundidad; esto coincide con reportes anteriores del Escudo Guayanés señalados por Fölster (1986), Dezzeo et al. (2004) y Durán (2011).
En síntesis, el bv2 tiene los mayores valores de relación Ca/Al; evidentemente eso está asociado a niveles ligeramente superiores de Ca y constituye una condición favorable que se refleja en el mejor desarrollo de la vegetación; por lo tanto, este sector muestra la mayor área basal. Resultados similares han sido reportados por Schaberg, Tilley, Hawley, DeHayes & Bailey (2006) y Baribault, Kobe & Rothstein (2010). Conviene destacar que el bosque de valle 1 (bv1) muestra un área basal elevada (aunque inferior al bv2), está dominado por M. excelsa y Ter Steege (1994) ha demostrado que esta especie tiene una buena adaptación al exceso de humedad. Pero, se requieren estudios particulares para determinar los mecanismos que permiten el excelente desarrollo de esta especie, en condiciones de alta toxicidad por aluminio.
Con respecto al ordenamiento de las parcelas, se considera que es más útil la información del sotobosque porque es allí donde hay más diversidad (Gentry & Dodson, 1987). El ACL genera un arreglo bastante lógico; su 75% en la varianza acumulada explicada por los ejes 1 y 2 se considera adecuado si se compara con los valores de 30-40% obtenidos por Suárez (1991, en Caparo) y Lugo (2006, en la Orinoquia Venezolana). La agrupación de las parcelas de cima y ladera en el sector inferior izquierdo confirma que no hay diferencias florísticas relevantes entre estos levantamientos. El ACC es otro método multivariante que ratifica las relaciones florísticas entre las parcelas y las tendencias de cada especie en cuanto a sus preferencias edáficas.
En cuanto a la posibilidad de autocorrelación, Legendre (1993) señala que esto ocurre cuando al menos parcialmente se pueden predecir los valores de una localidad por los valores de los puntos vecinos. Se considera que en general esta situación se presentaría si la distancia entre sub-parcelas fuera muy pequeña para hacer levantamientos válidos en sotobosque; en este trabajo, se usó de manera sistemática una distancia de 30m y se considera que eso es apropiado para registrar la variabilidad que existe dentro de cada parcela de 1ha. Los resultados confirman los argumentos anteriores; tanto el análisis indirecto como el análisis directo de gradiente muestran muy separadas a subparcelas de sotobosque que están dentro de la misma parcela de 1ha; este es el caso de bv11c y bv11d (en el ACL) y bv21a y bv21b (en el ACC). Sin embargo, se encontró que la variable arena (a) obtuvo un alto grado de correlación negativa con la variable arcilla (A) y se omitió la primera del análisis multivariante. Pero, desde el punto de vista ecológico, esta variable no debería excluirse; los resultados de los análisis de las muestras de suelo obtenidas en las calicatas demuestran que los mayores contenidos de arena se presentan en el valle 2 y esas condiciones son muy favorables para las especies C. commune, P. officinalis, P. decandrum y Calathea sp. En todo caso, la correlación entre arena y arcilla no puede atribuirse a la técnica de muestreo; Legendre (1993) indica que en la naturaleza existen, en diferentes escalas, procesos físicos que generan la aparición de gradientes o de mosaicos; puede que esta estructura espacial no sea favorable para los supuestos de la estadística, pero permite la funcionalidad de los ecosistemas. Algunos estudios desarrollados en Brasil por Laurance et al. (1999) y Baraloto et al. (2011) también reportan la existencia de correlación negativa entre los contenidos de arcilla y de arena en los suelos.
Como conclusión, se encontró una adecuada relación entre el suelo y la vegetación ya que se logró la identificación de tres comunidades en tres condiciones edáficas bien diferenciadas: un bosque dominado por Mora excelsa localizado en un valle estrecho con alto contenido de limo, un bosque de pantano dominado por Catostemma commune ubicado en un valle amplio arenoso y un bosque dominado por Alexa imperatricis que se encuentra en colinas arcillosas. La mayoría de los suelos tienen un pH entre 3.1 y 4.5; los nutrientes están en muy bajas concentraciones (N: 0-0.2%; P: 0-14ppm; K: 0-0.3Cmol/kg), como consecuencia de un largo proceso de lixiviación, en un sustrato que previamente se había sometido a erosión, transporte y deposición; el Al está en concentraciones tóxicas. Estos resultados coinciden con otras investigaciones realizadas en esta región, pero en el presente trabajo se comprobó que una relación Ca/Al mayor a 1 significa una neutralización del efecto tóxico del Al. En esa condición se detectó que la comunidad con mejor desarrollo es el bosque dominado por C. commune, que posee un área basal de 32.3 m2/ ha; se interpreta que las altas concentraciones de Ca en este sector pudieran venir de diques de diabasa que existen en los alrededores. En general, los suelos evaluados no son aptos para actividades agropecuarias; la eliminación del bosque produciría una pérdida sustancial de los nutrientes y la interrupción de su ciclo, lo cual podría ser irreversible (Mackensen et al., 2000; Hernández et al., 2005). Por lo tanto, el mejor uso que se puede dar a estos territorios es mantenerlos como áreas de protección de la biodiversidad (Parques Nacionales, Monumentos Naturales) o regulados por figuras que permitan un aprovechamiento muy ligero (Reservas Forestales) de los diversos productos que se pueden extraer de los bosques. Parece obvio que el mantenimiento de una alta cobertura boscosa es un elemento imprescindible para la conservación de estas comunidades.
Agradecimientos
Al personal gerencial, técnico y obrero de las empresas Aserradero Hermanos Hernández y COMAFOR, por el apoyo logístico prestado durante la realización de los trabajos de campo.
REFERENCIAS
Acosta, J., Martínez-Martínez, S., Faza, A. & Arocena, J. (2011). Accumulations of major and trace elements in particle size fractions of soils on eight different parent materials. Geoderma, 161, 30-42. [ Links ]
Aserradero Hermanos Hernández. (1992). Plan de Ordenación y Manejo Forestal. Unidad C-4 de la Reserva Forestal Imataca. Upata: Author. [ Links ]
Baraloto, C., Rabaud, S., Molto, Q., Blanc, L., Fortunel, C., Hérault, B., Dávila, N., Mesones, I., Ríos, M., Valderrama, E. & Fine, P. (2011). Disentangling stand and environmental correlates of aboveground biomass in Amazonian forests. Global Change Biology, 17, 2677-2688. [ Links ]
Baribault, T. W., Kobe, R. K. & Rothstein, D. E. (2010). Soil calcium, nitrogen, and water are correlated with aboveground net primary production in northern hardwood forests. Forest Ecology and Management, 260, 723-733. [ Links ]
Becker, M. & Asch, F. (2005). Iron toxicity in rice - conditions and management concepts. Journal of Plant Nutrition and Soil Science, 168, 558-573. [ Links ]
Berger, T., Swoboda, S., Prohaska, T. & Glatzel, G. (2006). The role of calcium uptake from deep soils for spruce (Picea abies) and beech (Fagus sylvatica). Forest Ecology and Management, 229, 234-246. [ Links ]
Berry, P. E., Huber, O. & Holst, B. K. (1995) Floristic analysis and phytogeography. In P. E. Berry, B. K. Holst & K. Yatskievych (Eds.), Flora of the Venezuelan Guayana (Vol. 1, pp. 161-191). St Louis, MO: Missouri Botanical Garden Press. [ Links ]
Biondi, E. (2011). Phytosociology today: methodological and conceptual evolution. Plant Biosystems, 145, 19-29. [ Links ]
Braun-Blanquet, J. (1979). Fitosociología. Madrid: H. Blume. [ Links ]
Boley, J., Drew, A. & Andrus, R. (2009). Effects of active pasture, teak (Tectona grandis) and mixed native plantations on soil chemistry in Costa Rica. Forest Ecology and Management, 257, 2254-2261. [ Links ]
Cardoso, I. & Kuyper, T. (2006). Mycorrhizas and tropical soil fertility. Agriculture Ecosystems & Environment, 116, 72-84. [ Links ]
Chacón, N. & Dezzeo, N. (2004). Phosphorus fractions and sorption processes in soil samples taken in a forest-savanna sequence of the Gran Sabana in southern Venezuela. Biology and Fertility of Soils, 40, 14-19. [ Links ]
Clements, F. (1916). Plant succession: an analysis of the development of vegetation. Washington, D.C.: Carnegie. [ Links ]
Costa, M., Rosas, M., De Souza, V., Rosas, M. & De Almeida, M. (2012). Relações solo-superfície geo-mórfica em uma topossequência várzea - terra firme na região de Humaitá. Revista Brasileira de Ciência do Solo, 36, 325-336. [ Links ]
Cronan, C. S. & Grigal, D. F. (1995). Use of calcium aluminum ratios as indicators of stress in forest ecosystems. Journal of Environmental Quality, 24, 209-226. [ Links ]
Cruz, P. G., Batalha, M. A., Pivello, V. R. & Meirelles, S. T. (2002). Soil-vegetation relationships in cerrado (Brazilian savanna) and semideciduous forest, South-eastern Brazil. Plant Ecology, 160, 1-16. [ Links ]
Cuevas, E. & Medina, E. (1983). Root production and organic matter decomposition in a tierra firme forest of the upper Rio Negro basin. In W. Böhm, L. Kutschera & E. Lichtenegger (Eds.), International symposium on root ecology and its practical application (pp. 653-666). Irdning: Gumpenstein. [ Links ]
Curtis, J. & McIntosh, R. (1951). An upland forest continuum in the praire-forest border region of Wisconsin. Ecology, 32, 476-496. [ Links ]
Dakora, F. & Phillips, D. (2002). Root exudates as mediators of mineral acquisition in low-nutrient environments. Plant and Soil, 245, 35-47. [ Links ]
Dezzeo, N. & Fölster, H. (1994). Los suelos - Ecología de la altiplanicie de la Gran Sabana. Scientia Guaianae, 4, 45-86. [ Links ]
Dezzeo, N., Chacón, N., Sanoja, E. & Picón, G. (2004). Changes in soil properties and vegetation characteristics along a forest-savanna gradient in southern Venezuela. Forest Ecology and Management, 200, 183-193. [ Links ]
Dike, M. (2010). Proximate, phytochemical and nutrient compositions of some fruits, seeds and leaves of some plant species at Umudike, Nigeria. Journal of Agricultural and Biological Science, 5, 7-16. [ Links ]
Durán, C. (2011). Forest gaps structure and tree regeneration in a montane Guayanan forest, Sierra de Lema, Venezuela (Unpublished doctoral dissertation). Universität Freiburg, Freiburg, Germany. [ Links ]
Fariñas, M. (1996). Análisis de la vegetación y de sus relaciones con el ambiente mediante métodos de ordenamiento. Mérida: Universidad de los Andes. [ Links ]
Fernández, L., Rojas, G., Roldán, T., Ramírez, M., Zegarra, H., Uribe, R., Reyes, R., Flores, D. & Arce, J. (2006). Manual de técnicas de análisis suelos aplicadas a la remediación de sitios contaminados. México DF: Instituto Mexicano del Petróleo, Secretaría de Medio Ambiente y Recursos Naturales, Instituto Nacional de Ecología. [ Links ]
Fölster, H. & Huber, O. (1984). Interrelaciones suelos-vegetación en el área de Galipero, Territorio Federal Amazonas. Caracas: Ministerio del Ambiente. [ Links ]
Fölster, H. (1986). Forest-savanna dynamics and desertification processes in the Gran Sabana. Interciencia, 11, 311-316. [ Links ]
Fölster, H. & Dezzeo, N. (1994). La degradación de la vegetación - Ecología de la altiplanicie de la Gran Sabana. Scientia Guaianae, 4, 145-186. [ Links ]
Fölster, H., Dezzeo, N. & Priess, J. (2001). Soil-vegetation relationship in base-deficient premontane moist forest–savanna mosaics of the Venezuelan Guayana. Geoderma, 104, 95-113. [ Links ]
Franco, W. (1988). Los suelos del Lote Boscoso San Pedro y Reservas Forestales Imataca, Guarapiche y Ticoporo. Mérida: Universidad de Los Andes. [ Links ]
Fuentes, J. & Madero, A. (1996). Suelos - Ecología de la cuenca del Río Caura, Venezuela. Scientia Guaianae, 6, 44-47. [ Links ]
García-Montiel, D., Neill, C., Melillo, J., Thomas, S., Steudler, P. & Cerri, C. (2000). Soil phosphorus transformations following forest clearing for pasture in the Brazilian Amazon. Soil Science Society of America Journal, 64, 1792-1804. [ Links ]
Gentry, A. & Dodson, C. (1987). Contribution of non-trees to species richness of a tropical rain forest. Biotropica, 19(2), 149-156. [ Links ]
Gibbs, A. & Barron, C. (1983). The Guiana Shield reviewed. Episodes, 2, 7-14. [ Links ]
Gilabert, J., López, R. & Pérez, R. (1990). Manual de métodos y procedimientos de referencia. Análisis de suelos para diagnóstico de fertilidad. Maracay: FONAIAP, CENIAP. [ Links ]
Gleason, H. (1917). The individualistic concept of the plant association. Bulletin of the Torrey Botanical Club, 32, 1-20. [ Links ]
Gunsé, B., Garzón, T. & Barceló, J. (2003). Study of aluminum toxicity by means of vital staining profiles in four cultivars of Phaseolus vulgaris L. Journal of Plant Physiology, 160, 1447-1450. [ Links ]
Hernández, L., Mansutti, A., Silva, N., Rosales, J., Castellanos, H., Valero, N., Delgado, L., Tomedes, R. & Rondón, M. (2005). Reserva Forestal El Caura. Ciudad Guayana: Universidad Experimental de Guayana. [ Links ]
Herrera, R., Jordan, C., Klinge, H. & Medina, E. (1978). Amazon ecosystems. Their structure and functioning with particular emphasis on nutrients. Interciencia, 3, 223-232. [ Links ]
Herrera, R. (2000). Algunos aportes del Proyecto Amazonas al conocimiento sobre los suelos del Río Negro y a la biogeoquímica de la región. Scientia Guaianae, 11, 7-13. [ Links ]
Johnston, M. H. (1992). Soil-vegetation relationships in a tabonuco forest community in the Luquillo Mountains of Puerto-Rico. Journal of Tropical Ecology, 8, 253-263. [ Links ]
Jordan, C. (1982). The nutrient balance of an Amazonian rain forest. Ecology, 63, 647-654. [ Links ]
Kass, D. (1996). Fertilidad de suelos. San José: EUNED. [ Links ]
Klute, A. (Ed.). (1986). Methods of soil analysis. Part 1. Physical and mineralogical methods. Madison, WI: American Society of Agronomy & Soil Science Society of America. [ Links ]
Laurance, W. F., Fearnside, P. M., Laurance, S. G., Delamonica, P., Lovejoy, T., Rankin-de Merona, J., Chambers, J. Q. & Gascona, C. (1999). Relationship between soils and Amazon forest biomass: a landscape-scale study. Forest Ecology and Management, 118, 127-138. [ Links ]
Legendre, P. (1993). Spatial autocorrelation: trouble or new paradigm? Ecology, 74, 1659-1673. [ Links ]
Lozada, J. (2008). Sucesión vegetal en bosques aprovechados de la Reserva Forestal Caparo y Reserva Forestal Imataca, Venezuela (Disertación doctoral). Universidad de Valencia, Valencia, España. [ Links ]
Lozada, J., Guevara, J., Hernández, C., Soriano, P. & Costa, M. (2011a). Bosques de la zona central de la Reserva Forestal Imataca, Estado Bolívar, Venezuela. Biollania, 10(edición especial), 47-62. [ Links ]
Lozada, J., Guevara, J., Soriano, P. & Costa, M. (2011b). The organismic and the continuous approaches applied to phytosociological relationships in a lowland neotropical forest, Venezuela. Plant Biosystems, 145, 65-73. [ Links ]
Lugo, L. (2006). La fisiografía, los suelos, la vegetación y su relación con el sistema de agricultura migratoria, en el sector norte de la Reserva Forestal Sipapo, Estado Amazonas, Venezuela (Disertación doctoral). Universidad de Valencia, Valencia, España. [ Links ]
Mackensen, J., Tillery-Stevens, M., Klinge, R. & Fölster, H. (2000) . Site parameters, species composition, phytomass structure and element stores of a terra-firme forest in east-Amazonia, Brazil. Plant Ecology, 151, 101-119. [ Links ]
MARN-UCV. (2003). Bases técnicas para el ordenamiento territorial de la Reserva Forestal Imataca. Caracas: Ministerio del Ambiente y de los Recursos Naturales & Universidad Central de Venezuela. [ Links ]
McCune, B. & Mefford, M. (1999). PC-ORD. Multivariate Analysis of Ecological Data [computer software]. Gleneden Beach, OR: MjM Software. [ Links ]
McIntosh, R. (1967). The continuum concept of vegetation. Botanical Review, 33, 130-187. [ Links ]
Melfi, A., Cerri, C., Fristch, E., Milton, L. & Formoso, L. (1999). Tropical soils: genesis, distribution and degradation of lateritic pedologycal system. In L. Milton, L. Formoso & C. Cerri (Eds.), Workshop on tropical soils (pp. 1-30). Rio de Janeiro: Academia Brasileira de Ciências. [ Links ]
Menéndez, A. (1968). Revisión de la estratigrafía de la Provincia de Pastora según el estudio de la Región de Guasipati, Guayana Venezolana. Boletín de Geología, 9, 309-338. [ Links ]
Miranda de Andrade, L., Gomes, L., Fernandes, G., Velho, L., Cotta, M., Rodrigo, D., Haridasan, M. & Franco, F. (2011). Al -hyperaccumulator Vochysiaceae from the Brazilian Cerrado store aluminum in their chloroplasts without apparent damage. Environmental and Experimental Botany, 70, 37-42. [ Links ]
Montgomery, C. & Hurley, P. (1978). Total-rock U-Pb and Rb-Sr systematics in the Imataca Series, Guayana Shield, Venezuela. Earth and Planetary Science Letters, 39, 281-290. [ Links ]
Rivas-Martínez, S. & Rivas-Sáenz, S. (2006). Worldwide Bioclimatic Classification System. Retrieved from http://www.ucm.es/info/cif/data/indexc.htm [ Links ]
Rivas-Martínez, S., Navarro, G., Penas, A. & Costa, M. (2011). Biogeographic map of South America. A preliminary survey. International Journal of Geobotanical Research, 1, 21-40. [ Links ]
Rull, V. (1991). Contribución a la paleoecología de Pantepui y la Gran Sabana (Guayana Venezolana): clima, biogeografía y ecología. Scientia Guaianae, 2, 1-133. [ Links ]
Schaberg, P. G., Tilley, J. W., Hawley, G. J., DeHayes, D. H. & Bailey, S. W. (2006). Associations of calcium and aluminum with the growth and health of sugar maple trees in Vermont. Forest Ecology and Management, 223, 159-169. [ Links ]
Schargel, R. (2005). Geomorfología y suelos de los llanos venezolanos. In J. Hétier & R. López (Eds.), Tierras llaneras de Venezuela (pp. 57-113). Mérida: IRD, CIDIAT & UNELLEZ. [ Links ]
Schargel, R. & Marvaez, P. (2009). Suelos - Estudio de los suelos y la vegetación (estructura, composición florística y diversidad) en bosques macrotérmicos no-inundables, Estado Amazonas, Venezuela. Biollania, 9, 99-109. [ Links ]
Schruben, P., Wynn, J., Gray, F., Cox, D., Stewart, J. & Brooks, E. (1997). Geology and resource assessment of the Venezuelan Guayana Shield at 1:500 000 scale. Reston, VA: US Geological Survey. [ Links ]
Silva, J. F. & Sarmiento, G. (1976). La composición de las sabanas de Barinas en relación con las unidades edáficas. Acta Científica Venezolana, 27, 68-79. [ Links ]
Sparks, D. L., Page, A. L., Helmke, P. A., Loeppert, R. H., Soltanpour, P. N., Tabatabai, M. A., Johnston, C. T. & Summer, M. E. (Eds.). (1996). Methods of Soil Analysis. Part 3. Chemical Methods. Madison, WI: Soil Science Society of America & American Society of Agronomy. [ Links ]
Suárez, A. (1991). Análisis de la vegetación a través de métodos multivariantes en la Reserva Forestal de Caparo (Disertación de Maestría). Universidad de Los Andes, Mérida, Venezuela. [ Links ]
Ter Steege, H. (1994). Flooding and drought tolerance in seeds and seedlings of two Mora species segregated along a soil hydrological gradient in the tropical rain forest of Guyana. Oecologia, 100, 356-367. [ Links ]
Thompson, J. & Legge, R. (1987). The role of free radicals in senescence and wounding. New Phytologist, 105, 317-344. [ Links ]
Vitousek, P. & Denslow, J. (1986). Nitrogen and phosphorus availability in treefall gaps of a lowland tropical rain-forest. Journal of Ecology, 74, 1167-1178. [ Links ]
Yamauchi, M. & Peng, X. (1993). Ethylene production in rice bronzing leaves induced by ferrous iron. Plant and Soil, 149, 227-234. [ Links ]
Aserradero Hermanos Hernández. (1992). Plan de Ordenación y Manejo Forestal. Unidad C-4 de la Reserva Forestal Imataca. Upata: Author. [ Links ]
Baraloto, C., Rabaud, S., Molto, Q., Blanc, L., Fortunel, C., Hérault, B., Dávila, N., Mesones, I., Ríos, M., Valderrama, E. & Fine, P. (2011). Disentangling stand and environmental correlates of aboveground biomass in Amazonian forests. Global Change Biology, 17, 2677-2688. [ Links ]
Baribault, T. W., Kobe, R. K. & Rothstein, D. E. (2010). Soil calcium, nitrogen, and water are correlated with aboveground net primary production in northern hardwood forests. Forest Ecology and Management, 260, 723-733. [ Links ]
Becker, M. & Asch, F. (2005). Iron toxicity in rice - conditions and management concepts. Journal of Plant Nutrition and Soil Science, 168, 558-573. [ Links ]
Berger, T., Swoboda, S., Prohaska, T. & Glatzel, G. (2006). The role of calcium uptake from deep soils for spruce (Picea abies) and beech (Fagus sylvatica). Forest Ecology and Management, 229, 234-246. [ Links ]
Berry, P. E., Huber, O. & Holst, B. K. (1995) Floristic analysis and phytogeography. In P. E. Berry, B. K. Holst & K. Yatskievych (Eds.), Flora of the Venezuelan Guayana (Vol. 1, pp. 161-191). St Louis, MO: Missouri Botanical Garden Press. [ Links ]
Biondi, E. (2011). Phytosociology today: methodological and conceptual evolution. Plant Biosystems, 145, 19-29. [ Links ]
Braun-Blanquet, J. (1979). Fitosociología. Madrid: H. Blume. [ Links ]
Boley, J., Drew, A. & Andrus, R. (2009). Effects of active pasture, teak (Tectona grandis) and mixed native plantations on soil chemistry in Costa Rica. Forest Ecology and Management, 257, 2254-2261. [ Links ]
Cardoso, I. & Kuyper, T. (2006). Mycorrhizas and tropical soil fertility. Agriculture Ecosystems & Environment, 116, 72-84. [ Links ]
Chacón, N. & Dezzeo, N. (2004). Phosphorus fractions and sorption processes in soil samples taken in a forest-savanna sequence of the Gran Sabana in southern Venezuela. Biology and Fertility of Soils, 40, 14-19. [ Links ]
Clements, F. (1916). Plant succession: an analysis of the development of vegetation. Washington, D.C.: Carnegie. [ Links ]
Costa, M., Rosas, M., De Souza, V., Rosas, M. & De Almeida, M. (2012). Relações solo-superfície geo-mórfica em uma topossequência várzea - terra firme na região de Humaitá. Revista Brasileira de Ciência do Solo, 36, 325-336. [ Links ]
Cronan, C. S. & Grigal, D. F. (1995). Use of calcium aluminum ratios as indicators of stress in forest ecosystems. Journal of Environmental Quality, 24, 209-226. [ Links ]
Cruz, P. G., Batalha, M. A., Pivello, V. R. & Meirelles, S. T. (2002). Soil-vegetation relationships in cerrado (Brazilian savanna) and semideciduous forest, South-eastern Brazil. Plant Ecology, 160, 1-16. [ Links ]
Cuevas, E. & Medina, E. (1983). Root production and organic matter decomposition in a tierra firme forest of the upper Rio Negro basin. In W. Böhm, L. Kutschera & E. Lichtenegger (Eds.), International symposium on root ecology and its practical application (pp. 653-666). Irdning: Gumpenstein. [ Links ]
Curtis, J. & McIntosh, R. (1951). An upland forest continuum in the praire-forest border region of Wisconsin. Ecology, 32, 476-496. [ Links ]
Dakora, F. & Phillips, D. (2002). Root exudates as mediators of mineral acquisition in low-nutrient environments. Plant and Soil, 245, 35-47. [ Links ]
Dezzeo, N. & Fölster, H. (1994). Los suelos - Ecología de la altiplanicie de la Gran Sabana. Scientia Guaianae, 4, 45-86. [ Links ]
Dezzeo, N., Chacón, N., Sanoja, E. & Picón, G. (2004). Changes in soil properties and vegetation characteristics along a forest-savanna gradient in southern Venezuela. Forest Ecology and Management, 200, 183-193. [ Links ]
Dike, M. (2010). Proximate, phytochemical and nutrient compositions of some fruits, seeds and leaves of some plant species at Umudike, Nigeria. Journal of Agricultural and Biological Science, 5, 7-16. [ Links ]
Durán, C. (2011). Forest gaps structure and tree regeneration in a montane Guayanan forest, Sierra de Lema, Venezuela (Unpublished doctoral dissertation). Universität Freiburg, Freiburg, Germany. [ Links ]
Fariñas, M. (1996). Análisis de la vegetación y de sus relaciones con el ambiente mediante métodos de ordenamiento. Mérida: Universidad de los Andes. [ Links ]
Fernández, L., Rojas, G., Roldán, T., Ramírez, M., Zegarra, H., Uribe, R., Reyes, R., Flores, D. & Arce, J. (2006). Manual de técnicas de análisis suelos aplicadas a la remediación de sitios contaminados. México DF: Instituto Mexicano del Petróleo, Secretaría de Medio Ambiente y Recursos Naturales, Instituto Nacional de Ecología. [ Links ]
Fölster, H. & Huber, O. (1984). Interrelaciones suelos-vegetación en el área de Galipero, Territorio Federal Amazonas. Caracas: Ministerio del Ambiente. [ Links ]
Fölster, H. (1986). Forest-savanna dynamics and desertification processes in the Gran Sabana. Interciencia, 11, 311-316. [ Links ]
Fölster, H. & Dezzeo, N. (1994). La degradación de la vegetación - Ecología de la altiplanicie de la Gran Sabana. Scientia Guaianae, 4, 145-186. [ Links ]
Fölster, H., Dezzeo, N. & Priess, J. (2001). Soil-vegetation relationship in base-deficient premontane moist forest–savanna mosaics of the Venezuelan Guayana. Geoderma, 104, 95-113. [ Links ]
Franco, W. (1988). Los suelos del Lote Boscoso San Pedro y Reservas Forestales Imataca, Guarapiche y Ticoporo. Mérida: Universidad de Los Andes. [ Links ]
Fuentes, J. & Madero, A. (1996). Suelos - Ecología de la cuenca del Río Caura, Venezuela. Scientia Guaianae, 6, 44-47. [ Links ]
García-Montiel, D., Neill, C., Melillo, J., Thomas, S., Steudler, P. & Cerri, C. (2000). Soil phosphorus transformations following forest clearing for pasture in the Brazilian Amazon. Soil Science Society of America Journal, 64, 1792-1804. [ Links ]
Gentry, A. & Dodson, C. (1987). Contribution of non-trees to species richness of a tropical rain forest. Biotropica, 19(2), 149-156. [ Links ]
Gibbs, A. & Barron, C. (1983). The Guiana Shield reviewed. Episodes, 2, 7-14. [ Links ]
Gilabert, J., López, R. & Pérez, R. (1990). Manual de métodos y procedimientos de referencia. Análisis de suelos para diagnóstico de fertilidad. Maracay: FONAIAP, CENIAP. [ Links ]
Gleason, H. (1917). The individualistic concept of the plant association. Bulletin of the Torrey Botanical Club, 32, 1-20. [ Links ]
Gunsé, B., Garzón, T. & Barceló, J. (2003). Study of aluminum toxicity by means of vital staining profiles in four cultivars of Phaseolus vulgaris L. Journal of Plant Physiology, 160, 1447-1450. [ Links ]
Hernández, L., Mansutti, A., Silva, N., Rosales, J., Castellanos, H., Valero, N., Delgado, L., Tomedes, R. & Rondón, M. (2005). Reserva Forestal El Caura. Ciudad Guayana: Universidad Experimental de Guayana. [ Links ]
Herrera, R., Jordan, C., Klinge, H. & Medina, E. (1978). Amazon ecosystems. Their structure and functioning with particular emphasis on nutrients. Interciencia, 3, 223-232. [ Links ]
Herrera, R. (2000). Algunos aportes del Proyecto Amazonas al conocimiento sobre los suelos del Río Negro y a la biogeoquímica de la región. Scientia Guaianae, 11, 7-13. [ Links ]
Johnston, M. H. (1992). Soil-vegetation relationships in a tabonuco forest community in the Luquillo Mountains of Puerto-Rico. Journal of Tropical Ecology, 8, 253-263. [ Links ]
Jordan, C. (1982). The nutrient balance of an Amazonian rain forest. Ecology, 63, 647-654. [ Links ]
Kass, D. (1996). Fertilidad de suelos. San José: EUNED. [ Links ]
Klute, A. (Ed.). (1986). Methods of soil analysis. Part 1. Physical and mineralogical methods. Madison, WI: American Society of Agronomy & Soil Science Society of America. [ Links ]
Laurance, W. F., Fearnside, P. M., Laurance, S. G., Delamonica, P., Lovejoy, T., Rankin-de Merona, J., Chambers, J. Q. & Gascona, C. (1999). Relationship between soils and Amazon forest biomass: a landscape-scale study. Forest Ecology and Management, 118, 127-138. [ Links ]
Legendre, P. (1993). Spatial autocorrelation: trouble or new paradigm? Ecology, 74, 1659-1673. [ Links ]
Lozada, J. (2008). Sucesión vegetal en bosques aprovechados de la Reserva Forestal Caparo y Reserva Forestal Imataca, Venezuela (Disertación doctoral). Universidad de Valencia, Valencia, España. [ Links ]
Lozada, J., Guevara, J., Hernández, C., Soriano, P. & Costa, M. (2011a). Bosques de la zona central de la Reserva Forestal Imataca, Estado Bolívar, Venezuela. Biollania, 10(edición especial), 47-62. [ Links ]
Lozada, J., Guevara, J., Soriano, P. & Costa, M. (2011b). The organismic and the continuous approaches applied to phytosociological relationships in a lowland neotropical forest, Venezuela. Plant Biosystems, 145, 65-73. [ Links ]
Lugo, L. (2006). La fisiografía, los suelos, la vegetación y su relación con el sistema de agricultura migratoria, en el sector norte de la Reserva Forestal Sipapo, Estado Amazonas, Venezuela (Disertación doctoral). Universidad de Valencia, Valencia, España. [ Links ]
Mackensen, J., Tillery-Stevens, M., Klinge, R. & Fölster, H. (2000) . Site parameters, species composition, phytomass structure and element stores of a terra-firme forest in east-Amazonia, Brazil. Plant Ecology, 151, 101-119. [ Links ]
MARN-UCV. (2003). Bases técnicas para el ordenamiento territorial de la Reserva Forestal Imataca. Caracas: Ministerio del Ambiente y de los Recursos Naturales & Universidad Central de Venezuela. [ Links ]
McCune, B. & Mefford, M. (1999). PC-ORD. Multivariate Analysis of Ecological Data [computer software]. Gleneden Beach, OR: MjM Software. [ Links ]
McIntosh, R. (1967). The continuum concept of vegetation. Botanical Review, 33, 130-187. [ Links ]
Melfi, A., Cerri, C., Fristch, E., Milton, L. & Formoso, L. (1999). Tropical soils: genesis, distribution and degradation of lateritic pedologycal system. In L. Milton, L. Formoso & C. Cerri (Eds.), Workshop on tropical soils (pp. 1-30). Rio de Janeiro: Academia Brasileira de Ciências. [ Links ]
Menéndez, A. (1968). Revisión de la estratigrafía de la Provincia de Pastora según el estudio de la Región de Guasipati, Guayana Venezolana. Boletín de Geología, 9, 309-338. [ Links ]
Miranda de Andrade, L., Gomes, L., Fernandes, G., Velho, L., Cotta, M., Rodrigo, D., Haridasan, M. & Franco, F. (2011). Al -hyperaccumulator Vochysiaceae from the Brazilian Cerrado store aluminum in their chloroplasts without apparent damage. Environmental and Experimental Botany, 70, 37-42. [ Links ]
Montgomery, C. & Hurley, P. (1978). Total-rock U-Pb and Rb-Sr systematics in the Imataca Series, Guayana Shield, Venezuela. Earth and Planetary Science Letters, 39, 281-290. [ Links ]
Rivas-Martínez, S. & Rivas-Sáenz, S. (2006). Worldwide Bioclimatic Classification System. Retrieved from http://www.ucm.es/info/cif/data/indexc.htm [ Links ]
Rivas-Martínez, S., Navarro, G., Penas, A. & Costa, M. (2011). Biogeographic map of South America. A preliminary survey. International Journal of Geobotanical Research, 1, 21-40. [ Links ]
Rull, V. (1991). Contribución a la paleoecología de Pantepui y la Gran Sabana (Guayana Venezolana): clima, biogeografía y ecología. Scientia Guaianae, 2, 1-133. [ Links ]
Schaberg, P. G., Tilley, J. W., Hawley, G. J., DeHayes, D. H. & Bailey, S. W. (2006). Associations of calcium and aluminum with the growth and health of sugar maple trees in Vermont. Forest Ecology and Management, 223, 159-169. [ Links ]
Schargel, R. (2005). Geomorfología y suelos de los llanos venezolanos. In J. Hétier & R. López (Eds.), Tierras llaneras de Venezuela (pp. 57-113). Mérida: IRD, CIDIAT & UNELLEZ. [ Links ]
Schargel, R. & Marvaez, P. (2009). Suelos - Estudio de los suelos y la vegetación (estructura, composición florística y diversidad) en bosques macrotérmicos no-inundables, Estado Amazonas, Venezuela. Biollania, 9, 99-109. [ Links ]
Schruben, P., Wynn, J., Gray, F., Cox, D., Stewart, J. & Brooks, E. (1997). Geology and resource assessment of the Venezuelan Guayana Shield at 1:500 000 scale. Reston, VA: US Geological Survey. [ Links ]
Silva, J. F. & Sarmiento, G. (1976). La composición de las sabanas de Barinas en relación con las unidades edáficas. Acta Científica Venezolana, 27, 68-79. [ Links ]
Sparks, D. L., Page, A. L., Helmke, P. A., Loeppert, R. H., Soltanpour, P. N., Tabatabai, M. A., Johnston, C. T. & Summer, M. E. (Eds.). (1996). Methods of Soil Analysis. Part 3. Chemical Methods. Madison, WI: Soil Science Society of America & American Society of Agronomy. [ Links ]
Suárez, A. (1991). Análisis de la vegetación a través de métodos multivariantes en la Reserva Forestal de Caparo (Disertación de Maestría). Universidad de Los Andes, Mérida, Venezuela. [ Links ]
Ter Steege, H. (1994). Flooding and drought tolerance in seeds and seedlings of two Mora species segregated along a soil hydrological gradient in the tropical rain forest of Guyana. Oecologia, 100, 356-367. [ Links ]
Thompson, J. & Legge, R. (1987). The role of free radicals in senescence and wounding. New Phytologist, 105, 317-344. [ Links ]
Vitousek, P. & Denslow, J. (1986). Nitrogen and phosphorus availability in treefall gaps of a lowland tropical rain-forest. Journal of Ecology, 74, 1167-1178. [ Links ]
Yamauchi, M. & Peng, X. (1993). Ethylene production in rice bronzing leaves induced by ferrous iron. Plant and Soil, 149, 227-234. [ Links ]
*Correspondencia a:
José Rafael Lozada.Facultad de Ciencias Forestales y Ambientales, Universidad de Los Andes, Vía Chorros de Milla, 5101 Mérida, Venezuela. Correo electrónico jolozada@ula.ve
Pilar Soriano. Jardín Botánico de la Universidad de Valencia, Calle Quart 80, Valencia, 46008, España. Correo electrónico pilar.soriano@uv.es
Manuel Costa. Jardín Botánico de la Universidad de Valencia, Calle Quart 80, Valencia, 46008, España. Correo electrónico manuel.costa@uv.es
1. Facultad de Ciencias Forestales y Ambientales, Universidad de Los Andes, Vía Chorros de Milla, 5101 Mérida, Venezuela. Correo electrónico jolozada@ula.ve
2. Jardín Botánico de la Universidad de Valencia, Calle Quart 80, Valencia, 46008, España. Correo electrónico pilar.soriano@uv.es, manuel.costa@uv.es
Recibido 08-ii-2013. Corregido 02-VII-2013. Aceptado 31-VII-2013.