Revista de Biología Tropical
versión On-line ISSN 0034-7744versión impresa ISSN 0034-7744
Rev. biol. trop vol.57 no.1-2 San José mar./jun. 2009
Efecto de la calidad del agua de criaderos de mosquitos (Diptera: Culicidae) sobre la patogenicidad e infectividad de las zoosporas del hongo Leptolegnia chapmanii (Straminipila: Peronosporomycetes)
Sebastian A. Pelizza1, Claudia C. López Lastra1, Arnaldo Maciá1,3, Vilma Bisaro2 & Juan J. García1,3
1. Centro de estudios parasitológicos y de vectores CEPAVE, (CCT-CONICET-LA PLATA-UNLP), Calle 2 Nº 584, (1900), La Plata, Buenos Aires, Argentina, fax: +54-0221-4232327, tel: +54-0221-4233471; pelizza@cepave.edu.ar
2. Cátedra de Estadística, Facultad de Agronomía, Universidad Nacional de Rosario, Argentina.
3. Comisión de investigaciones científicas de la provincia de Buenos Aires, CIC.
Abstract: Effect of water quality in mosquito breeding sites on the pathogenicity and infectivity of zoospores from the fungus Leptolegnia chapmanii (Straminipila: Peronosporomycetes). The fungus Leptolegnia chapmanii is highly pathogenic to mosquito larvae in Argentina. We studied if physical and chemical characteristics of the water from mosquito breeding sites affect pathogenicity, and the infectivity of zoospores of L. chapmanii. Water samples were taken from pools filled by rains, urban ditches with domestic waste water, pools filled by overflow from Río de la Plata, and flower vases from the Cemetery of La Plata city. Sub-samples of water were analyzed for physical and chemical characteristics, while other sub-samples were used for laboratory bioassays. Containers with 150 ml of water samples, 25 Aedes aegypti larvae, and 2.8 x 105 zoospores of L. chapmanii, were incubated under controlled environment, and larval mortality was recorded after 48 h. There were highly significant differences among mortalities in water from cemetery vases (70.2%), rain pools water (99.5%), and pools with water from Rio de la Plata (95%). There were no significant differences among larval mortalities in water from ditches, rain pools and Río de la Plata pools. Leptolegnia chapmanii was successful as a biological control agent in all kinds of tested water qualities, producing high larval mortality. Rev. Biol. Trop. 57 (1-2): 371-380. Epub 2009 June 30.
Key words: Leptolegnia chapmanii, Aedes aegypti, larvae, water physical-chemical characteristics, larvae mortality, biological control.
En el Neotrópico, y particularmente en Argentina, la información sobre hongos patógenos de culícidos es escasa y fragmentaria (García y López 1989, López y García 1997). Si bien existe un gran número de hongos acuáticos parásitos y patógenos de plantas y animales, sólo la especie Lagenidium giganteum (Couch) ha sido ampliamente estudiada durante el transcurso de las dos últimas décadas y en la actualidad se la considera un importante agente de control biológico de larvas de mosquitos (Umphlett y Huang 1972, OMS 1979, Lacey y Lacey 1990, Scholte et al. 2004, Kerwin 2007). Otro importante hongo1 entomopatógeno de esta clase es Leptolegnia chapmanii Seymour (Seymour 1977), el cual ha sido aislado de larvas de varias especies de culícidos. Muchos autores han coincidido en adjudicar a L. chapmanii características que le dan potencialidad para actuar como agente de control biológico (Mc Innis y Zattau 1982, Seymour 1984, Lord y Fukuda 1988, Fukuda et al. 1997), como la alta mortalidad generada en organismos blanco y la especificidad de hospedadores entre otras.
El ciclo de vida de L. chapmanii comienza con la liberación de zoosporas móviles (fase asexual), las cuales se unen por quimiotactismo a la cutícula larval, se enquistan, y por mediación de factores mecánicos y enzimáticos, penetra el cuerpo de la larva, crece rápidamente en su interior invadiendo los distintos órganos y tejidos, y ocasiona su muerte. Posteriormente L. chapmanii emerge del cadáver para generar más zoosporas, las cuales pueden infectar nuevas larvas. En la fase sexual del ciclo se producen estructuras de resistencia (oosporas) que pueden permanecer inactivas en el ambiente cuando las condiciones se vuelven desfavorables, pudiendo germinar y originar nuevas zoosporas infectivas cuando las condiciones del entorno son favorables (Zattau y Mc Innis 1987).
López Lastra et al. (1999) registraron la presencia de L. chapmanii parasitando larvas de Ochlerotatus albifasciatus (Macquart) en los alrededores de la ciudad de La Plata (Buenos Aires, Argentina), constituyendo este hallazgo el cuarto aislamiento en el mundo y el primero en el Neotrópico de este patógeno. La distribución mundial conocida de esta especie se reduce a localidades de Carolina del Sur, Florida y Ohio en Estados Unidos (Mc Innis y Zattau 1982, Seymour 1984, Lord y Fukuda 1988, Fukuda et al. 1997). Dick et al. (1999) determinaron que los aislamientos de L. chapmanii de Florida, Estados Unidos, y de la Argentina constituyen un grupo monofilético basándose en secuencias de nucleótidos del 18 S ADNr. Este aislamiento nativo de L. chapmanii (ARSEF 5499-CEP 010) presentó un amplio espectro de hospedadores culícidos susceptibles, resultando no patogénico para la mayoría de los invertebrados "no blanco" y los vertebrados acuáticos evaluados en el laboratorio (López et al. 2004), como así también quedó demostrado en pruebas de laboratorio la amplia tolerancia de las zoosporas del aislamiento nativo a una serie de factores bióticos y abióticos (Pelizza et al. 2007a, 2007b). Investigaciones adicionales fueron llevadas a cabo para determinar la producción, supervivencia e infectividad de las zoosporas de este aislamiento de L. chapmanii para entender los parámetros que regulan la presencia de epizootias en condiciones naturales (Pelizza et al. 2008). Estos trabajos se realizaron utilizando como hospedador al mosquito del dengue, Aedes aegypti (L.). Los estudios de virulencia y patogenicidad en entomopatógenos no se limitan al nivel específico, sino que adquieren relevancia las diferencias que presentan los aislamientos de un patógeno, ya sea a partir de hospedadores, localidades o ambientes distintos. Hasta el presente, la información relativa a este nuevo aislamiento de L. chapmanii se reduce a su hallazgo (López et al. 1999), sus relaciones filogenéticas y evolutivas con otros miembros del mismo género o grupo superior (Dick et al. 1999) y un estudio sobre el espectro de hospedadores susceptibles y el efecto sobre la fauna asociada a los criaderos de culícidos (López et al. 2004).
El aislamiento nativo de L. chapmanii toleró una amplia gama de temperatura, pH y salinidad en condiciones controladas (Pelizza et al. 2007b). En condiciones de campo, la influencia de las variables físico-químicas del agua de los criaderos de culícidos sobre la viabilidad de L. chapmanii es desconocida.
Complementando la investigación sobre el aislamiento nativo de L. chapmanii, se realizó un estudio en condiciones de laboratorio con el objetivo de determinar si las características físico-químicas del agua de los ambientes donde se desarrollan algunos de los culícidos de mayor importancia sanitaria, afectan la patogenicidad e infectividad de las zoosporas de L. chapmanii.
Materiales y métodos
Se tomaron muestras de agua de ambientes de cría de larvas de culícidos en los alrededores de la ciudad de La Plata. Los ambientes examinados fueron: 1) charco temporario inundado por lluvias (en adelante, agua de lluvia); 2) zanja de desagüe pluvial y domiciliario en el casco urbano de la ciudad (en adelante, agua de zanja); 3) desbordes de agua del Río de La Plata que inundan ambientes temporarios en la Reserva Provincial de Punta Lara, Ensenada, Provincia de Buenos Aires (en adelante, agua de río); y 4) agua de recipientes artificiales (floreros de cemento) del Cementerio Municipal de La Plata (en adelante, agua de floreros). En cada ambiente se tomaron muestras de cuatro litros en recipientes plásticos. Un litro de agua proveniente de cada ambiente fue analizado en un laboratorio especializado acreditado por la Secretaria de Política Ambiental de la Provincia de Buenos Aires para cuantificar sus parámetros físicos, químicos y biológicos. Los restantes tres litros fueron filtrados a través de papel de filtro Watman® Nº 5 y utilizados para realizar los ensayos de patogenicidad y tolerancia de las zoosporas de L. chapmanii a los distintos tipos de agua.
Para estos ensayos se utilizaron recipientes plásticos de 46 cm2 de superficie y 200 ml de capacidad, en los cuales se colocaron 150 ml de uno de los cuatro tipos de ambientes muestreados, 25 larvas sanas de A. aegypti de IV estadio y 2.8 x 105 zoosporas/ml de L. chapmanii. Los recipientes fueron mantenidos a 25 ºC y fotoperíodo de 12-12 h (luz-oscuridad) en una incubadora. Se utilizaron tres recipientes y un control (tratado de igual forma que el resto pero sin la incorporación del inóculo fúngico) para cada tipo de agua. Tres repeticiones del ensayo fueron llevados a cabo en distintas fechas (N= 48). La mortalidad larval fue registrada a las 48 horas de iniciado el ensayo.
Análisis estadístico: Se aplicó un análisis de Componentes Principales (Johnson y Wichern 1992), en el cual las variables originales fueron las propiedades químicas del agua, y las observaciones, las muestras de agua de cuatro procedencias diferentes (lluvia, zanja, río y floreros). Para eliminar el sesgo de interpretaciones causadas por diferentes escalas de medición, se estandarizaron los datos según
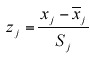
donde xj es la variable j-ésima, 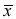 es la media de la variable j-ésima en la muestra, y Sj es el desvío de la variable j-ésima en la muestra. Se utilizaron sólo las propiedades métricas de las observaciones. Sólo los autovalores
es la media de la variable j-ésima en la muestra, y Sj es el desvío de la variable j-ésima en la muestra. Se utilizaron sólo las propiedades métricas de las observaciones. Sólo los autovalores 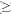 1 fueron retenidos para los análisis de Componentes Principales. En el análisis se trabajó con la matriz de correlaciones, por lo tanto, para medir la asociación entre las variables originales, Xk, y los CP, Yj, se utilizó el coeficiente de correlación entre ambos, dada por:
1 fueron retenidos para los análisis de Componentes Principales. En el análisis se trabajó con la matriz de correlaciones, por lo tanto, para medir la asociación entre las variables originales, Xk, y los CP, Yj, se utilizó el coeficiente de correlación entre ambos, dada por:
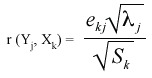
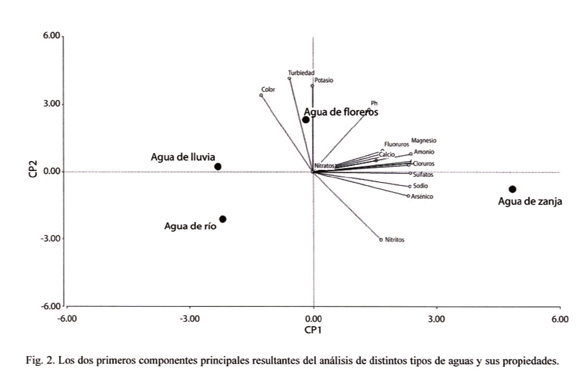
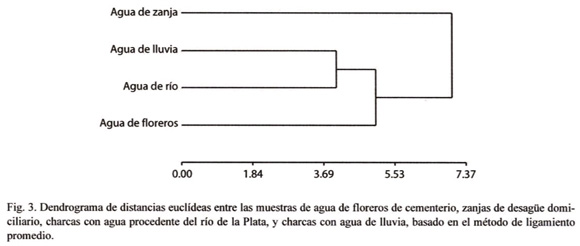
donde ekj es el coeficiente del autovector estandarizado, 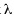 j es el autovalor j-ésimo, y Sk es la varianza de la variable k-ésima. Para analizar relaciones conjuntas entre observaciones y variables (tipos de aguas y propiedades químicas, respectivamente) se construyeron gráficos biplots (Gabriel 1971) a partir del análisis de Componentes Principales sobre la matriz de correlaciones, y un dendrograma utilizando el método de agrupamiento de encadenamiento promedio (average linkage) y calculando la distancia euclídea como distancia entre conglomerados. El análisis de Componentes Principales se realizó usando InfoStat versión 2007 (InfoStat 2001).
j es el autovalor j-ésimo, y Sk es la varianza de la variable k-ésima. Para analizar relaciones conjuntas entre observaciones y variables (tipos de aguas y propiedades químicas, respectivamente) se construyeron gráficos biplots (Gabriel 1971) a partir del análisis de Componentes Principales sobre la matriz de correlaciones, y un dendrograma utilizando el método de agrupamiento de encadenamiento promedio (average linkage) y calculando la distancia euclídea como distancia entre conglomerados. El análisis de Componentes Principales se realizó usando InfoStat versión 2007 (InfoStat 2001).
Para establecer la incidencia de las propiedades químicas del agua en la mortalidad larval, se realizó un análisis de la variancia bajo la hipótesis de nulidad de que la mortalidad larval no difirió entre los cuatro tipos de agua, seguido de un test a posteriori de Duncan (p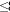 0.05).
0.05).
Resultados
Las características físico-químicas del agua utilizada en los ensayos, obtenida de los ambientes donde se desarrollan culícidos de importancia sanitaria, se mencionan en el Cuadro 1.
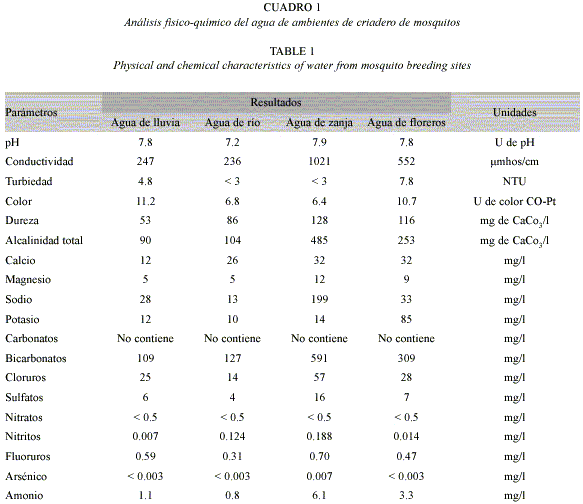
El porcentaje más elevado de mortalidad en las larvas fue 99.53 % + 0.13 (media + DE) a las 48 horas de iniciado el ensayo en agua de lluvia, mientras que el porcentaje menor fue 70.2 % + 1.25, correspondiente a agua de floreros (Fig. 1).
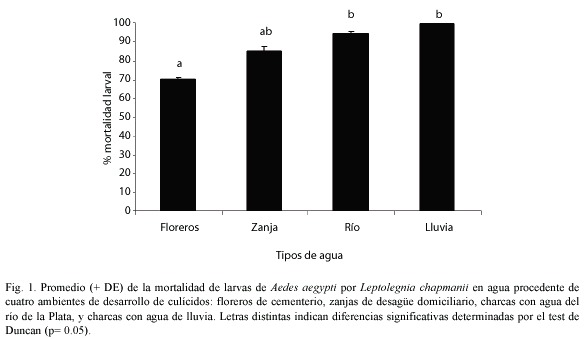
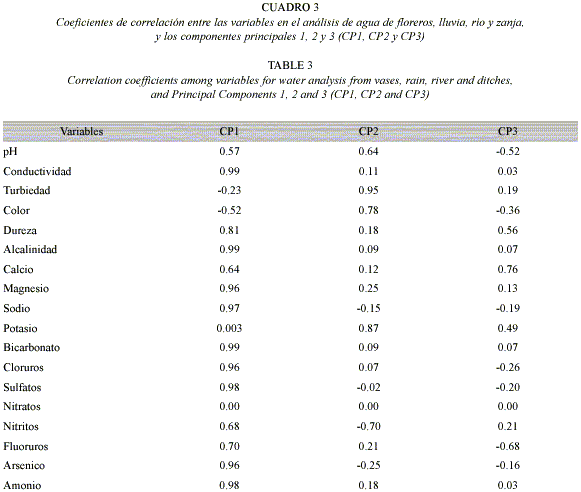
El primer componente en el análisis de componentes principales explicó el 66% de la variabilidad total del modelo, el segundo, el 20%, y el tercer el 13% (Cuadro 2). Las variables con un alto grado de correlación con el primer componente principal (CP1) fueron pH, conductividad, dureza, alcalinidad, magnesio, sodio, bicarbonatos, cloruros, sulfatos, fluoruros, arsénico y amonio. Este CP1 separó las aguas de lluvia y de río, con bajos contenidos de las variables citadas anteriormente, de las aguas de floreros y de zanja, con altos contenidos de las mismas. Las variables con alto grado de correlación con el segundo componente principal (CP2) fueron: turbiedad, color, potasio y nitritos. El CP2 indicó que valores altos de turbiedad, color y potasio, y bajos de nitritos, correspondieron a agua de floreros. Valores bajos de turbiedad, color y potasio y altos en nitritos correspondieron a agua de río y de zanja. El tercer componente principal (CP3) se correlacionó con los valores de calcio. Otras variables se correlacionaron con valores altos con el CP3, aunque en estos casos las correlaciones siempre fueron menores que con CP1 o CP2. El CP3 mostró que valores altos de calcio se asociaron a agua de río, floreros y zanja (Cuadro 3 y Fig. 2). El dendrograma (Fig. 3) obtenido por medio del análisis de conglomerados, confirmó el análisis descriptivo de CP. En él se observó que el agua de río y de lluvia fueron similares en cuanto a sus propiedades químicas y conforman un núcleo. El agua de floreros poseyó propiedades comunes con las anteriores, y el agua de zanja se separó de las anteriores por su disimilitud. En resumen, de acuerdo a las propiedades químicas de las muestras de agua analizadas, el agua de lluvia y de río resultaron similares, excepto por el contenido del calcio. El agua de lluvia y de río difirieron del agua de florero y de zanja, esta última con valores opuestos al resto de los tiposde agua en la mayoría de los casos.

El análisis de varianza evidenció diferencias altamente significativas (F = 5.74; 3, 32 g.l.; p = 0.0029) entre las medias de mortalidad larval producida a las 48 horas en cada tipo de agua. Se observaron diferencias significativas (p = 0.05) entre el porcentaje de mortalidad producido en agua de floreros con la de río y la de lluvia; no presentando diferencias significativas entre éstos dos últimos tipos de aguas (p> 0.05). Con respecto al agua de zanja, el porcentaje de mortalidad presenta un valor intermedio entre la producida en el agua de florero con la de río y lluvia.
Discusión
El efecto de la calidad del agua de los criaderos de mosquitos, medida por medio de sus características físico-químicas, sobre la infectividad de las zoosporas de L. chapmanii fue investigado en este estudio. Los cuatro tipos de agua evaluados correspondieron a criaderos donde se desarrollan culícidos importantes desde el punto de vista sanitario en el mundo y en amplias áreas de la Argentina. Estas especies son A. aegypti, Culex pipiens L. y O. albifasciatus. Las larvas de Aedes aegypti, el mosquito vector de dengue en América, se desarrollan en recipientes artificiales tales como cubiertas de automóviles que acumulan agua de lluvia, floreros en cementerios y otros recipientes artificiales. Culex pipiens, el mosquito de los domicilios, habita frecuentemente ambientes urbanos, criando en recipientes similares a los mencionados para A. aegypti, y en zanjas de desagüe con elevados niveles de materia orgánica y, en ocasiones, productos de uso domiciliario o industrial como lavandina, detergente y jabón. Ochlerotatus albifasciatus, conocido como el mosquito de las inundaciones, es una especie que produce molestias a los habitantes y animales domésticos en la Argentina, y es
vector de algunas arbovirosis (Calisher et al. 1985). Los adultos emergen de 6 a 16 días en promedio, después de la inundación de los ambientes deprimidos donde las hembras colocaron los huevos (Campos y Sy 2003)). El agua que provoca la inundación de los ambientes de O. albifasciatus proviene generalmente de lluvias intensas o prolongadas o de los desbordes de arroyos en el área platense cuando el Río de La Plata incrementa sensiblemente su nivel, generalmente por acción del viento intenso de dirección sudeste.
El aislamiento nativo de L. chapmanii tuvo un comportamiento exitoso en los cuatro tipos de agua evaluados, produciendo elevados niveles de mortalidad larval independientemente del tipo y características del agua evaluadas. Las diferencias observadas en la mortalidad larval por L. chapmanii entre los cuatro tipos de agua evaluados resultaron poco conspicuas si se comparan con la mortalidad producida por L. giganteum inoculado en lagunas experimentales, que infectó casi exclusivamente larvas mantenidas con agua clara y libre de materia orgánica en el tratamiento control. Lagenidium giganteum infectó entre el 27 y 100 % de las larvas de Culex quinquefasciatus (Say) desarrollándose en agua con bajos niveles de contaminación y materia orgánica, mientras que no registraron infecciones en agua con niveles moderados a altos de contaminación y materia orgánica (Jaronski y Axtell 1982). Algunas características de aguas contaminadas, como los niveles bajos de oxígeno disuelto, pH extremo y gran número de otros microorganismos presentes en el agua hacen que la infectividad y efectividad de las zoosporas de L. giganteum sea escasa o nula (Lord y Roberts 1985). También la temperatura elevada del agua y los altos niveles de contaminación orgánica pueden limitar la infección de mosquitos por L. giganteum (Fetter-Lasko y Washino 1978, Hallmon et al. 2000, Kerwin 2007). Sin embargo L. giganteum actuó con efectividad como control de larvas de Anopheles nigromaculis (Ludlow) en pasturas y de Culex tarsalis (Coquillet) en campos de arroz (Washino et al. 1976, Christensen et al. 1977).
Los resultados de este estudio permiten concluir que el aislamiento neotropical de L. chapmanii fue patogénico y virulento dentro de una amplia escala de contenido de materia orgánica y de contaminantes del agua. La mortalidad larval generada por zoosporas de L. chapmanii se vio poco afectada por las condiciones locales del agua en ambientes naturales y artificiales donde crían los culícidos. Consecuentemente, ello posibilitaría su aplicación a campo en una gran variedad de criaderos.
Agradecimientos
Este estudio fue parcialmente financiado por la Agencia Nacional de Promoción Científica y Técnica (PICT 11118/02), CICPBA, CONICET y Universidad Nacional de La Plata, La Plata, Argentina.
Resumen
Leptolegnia chapmanii es un potente patógeno de larvas de mosquitos. El objetivo del trabajo fue determinar si las características físico-químicas del agua de criaderos de culícidos de importancia sanitaria a nivel mundial afectan la patogenicidad e infectividad de las zoosporas de L. chapmanii. Se tomaron muestras de cuatro tipos de agua en Argentina: de lluvia, de zanja, del Río de La Plata, y de floreros del cementerio local. A una parte del agua se le realizaron estudios físicos-químicos, y otra parte fue utilizada en ensayos. Se colocó 150 ml de cada muestra en recipientes plásticos, con 25 larvas sanas de Aedes aegypti y 2.8 x 105 zoosporas de L. chapmanii. Fueron incubadas a 25 ºC y 12-12 (L-O). La mortalidad larval fue registrada a las 48 horas. Se utilizaron tres recipientes y un control por tratamiento, con tres repeticiones realizadas en distintos días. Se observaron diferencias altamente significativas entre la mortalidad larval en aguas de floreros del cementerio (70.2%), aguas de lluvias (99.53%), y del río de La Plata (95%). No hubo diferencias significativas entre la mortalidad larval en agua de zanja, lluvia y río. Leptolegnia chapmanii resultó exitoso en los cuatro tipos de aguas evaluados, produciendo elevados niveles de mortalidad larval.
Palabras clave: Leptolegnia chapmanii, Aedes aegypti, larvas, características físico-químicas del agua, mortalidad larval, control biológico.
Referencias
Adl M., G.B. Alastair, G.B. Simpson, M.A. Farmer, R.A. Andersen, D.R. Andersen, J.R. Barta, S.S. Bowser, G. Brugerolle, R.A. Fensome, S. Frederico, T.Y. James, S. Karpov, P. Kugrens, J. Krug, C.E. Lane, L.A. Lewis, J. Lodge, D.H. Lynn, D.G. Mann, R.M. Mccourt, L. Mendoza, O. Moestrup, S.E. Mozley- Standridge, T.A. Nerad, C.A. Shearer, A.V. Smirnov, F.W. Spiegel & M.F. Taylor. 2005. The new higher level classification of Eukaryotes with emphasis on the taxonomy of protists. J. Eukaryot. Microbiol. 52: 399-451. [ Links ]
Calisher C.H., T.P. Monath, C.J. Mitchell, M.S. Sabattini, C.B. Cropp, J. Kerschner, A.R. Hunt & J.S. Lazuick. 1985. Arbovirus investigations in Argentina, 1997-1980. III. Identification and characterization of viruses isolated, including new subtypes of Western and Venezuelan Equine Encephalites Viruses and four new Bunyaviruses (Las Maloyas, Resistencia, Barranqueras, and Antequera). Am. J. Trop. Med. Hyg. 34: 956-965. [ Links ]
Campos R.E. & V.E. Sy. 2003. Mortality in immatures of the floodwater mosquito Ochlerotatus albifasciatus (Diptera: Culicidae) and effects of parasitism by Strelkovimermis spiculatus (Nematoda: Mermithidae) in Buenos Aires Province, Argentina. Mem. Inst. Oswaldo Cruz 98: 199-208. [ Links ]
Christensen J.B., J.L. Fetter-Lasko, R.K. Washino, R.C. Husband & E.E. Kaufman. 1977. A preliminary field study employing Lagenidium giganteum, a fungus, as a posible biological control agent against the pasture mosquito Aedes nigromaculis. Proc. Calif. Mosq. Vector Control Assoc. 45: 105. [ Links ]
Dick M.W., M.C. Vick, J.G. Gibbings, T.A. Hedderson & C.C. López Lastra. 1999. 18 S rDNA for species of Leptolegnia and other Peronosporomycetes: JustificationforthesubclasstaxaSaprolegniomycetidae and Peronosporomycetidae and division of the Saprolegniaceae sensu lato into the families Leptolegniaceae and Saprolegniaceae. Mycol. Res. 103: 1119-1125. [ Links ]
Fetter-Lasko J.L. & R.K. Washino. 1978. Patterns of experimental infection of mosquito larvae by Lagenidium giganteum. J. Am. Mosq. Control Assoc. 46: 90. [ Links ]
Fukuda T., D.R. Willis & D.R. Barnard. 1997. Parasites of the asian tiger mosquito and other container-inhabiting mosquitoes (Diptera: Culicidae) in Northcentral Florida. J. Med. Entomol. 84: 226-233. [ Links ]
Gabriel, K.R. 1971. The biplot graphic display of matrices with application to principal component analysis. Biometrika 58: 453-467. [ Links ]
García J.J. & C.C. López. 1989. Infecciones por microsporidios y hongos en Culex dolosus (Lynch Arribalzaga 1981) (Diptera: Culicidae) en Argentina y Uruguay. Neotropica 35: 9-14. [ Links ]
Hallmon C.F., E.T. Schreider & M.A. Bloomquist. 2000. Field trials of three concentrations of Laginex as biological larvicide compared to Vectobac-12 AS as a biocontrol agent for Culex quinquefasciatus. J. Am. Mosq. Control Assoc. 16: 5-8. [ Links ]
InfoStat. 2001. Manual del usuario, versión 1. Universidad Nacional de Córdoba. Córdoba, Argentina. [ Links ]
Jaronski S.T. & R.C. Axtell. 1982. Effects of organic water pollution on the infectivity of the fungus Lagenidium giganteum (Oomycetes: Lagenidiales) for the larvae of Culex quinquefasciatus (Diptera: Culicidae): Field and laboratory evaluation. J. Med. Entomol. 19: 255-262. [ Links ]
Johnson, R.A. & D.W. Wichern. 1992. Applied Multivariate Statistical Analysis. 3ra. ed. Prentice-Hall Int., Englewood Cliffs, New Jersey, Estados Unidos. [ Links ]
Kerwin, J.L. 2007. Oomycetes: Lagenidium giganteum, p. 50-58. In T. G. Floore (ed.). Biorational Control of Mosquitoes. J. Am. Mosq. Control Assoc. 23, Bull. No. 7. [ Links ]
Lacey L.A. & C.M. Lacey. 1990. The medical importance of riceland mosquitoes and their control using alternatives to chemical insecticides. J. Am. Mosq. Control Assoc. 2: 1-93. [ Links ]
López C.C. & J.J. García. 1997. Presencia del hongo Coelomomyces ilensis var. indus como patógeno de larvas de mosquitos (Díptera: Culicidae) en la República Argentina. Rev. Iberoam. Micol. 14: 69-71. [ Links ]
López C.C., M.M. Steciow & J.J. García. 1999. Registro más austral del hongo Leptolegnia chapmanii (Oomycetes: Saprolegniales) como patógeno de larvas de mosquitos (Díptera: Culicidae). Rev. Iberoam. Micol. 16: 143-145. [ Links ]
López C.C., A.C. Scorsetti, G.A. Marti & J.J. García. 2004. Host range and specifity of an Argentinean isolate of the aquatic fungus Leptolegnia chapmanii (Oomycetes: Saprolegniales), a pathogen of mosquito larvae (Diptera: Culicidae). Mycopathologia 158: 311-315. [ Links ]
Lord J. & T. Fukuda. 1988. An ultrastructural study of Culex quinquefasciatus larvae by Leptolegnia chapmanii (Oomycetes: Saprolegniales). Mycopathologia 104: 67-74. [ Links ]
Lord J.C. & D.W. Roberts. 1985. Solute effects on Lagenidium Giganteum zoospores motility and bioassay reproducibility. J. Invertebr. Pathol. 46: 160-165. [ Links ]
Mc Innis T. Jr. & W.C. Zattau. 1982. Experimental infection of mosquitoes larvae by a species of the aquatic fungus Leptolegnia. J. Invertebr. Pathol. 39: 98-104. [ Links ]
Organización Mundial de la Salud. 1979. Data sheet on the biological control agent Lagenidium giganteum (Couch 1935). Organización Mundial de la Salud, Division of Vector Biology and Control, Ginebra, Suiza. [ Links ]
Pelizza S.A., C.C. López Lastra, J.J. Becnel, V. Bisaro & J. J. García. 2007a. Biotic and abiotic factors affecting Leptolegnia chapmanii infection in Aedes aegypti. J. Am. Mosq. Control Assoc. 23: 177-181. [ Links ]
Pelizza S.A., C.C. López Lastra, J.J. Becnel, V. Bisaro & J.J. García. 2007b. Effects of temparature, Ph and salinity on the infection of Leptolegnia chapmanii Seymour (Peronosporomycetes) in mosquito larvae. J. Invertebr. Pathol. 96: 133-137. [ Links ]
Pelizza S.A., C.C. López Lastra, J.J. Becnel, R.A. Humber & J.J. García. 2008. Further research on the production, longevity and infectivity of the zoospores of Leptolegnia chapmanii Seymour (Oomycota: Peronosporomycetes). J. Invertebr. Pathol. 98: 314-319. [ Links ]
Scholte E.J., B.G. Knols, R.A. Samson & W. Takken. 2004. Entomopathogenic fungi for mosquito control: A review. J. Insect. Sci. 4: 1-24. [ Links ]
Seymour R.L. 1977. The systematic significance of pathogenicity of fungi for animals and plants, p. 111-134. In J. D.. Briggs (ed). Biological Regulation of Vectors. U.S. DHEW Publication No. (NIH) 77-1180. National Institute of Health, Washington, DC, Estados Unidos. [ Links ]
Seymour R.L. 1984. Leptolegnia chapmanii, an Oomycetes pathogen of mosquito larvae. Mycologia 76: 113-120. [ Links ]
Umphlett C.J. & C.S. Huang. 1972. Experimental infection of mosquito larvae by a species of the aquatic fungus Lagenidium. J. Invertbr. Pathol. 20: 326-331. [ Links ]
Washino R.K., J. Fetter, C.K. Fukushima & K. Gonot. 1976. The establishment of Lagenidium giganteum, an aquatic fungal parasite of mosquitoes, three years after field introduction. Proc. Calif. Mosq. Control Assoc. 44-52. [ Links ]
Zattau W.C. & T. Mc Innis. 1987. Life cycle and mode of infection of Leptolegnia chapmanii (Oomycetes) parasitizing Aedes aegypti. J. Invertebr. Pathol. 50: 134-145. [ Links ]
1. Los autores reconocen que actualmente todos los taxa pertenecientes a los Oomycetes (hongos acuáticos inferiores) están actualmente ubicados dentro del reino Chromista (=Straminipila) (Adl et al. 2005) y han sido excluidas del grupo de los verdaderos hongos. No obstante, debido a que L. chapmanii ha sido considerado históricamente un hongo hasta hace pocos años, en el presente trabajo se lo considera como tal para los fines prácticos.












 uBio
uBio