Revista de Biología Tropical
versión On-line ISSN 0034-7744versión impresa ISSN 0034-7744
Rev. biol. trop vol.55 no.3-4 San José sep./dic. 2007
Yrma Gómez, Katiuska Gil, Elba González & Luz Marina Farías
Dpto. de Ciencias, Laboratorio de Investigaciones Biológicas, Universidad de Oriente, Núcleo de Anzoátegui, Venezuela; irmagomez52@hotmail.com. Fax: 058-0281-2819239
Abstract: Anti-fungi activity of organic extracts from the tree Fagara monophylla (Rutaceae) in Venezuela. The tree Fagara monophylla ranges throughout Tropical America. The genus Fagara has a diversity of alkaloid compounds with antibiotic properties; nevertheless, there are few reports antifungal activity of its organic compounds. Organic extracts from Venezuelan F. monophylla were tested for antimicrobial activity against Aspergillus terreus, A. flavus, Penicillium digitatum, P. funiculosum, P. citrinum, Paecilomyces and Candida albicans. Minimal Inhibitory Concentration (MIC) was determined. The susceptibility trials of organic fractions (Hex., CH2Cl2 and MeOH) showed that the highest inhibition was presented by MeOH against A. flavus (55 mm), P. digitatum (60 mm), P. funiculosum (56 mm) and C. albicans (26 mm). The activities of MeOH/EtOAc fractions 1 and 2 suggest a combined effect against A. flavus, P. digitatum and P. funiculosum. The MIC of 1 MeOH/ EtOAc subfraction activity was lower against C. albicans (32 µg/ml) and moderate (128 µg/ml) against P. digitatum. This organic extract has a great antifungal potential. The phytochemical proves and TLC testing on the organic extract, and the MeOH/EtOAc subfraction, respectively, indicated the presence of alkaloid compounds. Rev. Biol. Trop. 55 (3-4): 767-775. Epub 2007 December, 28.
Key words: antifungal activity, Fagara monophylla, fungi, MIC, organic extract.
Los géneros Fagara y Zantoxylum (Rutaceae), se encuentran tan estrechamente emparentados, que ha resultado problemática la clasificación taxonómica de ambos géneros (Stermitz y Sharifi 1980, De García et al. 1989). Estos géneros se habían mantenido históricamente separados, por las estructuras del perianto de ambos taxones (Stermitz et al. 1980). No obstante, Zantoxylum monophyllum ha sido clasificada como Fagara monophylla y posteriormente reclasificada como Z. monophyllum P. (Wilson) por lo que se consideran sinónimos (Steyermark y Huber 1978, Index Kewensis Plantarum Fanerogamum 1896, Huber et al. 1998).
Las especies de Fagara, son conocidas en la medicina tradicional por sus propiedades como sudorífero, diurético, salivadoras, estimulantes y vomitivas (Reisch et al. 1994). En la medicina tradicional venezolana, es conocido el uso de F. monophylla en el tratamiento del romadizo o inflamación de la mucosa nasal, la ictericia y la oftalmia (Etnobot DB 1999)
F. monophylla conocida en la etnobotánica como paneque, bosuga o bosúa es un árbol que crece hasta 10 m de altura, caracterizado por ser aromático y poseer ramas espinosas, hojas alternas y flores en panículos terminales. Está distribuida en América Tropical Continental y en algunas de las Antillas (Schenee 1984). Ésta junto con F. pterota, F. chiloperone y F. caribea, constituyen el género Fagara existente en Venezuela (Huber et al. 1998).
Los estudios fitoquímicos del género Fagara, indican que en su composición química existe una diversidad de alcaloides (NAPRALERT DB 2001). Específicamente, F. monophylla (Z. monophyllum) posee un alto contenido de alcaloides cuaternarios, en especial berberinas y piranoquinolinas zantofilinas (Stermitz y Sharif 1977, Stermitz et al. 1979, De García et al. 1989). A muchos de los alcaloides presentes en este género se les han atribuido propiedades antibióticas (Couillerot 1996). No obstante, hasta ahora, sólo se le conocen propiedades antifúngicas a las especies F. chalybea, F. holstii, F. holtziana, F. lemairei y F. zantoxyloides (NAPRALERT DB 2001), y poco se conoce acerca de estas propiedades en F. monophylla, por lo que el objetivo de esta investigación fue el de evaluar in vitro la actividad antifúngica de los extractos orgánicos presentes en la corteza de esta planta, con el fin de contribuir al conocimiento de la etnomédica de este género
Materiales y métodos
Recolección de la muestra y obtención de los extractos orgánicos: F. monophylla fue recolectada en la localidad de Sabana de Uchire (10°0200 N, 65°3100" W), Estado Anzoátegui, Venezuela, la muestra se encuentra depositada en el Herbario IRBR de la Universidad de Oriente, Venezuela; registrada con el número de colección 1794 (7 de Junio de 1983).
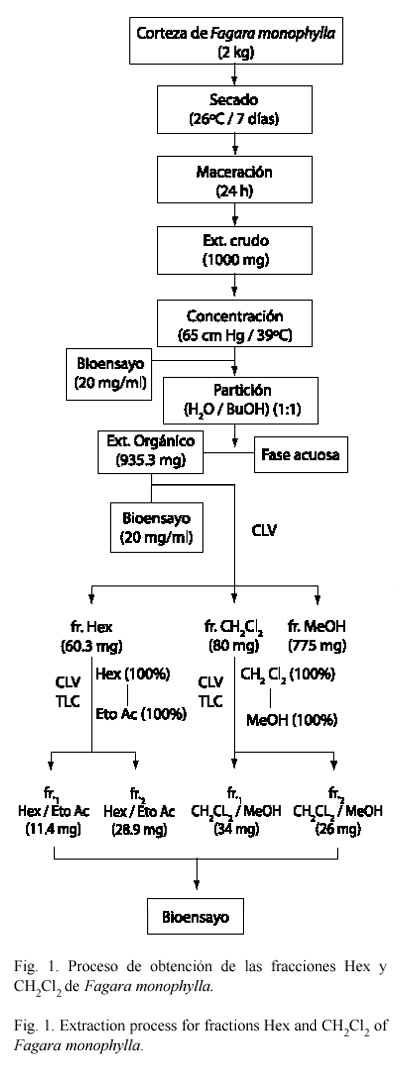
El material vegetal (2 kg) se secó a la sombra durante siete días a temperatura ambiente (26±3 ºC). Las muestras se sometieron a un proceso de maceración con metanol al 99.9 % durante un período de 24 h. La extracción fue repetida hasta agotamiento. Este extracto crudo fue filtrado, concentrado a presión reducida en un rotoevaporador (65 cm Hg/39 ºC) y luego sometido a un proceso de partición con la mezcla de disolventes agua/butanol (1:1). Este proceso permitió la separación de las fracciones orgánica y acuosa. La fracción acuosa fue descartada y la fracción orgánica fue seleccionada para su posterior fraccionamiento mediante la técnica de cromatografía líquida al vacío (VLC) (Coll y Bowden 1986) empleando disolventes de diferentes polaridades: hexano (Hex), diclorometano (CH2Cl2) y metanol (MeOH). Las fracciones Hex., CH2Cl2 y MeOH obtenidas, se concentraron a presión reducida (45-59 y 55 cm de Hg/39 ºC, respectivamente).
A cada una de las fracciones (fr.) orgánicas le fue probada su actividad antifúngica (Bauer et al. 1966). Las fracciones bioactivas se sometieron a un posterior fraccionamiento mediante VLC con gel de sílice, malla 70-230 (Merck), utilizando sistemas de disolventes con gradientes de polaridad (Pelletier 1986). Los eluatos obtenidos de cada fraccionamiento y que mostraron características similares por cromatografía de capa fina (TLC), fueron mezclados (Touchstone 1992). La TLC se realizó sobre placas de gel de silice 60F-245 de 5 mm de espesor. Las placas se revelaron con luz UV (245 mn) y el empleo de una solución reveladora de H2SO4 al 10 % en metanol, seguido de calentamiento.
La mezcla de los eluatos originó las fracciones: fr1 y fr2 Hex/EtOAc, fr1 y fr2 CH2Cl2/MeOH y fr1 y fr2 MeOH/EtOAc. La fr1 MeOH/EtOAc, fue seleccionada para llevar a cabo un nuevo fraccionamiento (EtOAc 100 % a MeOH 100 %), originando las subfracciones (sf.) sf1 y sf2 MeOH/EtOAc (Fig. 2). Ambas subfracciones fueron sometidas a las pruebas de susceptibilidad y determinada la CMI a la sf1 MeOH/EtOAc.
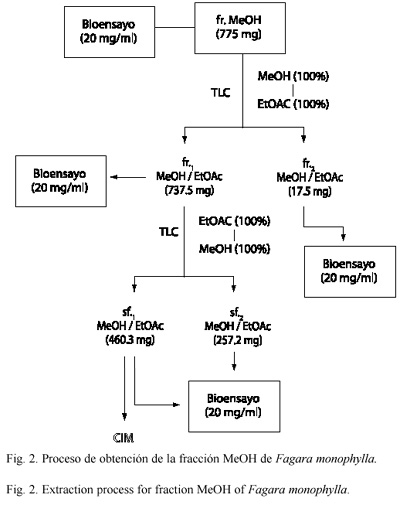
Un diagrama de flujo del proceso de extracción de los extractos orgánicos de F. monophylla se presenta en las Fig. 1 y 2.
Determinación de la actividad antifúngica: se emplearon cultivos puros de diferentes especies de hongos de los géneros Aspergillus: A. terreus (ATCC 10020), A. flavus (ATCC 10124), Penicillium: P. digitatum (ATCC 10030), P. citrinum (ATCC 1109), P. funiculosum (NRRL 1033), Paecilomyces sp. y Cándida albicans provenientes de los Laboratorios de Investigaciones Biológicas, y de Microbiología y Parasitología de la Universidad de Oriente.
Esporas de colonias jóvenes de siete días de crecimiento, se suspendieron homogéneamente en una solución de peptona al 0.1 %. A partir de esta suspensión se realizó un sistema de dilución hasta asegurar una concentración de 4 x 104 unidades formadoras de colonias (UFC/ml) (Kobayashi et al. 1996). 0.1 ml de esta suspensión se inoculó en la superficie del agar Czapex dox para el caso de hongos filamentosos y agar Sabureaud para C. albicans. El crecimiento bacteriano se inhibió mediante la adición de 1 ml/l de cloranfenicol (0.5 mg/ml) al medio de cultivo.
Los discos impregnados con 20 µl del extracto (20 mg/ml) se colocaron asépticamente sobre el medio de cultivo previamente inoculado con 0.1 ml de una suspensión esporangial. Los medios inoculados fueron enfriados a 4 °C durante 12 h previo a su incubación a 27 °C, a excepción de C. albicans la cual fue incubada a 37 °C durante 48 h.
La actividad antifúngica se determinó por la presencia de un halo de inhibición alrededor del disco. Los resultados se expresaron como el diámetro (mm) del halo de inhibición (Bauer et al. 1966). Como controles negativos se utilizaron discos impregnados con el disolvente empleado para la obtención del extracto.
Determinación de la concentración mínima inhibitoria: los extractos bioactivos fueron disueltos en DMSO al 10 % en agua y diluidos en forma seriada a concentraciones comprendidas entre 0.125 y 512 µg/ml. En cada caso, éstas fueron añadidas al medio de cultivo en una relación 1:9 (Delgado et al. 1994). El inóculo fue preparado a partir de un caldo nutritivo ajustado a una concentración de 10-4 UFC/ml. Las placas fueron incubadas a 27 °C durante 48 h y el crecimiento microbiano fue inspeccionado visualmente. La CMI fue definida como la más baja concentración del compuesto que previene cualquier crecimiento visible (Jawetz et al. 1992).
Pruebas fitoquímicas: al extracto orgánico se le realizaron las pruebas fitoquímicas para la identificación de las familias de compuestos pertenecientes a las saponinas, alcaloides, flavonoides, polifenoles, triterpenos, esteroles y taninos, según las técnicas descritas por Marcano y Hasegawa (1991). La técnica de la TLC y el uso del reactivo de Dragendorff, revelaron la presencia de alcaloides en la sf1 MeOH/EtOAc. Resultados A partir del macerado de F. monophylla se obtuvieron 1 000 mg del extracto crudo, el cual resultó bioactivo frente a todos los organismos ensayados (Cuadro 1). El extracto una vez particionado con la mezcla de butanol/H2O (1:1) resultó en la formación de un extracto orgánico (935.3 mg) y una fase acuosa (Fig. 1). 20 µl (20 mg/ml) del extracto orgánico se emplearon para realizar las pruebas de susceptibilidad. Estas pruebas mostraron, que el extracto orgánico sólo presentó actividad antifúngica frente a A. flavus (30 mm), P. digitatum (40 mm) C. albicans (24 mm), y una actividad fungistática frente a P. funiculosum (Cuadro 1).

El fraccionamiento del extracto orgánico por VLC con disolventes de diferentes polaridades produjo las siguientes fracciones (fr.): fr. Hex (60.3 mg); fr. CH2Cl2 (80 mg) y la fr. MeOH (775 mg) (Fig. 1). Las pruebas de susceptibilidad realizadas a estas fracciones se muestran en el Cuadro 2. Se observa, que la fr. Hex provocó inhibición frente a todos los hongos ensayados. La fr. CH2Cl2 sólo provocó la inhibición de P. funiculosum (27 mm) seguido de P. digitatum (25 mm) y A. flavus (22 mm). Mientras que fr. MeOH presentó la mayor actividad antifúngica frente a P. digitatum (60 mm), P. funiculosum (56 mm), A. flavus (55 mm) y C. albicans. (26 mm).

El fraccionamiento cromatográfico de la fr. Hex. (60.3 mg) mediante un sistema de disolventes de polaridad creciente (100 % Hex a 100 % EtOAc), originó las fracciones: fr1 y fr2 Hex/EtOAc (Fig. 1), las cuales resultaron inactivas (Cuadro 3).
El fraccionamiento de la fr. CH2Cl2 (80 mg) mediante CLV, empleando la mezcla de disolventes: CH2Cl2/MeOH (100 % CH2Cl2, a 100 % MeOH), originó las fracciones frI y fr2 CH2Cl2/MeOH (34 mg y 26 mg respectivamente) (Fig. 1).
Las pruebas de susceptibilidad de las fracciones fr1 y fr2 CH2Cl2/ MeOH (Cuadro 3) mostraron que la fr1 CH2Cl2/ MeOH sólo inhibió a Paecilomyces sp. (39 mm); mientras que la fr2 CH2Cl2/ MeOH, inhibió el mayor número de organismos y mostró su mayor actividad frente a A. terreus (43 mm) (Cuadro 3).
El fraccionamiento de la fr. MeOH (775 mg) mediante CLV empleando un sistema de disolventes con un gradiente de polaridad decreciente (100 % MeOH a 100 % EtOAc) produjo la formación de las fr1 y fr2 MeOH/EtOAc (737.5 mg y 17.50 mg, respectivamente) (Fig. 2).
La fr1 MeOH/EtOAc, presentó actividad antifúngica frente a A. flavus (50 mm), P. digitatum (39 mm), C. albicans. (31 mm) y P. funiculosum (27 mm); mientras que la fr2 MeOH/EtOAc, inhibió además de estos organismos, el crecimiento de A. terreus (32 mm) y Paecilomyces sp. (30 mm).
De acuerdo a las cantidades obtenidas para las fracciones fr1 y fr2 CH2Cl2/MeOH (34 y 26 mg, respectivamente), y fr1 y fr2 MeOH/EtOAc (737.5 y 17.5 mg, respectivamente), sólo se pudo fraccionar la fr1 MeOH/EtOAc y para ello, se empleó el sistema de disolventes MeOH/EtOAc (100 % EtOAc a 100 % MeOH). Como resultado de este proceso, se obtuvieron las subfracciones (sf): sf1 (460.3 mg) y sf2 (257.2 mg) MeOH/EtOAc (Fig. 2), de las cuales, la sf1 MeOH/EtOAc mostró los mayores halos de inhibición frente a P. digitatum (45 mm), seguido de P. funiculosum (39 mm); mientras que la sf2 MeOH/EtOAc, mostró mayor actividad antifúngica frente a C. albicans (46 mm) y P. digitatum (40 mm) (Cuadro 4).

Concentración mínima inhibitoria: el Cuadro 5 presenta los valores de la CMI de la subfracción sf1 MeOH/EtOAc para A. flavus, P. funiculosun, P. digitatum y C. albicans. En el ámbito de las concentraciones empleadas (0.125-512 µg/ml), el 100 % de la inhibición de C. albicans ocurrió a una concentración de 32 µg/ml del extracto, y para P. digitatum a 128 µg/ml. Las concentraciones de la sf1 MeOH/EtOAc empleadas para A. flavus y P. funiculosum, no provocaron la total inhibición de estos organismos.

Las pruebas fitoquímicas realizadas al extracto orgánico y la prueba de Dragendorf realizada a la sf1 MeOH/EtOAc revelaron la presencia de alcaloides en ambos extractos (Cuadro 6).

Discusión
Las pruebas de susceptibilidad realizadas al extracto crudo de F. monophylla (Cuadro 1), revelaron la presencia de compuestos o familias de compuestos con actividad antifúngica, evidenciando de acuerdo al registro de la base de datos de NAPRALERT DB (2001), que los resultados obtenidos en esta investigación constituyen uno de los primeros reportes de las propiedades antifúngicas presentes en esta planta.
En contraste a la amplia actividad antifúngica presente en el extracto crudo de F. monophylla, las pruebas de susceptilidad realizadas a la fracción orgánica, sólo resultaron positivas contra A. flavus (30 mm), P. digitatum (40 mm), y C. albicans. (24 mm) (Cuadro 1), lo cual sugiere la presencia de un posible efecto sinérgico. Es probable, que la acción conjunta de diferentes sustancias presentes en el extracto crudo, pueda potenciar el efecto antifúngico, en contraste al menor efecto observado cuando estas sustancias actúan separadamente (Hardman et al. 1996, Hay y Fenical 1996, Fauci et al. 1998).
La fracción Hex. inhibió el crecimiento de todos los organismos estudiados (Cuadro 2), lo cual indica, que los compuestos orgánicos de baja polaridad presentes en esta fracción son capaces de inhibir el crecimiento de estos organismos. Mientras que las pruebas de susceptibilidad realizadas a la fr. CH2Cl2 y fr. MeOH (Cuadro 2), afectaron a un menor número de éstos; efecto que pudiera estar relacionado con algunos de los mecanismos de acción de las sustancias antifúngicas, como es la posible alteración de la permeabilidad de la membrana y su afinidad por ella (Vanden-Bossche 1997).
El fraccionamiento de la fr. Hex (60.3 mg) condujo a una pérdida de la actividad antifúngica presente en los compuestos de esta fracción (Cuadro 3), lo cual podría explicarse debido a un efecto sinérgico entre los compuestos de las fracciones fr1 y fr2 Hex/EtOAc (11.4 y 28.9 mg, respectivamente) (Cuadro 2).
La fr2 CH2Cl2/MeOH presentó la mayor actividad antifúngica; mientras que la fr1 CH2Cl2/MeOH (34 mg) prácticamente no mostró este tipo de actividad (Cuadro 3). Las diferencias en actividad entre estas fracciones y la actividad mostrada por la fr. CH2Cl2 de la cual provienen (Cuadro 2), probablemente se deba a que los compuestos existentes en esta última, pudieran ejercer entre sí cierto grado de interferencia o antagonismo (Hardman et al. 1996), que no les permite la máxima expresión de su actividad.
Si se comparan las actividades antifúngicas mostradas por la fr. MeOH (Cuadro 2) y las fr1 y fr2 MeOH/EtOAc (Cuadro 3), se observa, que el o los compuestos con actividad antifúngica que inhiben el crecimiento de A. flavus, están presentes en la fr1 MeOH/EtOAc. En contraste, A. terreus y Peacilomyces sp., los cuales no fueron inhibidos por la fr. MeOH (Cuadro 2), resultaron inhibidos por los compuestos presentes en la fr2 MeOH/EtOAc (Cuadro 3), lo cual sugiere un efecto sinérgico entre los compuestos de ambas fracciones.
A pesar de que la fr. MeOH provocó un halo de inhibición de 60 mm frente a P. digitatum y de 56 mm frente a P. funiculosum (Cuadro 2), su fraccionamiento condujo a una reducción casi equitativa de su actividad frente a estos organismos (Cuadro 3). De ello es posible inferir, que en la fr. MeOH existe un efecto combinado de sustancias que potencian su actividad frente a estos organismos (Cuadro 3). Para el caso específico de C. albicans, la fr1 MeOH/EtOAc provocó una mayor inhibición del crecimiento de este organismo (31 mm).
El Cuadro 4 muestra que la sf1 y sf2 MeOH/EtOAc presentaron un incremento de la actividad antifúngica para P. digitatum (45 y 40 mm respectivamente) y C. albicans (31 y 46 mm respectivamente), lo cual sugiere, que el fraccionamiento de la fr1 MeOH/EtOAc pudiera potenciar la acción antifúngica del extracto resultante para estos organismos.
El halo de inhibición (46 mm) provocado por la sf2 MeOH/EtOAc, frente a C. albicans (Cuadro 4), es de particular importancia, si consideramos la resistencia que este organismo presenta actualmente a diferentes antifúngicos: flucytosine, griseofulvina, azoles, (Albertson et al. 1996, Vanden-Bossche 1997) y anfotericina B (Ribaud 1997).
La CMI de la sf1 MeOH/EtOAc, para C. albicans, estuvo representada por una concentración de 32 µg/ml (Cuadro 5), la cual la ubica dentro de aquellos extractos de plantas que poseen un gran potencial con actividad antifúngica (Rios et al. 1988). Para P. digitatum, la CMI fue de 128 µg/ml (Cuadro 5), concentración considerada como de eficiente grado de inhibición (Cimanga et al. 1996). Las concentraciones mayores de 500 mg/ml observadas para A. flavus y P. funiculosum se consideran no activas (Rios et al. 1988).
El Cuadro 6, muestra que la naturaleza química del extracto orgánico de F. monophylla, contiene sustancias alcaloides, compuestos que ocurren comunmente entre otras especies del género Fagara y Xanthophyllum (Couillerot et al. 1996, Chen et al. 1996, Deyun et al. 1996). Así mismo, la prueba de Dragendorf reveló la presencia de compuestos alcaloides en la sf1 MeOH/EtOAc. La presencia de alcaloides en la sf1 MeOH/EtOAc de F. Monophylla corrobora los informes de Gundiza (1987), quien afirma, que muchos compuestos alcaloides poseen propiedades antibacterianas y antifúngicas.
Agradecimientos
Al Consejo de Investigación de la Universidad de Oriente.
Resumen
Fagara monophylla está distribuida en América Tropical. El género Fagara tiene diversidad de compuestos alcaloides con propiedades antibacterianas; sin embargo existe escasa información acerca de su actividad antifúngica. Evaluamos extractos de F. monophylla in vitro con los hongos Aspergillus terreus, A. flavus, Penicillium digitatum, P. citrinum, P. funiculosum, Paecilomyces y Candida albicans determinando la Concentración Mínima Inhibitoria (CMI). Hicimos pruebas de susceptibilidad con las fracciones Hex., CH2Cl2 y la MeOH. La mayor inhibición la presentó la fracción MeOH frente a A. flavus (55 mm), P. digitatum (60 mm), P. funiculosum (56 mm) y C. albicans (26 mm). Las actividades mostradas por las fracciones 1 y 2 de MeOH/EtOAc sugieren la acción de un efecto combinado frente a A flavus, P, digitatum y P. funiculosum. La CMI de la subfracción 1 MeOH/EtOAc frente a Candida albicans fue baja (32 µg/ml), y para P. digitatum la CMI fue moderada (128 µg/ml). Este extracto orgánico posee gran potencial de actividad antifúngica. Las pruebas fitoquímicas y los ensayos realizados por TLC al extracto orgánico y a la subfracción 1 MeOH/EtOAc, respectivamente, mostraron la presencia de alcaloides.
Palabras claves: actividad antifúngica, Fagara monophylla. hongos, MIC, extracto orgánico.
Referencias
Albertson, G.D., M. Niimi, R.D. Cannon & H.F. Jenkinson. 1996. Multiple efflux Mechanisms are involved in Candida albicans fluconazole resistance. Antimicrob. Agente Chemother. 40: 2835-2841. [ Links ]
Bauer, A., W. Kirby, I. Sherris & M. Turk. 1966. Antibiotic susceptiblility testing by standardized single disk method. Am. J. Clin. Pathol. 45: 493-496. [ Links ]
Chen, H., R.X. Tan, Z.L. Liu & Y. Zhang. 1996. Antibacterial neoclerodane diterpenoids from Ajuga lupulina. J. Nat. Prod. 59: 663-670. [ Links ]
Cimanga, K., T. De Bruyne, A. Lasure, B. Van Poel, L. Pieters, M. Claeys D. Van den Berghe, K. Kambu, L. Tobna & A.J. Vlietinck. 1996. In Vitro biological activities of alkaloids from Cryptolepis sanguinolenta. Plant Med. 62: 22- 27. [ Links ]
Coll, J.C. & B.F. Bowden. 1986. The aplication of vacum liquid chromatography to the separation of terpene mixture. J. Nat. Prod. 49: 934-936. [ Links ]
Couillerot, E., C. Caron, J.C. Audran, J.C. Jordillier & J.C. Chenieux. 1996. Furoquinoline alkaloids acumulation in Fagara zanthoxyloides cell cultures is highly dependent on the presence of exogenous benzylamino purine. Plant–growth regul. Kluwer Academic Publishers-Dordrecht. 3: 203-206. [ Links ]
De García, L.A, J. Calle & M.T. Reguero. 1989. Pthytochemical Study of Zanthoxylum monophulum. Fitoterapia 60: 447-450. [ Links ]
Delgado, A., S. Amich, S. Prieto & M. Salve. 1994. Laboratorio clínico de microbiología. McGraw-Hill, Madrid, España. [ Links ]
Deyun, K., A.I. Gray, T.G. Hartley & P.G. Waterman. 1996. Alkaloids from an Australian accession of Zanthoxylum. Biochem. Syst. Ecol. 1: 87-88. [ Links ]
Fauci, A.S., E. Brauunwald, K.J. isselbacher, J.D. Wilson, J.B. Martin, D.L. Kasper & Dan L. Longo. 1998. Harrison: Principios de Medicina Interna. McGraw Hill, México D.F., México. [ Links ]
Gundiza, M. 1987. Antimicrobial activities of Helinus integrifolius. Fitoterapia 58: 180-183. [ Links ]
Hardman, J.G., L.E. Limbird, P.B. Molinoff, R.W. Ruddon. 1996. Goodman & Gilman: Las bases farmacológicas de la terapéutuca. McGraw-Hill, México D.F., México. [ Links ]
Hay, M.E. & W. Fenical. 1996. Chemical ecology and marine biodiversity: insights and products from the sea. Oceanography 9: 10-20. [ Links ]
Huber, O., R. Duno, R.C. Riina, F. Staffer, L. Pappaterra, A. Jimínez, S. Llamozas & G. Orsini. 1998. Estado Actual del Conocimiento de la Flora en Venezuela. Ministerio del Ambiente de los Recursos Naturales Renovables. Programa de las Naciones Unidas para el Desarrollo, Caracas, Venezuela. [ Links ]
Index Kewensis Plantarum fanerogamun. 1895. Suplementos hasta 1955. Oxford University, Oxford, Inglaterra. [ Links ]
Jawetz, E., J.L. Melnick, C.A. Adelberg, G.F. Broooks, J.S. Butel, L.N. Ornston. 1992. Microbiología Médica. Manual Moderno, México D.F., México. [ Links ]
Kobayashi, H., M. Naminoshi, T. Yoshimoto & T. Yokochit. 1996. A screening method for antimicotic and antifungal sustance using conidia of Pycularia oryzae. Modification and application to tropical marine fungy. J. Antibiotics. 9: 573-879. [ Links ]
Pelletier, S.W. 1986. Separation of diterpenoid, alkaloid mixture using vacuum liquid chromatography. J. Nat. Prod. 49: 892-900. [ Links ]
Reisch, J., N. Brescacin & A.A. Gurni. 1994. Constituents of Fagara species from Argentina. Fitoterapia 65: 379. [ Links ]
Ribaud, P. 1997. Fungal infections and the cancer patient. Eur J. Cancer. 33: 550-554. [ Links ]
Rios, J.L., M.C. Recio & A. Villar. 1988. Screening methods for natural products of the literature. J. Phytopharmacol. 23: 127-149. [ Links ]
Schnee, L. 1984. Plantas comunes de Venezuela. Facultad de Agronomía. Universidad Central de Venezuela, Caracas, Venezuela. [ Links ]
Stermitz, F.R. & I. Sharifi. 1977. Alkaloids of Zanthoxulum monophylum and Z. puntatum. Phytochemistry 16: 2003-2006. [ Links ]
Stermitz, F.R., M.A. Caolo & J.A. Swinehart. 1980. Alkaloids and other constituents of Zanthoxyllum Williamsii, Z. Monophyllum and Fagara. Phytochemistry 19: 1464-1472. [ Links ]
Steyermark, J.A & O. Huber. 1978. Flora del Avila. Flora y Vegetación de las Montañas del Avila de la Silla y del Naiguatá. Publicación especial de la Sociedad Venezolana de las Ciencias Naturales, bajo los auspicios de Vollmer Foundation. Ministerio del Ambiente y de los Recursos Naturales, Caracas, Venezuela. [ Links ]
Touchstone, J. 1992. Practice of thin layer cromatography. Wiley, Nueva York, EEUU. [ Links ]
Vanden,-Bossche, H. 1977. Mechanisms of antifungal resístanse. Rev. Iberoam. Micol. 14: 44-49. [ Links ]
Referencias Internet
Etnobot, D.B. 1999. Taxon Fagara monophylla. Disponible en http://probenat.usda.gov.8500/egr-brn/webace/ubetnnobotubacrass-Genusaobject-Fagara;consultado 7-III-2006. [ Links ]












 uBio
uBio 

