Revista de Biología Tropical
versión On-line ISSN 0034-7744versión impresa ISSN 0034-7744
Rev. biol. trop vol.54 no.2 San José jun. 2006
Citotoxicidad del cadmio en hepatocitos de ratón albino y sus posibles implicaciones en ambientes tropicales
Letty Marcano1, Clarisa de R. Faría2, Ingrid Carruyo1 & Xiomara Montiel1
1 Facultad Experimental de Ciencias, Departamento de Biología, Universidad del Zulia, Venezuela. Telefax (0261) 7483012; lettymarcano@cantv.net; letty_marcano@hotmail.com
Correspondencia: Letty Marcano.
2 Facultad de Medicina, Cátedra de Histología, Universidad del Zulia, Maracaibo, Zulia, Venezuela.
Recibido 20-I-2005. Corregido 21-VIII-2005. Aceptado 24-IX-2005.
Abstract. Cadmium citotoxicity in mice hepatocytes and impications on tropical environments. We analyzed phenotypic, structural and ultrastructural alterations induced by Cd+2 in hepatocytes extracted from Swiss Albino mice. Cadmium was given orally in watery solution of CdCl2 during 100 days at concentrations of 50 ppm, 100 ppm and 150 ppm. In controls, distilled water alone was used. The samples were processed with the paraffin inclusion and hematoxilin-eosin coloration techniques for light microscopy. For transmission electron microscopy we used the conventional technique. We found phenotypic (size and weight differences) and physiologic changes (muscular weakness, unrest); at the structural level we noticed loss of trabecular disposition and of lobulillar architecture, lymphocyte agglomeration, vacuolization, dilatation of sinusoid and central vein, among others. The ultrastructural study evidenced alterations coincident with those seen with light microscopy, which were accentuated with the increase of metal concentration: nucleolus with a high number of fibrillar centers (50 ppm); voluminous lipidic drops in the cytoplasm, loose endoplasmic rough reticulum, citoplasmatic vacuolization, altered lisosomes and peroxisomes (100 ppm); contracted nuclei with condensed cromatine, dilatation of intracellular space and mitochondria, and loss of fibrillar areas (150 ppm). Cadmium produces a toxic effect in the hepatic cells; the effect is more severe at higher concentration, leading to cellular necrosis. Rev. Biol. Trop. 54(2): 257-263. Epub 2006 Jun 01.
Key words: cadmium, citotoxity, hepatocytes, histology, ultrastructure.
El uso del cadmio se ha extendido rápidamente y su eliminación se ha convertido en un problema de salud (Benin 1999), que se ha venido generalizando en los países latinoamericanos y esta teniendo un impacto en los ecosistemas tropicales (García-Céspedes et al. 2004, Salazar et al. 2004, Cordero et al. 2005). Este se obtiene como un subproducto de la fundición del cobre, plomo y cinc, y es utilizado en la industria de la galvanoplastía, en la fabricación de baterías y cerámicas, como pigmento en pinturas, como estabilizador de plásticos y en la elaboración de plaguicidas y fertilizantes (Doli 1993). Al ser fácilmente absorbido y acumulado en los tejidos por períodos largos, el cadmio causa daños en diversos órganos (Swiergoz et al. 1998).
En los animales superiores el cadmio se acumula principalmente en hígado y riñón (Doli 1993), pudiendo llegar a concentraciones superiores a lo permisible según la Administración de Salud y Seguridad Ocupacional (OSHA 1992). En el organismo se une a la metalotioneina (Hamada et al. 1996, Conto et al. 1997) y cuando su concentración sobrepasa la síntesis de esta proteína, induce alteraciones tales como: neuropatía, nefropatía, osteopatía y cáncer (Allison et al. 1996, Orlowski et al. 1998, Croute et al. 2000). En invertebrados, como crustáceos y moluscos, gran parte del cadmio se une a la metalotioneina o bien a proteínas similares y se acumula en el hepatopancreas en forma de complejos metalotioneina-cadmio (Rengel et al. 1993, Fernández et al. 2000).
Existen informes del efecto que produce el cadmio en organismos vivos; por ejemplo, en peces induce alteraciones del crecimiento y reproducción (Rengel et al. 1997, Bouche et al. 2000), en el cangrejo marino Mitrax verrucosus origina un significativo retardo en el desarrollo de las larvas (Rengel et al. 1993). También se ha establecido el efecto genotóxico y clastogénico tanto en tejido vegetal (Zhang y Yang 1994, Marcano et al. 1998) como en tejido animal (Sánchez-Galan et al. 2001) y en cultivos celulares (Azzouzi et al. 1994, Tsangaris y Tzortzatou-Stahopoulou 1998).
En el presente trabajo se realizó el estudió de las alteraciones histológicas y ultraestructurales en hepatocitos de ratones albino suizo (Mus musculus), expuestos experimentalmente al cloruro de cadmio (CdCl2).
Materiales y métodos
Se utilizaron 82 ratones hembras, destetados, de 22 días de nacidos, con una talla y peso promedio de 6.41±0.53 cm y 22.34±2.3 g, los cuales recibieron una dieta estándar basada en un alimento comercial (ratarina-purina), mantenidos y tratados de acuerdo a las "Normas de bioética y bioseguridad para la investigación con organismos vivos, ambiente y bioterios", establecidas por el Ministerio de Ciencia y Tecnología y el Fondo Nacional de Ciencia, Tecnología e Innovación (Venezuela), para el uso de animales de experimentación.
Los animales fueron distribuidos en tres grupos: Grupo A.- 16 ratones control, sometidos a ingesta at libitum con agua destilada por un período de 100 días. Grupos B, C y D, constituidos por 22 ratones cada uno, a los cuales se les sustituyó el agua destilada por solución de CdCl2 a concentraciones de 50 ppm, 100 ppm y 150 ppm respectivamente.
Finalizada la fase experimental, los animales fueron anestesiados con éter, sacrificados y extraído su hígado, que fue cortado en secciones sagitales y transversales, para ser procesado por microscopía óptica y electrónica.
Procesamiento para microscopía óptica. Las muestras se fijaron en formaldehído al 40% tamponado con amortiguador fosfato 0.1 M pH 7.6 durante 3 días, luego deshidratadas en concentraciones crecientes de etanol, infiltradas e incluidas en parafina para la realización de cortes de 2 a 3 µy su posterior tinción con la técnica de hematoxilina-eosina y observación en un fotomicroscopio, modelo Carl Zeiss.
Procesamiento para microscopía electrónica. Se fijaron las muestras en glutaraldehído al 2% en amortiguador cacodilato 0.1 M pH 7.2 por 2 hr a temperatura ambiente y post-fijadas en tetraóxido de osmio al 1% en el mismo buffer por 1 hr. Posteriormente se deshidrató con etanol y óxido de propileno e infiltró en resina poliester Araldita 502, realizándose cortes de 200 a 400 Å, que fueron teñidos por la técnica de acetato de uranilo y citrato de plomo, para ser observados en un microscopio electrónico de transmisión (Hitachi H-500) a 100 KV.
Resultados
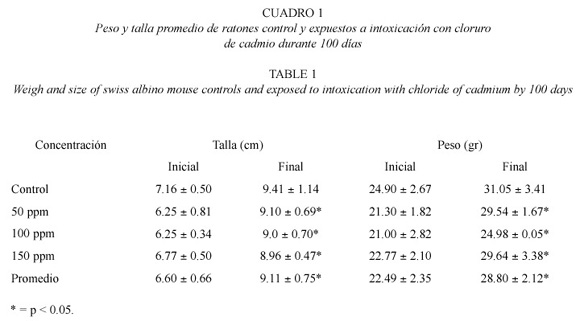
Cambios fenotípicos y/o fisiológicos. Posterior a los 30 días de iniciado el ensayo, todos los animales expuestos al toxico comenzaron a presentar cambios, no observados en los controles, los cuales se acentuaron a medida que la concentración de CdCl2 y el tiempo de exposición se incrementó, entre estos cambios se observó: pigmentación y caída del pelo, oscurecimiento de los ojos, debilidad muscular e intranquilidad. También se observaron diferencias en la talla y el peso con respecto a los controles al aplicar la prueba t de student (Cuadro 1).
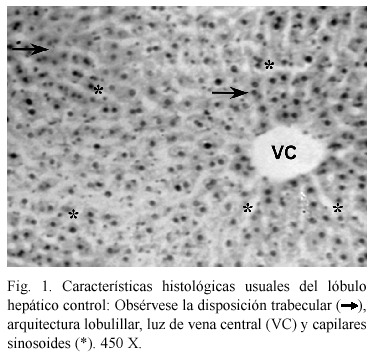
Alteraciones histológicas. En la Fig. 1 se presenta un corte histológico del lóbulo hepático control, mostrando la disposición trabecular, arquitectura lobulillar, luz de vena central y capilares sinosoides con patrones normales.
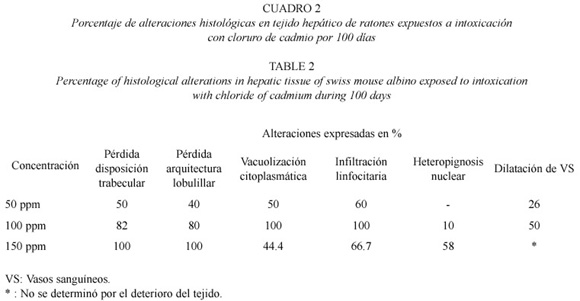
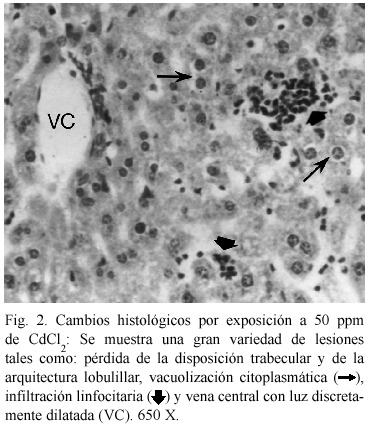
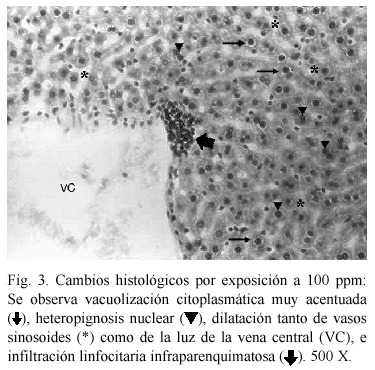
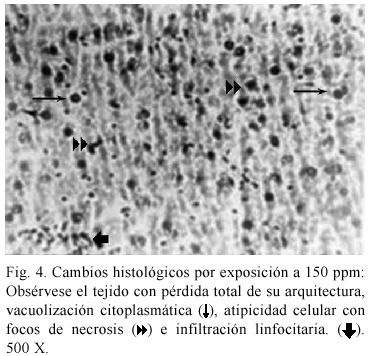
El resultado del análisis de los ratones expuestos reveló diversas alteraciones histológicas en todos los animales sometidos a intoxicación con cloruro de cadmio (Cuadro 2). A 50 ppm (Fig. 2), se muestra pérdida de la disposición trabecular y de la arquitectura lobulillar, vacuolización citoplasmática, infiltración linfocitaria y vena central con luz discretamente dilatada. La Fig. 3. muestra los cambios histológicos ocasionados por la exposición a 100 ppm. Se observó vacuolización citoplasmática muy acentuada, heteropignosis nuclear, dilatación de vasos sinosoides así como de la vena central, e infiltración linfocitaria infraparenquimatosa; se observa además la presencia de células binucleadas. La Fig. 4 muestra las alteraciones en los hepatocitos de animales expuestos a 150 ppm, obsérvese el tejido con pérdida total de su arquitectura, vacuolización citoplasmática, atipicidad celular con focos de necrosis e infiltración linfocitaria.
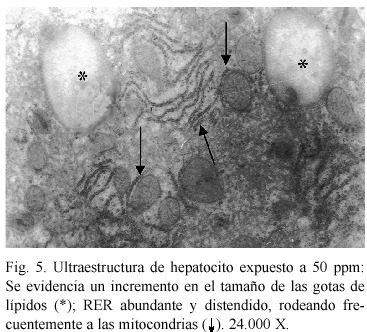
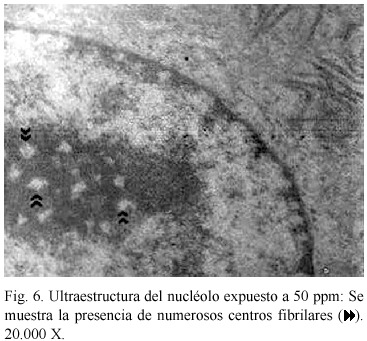
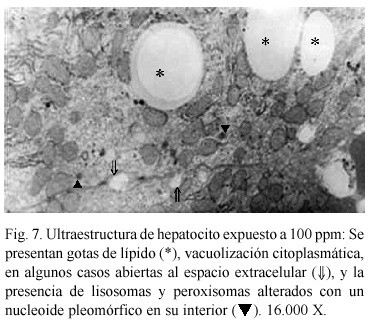
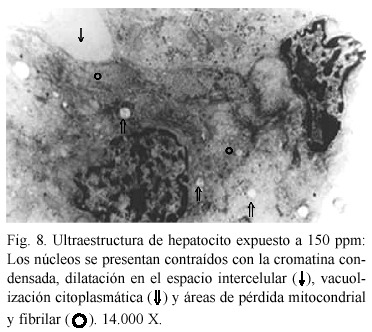
Alteraciones ultraestructurales. El análisis ultraestructural refleja cambios en los organelos que se relacionan con un aumento de la actividad metabólica. A concentración de 50 ppm, se evidenció un aparente incremento en el tamaño de las gotas de lípidos; retículo endoplasmático rugoso (RER) abundante y distendido, rodeando frecuentemente a las mitocondrias (Fig. 5); también se observó un nucleolo caracterizado por la presencia de numerosos centros fibrilares (Fig. 6). A 100 ppm (Fig. 7), se presentan gotas de lípidos, vacuolización citoplasmática, en algunos casos abiertas al espacio extracelular y la presencia de lisosomas y peroxisomas alterados con un nucleoide pleomórfico en su interior. Cuando se aumenta la concentración hasta 150 ppm, los cambios observados fueron más drásticos, los núcleos se presentan contraídos con la cromatina condensada, existiendo dilatación en el espacio intercelular, vacuolización citoplasmática y áreas de pérdida mitocondrial y fibrilar (Fig. 8).
Discusión
Los resultados obtenidos por microscopía óptica, reflejan la citotóxicidad del metal posiblemente como consecuencia del efecto inhibitorio sobre las enzimas responsables del mantenimiento de la integridad celular, tal como lo señalan Vaglio et al. 1999. Korotkov et al. 1998 sugieren que el cadmio altera la estructura de la membrana celular y mitocondrial por su efecto inhibitorio sobre la actividad de las enzimas glutatión reductasa, glutatión peroxidasa y catalasa; reportando además cambios de permeabilidad de la membrana interna mitocondrial, instaurando un incremento de la permeabilidad al K+2 y al H+2. Koizumi et al. 1996 establecen que el cadmio produce inhibición de la ATPasa Na+2 – K+2, originando un incremento del sodio intracelular lo cual ocasiona retención de agua e histolisis celular. Las manifestaciones reportadas en esta investigación son compatible con una hepatitis crónica inespecífica (Cotran 1992, Doli 1993).
La presencia de células binucleadas observadas, podrían ser consecuencia de la despolimerización de la actina, proteína requerida para la citoquinesis en células animales (Wanz y Templeton 1996) y como consecuencia del papel antagónico del cadmio con el calcio (Koizumi et al. 1996, Carfagna et al. 1996).
La distensión, proliferación y disposición del RER alrededor de las mitocondrias, observadas en el análisis ultraestructural, pueden ser el resultado de reacciones del hepatocito ante el agente tóxico, probablemente producto del aumento en la síntesis de proteínas, evidenciada por la cantidad de centros fibrilares encontrados, ya que son considerados como organizadores nucleolares en fase activa o transcripcional (Scheers et al. 1994, Marcano et al. 2002). El incremento de gotas de lípidos y las variaciones en los peroxisomas, se relaciona con una alteración en el metabolismo de los lípidos tal y como lo describen Koizumi et al. 1996.
Las alteraciones observadas a 150 ppm son compatibles con una necrosis celular inducida por el tóxico, tal y como ha sido reportado por otros autores (Doli 1993, Orlowski et al. 1998).
Los resultados coinciden con los obtenidos utilizando este y otros metales en diversos sistemas biológicos (Cotran 1992, Rengel et al. 1997, Pulido et al.1998, Benin et al. 1999, Marcano et al. 2001, 2002).
Los resultados permiten sugerir que el cadmio ejerce un efecto citotóxico en los hepatocitos de animales sometidos a intoxicación crónica, probablemente como consecuencia del estrés oxidativo y manifestado con alteraciones en la actividad biosintética y en el metabolismo de lípidos, el cual se hizo mas severo con el aumento de la concentración, pudiendo conllevar a una necrosis celular.
Agradecimiento
Las autoras expresan su agradecimiento a la División de Investigación de la Facultad Experimental de Ciencias y al Consejo Científico y Humanístico (CONDES) de la Universidad del Zulia por el financiamiento de éste trabajo.
Resumen
Se realizó un análisis de las alteraciones fenotípicas, estructurales y ultraestructurales inducidas por Cd+2 en hepatocitos de ratón albino suizo. El metal fue suministrado vía oral en solución acuosa de CdCl2 durante 100 días a concentraciones de 50 ppm, 100 ppm y 150 ppm, en los controles la solución de cadmio fue sustituida por agua destilada. Las muestras fueron procesadas utilizando la técnica de inclusión en parafina y teñidas con hematoxilina- eosina para microscopía óptica y por la técnica convencional para microscopía electrónica de transmisión. Identificamos cambios fenotípicos (diferencias entre talla y peso) y fisiológicos (debilidad muscular e intranquilidad); a nivel histológico, pérdida de la disposición trabecular y de la arquitectura lobulillar, focos de aglomerados linfocíticos, vacuolización, dilatación de sinosoides y de la vena central. El estudio ultraestructural señala diversas alteraciones tales como: nucléolo con un elevado número de centros fibrilares (50 ppm); voluminosas gotas de lípidos en el citoplasma, retículo endoplasmático rugoso distendido, vacuolización citoplasmática, lisosomas y peroxisomas alterados (100 ppm); núcleos contraídos con cromatina condensada, dilatación en el espacio intracelular y áreas de pérdida mitocondrial y fibrilar (150 ppm). Sugerimos que el cadmio ejerce un efecto tóxico en las células hepáticas el cual se hace más severo con el aumento de la concentración, llevando a la necrosis celular.
Palabras clave: cadmio, citotoxicidad, hepatocitos, histología, ultraestructura.
Referencias
Allison, K., E. Cerny, D. Smith, A. Wagh & M. Bhattacharyya. 1996. Effects of Cadmium on Osteoclast Formation and Activity in Vitro. Toxicol. Appl. Pharm. 140: 451-460. [ Links ]
Azzouzi, B., G. Tsangaris, O. Pellegrini & J. Benveniste. 1994. Cadmium induce apoptosis in a human cell T line. Toxicology 88: 127-139. [ Links ]
Benin, A., J. Sargent, M. Dalton & S. Rodaks. 1999. High concentrations of heavy metals in neighborhoods near ore smelters in northern Mexico. Environ. Health. Persp. 107: 4. [ Links ]
Bouché, L., F. Habets, S. Biagianti-Risbourg & G. Vernet. 2000. Toxic effects and bioaccumulation of admium in the aquatic oligochaete Tubifex tubifex M. Ecotox. Environ. Safe. 46: 246–251. [ Links ]
Carfagna, Ma., G. Ponsier & B. Muhoberac. 1996. Inhibition of ATPase activity in rat synaptic plasma membranes by simultaneous exposire to metals. Chem. Biol. Interac. 100: 53-65. [ Links ]
Conto, C., M. Petit-Ramel, R. Faure & D. Garin. 1997. Cadmium bioaccumulation in Carp (Cyprinus carpio) tissues during long-term high exposure: analysis by inductively coupled plasma-mass spectrometry. Ecotox.. Environ. Safe. 38: 137-143. [ Links ]
Cordero, J., M. Guevara, E. Morales & C. Lodeiros. 2005. Efecto de metales pesados en el crecimiento de la microalga tropical Tetraselmis chuii (Prasinophyceae). Rev. Biol. Trop. 53: 325-330. [ Links ]
Cotran. R. 1992. Patología Estructural y Funcional. Interamericana. Vol. II. México, D.F. 1012. p. [ Links ]
Croute, F., B. Beau, C. Arrabit, Y. Gaubin, F. Delmas, J.C. Murat & J.P. Soleilhavoup. 2000. Pattern of Stress Protein Expression in Human Lung Cell-Line A549 after Short- or Long-Term Exposure to Cadmium. Environ. Health. Persp. 108(1): 55-60. [ Links ]
Doli, R. 1993. Cadmium in the human environment. Toxicity and Carcinogenicity. Oxford University, Oxford, Inglaterra. 496 p. [ Links ]
Fernández-Leborans, G. & Y. Olalla Herrero. 2000. Toxicity and bioaccumulation of lead and cadmium in marine protozoan communities. Ecotox. Environ. Safe. 47: 266-276. [ Links ]
García-Céspedes, J., J. Acuña-González & J.A. Vargas- Zamora. 2004. Metales traza en sedimentos costeros de Costa Rica. Rev. Biol. Trop. 52 (Supl. 3A): 51-60. [ Links ]
Hamada, T., T. Sasaguri, A. Tanimoto, N. Arima., S. Shimajiri., T. Abe & Y. Sasaguri. 1996. Apoptosis of Human Kidney 293 Cells Is Promoted by Polymerized Cadmium-Metallothionein. Biochem. Biophys. Res. Commun. 219: 829-834. [ Links ]
Koizumi, T., H. Shirakura, H. Kumagai, H. Tatsumoto & T. Suzuki. 1996. Mechanism of cadmium induce cytotoxicity in rat hepatocytes: cadmium induce active oxygen - related permeability changes of the plasma membrane. Toxicology 114: 125-134. [ Links ]
Korotkov, S., I. Skuiskii & V. Giazunov. 1998. Cd+2 effects on respiration and swelling of rat liver mitochondria were modified by monovalent cations. J. Inorg. Biochem. 70: 17-23. [ Links ]
Marcano, L., X. Montiel, I. Carruyo, M. Bracho & L. Atencio. 1998. Efecto mitotóxico y genotóxico del cadmio en células meristemáticas de cebolla (Allium cepa L.). Ciencia 6(2): 93-99. [ Links ]
Marcano, L., I. Carruyo & X. Montiel. 2001. Alteraciones citológicas inducidas por el cadmio en células meristemáticas de raíces de cebolla (Allium cepa L.). Rev. Fac. Agrom. 18: 247-487. [ Links ]
Marcano, L., I. Carruyo, A. Del Campo & X. Montiel. 2002. Effect of cadmium on the nucleoli of meristematic cells of onion Allium cepa L: An ultrastructural study. Environ. Res. 88: 30-35. [ Links ]
Occupational Safety & Health Administration. (OSHA). 1992. Occupational Exposure to Cadmium. Std. 29CFR 1910-1927. [ Links ]
Orlowski, C., J. Piotrowski, J. Subdys & A. Gras. 1998. Urinary cadmium as indicator of renal cadmium in humans and autopsy study. Hum. Exp. Toxicol. 17: 302-306. [ Links ]
Pulido, M., A. Rodríguez, H. Finol, A. Márquez, M. Girón, I. Aguilar & B. Bello. 1998. Ultrastructural changes in mouse hepatocytes caused by Crotalus vegrandis venom. International Congress on Electron Microscopy. Cancun, Mexico. (CD). [ Links ]
Rengel, I., K. Chung, J. Bolaños & J. Fermín. 1993. Efecto de la interacción entre el cadmio, la salinidad y la temperatura sobre el desarrollo larvar de Mitrhax verrucosus. Milne Edward. 1832. (Crustacea, Decapoda, Majidae). Ciencia 1: 13-25. [ Links ]
Rengel, I., R. Salas, M. Chávez, A. González, B. Borges & E. Bonalde. 1997. Respuestas histológicas y genéticas inducidas por el cadmium en la tilapia roja (Pices; Cichlidae, Oreochromis sp). Ciencia 5(3): 191-204. [ Links ]
Salazar M., A., O.G. Lizano & E.J. Alfaro. 2004. Composición de sedimentos en las zonas costeras de Costa Rica utilizando Fluorescencia de Rayos-X (FRX). Rev. Biol. Trop. 52 (Suppl. 2): 61-75. [ Links ]
Sánchez-Galán, S., A. Linde, F. Aylion & E. García- Vazquez. 2001. Induction of micronuclei in Eei (Anguilla anguilla L.) by heavy metals. Ecotox. Environ. Safe. 49: 139-143. [ Links ]
Scheers, S. & D. Weisemberg. 1994. The nucleolus. Curr. Cell Biol. 6: 354-359. [ Links ]
Swiergosz, R., M. Zakrzewska, K. Sawicka-Kapusta, K. Bacia & I. Janowska. 1998. Accumulation of cadmium in and its effect on bank Vole tissues after chronic exposure. Ecotox. Environ. Safe. 41: 130-136. [ Links ]
Tsangaris, E. & F. Tzortzatou-Stahopoulou. 1998. Cadmium induces apoptosis differentially on immune system cell lines. Toxicology 128: 143-150. [ Links ]
Vaglio, A. & C. Lansdriscina. 1999. Changes in liver enzyme activity in the Teleost Sparus aurata in response to cadmium intoxication. Ecotox. Environ. Safe. 43: 111-116. [ Links ]
Wang, Z. & D. Templeton. 1996. Cellular Factors Mediate Cadmiun-Dependent Actin Depolymerization. Toxicol. Appl. Pharm. 139: 115-121. [ Links ]
Zhang, Y. & X. Yang. 1994. The toxic effects of cadmium on cell division and chromosomal morphology of Hordeum vulgare. Mutation Res. 312: 121-126. [ Links ]












 uBio
uBio