Revista de Biología Tropical
versión On-line ISSN 0034-7744versión impresa ISSN 0034-7744
Rev. biol. trop vol.49 no.2 San José jun. 2001
Abstract
The trophic and reproductive ecology of catfish (Trichomycterus caliense and Astroblepus cyclopus) was studied in the Quindio River upper Basin, Alto Cauca, Colombia. The pH was neutral, water oxygen content high (8.4 ppm) and temperature in the habitats was 18.63ºC; both species are nonmigratory and sympatric with four other fish species. The ovaries mature primarily between May and September in T. caliense; between December and May in A. cyclopus. The mean size at maturity is 8.3 cm (standard length) in T. caliense and 6.0 cm (standard length) in A. cyclopus; the sex ratio is 1:1 in T. caliense (X²=3.4, P>0.05) and in A. cyclopus (X²=1.44, P>0.1); the fecundity is low (191 and 113 oocytes respectively) and the eggs are small (1.5 and 2.39 mm respectively). The fishes are insectivorous and specialize in Coleoptera, Diptera and Trichoptera; Spearman Rank Correlation Coefficients (rs=0.464) indicated that there are differences (T= 2.5148, P<0.01) between their diets; both taxa did not agree with the expected trophic habits for sympatric species that are morphologically similar and related in the same trophic level.
Key words
Ecology, trophic, reproduction, neotropical, catfish, Trichomycterus caliense, Astroblepus cyclopus.
Los Andes y regiones de pradera de Sur América se caracterizan por la presencia de especies en pequeñas fuentes de agua como es el caso del género Trichomycterus de amplia distribución en el neotrópico (Pinna 1992) y del único género de la familia Astroblepidae, Astroblepus (Buitrago 1995), donde cumplen un papel muy importante en el equilibrio de los organismos acuáticos; el cual se ha conseguido a través de una evolución local, lo que indica una fauna endémica asociada muy especialmente con el ambiente (Collett 1962, Miles l971, Arratia y Menú 1984, Buitrago-Suarez y Galvis 1997). Los siluriformes son uno de los elementos representativos de la fauna suramericana y de los taxones lóticos, los antecedentes sobre su hábitat y ciclos de vida son escasos y generales, lo cual es básico para predecir sus respuestas a cambios drásticos de las poblaciones (Arratia 1983, Power et al. 1988).
Astroblepus y Trichomycterus poseen hábitos predominantemente nocturnos, se logran capturar con nasa, costales y anzuelos. Durante el día se esconden en cuevas, por debajo de las piedras, troncos y bajo la vegetación ribereña (Dahl 1971). Astroblepus cyclopus y T. caliense fueron abundantes en todas las cuencas hidrográficas del Alto Cauca. Actualmente las poblaciones están diezmadas debido a la contaminación, destrucción de la vegetación ribereña e introducción de especies exóticas, voraces y agresivas (Arratia 1983). Por lo tanto, se pretende determinar aspectos biológicos de T. caliense y A. cyclopus en la cuenca alta del río Quindio, especies que presentan importancia como peces de consumo en la región.
Materiales y Métodos
Se realizaron muestreos mensuales diurnos y nocturnos desde noviembre de 1994 hasta noviembre de 1995 en quebradas o drenajes de tipo primario y secundario en la parte alta del río Quindio (4º3602 N y los 75º3713 W) entre los 1500-1800 m. En total se examinaron 118 ejemplares de A. cyclopus y 142 de T. caliense. Las capturas se efectuaron con anzuelo, costal y nasa. Las muestras obtenidas se conservaron in situ en hielo y de esta manera se transportaron al laboratorio de ictiología, Depto. de Biología de la Universidad del Quindio en Armenia, Colombia y en donde se depositaron muestras representativas (IUQ 273 y IUQ 425).
Los parámetros físicos y químicos se determinaron mensualmente en tres estaciones de trabajo. El pH se determinó con potenciómetro, el oxígeno disuelto y las temperaturas con oxímetro, el ancho y la profundidad de las fuentes de agua con flexómetro y vareta graduada, el color por observación directa.
A la frecuencia mensual para machos y para hembras de cada especie se le aplicó la prueba de Chi cuadrado. La relación longitud total- peso total se determinó a través de correlación simple (Pearson) para 37 hembras y 39 machos de T. caliense; 61 hembras y 45 machos de A. cyclopus. El factor de condición se obtuvo mediante la ecuación K= W/LT (Ricker 1971). La talla de maduración gonadal a través del método estadístico gráfico. La relación gonosomática (IGS) se determinó con la fórmula: IGS= Wo/Wt X 100, siendo Wo=Peso gónada (g) y Wt= peso total (g). Para la fecundidad, se tomaron oocitos maduros previamente fijados en formol al 5% para su posterior secado a 40ºC durante 20 minutos y así realizar el conteo directo. Con los métodos de frecuencia de ocurrencia y numérica (Hyslop 1980), se realizó el análisis de los presentes items en 117 estómagos de A. cyclopus y en 95 de T. caliense. La comparación de dietas se realizó por correlación de Spearman (rs), y se comprobó su significancia con una prueba t. La aplicación de este método estadístico se da como criterio ecológico en sistemática, sobre grupos estructuralmente similares y en especies simpátricas filogenéticamente relacionadas (Fritz 1974).
Resultados
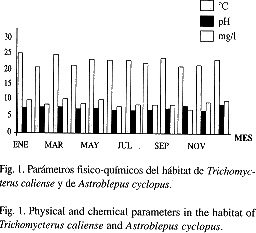
Hábitat:Las especies habitan principalmente en pequeñas quebradas de tipo primario y secundario, aunque se localizaron en la arteria principal de la cuenca, pero en poca cantidad. En general, presentaron amplia distribución en la región, ya que se colectaron en todos los sitios muestreados. Los hábitats se caracterizaron por presentar aguas claras durante todo el año, tienen en promedio una profundidad de 15.35 cm (9.0-21.9 cm), y un ancho de 115.3 cm (98-146 cm). Los parámetros físico químicos fluctuaron muy poco durante el año y entre los períodos secos y lluviosos, en general registraron una temperatura ambiente de 21.72ºC (19.75-24ºC) y del agua de 18.63ºC (18.19-25ºC), pH 6.86 (6.46-7.12), oxígeno disuelto 8.35mg/lt (6.15-10.5 mg/lt) (Fig. 1). En cada uno de los sitios muestreados, se observó un flujo constante de agua, aunque en el período seco puede disminuir considerablemente. En sus recorridos presentaron rápidos, sitios de pequeñas caídas, ocasionadas por las pendientes del terreno, típicos de alta montaña neotropical y sitios de flujo y charcos, los cuales son preferidos por las especies objeto de este artículo. En la región las orillas de las quebradas se hallaron muy poco protegidas e inclusive sin vegetación; los pocos sitios que aún tienen pequeñas franjas protectoras están compuestos principalmente por bosque de tipo secundario con una población arbustiva considerable entre las cuales predomina la matandrea Hedichium coronarium, también se observó pequeños guaduales, zonas de pasto y cultivos de café y plátano que invaden hasta la orilla. El comportamiento de temperatura en los sitios de trabajo fue diferente, con pocas variaciones entre los lugares y a lo largo del período del estudio (Fig. 1). En el pH se observaron variaciones muy marcadas, pero la tendencia es hacia la neutralidad. El oxígeno disuelto fue relativamente elevado y con pocas fluctuaciones, además, la estructura física de la superficie de las quebradas esta influenciada por yuxtaposición con la atmósfera terrestre. Por lo tanto se da intercambio entre la atmósfera y la superficie del agua. Lo que da como resultado alta concentración de oxígeno disuelto en estos hábitats (Jones y Holmes 1996). Además, se observó asociación estrecha entre la temperatura y la concentración de oxígeno disuelto (Fig. 1). El ancho y profundidad de las quebradas o pequeños drenajes son relativamente constantes a lo largo del año. Se logró observar que las quebradas no alteran sus caudales por períodos largos, sufren aumentos después de un fuerte aguacero y regresan a su cauce normal rápidamente, debido a que las quebradas son de trayecto corto y se localizan en terrenos de alta montaña neotropical. En general el ancho vario entre 80-180 cm (promedio 115 cm) y la profundidad fluctúo entre 6.5-32.5 cm (promedio 15.35 cm).
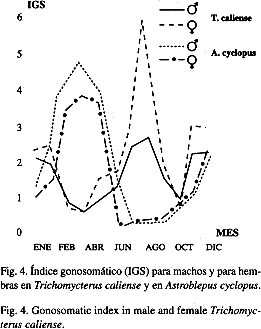
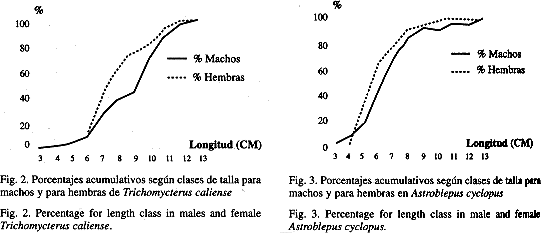
Reproducción: Predominaron, en ambas especies, las hembras sobre los machos. En T. caliense se descubrió de junio a septiembre y noviembre un incremento considerable en las hembras, lo que se relacionó con los períodos de desove de la especie. De igual manera, A. cyclopus registró un aumento de febrero a marzo y de junio a septiembre, lo cual coincidió con su período de reproducción y con la época de lluvias mínimas. Sin embargo, los datos no se desviaron de la proporción 1: 1 esperada (X²= 3.4, P> 0.05 g.l.=1) en T. caliense y en A. cyclopus (X² = 1.44, P> 0.1 g.l.= 1). T. caliense registró una fecundidad promedio de 191 (170-223) ovocitos por hembra en estado de predesove, con un diámetro promedio de 1.5 mm (1.24-1.74). A. cyclopus obtuvo una fecundidad media de 113 (107-120) oocitos por hembra y un diámetro de 2.39 mm (2.08-2.66 mm) relativamente grandes. Las diferencias entre el número de ovocitos en ambas especies se debe a la predación que ejerce A. cyclopus sobre T. caliense, el 1.42% de la alimentación total de A. cyclopus son larvas y alevinos de T. caliense (Cuadro 1). Además, el número total de individuos capturados de T. caliense (1003 ejemplares o sea el 42.97%) es alto frente a A. cyclopus (623 individuos que corresponden al 25.84%). Los machos de T. caliense alcanzaron la talla mínima de maduración a los 3.0 cm de longitud estándar y el 50% lo realizó a los 9.2 cm; la talla mínima de maduración en hembras es de 6.0 cm de longitud estándar y el 50% de la población lo efectuó a los 7.4 cm (Fig.2) para la cual se requiere establecer una talla mínima de captura de 8.3 cm de longitud estándar para machos y para hembras. Los machos A. cyclopus alcanzaron su talla mínima de maduración a los 3.0 cm de longitud estándar y en hembras de 4.0 cm o sea que el 50% lo hace a los 5.6 cm de longitud estándar (Fig. 3) por lo tanto se deberá establecer una talla mínima de captura de 6.0 cm de longitud estándar. Se logró identificar que T. caliense se reproduce anualmente en aguas lóticas, y su período reproductivo se extiende desde mayo hasta septiembre, con un pico reproductivo en agosto (Fig. 4), lo cual incidió con la época lluviosa (septiembre), sin embargo la maduración gonadal se da en periodo seco (junio-agosto), pH, ancho y profundidad bajos. Lo cual sugiere que el desove se dió al inicio de las primeras lluvias. Durante el período del estudio no se observaron en T. caliense caracteres externos, que pudieran diferenciar machos y hembras, excepto cuando están en estado de predesove se puede distinguir las hembras por el abultamiento en la región abdominal y la coloración amarilla. Manriquez et al. (1988) observó lo mismo en T. areolatus. En A. cyclopus se logró observar en los machos la presencia de una prolongación de tejido a partir del poro urogenital (u órgano copulador), el cual varía en longitud según el estado de desarrollo gonadal, y alcanzó registros de 1.2 mm en estadio I, hasta 13.2 mm en estadios III y IV.
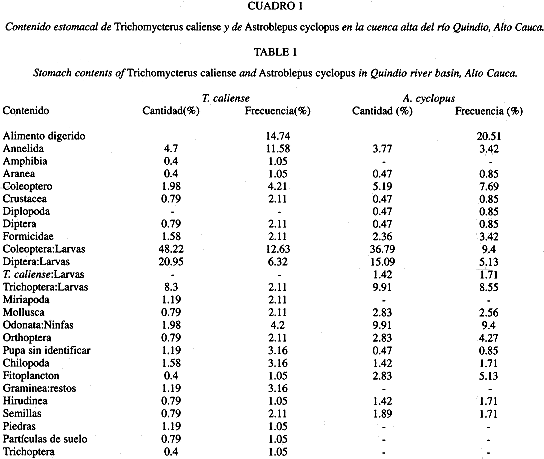
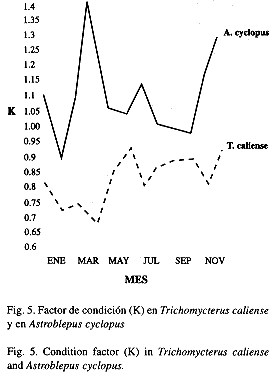
Alimentación: Los estómagos de ambas especies corresponden al tipo 2A propuesto por Vegas (1977). Se observaron tres regiones básicas: fúndica, cardial y pilórica; la fúndica y la cardial se dilatan a un más en el momento de digerir el alimento. Las paredes de estos estómagos son musculosas y fuertes, aunque en A. cyclopus son más gruesas y de un color blanquecino, mientras en T. caliense se torna de un color que va desde rosado claro hasta rosado intenso. Los estómagos de T. caliense tienen una longitud promedio de 3.4 cm (1.1-5.7 cm) mientras en A. cyclopus tienen un promedio de 2.55 cm (1.2-3.9 cm). El ancho del estómago en T. caliense registró un valor promedio de 0.74 cm (0.28-1.2 cm), mientras A. cyclopus presentó una media de 1.2 cm (0.2-2.3 cm). En T. caliense la dieta (cuadro 1) lo componen larvas de Coleoptera (48.22%), Diptera (20.95%), Trichoptera (8.3%) y adultos de Annelida (4.7%). Los coleópteros predominaron en el segundo semestre del año, mientras los dípteros sobresalieron en enero, febrero, abril, junio, julio y agosto; los tricópteros en marzo, agosto y septiembre, y los anélidos superaron en abril, mayo y julio. Por el método de frecuencia de ocurrencia se logró determinar que los taxones más frecuentes son larvas de Coleoptera (12.63%) y adultos de Anelida (11.58%). En A. cyclopus los hábitos alimenticios (cuadro 1) lo conformaron las larvas y adultos de Coleoptera (41.98%), Diptera (15.09%), Trichoptera y ninfas de odonata (9.91%). Los coleópteros dominaron en marzo, junio y agosto a octubre; los dípteros en enero, febrero, junio y septiembre; los tricópteros y ninfas de Odonata superaron durante el segundo semestre de 1995. Por el método de frecuencia de ocurrencia se determinó que los taxones más continuos pertenecen a ninfas de Odonata y larvas de Coleoptera (9.4%), larvas de Trichoptera (8.55%) y Coleoptera adultos (7.69%). Una prueba T sobre rs= 0.46439 indicó que la correlación entre las dietas T.caliense y A.cyclopus es significativa (T= 2.5148, P< 0.01 g.l.= 23). Los resultados obtenidos en el presente trabajo corroboran que las dos especies compiten por el alimento, lo cual se relaciona con la predación que ejerce A. cyclopus sobre T. caliense, además, de los estados de desnutrición de la langara (Fig. 5) frente al negro reflejó la ventaja adaptativa y estratégica en la captura y el consumo de alimento por parte de A. cyclopus. Las especies objeto de este artículo, capturan su alimento en el sustrato o en diferentes sitios de la columna de agua, una vez que la presa cae al agua, los peces la buscan con sus barbillas, en el momento de entrar en contacto presa-barbilla, la ingieren rápidamente mediante fuertes movimientos de la cabeza y el cuerpo.
Se logró observar que los registros máximos de factor de condición (K) para T. caliense (Fig. 5) se obtuvieron en junio, de agosto a octubre y en diciembre, que coincidieron con valores bajos de peso de estómago e índice de voracidad, a excepción de diciembre donde se registró el valor más alto del año, lo cual se relacionó con el período de desove de la especie; los datos mínimos del factor de condición se registraron de febrero a abril relacionado con valores altos de índice de voracidad, del peso de estómago, del índice gonadosomático y los períodos lluviosos del año. Se obtuvo un K promedio de 0.82 (0.66-0.91), lo cual indicó estados de desnutrición de la especie. Se alcanzó a descubrir que los registros máximos de factor de condición para A. cyclopus (Fig. 5) se encontraron en abril y diciembre, relacionados con el período lluvioso, pesos altos de estómago (a excepción de diciembre), índice de voracidad bajo y el índice gonadosomático alto. Se obtuvo un K= 1.1 (0.89-1.4), que indicó un estado de sobre alimentación. La diferencia entre los valores del factor de condición (K) en ambas especies, obedecen a comportamiento y preferencia de hábitat; mientras T. caliense es infrabiótica, A. cyclopus ocupó toda la columna de agua y se mantiene en actividad tanto diurna como nocturna, razón por la cual este grupo es más eficiente en su actividad trófica. Se obtuvieron registros bajos: 14 estómagos vacíos (14.4%) de 97 examinados en T. caliense, en A. cyclopus se encontraron 11 (9.4%) de 117 examinados.
No se observaron en ambas especies movimientos migratorios de índole reproductivo o trófico. En todas las épocas y a cualquier hora se capturaron ejemplares con o sin alimento en su estómago. De igual forma con gónadas maduras e inmaduras, lo anterior se sustentó, además, por la colecta de larvas y alevinos tanto en las quebradas como en el río Quindio. Se observó que existe una relación estrecha y positiva entre peso-longitud en ambas especies (Y=23.87+3.61X, r=0.94 n=76 en T. caliense; Y=18.70+2.96X, r=0.90 n=106 en A. cyclopus).
Parasitismo: Durante el período del estudio se encontraron en ocho ejemplares de T. caliense (cinco hembras y tres machos) de longitud estándar promedio 9.53 cm (7.42-11.97 cm) y en dos espécimenes de A. cyclopus (una hembra y un macho) con longitud estándar promedio de 8.22 cm (5.95-10.5 cm) que presento nemátodos en la primera porción del intestino, posteriormente determinados como Contracaecum sp.
Interacción de las especies: A. cyclopus y T. caliense, conviven en simpatría y no ocuparon el mismo nicho en la columna de agua, de tal manera T. caliense, prefiere enterrarse en el lodo, la arena, o bajo las piedras, es decir es infrabentónica, mientras A. cyclopus ocupó la superficie del sustrato o las paredes de piedras, troncos y tierra en todos los niveles a los cuales se adhiere, o sea es epibentónica de ahí que su correlación trófica sea significativa. Ambas especies prefieren posarse bajo la vegetación ribereña, donde capturan con eficiencia el alimento. Lo anterior se asoció con la búsqueda de ítems alimenticios que se encuentran en este microhábitat, lo cual se comprobó con base en observaciones hechas en ejemplares confinados en un acuario, donde se logró notar que durante el día T. caliense fue activo y permaneció la totalidad del tiempo en el fondo, su máxima actividad se observó en horas de la noche, y sólo cuando no han consumido durante varios días se les descubre efectuar cortas salidas. Astroblepus ciclopus mostró una actividad mixta, es decir, diurna y nocturna; presentó territorialidad, aleja agresivamente a los demás individuos que se le acerquen; buscan su presa en todos los niveles de la columna de agua, inclusive remueven el sustrato en las horas de mayor temperatura(1:00 pm-2:00 pm) se alcanzó a notar que todos los individuos ascendían a la superficie, en algunos casos sacando hasta una cuarta parte del cuerpo fuera del agua, ambas especies consumen todos los insectos que llegaban al agua; igual observación se reporta en Cataño & López (1989) para T. caliense.
A excepción de la predación de A. cyclopus sobre T. caliense, las especies colectadas en estos hábitats (cuadro 1) no registraron predadores; como es de esperarse en quebradas de alta montaña neotropical (Reznick et al. 1996).
Se logró determinar seis especies simpátricas en estos hábitats se incluye a T. caliense y A. cyclopus. Se determinó que T .caliense (22.84%) y Bryconamericus caucanus (19.41%) son los taxones más abundantes; y en menor cantidad se tiene a Cetopsorhamdia boquillae (8.38%), Astyanax aurocaudatus (3.32%) y Poecilia caucana (0.80%). Los datos de esta especie y de A. cyclopus derivan de sus hábitos alimenticios y de la capacidad de adaptación a estos ambientes. Wootton (1992) planteó que peces alguívoros y consumidores de material vegetal se incrementan con el tamaño de la quebrada, mientras los consumidores de invertebrados acuáticos disminuyeron. Igual sucedió en este trabajo, dado que los muestreos se realizaron en quebradas pequeñas con temperatura mínima del agua de 18ºC, lo que facilitó la proliferación de insectos acuáticos.
Por observación directa se logró comprobar que los principales factores antrópicos que están afectando la supervivencia de las especies en la región son: la deforestación de las zonas ribereñas a los cuerpos de agua, la utilización de productos químicos en las labores de control de plagas y enfermedades del café y que luego son vertidos a las corrientes
Discusión
La descripción del habitat de las especies, coincidió con lo anotado por Gaston (1996) y muy posiblemente estos taxones describen una curva normal respecto a su rango-tamaño de distribución. Cataño & López (1989) encontraron T. caliense en ríos y lagos. Además, describieron el ambiente de T. caliense y coincidieron al afirmar que estos peces se encontraron en aguas claras con sustratos formados por lodo, arena y piedra; miden en promedio 65 cm de ancho y 20 cm de profundidad, con temperaturas del agua que oscilaron entre 15-25ºC (promedio de 21.5ºC). En T. striatum (= Pygidium striatum) de quebradas en Panamá Central se observó que habita en ambientes lóticos de sustrato conformado por arena fina y piedras. Esta especie se halló enterrada en el fondo de la columna de agua (Power et al. 1988). Arratia (1983) y Dahl (1971) plantearon que los trichomictéridos ocupan zonas muertas (charcos) de formaciones torrentícolas; en estos sitios se observó la acumulación de arena, lodo, material vegetal y a veces piedra. Sin embargo, Power et al. (1988) planteó que son taxones propios de ambientes lóticos, aunque en algunos casos se localizaron en los remansos. Román-Valencia (1996) describió un hábitat similar para Piabucina sp. en la cuenca del río la Vieja. En cuanto a la fecundidad, Cataño & López (1989) reportaron valores promedio de 353 (160-690) ovocitos por hembra, con diámetro de 1.15 mm (0.7-2.0); Manriquez et al. (1988) registró un rango entre 100-1250 ovocitos en T. areolatus. Kenneth & Leggett (1994) y Ortaz (1993) afirmaron que en peces pequeños con una madurez temprana, se produce una baja fecundidad y un tamaño reducido de los ovocitos y viceversa, que corresponden a estrategias reproductivas. Para Cataño y López (1989) la baja fecundidad en T. caliense se debe a lo reducido de su hábitat y a la ausencia de predadores naturales. Bone et al. (1995) plantearon que existe una relación muy significativa entre fecundidad y tamaño del huevo. Toda vez que la amplitud del ovario se limita con la longitud de la hembra. En cuanto a la proporción de sexos, Manriquez et al. (1988) observó un predominio de los machos en T. areolatus; sin embargo, no aplicó una prueba estadística para comprobar las diferencias observadas. Cataño y López (1989) plantearon que el proceso de reproducción se lleva a cabo a una talla promedio de 12.88 cm (9.2-13.8) de longitud estándar en machos y en hembras; Román-Valencia (1995) observó ejemplares con talla promedio de 9.0 cm de longitud estándar en estado de predesove; Manriquez et al. (1988) planteó una talla mínima para individuos maduros de 5.67 cm en machos y 5.11 cm en hembras de T. areolatus, sin embargo, no aplicó una prueba estadística a sus datos. Román-Valencia (1995) reportó ejemplares con gónadas maduras en enero de 1994; Cataño y López (1989) concluyeron de manera equivocada que esta especie se reproduce durante todas las épocas del año (lluviosa y seca); Manriquez et al. (1988) registró en T. areolatus un período reproductivo largo, aunque no comprobó si tiene varios desoves. De igual manera, se observó A. cyclopus se reproduce en aguas lóticas y su período reproductivo se extiende desde diciembre hasta mayo; con un pico reproductivo en abril (Fig. 4), asociado con el inicio de las lluvias, con temperaturas máximas del agua, con pH cercano a la neutralidad, con valores bajos de anchura y profundidad de las quebradas. Por observaciones hechas en acuario se notó que las especies maduraron sus gónadas durante el segundo semestre de 1995, pero no lograron su desove. Un resultado similar reportaron Cataño & López (1989) en T. caliense, lo cual se debe a la falta de estímulos de la corriente de agua.
Cataño & López 1989) reportaron una dieta similar pero con preferencia de dípteros, nemátodos, larvas y adultos de coleópteros. Para T. corduvense Ferriz (1998) reportó que la dieta esta conformada por insectos: larvas de quironómidos, ninfas de efemerópteros y larvas de tricópteros. Kramer & Bryant (1995) plantearon que T. striatum se alimenta exclusivamente en el bentos, así encontraron en el tracto alimentario invertebrados acuáticos (98%), escamas (3%) y algas. Collette (1962) encontró en el estómago de dos paratipos macho y hembra de A. pholeter tres ninfas del género Euthyplocia (Ephemeridae) y restos de este taxon. Machado-Allison (1993) planteo que los siluriformes poseen una gran variedad de hábitos alimenticios. La prioridad de consumo obedece a un mecanismo de defensa de los macroinvertebrados acuáticos frente a sus depredadores, los cuales en el día salen poco y en la noche se incrementan notoriamente o viceversa (Flecker 1992), lo cual se ajusta al comportamiento de los peces en estudio, que prefieren la noche para realizar sus actividades tróficas. La interpretación obtenida por el rango de correlación de Spearman (rs) para el contenido estomacal de T. caliense y A. cyclopus no coincidieron con los hábitos tróficos esperados para especies simpátricas estructuralmente similares y relacionadas en el mismo nivel trófico, como lo planteó Fritz (1974). La estabilidad de los parámetros físicos y químicos a lo largo del año registrados en el presente estudio, coincidió con lo anotado por Bussing (1993) en el sentido de que los ambientes acuáticos son propicios para adquirir su alimento y llevar a cabo los procesos de desarrollo y reproducción. Mora et al. (1992) afirmaron que un bajo número de ejemplares en estado de madurez es atribuible al comportamiento reproductivo de una especie que registró migración, corroborada por su presencia en otros sitios poco comunes. No existen reportes previos de parasitismo en estos grupos. En el único registro (Freihofer & Neil 1967) se relacionó con un tipo de comensalismo entre larvas de Chironomidae (Insecta: Diptera) con Astroblepus orientalis y A. peruanus.
Agradecimientos
Este artículo se realizó durante una comisión de estudios otorgada por la Universidad del Quindio (Depto. de Biología) y una beca Doctoral de Colciencias. También se agradece a Eldredge Bermingham en el Instituto Smithsonian de Investigaciones Tropicales, Panamá (STRI) y a funcionarios de su biblioteca, en donde se realizaron consultas bibliográficas.
Resumen
El período de reproducción de Trichomycterus caliense ocurrió entre mayo y septiembre; de Astroblepus cyclopus sucedió de diciembre hasta mayo, es decir que tienen épocas de reproducción alternadas entre sí; la talla promedio de captura fue de 8.3 cm de longitud estándar para T. caliense y de 6.0 cm de longitud estándar para A. cyclopus; la proporción macho a hembra fue de 1:1 (X²= 3.4, P>0.05) en T. caliense y en A. cyclopus (X² = 1.44, P> 0.1); la fecundidad fue baja, así como el diámetro del ovocito (191 con 1.5 mm) en T. caliense y en A. cyclopus (113 con 2.39 mm). Son peces insectívoros con predominio de Coleoptera, Diptera, y Trichoptera, además compiten por alimento y espacio; el rango de correlación de Spearman (rs= 0.46439) señala que las dietas son estadísticamente significativas (T=2.5148, P< 0.01), así ambos táxones no coincidieron con los hábitos tróficos esperados para especies simpátricas morfológicamente similares y relacionadas en el mismo nivel trófico; se registró por primera vez a Contracaecum sp. (Nematoda) como un parásito intestinal en ambas especies. Prefieren pequeñas quebradas de alta montaña neotropical, de tipo primario y secundario con flujo constante de agua y cristalina, de abundante vegetación ribereña, el sustrato está estructurado por lodo, arena, piedras, troncos y material de origen vegetal en descomposición, con pH alrededor de la neutralidad, oxígeno disuelto alto (8.38 ppm) y temperaturas promedio de 18.63ºC; de amplia distribución en la cuenca, se determinaron seis especies simpátricas en estos hábitats. T. caliense (con 22.84%) y Bryconamericus caucanus (con 19.41%) son los táxones más abundantes.
Referencias
Arratia, G. 1983. Preferencias de hábitat de peces siluriformes de aguas continentales de Chile (Fam. Diplomystidae y Trichomycteridae). Stud. Neotrop. Fauna Environ 18: 217-237. [ Links ]
Arratia, G. & S. Menu. 1984. New catfishes of the genus Trichomycterus from the High Andes of South America ( Pisces, Siluriformes) with Remarks on Distribution and Ecology. Zool. Jb. Syst. 111: 493-520. [ Links ]
Bone,Q. , N. B. Marshall & J.H.S. Blaxter. 1995. Biology of Fishes. Chapman & Hall, Nueva York 332 p. [ Links ]
Buitrago-Suárez, U. A. 1995. Sistemática de las especies Colombianas del género Astroblepus Humboldt 1805 (Pisces:Siluroidei:Astroblepidae). Tesis M.Sc. Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Bogotá 122p.
Buitrago-Suárez,U. A. & G. Galvis 1997. Description of some accessory structures of the urogenital system in the neotropical family Astroblepidae (Pisces, Siluroidei). Rev. Acad. Colomb. Cienc. 21: 347-352. [ Links ]
Bussing, W.A. 1993. Fish communities and environmental characteristics of a tropical rain forest river in Costa Rica. Rev. Biol. Trop. 41 : 791-809. [ Links ]
Cardona M, C. Román-Valencia, J.L. Jiménez & H. Hurtado T. 1998. Composición y diversidad de los peces de la quebrada San Pablo en Alto Cauca, Colombia. Boletín Ecotropica 32:11-24. [ Links ]
Cataño,Q. G & P.H. López. 1989. Estudio preliminar de la biología del lángaro Pygidium caliense Eigenmann,1912 (Pisces:Teleostei). Trabajo de grado (Zootecnia), Universidad Nacional de Colombia, Palmira, Colombia. 95 p. [ Links ]
Collette B.B. 1962. Astroblepus pholeter, a new species of cave-dwelling catfish from Eastern Ecuador. Proc. Biol. Soc. Wash., 75: 311-314. [ Links ]
Dahl,G.1971. Los peces del norte de Colombia. Inderena, Bogotá 66-81 p. [ Links ]
Ferriz A.R. 1998. Alimentación de Trichomycterus corduvense Weyenbergh,1879 (Teleostei:Trichomycteridae) en dos ríos Serranos de San Luis, Argentina. Hidrobiología 8:43-49. [ Links ]
Flecker, A. 1992. Fish predation and evolution of invertebrate drift periodicity: evidence from neotropical streams. Ecology 73: 438-448 [ Links ]
Freihofer,C.W.& E.H.Neil. 1967. Comensalism between midge larvae (Diptera:Chironomidae) and catfishes of the families Astroblepidae and Loricariidae. Copeia 1967: 39-45. [ Links ]
Fritz,S.E. 1974. Total diet comparasion fishes by Spearman rank correlation coefficients. Copeia 1974: 210-214. [ Links ]
Gaston,K.J. 1996. Species-range-size distributions:patterns, mechanisms and implications. TREE 11: 197-201. [ Links ]
Hyslop,E.J. 1980. Stomach contents analysis a review of metods and their aplication. J. Fish Biol. 17: 411-429. [ Links ]
Jones,J.B. & R.M.Holmes. 1996. Surface-subsurface interactions in stream ecosystems. TREE 11: 239-242. [ Links ]
Kennet T.F. & W.E. Legget. 1994. Fisheries ecology in the context of ecological and evolutionary theory. Ann. Rev. Ecol. Syst. 25: 401-422. [ Links ]
Kramer L.D. & M. J. Bryan . 1995. Intestine length in the fishes of a tropical stream: 2. Relationships to diet-the long and short of a convoluted issue. Env. Biol. Fish. 42:129-141. [ Links ]
Machado-Allison A. 1993. Los peces de los llanos de Venezuela: Un ensayo sobre su historia natural. Universidad Central de Venezuela. Caracas, 143 p. [ Links ]
Manriquez A., L Huaquín, M. Arellano & G. Arratia. 1988. Aspectos Reproductivos de Trichomycterus areolatus Valenciennes, 1846 (Pisces:Teleostei:Siluriformes) en Río Angostura, Chile. Stud. Neotrop. Fauna Environ. 23: 89-102. [ Links ]
Miles,C. 1971. Los peces del río Magdalena. Ediciones U.T., Ibague, Colombia. 214p. [ Links ]
Mora,G., L.S.Tellez., P.Cala & G. Guillot. 1992. Estudio bioecológico de la ictiofauna del lago de tota (Boyacá), con enfasis en la trucha arco iris (Oncorynchus mykiss). Rev. Acad. Colomb. Cien. XVIII: 409-422. [ Links ]
Ortaz,M. 1993. Estrategias reproductivas de los peces de una pequeña cuenca hidrográfica al norte de Venezuela. Acta Cien. Venezolana 44: 47-48. [ Links ]
Pinna, M.C.C. de 1992. Trichomycterus castroi, a new species of trichomycterid catfish from the Rio Iguacu of Southestern Brazil (Teleostei: Siluriformes). Ichthyol. Explor. Freshwaters 3: 89-95. [ Links ]
Power,E.M., R.J.Stout., C.E.Cushing, P.P.Harper, F.R.Hauer, P.W.J.Matthews, P.B.Moyle, B.Statzner & I.R.Wais de 1988.Biotic and abiotic controls in river and stream communities. J.Nat. Amer. Benthol Soc. 7: 456-479. [ Links ]
Reznick. D. N., F. H. Rood, & M. Cardenas. 1996. Life-history evolutions in guppies (Poecilia reticulata: Poecilidae) IV. Parallelism in life-history phenotypes. Amer. Naurt. 147: 319-338. [ Links ]
Ricker,W. (ed.) 1971. Methods for assesment of fish production in fresh water. Backwell,London. 326 p. [ Links ]
Román-Valencia 1995. Lista anotada de los peces de la cuenca del río la vieja. Alto Cauca, Colombia. Boletín Ecotrópica 29: 11-19. [ Links ]
Román-Valencia, C. 1996 Historia Natural del rollizo, Piabucina sp. (Pisces:Lebiasinidae) en la cuenca del río La Vieja, Alto Cauca. Dahlia. Rev. Asoc. Colomb. Ictiol. 1: 89-96. [ Links ]
Vegas V., M. 1977. Ictiología: texto experimental. Universidad del Valle, Centro de Publicaciones, División de Ciencias, Depto. de Biología, Cali, Colombia. 269 p. [ Links ]
Wootton,R.S. 1992. Fish ecology. Chapman & Hall, Nueva York. 212 p. [ Links ]
1 Universidad del Quindio, Departamento de Biología, A.A. 460, Armenia, Quindio, Colombia. Fax: (57) 67462563; croman@cocora.uniquindio.edu.co












 uBio
uBio