Revista de Biología Tropical
versión On-line ISSN 0034-7744versión impresa ISSN 0034-7744
Rev. biol. trop vol.49 no.2 San José jun. 2001
Recibido 14-IV-2000. Corregido 10-X-2000. Aceptado 23-X-2000
Abstract
Growth (length), was compared in A. franciscana populations from Utah, United States of America, and Yape, Chile, and A. persimilis (population from Salinas de Hidalgo, Argentina), cultured under controlled conditions (24°C, seawater 35 g/l, feeding with Chaetoceros calcitrans). There were significant differences among all stages of A. franciscana (Utah) and A. persimilis, whereas we found significantly differences only in two stages of A. persimilis and A. franciscana (Yape); both A. franciscana had similar total lengths in all stages analyzed. Habitat adaptations could explain these results.
Key words
Artemia, growth, habitats, population (s), stage.
El crustáceo Artemia (Leach 1819) ha adquirido mucha importancia en la actualidad por su gran demanda en la acuicultura (Sorgeloos et al. 1986), puesto que representa una de las dietas vivas de más amplia utilización en el cultivo de peces marinos y crustáceos. Producto de este interés en la actualidad se comercializan quistes de diferente origen, principalmente de la especie A. franciscana (Kellog 1906), proveniente del gran lago salado en Estados Unidos (Triantaphyllidis et al. 1998). No obstante actualmente se están explotando otras especies, principalmente en China (Triantaphyllidis et al. 1994, Xin et al. 1994), Brasil, y Vietnam (Landau 1992).
La inoculación o transplante requiere necesariamente probar las características de las poblaciones utilizadas fin de evaluar la respuesta potencial al ambiente y de esta forma predecir eventualmente la capacidad de generar una biomasa compatible con los intereses económicos (Landau 1992). Se ha preferido cultivar A. franciscana, ya que ésta resiste mejor factores abióticos, en comparación a las especies partenogenéticas, lo que ha sido demostrado principalmente al observarse sobrevivencia y fecundidad significativamente mayores de A. franciscana (Triantaphyllidis et al. 1995, Barata et al. 1996), Aunque no se han encontrado diferencias significativas en cuanto a crecimiento individual en función del tiempo (Triantaphyllidis et al. 1995). Artemia franciscana tiende además a presentar mejor éxito colonizador si se introduce en nuevos hábitats, desplazando a la fauna nativa (Williams y Geddes 1991).
La especie A. franciscana es dominante en el nuevo mundo, y se encuentra distribuida desde Canadá hasta la zona central de Chile. Por otro lado se encuentra la especie A.persimilis (Piccinelli y Prosdocimi 1968), que hasta 1996 se supuso que la última especie era endémica de Argentina, no obstante después se encontró que esta se encuentra en el sur de Chile (Gajardo et al. 1998, Gajardo et al. 1999, De los Ríos y Zúñiga 2000). La expansión de estas especies en el continente se debe principalmente al transporte de quistes por medio de aves acuáticas, lo que sería una causal potencial para que ambas especies pudieran colonizar nuevos hábitats, con probabilidades de desarrollo poblacional variables (Gajardo et al. 1992, 1995, 1998). Como objetivo de este trabajo se va a analizar el crecimiento individual expresado en largo total, de la población de A. franciscana de Yape (Chile), comparada con A. franciscana (Utah, Estados Unidos) y A. persimilis (Salinas de Hidalgo Argentina), estas serán mantenidas bajo condiciones controladas de luz, temperatura, salinidad y alimentación.
Materiales y Métodos
Se cultivaron en condiciones controladas las siguientes poblaciones: 1) Artemia franciscana (Great Salt Lake, Mackay Marine Brine Shrimp Company, Estados Unidos), 2) Artemia franciscana (Yape; Chile), y 3) Artemia persimilis (Salinas de Hidalgo; Argentina). Estas se cultivaron a partir de quistes, producidos y almacenados en el Departamento de Acuicultura, de la Universidad de Antofagasta.
Los quistes se hicieron eclosionar según el método descrito por Sorgeloos et al. (1986), los nauplios resultantes se sembraron por triplicado con densidades de 1 ind/ml en tubos de PVC de 10 cm de diámetro por 20 cm de largo, con un volumen aproximado de 1 l (a 90% de su capacidad), cubiertos en el extremo inferior con malla de fitoplancton de 100 mm de trama, los tubos se suspendieron dentro de un acuario de fibra de vidrio a con 70 l de agua de mar (35 gr/l). El sistema se mantuvo con iluminación continuada durante todo el período de experimentación, (15 días) mediante dos lámparas fluorescentes de 40 watts, a una temperatura de 24-25ºC regulada con calefactores de 60 watts, aireación permanente y alimentación a saciedad con Chaetoceros calcitrans. El experimento se realizó en el laboratorio de cultivo de crustáceos de la Universidad de Antofagasta, en Antofagasta, Chile.
Cada dos días se extrajeron 30 individuos de cada población (diez por repetición), los que se anestesiaron con una solución de cloroformo saturado en agua de mar y posteriormente se fijaron en formalina glucosada al 10 %. Una vez finalizado el período experimental se midió la longitud total (LT) de los individuos, con una lupa provista de ocular micrométrico. Se consideró además el estadio de desarrollo de los individuos y el tiempo en que este se presentó en más del 60 % de los individuos. Se analizaron los estadios metanauplio final (MF), juvenil inicial (JI), juvenil final (JF), adulto inicial (AI) y adulto (A), según la nomenclatura usada por Correa-Sandoval et al. (1994). A los datos obtenidos se les aplicaron las pruebas de normalidad y homocedasticidad de Bartlet mediante el programa Statistica 5.0 para usar posteriormente un análisis de varianza a una vía, para determinar si existieron diferencias en los datos obtenidos. Finalmente se usó a posteriori la prueba de comparaciones múltiples de Tukey, con el objetivo de determinar los grupos más similares entre sí.
Resultados
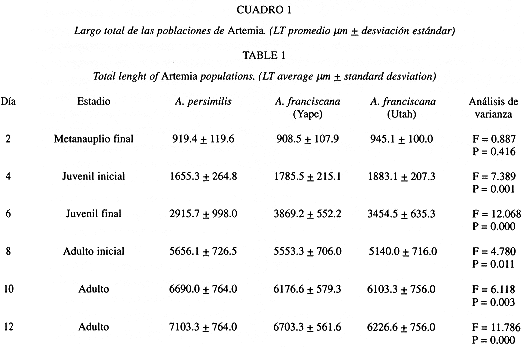
La Cuadro 1 resume los LT para las tres poblaciones estudiadas y para los estadios evaluados. Los adultos se obtuvieron a partir del décimo día de cultivo registrándose un crecimiento relativamente rápido. Como observación anexa es necesario destacar la alta sobrevivencia que se registró al final del período experimental.
Aunque en el estadio metanauplio final (Cuadro 1) no hay diferencias significativas para las tres poblaciones (A. persimilis: 919.4, A. franciscana Yape: 908.5; y A. franciscana Utah: 945.1 mm), las poblaciones de A. franciscana (Utah: 6 103.3; 6 226.6; y 7 753.3 mm. Yape: 6 176.6; 6 703.3; y 7 360.0 mm), presentaron tamaños significativamente menores que A. persimilis (6 690.0; 7 103.3; y 8 203.3 mm) para los días 10; 12 y 14 respectivamente (Cuadro 1). Estos datos nos indicarían que A. persimilis tiende a alcanzar mayor LT que A. franciscana.
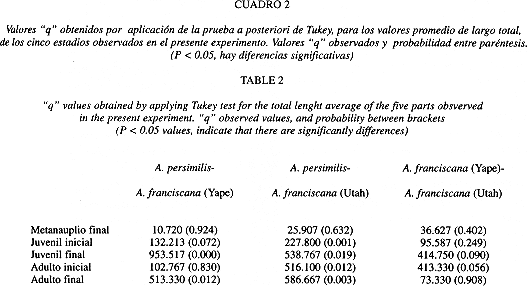
Según la prueba de comparaciones múltiples de Tukey, se encontraron diferencias significativas, para todos los estadios, entre A. persimilis y la población de A. franciscana de Yape (Cuadro 2). Al comparar A. persimilis con A. franciscana de Utah, sólo hubo diferencias significativas para los estadios de juvenil final (Q: 953.517, P = 0.000), y adulto final (Q: 513.330, P = 0.012)(Cuadro 2).
Discusión
Los resultados obtenidos en este trabajo se encuentran dentro de los niveles de tiempo señalados en la literatura, el que se extiende entre 10 a 30 días (Sorgeloos et al. 1986, Wear y Haslett 1986, Correa-Sandoval et al. 1994, Savage & Knott 1998).
Se encontraron diferencias significativas en el crecimiento individual entre A. franciscana y A. persimilis; resultados similares encontraron Triantaphyllidis et al. (1995) al comparar el crecimiento entre A. franciscana y A. parthenogenetica a diferentes niveles de salinidad. En ambos casos, los resultados se pueden deber a las diferencias en la información genética de cada una de las especies (Gajardo y Bearmore 1993, Correa-Sandoval et al. 1994 Pilla y Bearmore 1994, Gajardo et al. 1995, Colihueque y Gajardo 1996, Triantaphyllidis et al. 1997a, 1997b, Rodríguez et al. 1998, Gajardo et al. 1998).
Al comparar el crecimiento individual para cada uno de los estadios por separado se encontraron diferencias significativas, por lo que no se justifica el análisis como un sistema continuo como se ha descrito en trabajos de este tipo (Wear y Haslett 1986, Triantaphyllidis et al. 1995), pues el crecimiento individual en Artemia, al igual que en otros crustáceos se debe tratar como un modelo discreto, similar al planteado para copépodos por Escribano (1992). No obstante Correa-Sandoval et al. (1994), que emplearon un método similar al utilizado en el presente trabajo, no encontraron diferencias significativas al comparar el crecimiento entre estadios.
Uno de los factores ambientales que influye en el desarrollo de poblaciones de Artemia en especial en el crecimiento individual de los organismos es el tipo de ión predominante en el hábitat, así tenemos que hay poblaciones adaptadas a salmueras ricas en cloruros, sulfatos y carbonatos, desarrollándose al máximo en predominancia de uno de estos tres iones (Cole y Brown 1967), y si son cultivadas a un medio con otra composición iónica su crecimiento y fecundidad disminuirían ya que se gastaría energía en osmorregular. Los individuos estudiados sus hábitats naturales tienen gran predominancia de cloruros (Amat et al. 1994a, 1994b, Gajardo et al. 1998, Zúñiga et al. 1999), por lo que no serían afectados por este parámetro al ser mantenidos en agua de mar.
En condiciones naturales cada población tiene un nivel óptimo de temperatura y salinidad, en que se va a obtener un óptimo desarrollo reflejado en crecimiento individual, fecundidad y sobrevivencia (Wear y Hasslett 1986). Por lo general un aumento de temperatura en condiciones naturales lleva consigo similar respuesta en evaporación y salinidad, que puede llegar a un punto máximo en que puede afectar negativamente a la población (Wear y Haslett 1986, Del Castillo Arias y Farfan 1997).
La población de A. franciscana de Utah, tiene sobrevivencia óptima a salinidad entre 30 y 120 %o con 18° y 34°C, mientras que A. persimilis tiene entre 60%o a 90 %o de salinidad con temperaturas entre 19° y 26°C (Vanhaecke et al. 1984, Sorgeloos et al. 1986). Para la población de A. franciscana de Yape, esta solo presentó diferencias significativas en LT en comparación a A. persimilis en los estadíos JF y AF, mientras que para A. persimilis y A. franciscana (Utah) solo hubo similitud para MF. Estos resultados supondrían que la A. franciscana de Yape, no tendrían valores de salinidad y temperatura óptimos con parcialmente similares.
A. franciscana vive principalmente en zonas tropicales y subtropicales cálidas, desde Estados Unidos hasta la zona central de Chile (Triantaphyllidis et al. 1998). Esto implicaría que sus hábitats estarían expuestos a una mayor presión de evaporación, lo que haría que las poblaciones tengan mayor resistencia a variaciones de temperatura y salinidad, lo que ha sido observado para poblaciones chilenas por Zúñiga et al. (1994, 1999). El gran Lago Salado de Utah (Estados Unidos) presenta salinidad promedio de 200 g/l relativamente constante en el año, sin tener periodos de desecación (Cuellar 1992), mientras que las lagunas costeras de Yape (Tarapacá, Chile), son lagunas ubicadas en el litoral rocoso supramareal con salinidad variable entre 50 a 200 g/l, presentando desecación en algunos periodos en el año (Amat et al. 1994a, Zúñiga et al. 1999)
Por otro lado A. persimilis vive en zonas subtropicales y templadas frías (Amat et al. 1994a, Gajardo et al. 1998, Triantaphyllidis et al. 1998), esto se debería a que esta especie estaría aclimatada a hábitats más estables en cuanto a salinidad, y a los menores niveles de temperatura y salinidad en que se encuentra su desarrollo óptimo. Las poblaciones argentinas viven en hábitats que no presentan periodos de desecación con salinidad variable pero inferior a 200 g/l (Amat et al. 1994a), mientras que la población chilena en Torres del Paine la salinidad promedio de 26 g/l (Campos et al. 1996).
Se puede concluir que las poblaciones de A. franciscana de Utah y Yape alcanzan menor tamaño que A. persimilis, ya que las condiciones de cultivo (temperatura y salinidad) fueron óptimas para A. persimilis . La población de A. franciscana de Yape, al presentar algunas similitudes en LT con A. persimilis, haría sugerir que la primera de manera óptima en condiciones ambientales parcialmente similares a las necesarias para A. franciscana. Por otro lado el crecimiento en Artemia no debe analizarse como un modelo continuado, ya que cada uno de los estadíos tiene distinta respuesta de crecimiento.
Agradecimientos
Se agradece la valiosa ayuda de Gonzalo Gajardo Juan Zamorano, e Eliana Ibáñez, y a revisores anónimos por sus valiosos aportes al presente trabajo.
Resumen
Se comparó el crecimiento individual expresado en largo total, de dos poblaciones de A. franciscana (Utah, Estados Unidos, y Yape, Chile) y A. persimilis (Salinas de Hidalgo, Argentina) cultivadas a partir de quistes bajo condiciones controladas (24°C, agua de mar 35 g/l, alimentación con Chaetoceros calcitrans). Se encontraron diferencias significativas en todos los estadios analizados entre las poblaciones de A. franciscana de Utah y A. persimilis, mientras que entre A. persimilis y A. franciscana de Yape, hubo similitudes sólo en dos estadios, y A. franciscana de Utah y Yape registraron similar tamaño corporal para todos los estadios analizados. Las adaptaciones a los hábitats podrían explicar estos resultados.
Referencias
Amat, F., F. Hontoria, J.C. Navarro, R. Cohen & S. Rodríguez. 1994a. Aproximación preliminar a la distribución del género Artemia (especie persimilis) en Argentina. Provincia de Buenos Aires y La Pampa. Actas del VIII congreso Latinoamericano de. Santa Fe de Bogotá, Colombia. 562 p. [ Links ]
Amat, F., F. Hontoria, O. Zúñiga & R. Wilson. 1994b. Localización y caracterización de poblaciones chilenas del crustaceo Artemia. Actas del VIII Congreso Latinoamericano de Acuicultura. Santa Fe de Bogotá, Colombia. 562 p. [ Links ]
Barata, C., F. Hontoria & F. Amat. 1996. Estimation of the biomass production of Artemia with regard to its use in aquaculture: Temperature and strains effects. Aquaculture 142: 171-189. [ Links ]
Browne, R.A. & K.M. Halanych. 1989. Competition between sexual and parthenogenetic Artemia: a re-evaluation (Branchiopoda, Anostraca). Crustaceana 57: 57-71. [ Links ]
Campos, H., D. Soto, O. Parra, W. Steffen & G. Agüero. 1996. Limnological studies of Amarga Lagoon, Chile: a saline lake in Patagonian South America. Int. J. Salt Lake Res. 4: 301-314. [ Links ]
Cole, G. & R.J. Brown. 1967. The chemistry of Artemia habitats. Ecology 48: 858-861. [ Links ]
Colihueque, N. & G. Gajardo.1996. Chromosomal analysis in Artemia populations from South America. Citobios. 88: 141-188. [ Links ]
Correa-Sandoval, F., D. Voltolina-Lobina, L. F. Bückle-Ramirez & B. Cordero-Esquivel. 1994. The growth rates of four populations of Artemia franciscana (Anostraca, Artemiidae). Rev. Biol. Trop. 42: 605-609. [ Links ]
Cuellar O.1992. Some notes on the efects of high salinity on brine shrimp, Artemia salina (L., 1758) from Great salt Lake, Utah (Branchiopoda, Anostraca). Crustaceana 63: 214-215. [ Links ]
De los Ríos P & O Zúñiga. 2000. Comparación biométrica del lóbulo frontal en poblaciones americanas de Artemia (Anostraca, Artemiidae). Rev. Chil. Hist. Nat. 73: 31-38. [ Links ]
Del Castillo Arias, E. & C. Farfan. 1997. Hydrobiology of a salt pan from the Peninsula of baja California, México. Int. J. Salt Lake Res. 6: 233-248. [ Links ]
Escribano, R. 1992. Tamaño dependencia del crecimiento corporal en copépodos marinos. Est. Oceanol. 11: 29-37. [ Links ]
Gajardo, G.M., R. Wilson & O Zúñiga. 1992. Report on the ocurrence of Artemia in a saline deposit of the Chilean Andes (Branchiopoda, Anostraca). Crustaceana 63: 169-174. [ Links ]
Gajardo, G.M. & J.A. Beardmore. 1993. Electrohoretic evidence suggest that the Artemia found in the Salar de Atacama, Chile, is A. franciscana Kellog. Hydrobiologia 257: 65-71. [ Links ]
Gajardo, G., M. da Conceicao, L. Weber & J.A. Beardmore. 1995. Genetic variability and interpopulational differentiation of Artemia strains of South America. Hydrobiologia 302: 21-29. [ Links ]
Gajardo, G., N. Colihueque, M. Parraguez & P. Sorgeloos. 1998. Morphologic differentiation and reproductive isolation of Artemia populations from South America. Int. J. Salt Lake Res. 7: 133. [ Links ]
Gajardo, G.M., C. Mercado, J.A. Beardmore & P. Sorgeloos. 1999. International study on Artemia. LX. Allozyme data suggest that a new Artemia population in southern Chile (50°29'S; 73°45'W) is A. persimilis. Hydrobiologia405: 117-123. [ Links ]
Landau M. 1992. Introduction to Aquaculture. Wiley. Nueva York. 440 p. [ Links ]
Pilla, E.J.S. & J.A. Beardmore. 1994. Genetic and morphologic differentiation in old world bisexual species of Artemia (the brine shrimp). Heredity 72: 47-56. [ Links ]
Rodriguez Gil, S., A.G. Papeshi & R.G. Cohen. 1998. Mitotic and meiotic chromosomes of Artemia (Branchiopoda) from populations of La Pampa province, Argentina, J. Crust. Biol. 18: 36-41. [ Links ]
Savage, A. & B. Knott 1998. Artemia parthenogenetica in Lake Hayward, Western Australia. I. Interrupted recruitment into adult stages in response to seasonal limnology. Int. J. Salt Lake Res. 7: 1-12. [ Links ]
Sorgeloos, P., P. Lavens, P. Leger, W. Tackaert & D. Versichele. 1986. Manual for the culture and use of brine shrimp Artemia in aquaculture. Administración Belga para el desarrollo y la cooperación; FAO. Universidad Estatal de Gante, Facultad de Agricultura, Bélgica. 319 p. [ Links ]
Triantaphylidis, G.V., B. Zhang, L. Zhu & P. Sorgeloos. 1994. International study on Artemia. L. Review of the literature on Artemia from salt lakes in the Poeples Republic of China. Int. J. Salt Lake Res. 3: 95-104. [ Links ]
Triantaphyllidis, G.V., K. Poulopoulou, T.J. Abatzopoulos, C.A. Pinto-Pérez & P. Sorgeloos. 1995. International study on Artemia XLIX. salinity effects on survival, maturity, growth, biometrics, reproductive, and lifespan characteristics of a bisexual Artemia. Hydrobiologia 302: 215-227. [ Links ]
Triantaphyllidis, G.V., G.R.J. Criel, T.J. Abatzopoulos, K.M. Thomas, J. Peleman, J.A. Beardmore & P Sorgeloos. 1997. International study on Artemia LVII. Morphological and molecular characters suggest conspecifity of all bisexual European and North African Artemia populations. Mar. Biol. 129. 477-487. [ Links ]
Triantaphyllidis, G.V., G.R.J. Criel, T.J. Abatzopoulos & P. Sorgeloos. 1997. International study of Artemia. LIII. Morphological study of Artemia with emphasis to Old World strains. I. Bisexual populations. Hydrobiologia 357: 139-153. [ Links ]
Triantaphyllidis GV., TJ Abatzopoulos & P Sorgeloos. (1998). Review of the biogeography of the genus Artemia (Crustacea, Anostraca). J. Biogeogr. 25: 213-226. [ Links ]
Vanhaecke P., S.E. Siddall & P Sorgeloos. (1984) International study on Artemia XXXII. Combined effects of temperature and salinity on the survival of Artemia of various geographical origins. Mar Biol. Ecol. 80: 259-275. [ Links ]
Wear, R. & S. Haslett 1986. Effects of temperature and salinity on the biology of Artemia franciscana Kellog, from lake Grassmere, New Zeland.1.Growth and mortality. J. Exp. Mar. Biol Ecol. 98: 153-166. [ Links ]
Williams, W.D. & M.C. Geddes. 1991. Anostracans of Australan Salt Lake, with particular reference to a comparison of Parartemia and Artemia, p.351-368. In : RA,. Browne, P. Sorgeloos, & CNA. Trotman (eds.). Artemia Biology. CRC Boca Raton Florida. Estados Unidos. [ Links ]
Xin, N., J. Sun, B. Zhang, G.V. Triantaphyllidis, G. Van Stappen & P. Sorgeloos. 1994. International study on Artemia. LI. New survey of Artemia resourses in the Poepless Republic of China. Int. J. Salt Lake Res. 3: 105-112. [ Links ]
Zúñiga O., Wilson R., Ramos R., E. Retamales & L. Tapia. 1994. Ecología de Artemia franciscana en la Laguna Cejas, Salar de Atacama (Chile). Est. Oceanol. 13: 71-84. [ Links ]
Zúñiga O., Wilson R., F. Amat & F. Hontoria. 1999. Distribution and characterization of Chilean populations of the brine shrimp Artemia (Crustacea, Branchiopoda, Anostraca). Int. J. Salt Lake Res. 8: 23-40. [ Links ]
1 Laboratorio de Ecología Acuática, Facultad de Ocenografía y Pesquería, Universidad Austral de Chile, Casilla 1327, Puerto Montt, Chile. Fono-Fax: 56-65-255243; prios@smtp.uach.cl












 uBio
uBio