A nivel mundial, el cáncer gástrico (CG) es el sexto en incidencia y el tercero en mortalidad por cáncer. En Costa Rica es el cuarto cáncer más frecuente (tasa ajustada por edad de 12,8/100 000 habitantes) y el primero en mortalidad (tasa ajustada por edad de 10,3/100 000 habitantes). Además, para 2020, se reportaba una prevalencia de 27 casos/100 000 habitantes y proyecciones de la Agencia Internacional de Investigación en Cáncer indican que el número de casos nuevos en Costa Rica se duplicará para 2040.1 El porcentaje de sobrevida global a 5 años para pacientes con CG en Costa Rica es de 41%.2 La mayoría de los tumores en estómago corresponde a adenocarcinomas gástricos (ACG), clasificados histológicamente (clasificación de Lauren) en dos tipos: difuso e intestinal. El ACG difuso se relaciona principalmente con mutaciones en CDH1 (E-cadherina).3 El ACG de tipo intestinal es el resultado de una serie de lesiones precancerosas conocidas como la cascada de Correa, que describe la transformación desde una mucosa gástrica normal hasta el carcinoma in situ.4
El principal factor de riesgo asociado al ACG de tipo intestinal es la infección con la bacteria Helicobacter pylori (H. pylori).5 Sin embargo, solamente un pequeño porcentaje de los individuos infectados con H. pylori desarrolla un cuadro maligno,6 por lo que la infección no es un factor predictivo, sino una variable que se combina con factores genéticos y ambientales para favorecer la aparición de las lesiones. Las guías internacionales indican la erradicación de H. pylori cuando existe dispepsia, lesiones precancerosas, úlceras y antecedentes familiares de CG.7
Para el diagnóstico de H. pylori, existen pruebas no invasivas (ureasa en aliento o prueba de antígeno en heces), pero a veces es imperativo el diagnóstico por endoscopia del tracto digestivo alto: en poblaciones de baja prevalencia de la infección, pacientes dispépticos con antecedentes familiares de CG y edad avanzada, si no hay contraindicaciones.7
De elegirse este método, se recomienda la toma de dos biopsias de antro, dos de cuerpo y una de la incisura para la detección de lesiones precancerosas.8
La detección de H. pylori se realiza mediante una tinción histoquímica convencional. Se recomienda
el uso de inmunohistoquímica cuando hay mucha gastritis crónica activa, ya que se requiere una mayor sensibilidad. De igual forma, también se puede recurrir a una prueba de ureasa rápida (RUT) como diagnóstico de primera línea, ya que es una prueba de alta sensibilidad y especificidad. La sensibilidad de la prueba aumenta si se toman dos biopsias, una de cuerpo y una de antro.9
De previo a realizar las pruebas de detección de H. pylori, invasivas o no, debe suspenderse el tratamiento con inhibidores de bombas de protones (IBP) por al menos dos semanas y con antibióticos y compuestos de bismuto, por al menos cuatro semanas.7
El cultivo de H. pylori puede ser necesario cuando los pacientes presentan resistencia a tratamiento y se requiere realizar una prueba de sensibilidad a antibióticos, así como para obtener los datos poblacionales de los niveles de resistencia que definen la selección del tratamiento empírico. Este método no se hace de rutina en los laboratorios de bacteriología en Costa Rica, probablemente porque presenta varios desafíos. El primero de ellos, es la propia toma de la muestra, que debe efectuarse por endoscopia ya que se requiere una biopsia de la mucosa gástrica. La endoscopia, si bien es un proceso de riesgo mínimo, es invasiva. Durante el proceso de toma de la muestra, se pueden introducir microorganismos provenientes del tracto digestivo superior, el tracto respiratorio y la cavidad bucal, por lo que hay una alta probabilidad de contaminación. H. pylori es una bacteria microaerofílica que requiere de concentraciones de oxígeno menores al 5% para sobrevivir, lo cual complica su cultivo y hace que no sea una metodología que cualquier laboratorio de bacteriología pueda implementar.
Esta investigación se llevó a cabo con el objetivo de documentar las experiencias de la implementación de toma de muestra y cultivo de la bacteria H. pylori en una pequeña muestra de pacientes en Costa Rica, para compararlo con otras pruebas utilizadas actualmente en la rutina clínica (RUT y diagnóstico histopatológico) y describir los diagnósticos asociados con los aislamientos obtenidos.
Métodos
Selección de pacientes. Se incluyó a pacientes costarricenses de entre los 35 y 70 años, de ambos sexos y sin distinción de etnia, quienes asistieron al Servicio de Endoscopia Digestiva del Hospital Clínica Bíblica entre febrero y junio del 2019 por necesidad clínica de endoscopia de tracto gastrointestinal superior y quienes aceptaron participar en el estudio mediante un consentimiento informado. El proyecto contó con la aprobación del Comité Ético Científico de la UCR.
Se excluyó a aquellas personas que presentaban alguna de las siguientes enfermedades o características: linfoma de MALT, úlcera duodenal, operaciones por enfermedad remanente (cirugía previa por CG o tumores gástricos secundarios), haber tomado tratamientos contra H. pylori en los últimos 30 días o IBP en los últimos 14 días.
Endoscopia de tracto digestivo superior. La sedación de los pacientes se realizó con propofol endovenoso a dosis estándar. Se realizó un procedimiento diagnóstico de endoscopia de tracto digestivo superior con equipos de endoscopia Pentax 7010 (Pentax Medical, Tokio, Japón).
Muestras de tejido y diagnóstico endoscópico. Se tomaron seis muestras de tejido fresco de mucosa gástrica de aproximadamente 0,5 cm3 y distribuidas de la siguiente manera: dos de antro, dos de cuerpo y una de la incisura angular, para su evaluación histológica según el protocolo de Sídney.8 El diagnóstico endoscópico fue asignado según la lesión más grave detectada. La biopsia para cultivo de H. pylori fue tomada del antro en zonas donde se observaron cambios de inflamación crónica, cambios de patrón de cripta llena o áreas con gastritis en patrón nodular y se evitaron zonas con metaplasia intestinal (MI).
Diagnóstico histopatológico. Las biopsias fueron incluidas en parafina y se elaboraron dos láminas por zona, de las cuales una fue teñida con hematoxilina-eosina, según los métodos de rutina para la evaluación histológica, y la otra con azul de toluidina para el diagnóstico de H. pylori.
Prueba de ureasa rápida. El resultado de la RUT fue consultado del reporte del diagnóstico endoscópico de los pacientes cuya muestra dio un cultivo positivo por H. pylori. Solo se realizó para los pacientes que tenían la prueba indicada por el médico tratante. El resultado reportado para la prueba es positivo o negativo.
Transporte de las biopsias. Se elaboró un medio de transporte semisólido con 7.5 g de agar Brucella (Oxoid, Hampshire, Reino Unido), 6.3 g de caldo infusión cerebro-corazón (BHI, Oxoid, Hampshire, Reino Unido) y 1 vial de suplemento selectivo para H. pylori (Oxoid, Hampshire, Reino Unido), añadido posterior a la esterilización. Las muestras se mantuvieron en refrigeración (4- 8°C), se transportaron a temperatura ambiente (aproximadamente 25°C) y fueron procesadas dentro de las 8 horas posteriores a su obtención.
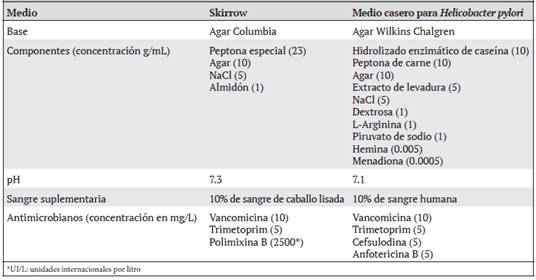
Cultivo. La biopsia fue macerada con 0.4 mL de caldo BHI en un tubo cónico de 1.5 mL con un pistilo plástico estéril. Se distribuyó 0.1 mL del macerado en cuatro placas: dos de agar Skirrow10 y dos de medio selectivo para Helicobacter (base anaerobia Wilkins-Chalgren suplementada con suplemento selectivo para H. pylori y 10% sangre humana).11 La composición de ambos medios se muestra comparativamente en el Cuadro 1. La sangre humana utilizada se obtuvo bancos de sangre, de unidades expiradas de glóbulos rojos empacados. Una placa de cada medio se incubó en una jarra de 2.5 L y se colocaron sobres generadores de dos atmósferas distintas: microaerofilia con CampyGen y anaerobiosis generada con AnaeroGen, a 37°C y por al menos 48 horas y hasta 10 días. Todos los medios de cultivo, así como los sobres generadores de atmósfera eran de la marca Oxoid (Hampshire, Reino Unido). La positividad del cultivo y la presencia de contaminantes se evaluaron cualitativamente mediante la observación de la morfología colonial.
H. pylori presenta colonias puntiformes de aproximadamente 1 mm de diámetro, incoloras y lisas, sin presencia de hemólisis. El porcentaje de recuperación de cultivo se obtuvo dividiendo el número de cultivo positivo por H. pylori entre el total de muestras procesadas.
Cuadro 1 Composición detallada de los medios de cultivo utilizados en el estudio para cultivar Helicobacter pylori
Identificación de H. pylori. Los crecimientos bacterianos obtenidos se identificaron con las pruebas habituales para H. pylori11, la observación morfológica al fresco en solución fisiológica (movilidad y morfología), con tinción de Gram (morfología bacilar helicoidal y tinción Gram negativa) y pruebas bioquímicas: actividad ureasa positiva en caldo urea de Steward, catalasa positiva con peróxido de hidrógeno y oxidasa positiva en tiras (Oxoid, Hampshire, Reino Unido).
Análisis estadísticos. Todos los análisis incluidos en el estudio se ejecutaron utilizando el software GraphPad Prism versión 9.4.0 para Windows (GraphPad Software LLC, San Diego, CA). Para el análisis de normalidad de los datos demográficos se empleó la prueba de Shapiro-Wilks. Para el análisis de variables dicotómicas se usaron pruebas t no pareadas por el método de Holm-Šídák. La comparación entre el cultivo y la prueba de ureasa rápida se efectuó mediante una tabla de contingencia y se calculó la concordancia con el coeficiente kappa de Cohen.
Resultados
Características demográficas de los pacientes. Se incluyó a 44 pacientes, de los cuales 24 (54.5%) fueron hombres. Las edades de los participantes se encontraban entre los 36 y 70 años, con una media de 50.6 ± 10.0. Estratificada por sexo, en las mujeres la edad media fue de 50.7 ± 10.4 (rango: 36-70) y en los hombres, 50.5 ± 9.9 (rango: 36-68). Tanto las edades totales como las estratificadas por sexo presentaron una distribución normal (p>0.05 en la prueba de Shapiro-Wilks).
Cultivo de Helicobacter pylori. De las 44 biopsias cultivadas, se logró recuperar H. pylori en 27, lo cual representa un 61.4% de éxito. Durante los dos primeros meses del estudio, las biopsias se cultivaron tanto en atmósfera microaerofílica como anaerobia y, aunque no se observó diferencia en la positividad del cultivo entre ambas; no obstante, sí se evidenció un crecimiento más débil y un estado fisiológico subóptimo de la bacteria en atmósfera anaerobia, por lo que se decidió continuar el cultivo en condiciones de microaerofilia. No se apreció una diferencia en la positividad del cultivo entre medios de cultivo, el Skirrow y el medio selectivo para Helicobacter; sin embargo, el crecimiento de H. pylori en el medio Skirrow fue menos abundante, pero también lo fue el de los contaminantes. Al análisis, se observó que el porcentaje de éxito de recuperación semanal fue aumentando durante las primeras 5 semanas, con una pequeña disminución en las semanas 6 y 7, para luego alcanzar una meseta con un éxito del 100% después de la semana 11 (Figura 1).
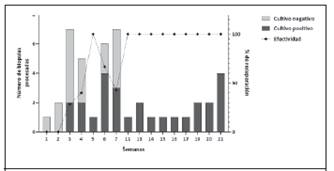
Figura 1 Evolución temporal de la cantidad de biopsias procesadas y el porcentaje de positividad del cultivo de Helicobacter pylori a partir de biopsias gástricas. El porcentaje de efectividad del cultivo incrementó hasta alcanzar un 100% a partir de la semana 11 debido a una mejor selección de los pacientes a los cuales se les tomó muestras.
Comparación del cultivo con la prueba de ureasa rápida. Se contó con resultado de la RUT para 27 de los sujetos con biopsia positiva para cultivo. El cultivo de la bacteria fue positivo en 9 de los 10 pacientes con RUT positiva. En los pacientes con RUT negativa, se recuperó la bacteria en 6 de 17. Se obtuvieron resultados similares en ambas pruebas en un 74% (Cuadro 2).
Cuadro 2 Tabla de contingencia para los resultados obtenidos al analizar las biopsias por dos métodos de detección de H. pylori sobre biopsia: prueba de ureasa rápida y cultivo
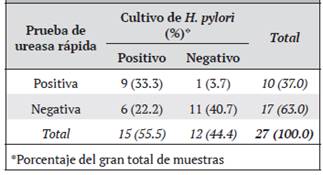
La combinación de ambos métodos, es decir, catalogar como positivo a un paciente con cualquiera de las pruebas positivas, permitió una detección de la bacteria en un 60% de los casos, mientras que el cultivo por sí solo detectó en un 56% y la RUT por sí sola en un 37%. Se calculó la concordancia entre ambos métodos mediante el coeficiente kappa de Cohen, que arrojó un resultado de 0.48.
Diagnóstico endoscópico. Se les realizó el diagnóstico endoscópico a todos los sujetos incluidos en el estudio. El resultado del cultivo según la patología diagnosticada se muestra en la Figura 2. Las lesiones más frecuentes fueron gastritis eritematosa, gastritis crónica superficial, gastritis erosiva y lesiones esofágicas. Se observó una mayor cantidad de cultivos positivos por H. pylori en las muestras de pacientes con diagnóstico de gastritis eritematosa (p=0.007) y gastritis crónica superficial (p=0.008).
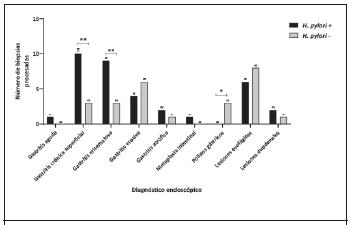
Figura 2 Resultado del cultivo de Helicobacter pylori según el diagnóstico endoscópico. La mayor parte de los cultivos positivos se obtuvieron en pacientes con gastritis crónica superficial y gastritis eritematosa. *p < 0.05, **p < 0.01
Diagnósticos histopatológicos. Se realizó el diagnóstico histopatológico en cuerpo, incisura y antro para 25 de las 27 biopsias con cultivo positivo para H. pylori. Dos muestras fueron excluidas debido a que no fue posible realizarles el diagnóstico histopatológico. Todas las biopsias con cultivo positivo presentaron gastritis crónica, mientras que un 80% presentó atrofia en antro y un 92% en incisura. Solamente un 12% de los pacientes con cultivo positivo presentaron MI, mayoritariamente en la incisura.
De las 25 biopsias con cultivo positivo por H. pylori y análisis histopatológico, 21 dieron positivo por ambos métodos. Se presentaron cuatro casos en los que la tinción por azul de toluidina no permitió detectar la presencia de la bacteria, mientras que sí se detectó mediante el método de cultivo. Todos estos casos presentaron un diagnóstico histológico de gastritis crónica, tres de ellos con atrofia. No hubo casos en los que se detectara la bacteria por el método de tinción y no se lograra cultivar.
Discusión
Este estudio se practicó sobre biopsias obtenidas en una muestra de pacientes costarricenses adultos, con una distribución balanceada entre hombres y mujeres y con edades promedio similares entre ambos grupos. Se trata de un grupo pequeño de pacientes que acude al servicio de endoscopia de un hospital privado por elección propia o por indicación de su médico de cabecera. El fin fue determinar la viabilidad del cultivo de la bacteria H. pylori en Costa Rica por medio de la documentación de toma de muestras, la comparación del diagnóstico histopatológico y la descripción de los diagnósticos asociados a los aislamientos obtenidos con los resultados de la ureasa rápida. Se pretende que los protocolos y resultados estén disponibles para que otros laboratorios a nivel nacional y regional incursionen en el cultivo primario de H. pylori a partir de biopsias gástricas obtenidas por endoscopia. El aumento de los niveles de resistencia a antimicrobianos por parte de H. pylori tiene como consecuencia una disminución en el éxito del tratamiento de erradicación, que consiste en una combinación de dos o tres antimicrobianos, junto con un IBP, por periodos de 10 a 14 días, lo que constituye un régimen difícil para el paciente.7 El cultivo de H. pylori permite realizar la prueba de sensibilidad a antimicrobianos (PSA) y obtener información adicional sobre la bacteria, como las características de virulencia.12-15
La experiencia del endoscopista en la toma de muestra es fundamental, ya que la distribución de H. pylori en la mucosa estomacal no es homogénea, por lo que debe procurarse la toma de biopsias de los sitios con mayor probabilidad de carga bacteriana y evitar, para fines de cultivo, la toma de muestras en sitios de atrofia o MI. Se debe favorecer la obtención desde sitios que muestran datos inflamatorios sugestivos de infección por H. pylori como el patrón de cripta llena, por ejemplo.
Algunos autores sugieren que para cultivo deben tomarse dos biopsias de antro y dos de cuerpo.11
En la recuperación de aislamientos bacterianos a partir de muestras clínicas, se debe tomar en cuenta el transporte de la muestra.16 Existen medios comerciales para el transporte de las biopsias; sin embargo, son de difícil obtención en Costa Rica debido a que no se utilizan de forma rutinaria, además de ser onerosos. Por lo tanto, desarrollamos una formulación semisólida, descrita como adecuada para el transporte de muestras de H. pylori y otras bacterias.17 Se suplementó con un cóctel de antibióticos selectivo para Helicobacter, debido a que usualmente la muestra presenta una alta contaminación con otras bacterias y levaduras del tracto gastrointestinal, lo que representa uno de los factores que más frecuentemente comprometen el éxito del aislamiento. Los antibióticos utilizados tanto para los medios de transporte como para los de cultivo, deben incluir al menos una sustancia específica para gram-positivos, una para gram-negativos, a la que H. pylori sea resistente y otra con actividad antifúngica.18
El cultivo se efectuó utilizando dos medios distintos, el Skirrow y el medio casero elaborado en nuestro laboratorio. Las diferencias en el crecimiento y el estado fisiológico de la bacteria pueden deberse a que la base anaerobia Wilkins Chalgren es más rica que la base utilizada para el Skirrow, ya que se encuentra suplementada con hemina, L-arginina y glucosa. De igual forma, el medio Skirrow no contiene un agente antifúngico, por lo que puede tener mayor riesgo de contaminación por hongos. Sin embargo, consideramos que su empleo es conveniente debido a que uno de los contaminantes más habituales de las muestras para cultivo de H. pylori son los lactobacilos. Estas bacterias son naturalmente resistentes a todos los antibióticos presentes en ambos medios; sin embargo, se observó un crecimiento deficiente en el Skirrow, por ser un medio menos nutritivo. Con base en estas observaciones, nuestra recomendación es utilizar ambos medios durante el aislamiento y solamente el medio casero para la amplificación de la bacteria necesaria para la realización de PSA, extracción de ADN u otras aplicaciones. A pesar de que la literatura concuerda en que la atmósfera ideal para cultivar H. pylori es la microaerofilia,19 un estudio reportó que el cultivo en condiciones de anaerobiosis aumentó el porcentaje de recuperación.20 Sin embargo, este no fue el caso en este trabajo, por lo que se decidió dejar de lado esta alternativa y centrarse en el cultivo microaerofílico.
En este estudio se obtuvo una recuperación del 61.4%; sin embargo, los porcentajes de recuperación reportados en las experiencias de otros laboratorios son muy heterogéneos y dependen de las variables citadas anteriormente (composición de medios de transporte y cultivo, experiencia del endoscopista en la toma de muestra, tiempo de procesamiento) y de la experiencia del laboratorio en general. Nuestra recomendación es que, con base en protocolos previamente descritos, cada laboratorio estandarice las condiciones que le permitan un buen porcentaje de recuperación y una implementación adaptada a sus actividades de rutina.
Entre los diferentes métodos de diagnóstico de H. pylori a partir de biopsias, es decir, la RUT, la histología y el cultivo, no hay un consenso de cuál de ellas es el estándar de oro y cada una tiene ventajas y desventajas. La RUT se caracteriza por ser rápida, barata y de fácil interpretación, mientras que el estudio histológico permite detectar no solo la presencia, sino también la extensión del daño y el tipo de lesión asociada a la infección. Sin embargo, es más costosa en tiempo y dinero y requiere un laboratorio especializado en procesamiento de tejidos. Además, algunos expertos cuestionan la identificación a nivel de especie de una bacteria únicamente por morfología en una tinción simple.
Por otro lado, teóricamente el cultivo tiene una especificidad del 100% y una vez que se obtiene el aislamiento, es posible efectuar pruebas adicionales de caracterización tales como PSA o presencia de determinados factores de virulencia. Las desventajas son la variabilidad del resultado, su dificultad por los requerimientos metabólicos de la bacteria, el costo y el tiempo para obtener un resultado (que ronda aproximadamente los 10 días).
Debido al reducido tamaño de muestra y a que no hay un estándar de oro entre los tres métodos, no se calcularon valores predictivos positivos o negativos ni de sensibilidad y especificidad, sino que se calculó el nivel de concordancia entre el cultivo y la RUT mediante el coeficiente kappa de Cohen y se encontró dentro del rango de concordancia moderada (0.41- 0.60). De igual forma, se observó que, al combinar los resultados de ambas pruebas, se incrementó el porcentaje de detección de la infección en 4%. En solamente uno de los casos con RUT positiva, no fue posible obtener el cultivo. Entre las razones que podrían causar un falso negativo en el cultivo, están la contaminación excesiva que no permita aislar exitosamente las colonias de H. pylori, un estado fisiológico alterado de la bacteria y una baja carga bacteriana, tratamiento reciente con antibióticos o IBP, entre otros. Por otro lado, también se presentaron RUT negativas en casos donde se logró obtener un cultivo. La RUT puede dar resultados falsos negativos por varias causas aparte del uso previo de antibióticos, IBP o presencia de MI extendida. Estos incluyen la distribución heterogénea de la bacteria en la mucosa o la presencia de sangrado de tracto digestivo alto.21,22 Se deben tener en cuenta algunas consideraciones para aumentar la sensibilidad de la prueba. Por ejemplo, tomar muestras del cuerpo del estómago cuando el paciente tenga una úlcera gástrica, debido a que en estos casos, hay una alta probabilidad de atrofia glandular y MI en el antro que disminuye la presencia de la bacteria.23 Por otro lado, la contaminación con formalina de las pinzas con las que se toma la biopsia es un factor que ha sido mencionado como causante de falsos negativos, pero los resultados no han sido concluyentes.24,25 Los falsos positivos son raros y se presentan por sobrecrecimiento de contaminantes ureasa positivos y la forma de evitarlos es la adición de algún agente antibacteriano en el reactivo.26
Con respecto a los diagnósticos endoscópicos y su relación con el resultado del cultivo, la mayor recuperación se obtuvo en pacientes con gastritis eritematosa y crónica superficial. Estas son las patologías en las que se esperaría encontrar una mayor carga bacteriana, en comparación con estadios más avanzados de la cascada de Correa como la atrofia y la MI, donde el hábitat de la bacteria está alterado, especialmente con respecto a la secreción de ácido.
En conclusión, este trabajo demuestra que la realización del cultivo de H. pylori en Costa Rica es factible ante las condiciones de nuestro país y recopila las indicaciones básicas para que otros laboratorios puedan implementar la técnica. El cultivo de H. pylori a partir de biopsias gástricas no es necesario en todos los casos como método diagnóstico, ya que existen otras alternativas más convenientes en tiempo, costo e invasividad. Sin embargo, como complemento de otros métodos, y en casos particulares como los pacientes que presentan cepas resistentes a antibióticos, es una herramienta fundamental para un abordaje óptimo del paciente que resulte en la mejor atención posible.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo y que han cumplido con todos los requisitos y proce dimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos.















