La hidroxicloroquina (HCQ) es un fármaco que inicialmente fue descrito como antimalárico. Su extracción proviene del árbol de quino (Cinchona pubescens), a partir del componente químico alcaloide llamado quinina. El primer uso de este compuesto se remonta a 1630, cuando incas lograron curar a la condesa de Chinchón de una enfermedad febril, con un “polvo misterioso” extraído de la corteza del árbol.1
Cientos de años después, la industria farmacéutica inicia la producción en masa de drogas antimaláricas derivadas de la quinina, debido a la epidemia de malaria entre los soldados americanos durante la Segunda Guerra Mundial.2 La cloroquina fue la primera droga comercializada en 1943 y, posteriormente, mediante modificaciones químicas, se elabora la HCQ, introducida en 1945.2 Ocho años después del fin de la guerra se reportan efectos antiinflamatorios del fármaco en los soldados con lupus eritematoso y artritis reumatoide.3 Sin embargo, desde 1894 se había reportado que la quinina era efectiva en lupus cutáneo.4
La farmacocinética de la HCQ se caracteriza por ser muy variable en su absorción. El fármaco se metaboliza en hígado y se excreta por vía renal, y su vida media de eliminación es de 30 a 50 días, aproximadamente.5 El inicio de acción del efecto antiinflamatorio se describe a las 4 a 6 semanas.6 Sin embargo, las concentraciones plasmásticas máximas se alcanzan alrededor del mes 6 de tratamiento,7 por lo cual ningún curso de tratamiento con fines antiinflamatorios debería ser inferior a este tiempo.
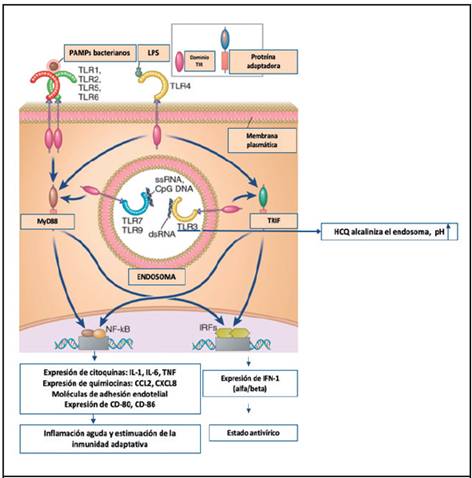
Figura 1. La hidroxicloroquina actúa como base, alcalinizando el endosoma, lo cual impide la unión de ligandos de autoantígenos a TLR, inhibiendo las vías de síntesis de citoquinas, moléculas de adhesión, quimiocinas y moléculas coestimuladoras. Modificada de Abbas Inmunología Básica, 7 ed. TNF=factor de necrosis tumoral, IL=interleucina, TLR=receptores tipo Toll, IFN= interferón, MyD88= gen de respuesta primaria de diferenciación mieloide, TRIF= adaptador que contiene el dominio TIR inductor de IFN-ß, HCQ=hidroxicloroquina, NF-KB= factor nuclear kappa B, IRF= factor regulador de interferón
El metabolismo de la HCQ ocurre en el hígado mediante el CYP450, el cual realiza el proceso de desalquilación y produce el metabolito activo del fármaco.8 Las principales isoformas del citocromo responsables del metabolismo de la HCQ son: CYP2C8, CYP3A4 y CYP2D6. Esto debe tomarse en cuenta desde el punto de vista clínico, al prescribir posibles fármacos que generen interacción por uso competitivo de estas isoformas del citocromo.9
La revisión se enfoca en los efectos de la HCQ en algunas de las enfermedades autoinmunes más prevalentes: lupus eritematoso sistémico (LES), artritis reumatoide (AR), síndrome de Sjögren, vasculitis sistémicas, nefropatía por IgA, síndrome antifosfolípido (SAF) y distintas enfermedades inmunológicas de la piel. También se revisarán los principales efectos adversos, especialmente la toxicidad de retina.
Mecanismos inmunomoduladores
Se han implicado diferentes mecanismos por los cuales la HCQ ejerce efectos inmunomoduladores.10 Los más importantes propuestos se mencionan en la Figura 1 y son: inhibición de quimiotaxis y fagocitosis, disminución en la presentación antigénica, disminución en la producción de citoquinas, principalmente interleucina (IL)-1, IL-2, IL-6, IL-17, IL-22, interferón (IFN) tipo I, IFN-γ, factor de necrosis tumoral (TNF)-α.11-12
Los receptores tipo toll (TLR, Toll-like receptors) son una familia de receptores para el reconocimiento de patrones moleculares, expresados en muchos tipos celulares, reconocen productos de una amplia variedad de microorganismos, así como de muchas moléculas no infecciosas.13 El reconocimiento por TLR de ligandos microbianos o no microbianos, da lugar a la activación de varias vías de transmisión de señales y, finalmente, activación de factores de transcripción que inducen la expresión de genes cuyos productos son esenciales para las respuesta inflamatoria y antivírica, mediante la producción de distintas citoquinas, como TNF, IL-1, IL-6, quimiocinas, moléculas de adhesión endotelial y moléculas coestimuladoras.14 Recientemente, se ha descrito que la HCQ también inhibe la señalización de los TLR, considerándose este uno de los mecanismos de acción fundamentales por los cuales ejerce efecto la droga.13 También inhibe la fosfolipasa A2 y, por lo tanto, antagoniza el efecto de prostaglandinas.
La molécula de HCQ inhibe la activación de los TLR a nivel del endosoma, TLR 3, TLR 7, TLR 8 y TLR 9, los cuales reconocen ácidos nucleicos.
Estos TLR también reconocen ácidos nucleicos de distintos autoantígenos en el contexto de un pH ácido a nivel de los lisosomas, lo cual podría estar involucrado en la generación de autoinmunidad.5,14 La HCQ es una base débil, pero capaz de inhibir la interacción de los TLR mencionados con los ácidos nucleicos de autoantígenos.5 La HCQ concentra muy bien en los lisosomas, por tener un pH bajo, y capta gran cantidad de iones de H+, por lo cual los lisosomas pierden su acidez usual, lo que conduce a disminución en la fagocitosis efectiva y menor producción de péptidos que, eventualmente, se convierten en antígenos.14-15 Por lo tanto, disminuye la síntesis de mediadores inflamatorios y de autoanticuerpos producidos por el estímulo de las distintas interleucinas, resultado final de la activación de los TLR mencionados.16
Lo interesante del fármaco es que a través de estos mecanismos descritos, inmunomodula los procesos de respuesta autoinmune vinculados tanto con la inmunidad innata, como con la inmunidad adaptativa humoral y celular (Cuadro 1).
Posterior a la descripción de su acción antimalárica y antinflamatoria, han surgido estudios científicos en los cuales se ha demostrado efectos beneficiosos de la HCQ en distintas patologías, como es el caso de enfermedad cardiovascular, como droga antineoplásica y antitrombótica, antimicrobiana (aparte del uso en malaria), e incluso en el tratamiento de la osteoartrosis.1,17
Efectos en lupus eritematoso sistémico
La eficacia y seguridad de la HCQ en el LES han sido ampliamente comprobadas en diversos estudios clínicos. Se ha descrito que el fármaco disminuye el riesgo de infecciones, la severidad y frecuencia de las exacerbaciones,18 el daño a órgano blanco acumulado, la progresión y severidad de la nefritis lúpica,19 y el riesgo de trombosis. También se ha demostrado que favorece el ahorro de glucocorticoides, disminuye el proceso de aterogénesis asociado a la enfermedad por mecanismos intrínsecos a la droga, así como por el ahorro de esteroides, y también aumenta la sobrevida. 5
Cuadro 1. Acciones concretas inmunomoduladoras de la HCQ*
| Efectos sobre inflamación aguda |
| Inhibición de la actividad de la histamina y degranulación eosinofílica |
| Inhibición de fosfolipasa A2 con reducción en producción de prostaglandinas y leucotrienos |
| Inhibición de la actividad polimorfonuclear y liberación de radicales de oxígeno |
| Reducción de la agregación plaquetaria |
| Reducción en la producción de fibronectina |
| Inhibición de la señalización de los receptores tipo Toll |
| Efectos sobre reacciones inmunoinflamatorias crónicas |
| Reducción en la proliferación de linfocitos |
| Reducción en la expresión de moléculas de HLA |
| Inhibición del ensamblaje de autoantígenos con moléculas de HLA clase II en las células profesionales presentadoras de antígeno |
| Disminución de la actividad de las células NK |
| Disminución en la producción de citoquinas (IL-1, IL-2, IL-6, IL-17, IL-22, IFN tipo I, IFNγ, TNFα) |
| Reducción de la velocidad de eritrosedimentación |
| *Modificado de Rainsford KD, Parke AL, Clifford-Rashotte M, Kean WF. 8 |
El primer estudio publicado que sugirió aumento de sobrevida en LES en relación con el uso de HCQ, es del 2001; en él se observó que un grupo de pacientes fallecidos por LES tenía menos concentraciones séricas de HCQ que el grupo de pacientes vivos con la enfermedad.20
Luego, en 2006, Ruiz-Irastorza y cols, presentaron un estudio de 232 pacientes con LES, donde se evidenció una disminución de riesgo de muerte de un 14-50 % en los pacientes tratados con HCQ. 21 Un año después, se publica el estudio LUMINA, el cual incluía una cohorte multiétnica de pacientes con LES y tratamiento con HCQ, con un seguimiento de 39 meses, que evidenció una disminución del riesgo de muerte mayor al 30 %.22 Por otra parte, se ha demostrado que la HCQ puede tener efectos protectores contra futuros eventos trombóticos en los pacientes con LES. 23
La evidencia sugiere que todo paciente con LES debería recibir tratamiento con HCQ durante la evolución de su enfermedad, manteniéndose en periodos de exacerbación y remisión del lupus, sin importar el tiempo que el paciente lleve en remisión.24 Las guías de recomendaciones de EULAR 2019 actualizadas en el manejo del LES, recomiendan que todo paciente con LES debe estar en tratamiento con HCQ, a menos que se encuentre contraindicado, a una dosis no mayor a 5 mg/Kg de peso real.25
Efectos antitrombóticos y uso en síndrome antifosfolípido
Diversos estudios han mostrado la efectividad antitrombótica del fármaco;23 en tanto favorece la inhibición de la agregación y adhesión plaquetaria.26 La HCQ es inhibidora de la ciclooxigenasa-1 (COX-1), y posiblemente esta sea una de las razones principales por las que la droga disminuye el riesgo de trombosis, puesto que disminuirá la síntesis de tromboxano A2.8
El fármaco reduce de manera significativa los riesgos trombogénicos de los anticuerpos antifosfolípidos, al igual que la unión de los anticuerpos de tipo IgG antiglicoproteína beta 2 a la bicapa fosfolipídica. También se ha evidenciado que la HCQ reduce la liberación de los gránulos plaquetarios, así como la expresión de glicoproteína IIb-IIIa inducida por los anticuerpos antifosfolípidos.27
Existe además, evidencia que afirma que la HCQ favorece la prevención de eventos trombóticos en el SAF primario.28 En un estudio retrospectivo de 114 pacientes, la HCQ mostró reducir de manera significativa la incidencia de eventos trombóticos durante un seguimiento de 10 años.29
El fármaco tiene la capacidad de disminuir los títulos de anticuerpos anticardiolipinas y antibeta-2 glicoproteína, a largo plazo en pacientes con SAF primario y secundario.29-30
Efectos en artritis reumatoide
La HCQ forma parte de la amplia posibilidad de opciones terapéuticas para la artritis reumatoide, y es uno de los denominados fármacos antirreumáticos modificadores de la enfermedad (DMARDs por sus siglas en inglés), para uso en combinación con otros inmunomoduladores. En los pacientes con artritis reumatoide, la HCQ produce clínicamente una mejoría significativa, pues favorece la disminución del dolor, el control de la inflamación sinovial, así como disminuye el riesgo metabólico intrínseco de la enfermedad y los marcadores inflamatorios.5
Estudios realizados en modelos murinos con artritis, no mostraron efectos protectores en manifestaciones sistémicas de la enfermedad, ni efectos en la disminución de la destrucción articular.8 Sin embargo, un estudio realizado por Silvia et al., publicado en 2005, demostró que la combinación de HCQ con metotrexate, disminuyó las concentraciones plasmáticas de fosfatasa ácida y alanino aminotransferasa, evento considerado por los autores como un reflejo de disminución de reacciones inflamatorias.31 Posteriormente, Vollenhoven et al., demostraron que las manifestaciones articulares de la enfermedad fueron controladas con mayor eficacia al combinar ambos fármacos, en comparación con cada una de las drogas por separado.32
Diversos estudios han mostrado que la HCQ en monoterapia, posee efectos limitados para evitar la progresión de la erosión articular.8 Sin embargo, podría ser que los diseños de estos ensayos clínicos tengan limitaciones, dado que, en diversas ocasiones, la evidencia de la destrucción sinovial es determinada en fases avanzadas de la enfermedad y no es buscada temprano. Esto pudiera conllevar a una incorrecta interpretación, concluyendo de forma errónea, que la HCQ no evita que ocurra la destrucción articular. Eventualmente, podrían diseñarse estudios que valoren el daño articular más temprano, mediante resonancia magnética, biomarcadores de daño articular, citoquinas, etc., con el fin de aclarar si la HCQ en monoterapia tiene algún efecto beneficioso al disminuir la evolución de la erosión y destrucción del tejido sinovial de manera temprana.8
Se ha descrito su uso en monoterapia para casos leves, así como en combinación con otros DMARD, como metotrexate, leflunomida y sulfasalazina. Clásicamente, es uno de los componentes del esquema terapéutico llamado O´Dell, junto al metotrexate y a la sulfasalazina. Un estudio clínico de 2006 documentó que esta triple terapia, en comparación con terapias biológicas como el etanercept, es adecuada, con grandes beneficios en términos de costo -efectividad y calidad de vida.33
Efectos en vasculitis sistémicas
Los efectos inmunomoduladores específicos por los que el la HCQ podría ser beneficiosa en las vasculitis sistémicas, se desconoce hasta la fecha. En las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilos (ANCA), se han descrito dos mecanismos inmunomoduladores principales. Se ha demostrado que el fármaco es capaz de inducir apoptosis en linfocitos T de memoria CD4+CD45RO+,34 así como se ha evidenciado disminución en los niveles de factor activador de las células B (BAFF).36 Estos efectos sobre la inmunidad adaptativa son en particular sobresalientes, puesto que se ha demostrado aumentos en los niveles de BAFF y en el conteo celular de linfocitos T de memoria en las vasculitis asociadas a ANCA.35-36
No existen estudios sistemáticos del uso de HCQ en vasculitis asociadas a ANCA. En un estudio retrospectivo se reportó 8 pacientes con vasculitis ANCA tratados con HCQ (6 pacientes ANCA-c positivos y 2 pacientes ANCA-p positivos).
De tal reporte de casos, 4 pacientes lograron disminución en el dolor articular, 2 disminuyeron los flares de la enfermedad y en 2 casos se consiguió la disminución de la dosis de prednisolona.37
La HCQ también se incluye en las recomendaciones terapéuticas de la vasculitis urticarial normo- o hipocomplementémica, ya sea en conjunto solo con antihistmínicos, o bien con otros tratamientos inmunosupresores; sin embargo, los esteroides siguen siendo requeridos.38 Reporte de casos en las últimas tres décadas, han documentado que la HCQ ha sido efectiva hasta en un 50 % de los pacientes con vasculitis urticarial, e incluso en presencia de vasculitis retiniana asociada.38
En arteritis de células gigantes, un doble ciego, aleatorizado y controlado de 64 pacientes, no reportó diferencia en recaídas entre pacientes tratados con HCQ 400 mg/d más esteroides, por 96 semanas, en comparación con aquellos casos que recibieron solo esteroides.37
Efectos en enfermedades dermatológicas
Una reciente revisión retrospectiva informó la eficacia de la HCQ en el tratamiento de la morfea, en 84 pacientes. Todos recibieron el fármaco como monoterapia durante al menos 6 meses. El estudio encontró que el 43 % tuvo una respuesta completa y otro 38 % tuvo, una parcial, superior al 50 %. 39
En el caso de la dermatomiositis, un estudio de 41 pacientes con dermatomiositis amiopática, solo 6 (14,6 %) fueron tratados de manera satisfactoria con HCQ en monoterapia; el resto de pacientes necesitó la adición de otro inmunosupresor: metotrexate, micofenolato mofetilo, azatioprina o gammaglobulina intravenosa.
En otro estudio reciente de 115 pacientes con dermatomiositis, de igual manera con forma amiopática, los antipalúdicos fueron los fármacos más usados; sin embargo, el control adecuado de la enfermedad ocurrió en solo el 11,4 % de los casos. El 30,7 % de los pacientes tratados con hidroxicloroquina, desarrolló una reacción de hipersensibilidad cutánea.40
Por otra parte, en el caso de la alopecia, un reporte en 2013 describió dos pacientes de alopecia totalis con excelente respuesta a la HCQ. Pero, una serie de casos posterior, de ocho pacientes con alopecia totalis y extensa alopecia areata, sugirió que la HCQ fue ineficaz.41 Eventualmente, podría haber subgrupos de pacientes con alopecia areata que puedan beneficiarse de la HCQ, pese a lo cual se necesitan ensayos clínicos controlados para determinar su efectividad.
En cuanto a la psoriasis, la HCQ no ha mostrado beneficio, por el contrario, se han descrito casos de psoriasis inversa inducida por el fármaco.42
Efectos en nefropatía por IgA
Las células dendríticas, TLR, interleucina-6, interferón alfa y TNF, poseen un rol de peso en la fisiopatología de esta glomerulonefritis, ya que las citoquinas generan un estímulo continuo de las células mesangiales, estimulando la acumulación de matriz extracelular y conduciendo a la glomeruloesclerosis y, consecuentemente, persistencia de proteinuria. La producción de estas citoquinas es favorecida por mecanismos efectores de anticuerpos de tipo IgA o IgG, contra la región bisagra de la IgA1.43
La evidencia del uso de la HCQ en la nefropatía por IgA, surge a partir de la observación de estudios clínicos que han mostrado el beneficio de la HCQ sobre la disminución del daño renal secundario a la nefritis lúpica. Kasitanon y cols., indicaron que cuando la HCQ es administrada a pacientes con nefritis lúpica membranosa, en conjunto con micofenolato mofetilo, es más probable que ocurra la remisión.44 Este estudio clínico favoreció el despertar de la hipótesis de que el fármaco también podría ser beneficioso en la disminución de la proteinuria persistente en pacientes con nefropatía por IgA, a pesar del bloqueo del eje renina-agiotensina-aldosterona.45
Un estudio de casos y controles incluyó 28 pacientes con nefropatía por IgA con proteinuria persistente (0.5-2.0 g/24 h), a pesar del uso de losartán. Demostró la reducción de la proteinuria en un 50 % respecto a la proteinuria inicial, en un 42,9 % de los casos que tomaron HCQ en conjunto con losartán, versus un 14,3 % de los casos que no tomaron HCQ. No se evidenció efectos beneficiosos sobre las cifras de tensión arterial, ni cambios en el aclaramiento de creatinina.45 Estos hallazgos son alentadores en el contexto de que per se, la nefropatía por IgA es una condición difícil de tratar y existen pocos estudios controlados aleatorizados, que documenten el beneficio de usar drogas inmunosupresoras en esta condición patológica.46 Por su parte, los esteroides, pese a mostrar evidencia de un efecto beneficioso en el control de esta enfermedad, aumentan por sí mismos el riesgo de eventos adversos, limitando su uso por largos periodos.
Efectos en síndrome de Sjögren
Hay controversia sobre el empleo de HCQ en esta patología. Algunos estudios han sugerido que el fármaco disminuye la inflamación a nivel glandular, y consecuentemente mejora los síntomas secos característicos. El mecanismo por el cual se ha evidenciado este efecto no es del todo conocido, sin embargo, se ha sugerido que la HCQ inhibe la actividad de la colinesterasa a nivel de las glándulas salivales y lacrimales.47
Un estudio que incluyó 32 pacientes femeninas tratadas con HCQ durante dos años, a dosis de 6,5 mg/kg/día, valoró el efecto de suspender de súbito el tratamiento durante 12 semanas. Se concluyó que aquellas pacientes que suspendieron el tratamiento empeoraban en parámetros subjetivos de xerooftalmia; no obstante, no se documentaron diferencias en el test de Schirmer.48
Por otra parte, a pesar del uso extendido de la HCQ en el síndrome de Sjögren, no ha mostrado ser efectivo en el tratamiento de la forma primaria del síndrome. En 2014, un estudio clínico aleatorizado controlado, comparó la HCQ vs. placebo en 120 pacientes con la enfermedad, y no se encontró mejoras significativas en los síntomas de sequedad, dolor o fatiga, posterior a los 6 meses de tratamiento.49
En 2017, se publicó un metanálisis en el cual se incluyó 4 estudios con un total de 215 pacientes con síndrome de Sjögren. En la revisión sistemática no se encontró diferencia significativa en mejoría de síntomas secos, ni modificación en el test de Schirmer, ni mejoría de la fatiga entre el grupo que utilizó HCQ y el del placebo. Se documentó que el grupo con HCQ disminuyó la velocidad de eritrosedimentación.50
Generalidades de la toxicidad de la HCQ
El fármaco tiene una vida media larga y una distribución plasmática variable, debido al amplio volumen de distribución que posee. Aunado a esto, solo la mitad de los metabolitos del fármaco son modificados por el aclaramiento renal;51 por lo tanto, estas características confieren al fármaco un riesgo no despreciable de toxicidad.
El fármaco pasa a través de la placenta, pero no parece causar daño al feto y, probablemente, sea beneficioso tanto para la madre como para el feto, por un mejor resultado del embarazo. Ambas drogas se excretan en la leche materna. Se demostró en modelos murinos en condición de embarazo, que la droga se acumula en la retina fetal. Sin embargo, esta acumulación no es permanente y no hay informes de que exista daño de este tipo.52
Es conocido que el principal efecto adverso de la HCQ es la toxicidad en la retina. Pero, se conoce otros efectos adversos menos comunes que pueden presentarse: prurito, cefalea, mareos y síntomas gastrointestinales. Efectos secundarios menos frecuentes incluyen: despigmentación de la cavidad oral, uñas, piel, cabello y erupción cutánea. La miopatía por HCQ es poco frecuente y se manifiesta característicamente con debilidad muscular proximal. En estos casos, una biopsia muscular puede determinar los hallazgos patológicos.53
Toxicidad ocular
Se ha descrito que la HCQ puede generar una condición denominada queratopatía en vortex o córnea verticillata, la cual rara vez causa molestias en la visión del paciente. En algunos casos avanzados, los pacientes pueden notar halos y resplandores. Los depósitos del fármaco se producen dentro del subepitelio; el tejido no se pigmenta de forma permanente y los depósitos no son irritantes. Aparecen como opacidades bilaterales finas, de color marrón dorado o gris, en la córnea inferior, y se ramifican desde un espiral central.51
La HCQ causa daño en la retina mediante la inhibición de la autofagia, como resultado del aumento del pH lisosómico de las células del epitelio pigmentario de la retina. Esta interferencia con la autofagia también provoca un aumento en la concentración de lipofuscina en células del epitelio pigmentario, que a su vez se relaciona con la degradación de los fotorreceptores. La HCQ también inhibe la actividad del polipéptido transportador de aniones orgánicos (OATP1A2), interrumpiendo el ciclo del todo transretinol en células del epitelio pigmentario, un paso importante en el ciclo visual.54
Siempre que se sospeche de retinopatía por HCQ, el médico prescriptor debe indagar el tiempo que tiene el paciente de tomar el fármaco, así como la dosis en miligramos por kilogramo de peso, que consume, dado que desde 2016, las recomendaciones respecto a la dosis, plantean que debe ser prescrita de acuerdo con el peso real del paciente y no según el peso ideal.55 También debe tomarse en cuenta la etnia, pues los pacientes asiáticos tienen más riesgo de desarrollar retinopatía.
Con respecto al tamizaje de retinopatía en quienes se encuentran en tratamiento con HCQ, la Asociación Americana de Oftalmología y el Royal College of Ophthalmologists, han establecido en sus guías más recientes (2016 y 2018), que el tamizaje oftalmológico basal por retinopatía debe ser al año de iniciar el uso de hidroxicloroquina, y anualmente después de los primeros 5 años de tratamiento, para los pacientes de riesgo. Los factores de riesgo para desarrollar toxicidad de retina con el uso del fármaco son los casos con: una dosis mayor de 5 mg/kg de peso real, uso del fármaco por más de 5 años, dosis acumulada del fármaco entre 600-1000 gramos, enfermedad renal crónica estadio 3-5, y uso concomitante con tamoxifeno por más de 6 meses (Cuadro 3).
Se aconseja una evaluación inicial con el fin de establecer un punto de referencia para comparar en el futuro, y así identificar pacientes con preexistencia de enfermedad de la retina, la cual podría confundir un daño preexistente con uno de novo.56
Estas pautas recomiendan que una vez que los signos definitivos de retinopatía son identificados, la suspensión del tratamiento debe ser considerada por el médico que prescribe. Es preciso destacar que, si los resultados de las pruebas de detección indican posibilidad, pero sin evidencia definitiva de retinopatía, el estudio oftalmológico debe repetirse o validarse usando un cribado adicional para confirmar el daño de la retina y así evitar la interrupción innecesaria de este medicamento.56-57
Cuadro 2 Factores de riesgo para el desarrollo de retinopatía por hidroxicloroquina
| Dosis diaria >5,0 mg/kg/peso real* |
| Dosis diaria >6,5 mg/kg/peso ideal |
| Uso prolongado del tratamiento. El riesgo es mínimo <5 años. |
| Dosis acumulada de exposición entre 600-1000 gramos |
| Enfermedad renal crónica estadio 3-5 |
| Uso concomitante de tamoxifeno por >6 meses |
| *A partir de 2016, la Asociación Americana de Oftalmología recomienda el cálculo de la dosis con el peso real y no el peso ideal. Cuadro modificado.55 |
En tales situaciones, estas pruebas de tamizaje pueden repetirse después de 6 a 12 meses. La continuación del tratamiento con HCQ es aconsejable, ya que si la retinopatía realmente estuviera presente, progresaría de forma lenta.54
La tomografía de coherencia óptica (OCT, por sus siglas en inglés) en conjunto con la campimetría, son los estudios de cribado de primera línea recomendados por la Asociación Americana de Oftalmología, para la detección de retinopatía por HCQ. Estos poseen mayor sensibilidad que el fondo de ojo para detectar lesión de la retina.55
Hidroxicloroquina e insuficiencia respiratoria aguda grave por SARS-Cov2
Aunque no estaba dentro del objetivo inicial de esta revisión, dado que el mundo atraviesa una de las más severas pandemias de las últimas décadas debido a un nuevo coronavirus, denominado SARS-CoV-2, el cual se encuentra cobrando la vida de miles de personas, y la HCQ ha sido una de las opciones terapéuticas planteadas, se revisará brevemente los mecanismos que se propone que están involucrados.
La HCQ ejerce dos funciones importantes en los pacientes con infección por SARS-CoV-2. La primera de ellas es la acción de un estado antivírico, mediante la interacción con organelas intracelulares como endosomas y lisosomas. Debido a la composición alcalina de la droga; se disminuye la acidificación de las organelas, interactuando así con la fusión de membranas. También genera alteraciones conformacionales en las proteínas de superficie del coronavirus (proteínas spike), así como podría inhibir la entrada del virus mediante cambios en la glicosilación del receptor 2 de la enzima convertidora de angiotensina (ACE2).58 La segunda función significativa de esta molécula en la infección respiratoria grave por SARS-CoV-2, es la inmunorregulación por inhibición de la señalización de los TLR endosómicos y, en consecuencia, disminución en la producción de interferón de tipos I, IL-1, IL- 6; quimiocinas; moléculas de adhesión endotelial y moléculas coestimuladoras.59
Conclusiones
La HCQ es un antiguo fármaco caracterizado por distintos efectos beneficiosos en enfermedades inmunológicas. El perfil de seguridad del fármaco es bueno, y tiene la ventaja de poder asociarse concomitantemente a otros fármacos inmunomoduladores, sin conllevar a estados severos de inmunosupresión. Su mecanismo de acción tiene la versatilidad de actuar modulando distintas vías del sistema inmune innato, así como del sistema adaptativo humoral y celular; de esta manera, el fármaco logra disminuir procesos persistentes de autoinflamación y autoinmunidad.
La toxicidad del fármaco consiste, sobre todo, en daño a la retina; es por ello que se deben realizar de manera rigurosa los cribados por enfermedad ocular, antes del inicio del tratamiento, así como mantener controles oftálmicos regulares anuales, en aquellos pacientes con factores de riesgo para desarrollar retinopatía.
La HCQ representa una opción terapéutica de la cual los clínicos pueden hacer uso como apoyo al tratamiento principal de las distintas enfermedades inmunológicas. Se requieren más estudios aleatorizados y controlados, con el propósito de dilucidar si la respuesta clínica favorable que presentan los pacientes al fármaco, se relacionan con cada una de las distintas enfermedades inmunológicas de manera específica.














