Los tumores del sistema hematopoyético y reticuloendotelial encabezan la lista de enfermedades malignas en la población pediátrica. En Costa Rica la incidencia en esta población es de un 41%, siendo el grupo de tumores más frecuentes entre los 0 y 14 años de edad.1 Dentro de este grupo de tumores se encuentra la leucemia, la cual se define como la proliferación anormal de un grupo celular hematopoyético. Para su diagnóstico se requiere de la presencia de más del 20% de blastos en un aspirado de médula ósea.
Históricamente, las leucemias se abordaban de forma sintomática y paliativa; ya a finales del siglo pasado se introdujo el manejo poliquimioterapéutico, con una sobrevida libre de enfermedad del 80% al 85% en países desarrollados.2 En el caso de Costa Rica, fue en 1967 cuando se decidió protocolizar el tratamiento de la LLA.3 Hasta la fecha se han utilizado varios protocolos de quimioterapia, en procura de mejorar la sobrevida a esta enfermedad.
A nivel mundial la incidencia de cáncer infantil se encuentra en aumento y aún más en países de bajos y medianos ingresos. Datos del Banco Mundial reportan que países de bajos y medianos ingresos tienen una incidencia de cáncer infantil de 267 casos por millón de personas, para 2012.4 En el caso de Costa Rica, el registro nacional de tumores reporta una incidencia de tumores del sistema hepatopoyético y reticulonedotelial, de 54 casos para 2014, siendo la leucemia infantil el cáncer pediátrico más frecuente.1 Las estadísticas y los estudios aportan información suficiente para fundamentar la necesidad de capacitar y dar a conocer la realidad oncológica y los tratamientos actuales, así como el manejo médico adecuado.
Los protocolos de quimioterapia para la leucemia linfocítica aguda (LLA) incluyen el uso de la L-asparginasa (L-ASA), una enzima proteica que hidroliza aspargina en ácido aspártico y amonio. La aspargina es un aminoácido fundamental para la formación proteica a nivel celular; si bien es un aminoácido no esencial, las células leucémicas carecen de esta capacidad de síntesis. Por lo tanto, la deprivación de aspargina resulta en la incapacidad de realizar el proceso de síntesis proteica, lo que conlleva a apoptosis de las células linfoblásticas.5,6 El uso de la L-ASA es esencial para que se logre una mejor sobrevida libre de enfermedad en los pacientes leucémicos. Sin embargo, su empleo conlleva varios efectos secundarios como: reacciones alérgicas e incluso anafilaxia, hiperglicemia, y pancreatitis. Todos deben tratarse a tiempo para disminuir la mortalidad asociada al fármaco. En el paciente leucémico y más el pediátrico, el diagnóstico de pancreatitis no es frecuente y, por el contrario, el dolor abdominal se asocia con más frecuencia a epigastralgia, diarrea o tiflitis.7 A continuación se presenta un paciente pediátrico con diagnóstico de LLA y dolor abdominal causado por pancreatitis asociada a L-ASA.
Presentación del caso
Paciente masculino, diagnosticado con LLA a la edad de 3 años; se estratificó como alto riesgo por la presencia de translocación (9:22) también conocida como cromosoma Filadelfia, y se inició tratamiento quimioterapéutico con protocolo AHOPCA 2008.
Inicialmente, en la fase de inducción del protocolo de tratamiento, recibió prednisona, vincristina, daunomicina y L-ASA, y presentó buena respuesta y sin efectos adversos. Se completó la inducción en el día 29 e inició la siguiente fase de consolidación. Al día 50 del protocolo, el paciente asistió a la consulta externa de hematología por dolor abdominal significativo de varias horas de evolución, localizado en zona de epigastrio, sin historia de vómitos ni fiebre. Al examen físico el paciente se encontró consciente, eupneico, afebril, con un abdomen blando depresible, no doloroso a la palpación, sin datos de irritación peritoneal, resto del examen físico sin hallazgos de importancia.
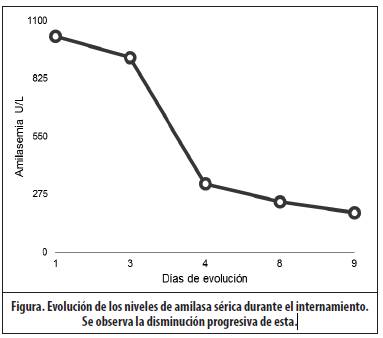
Por lo anterior, se decidió no colocar la quimioterapia indicada e inmediatamente se trasladó al Servicio de Emergencias, donde se le realizó laboratorios que documentaron anemia en 8,1mg/dL normocítica normocrómica, con leucocitos en 6,590/uL, neutrófilos absolutos en 5417/uL y plaquetas en 288,000/uL, amilasemia en 1027U/L, hipocalcemia en 2,1mg/dL, hipokalemia 2,2mEq/L y deshidrogenasa láctica aumentada en 518IU/L. Proteína C reactiva, transaminasas, y pruebas de función renal, dentro de parámetros normales.
Se practicó una gastroscopía, la cual se encontró dentro de límites normales, por lo que posteriormente se realizó ultrasonido de abdomen, en el cual se evidenció páncreas con morfología normal, aumentado de tamaño con edema e inflamación de grasa a nivel peripancreática y en los espacios pararrenales anteriores, así como la presencia de dos colecciones no grumosas; sin necrosis, masas, pseudoquistes o dilatación del conducto pancreático principal. Así, se obtuvo el diagnóstico de pancreatitis edematosa no biliar. El paciente se hospitalizó en el Servicio de Hematología, recibió manejo de líquidos con reposición de potasio, antiácidos y analgesia con morfina, y la indicación de nada vía oral para dar soporte nutricional, posteriormente con nutrición parenteral.
Se realizó ultrasonido control que reportó páncreas con leve pérdida de su ecogenicidad, leve engrosamiento de su cola, sin dilatación del conducto pancreático, sin evidencia de masas solidas o quísticas, sin presencia de líquidos o colecciones peripancreáticas. Además, líquido libre en moderada cantidad en el espacio hepatorenal y correderas parietocólicas.
A los 9 días de iniciado el cuadro, se evidenció ultrasonido de abdomen ya sin datos de pancreatitis, sin edema ni líquido peripancreático o libre. Por lo anterior y la buena evolución tanto clínica como de laboratorios, se suspendió la nutrición parenteral y se decidió reiniciar esquema quimioterapéutico.
El paciente ha continuado el protocolo de quimioterapia AHOPCA 2008 y se encuentra en fase de mantenimiento, sin secuelas secundarias a la pancreatitis. (Figura)
Discusión
La pancreatitis aguda se diagnostica obteniendo dos de tres de los siguientes criterios: dolor abdominal sugestivo de pancreatitis, amilasa o lipasa sérica tres o más veces su valor normal e imágenes sugestivas de pancreatitis.8,9
La L-ASA es la piedra angular de muchos tratamientos quimioterapéuticos, tanto en LLA pediátrica como en el linfoma no Hodgkin. Es así que actualmente forma parte de los protocolos de quimioterapia utilizados a nivel mundial en el tratamiento de LLA.2,8 Lo anterior, gracias a estudios multicéntricos como el del Dana-Faber Cancer Institute (DFCI) ALL Consortium, el cual comprobó que utilizar L-ASA por tiempos prolongados (más de 25 semanas) y en esquemas intensificados, aumentaba la tasa de sobrevida a cinco años libre de enfermedad.10 Un estudio randomizado realizado por la Asociación Italiana de Hematología y Oncología Pedriátrica, demostró que la L-ASA confiere un aumento significativo en pacientes libres de enfermedad a 10 años y de sobrevida general con una disminución del 40% de riesgo relativo de falla de tratamiento, comparado con pacientes que no recibieron L-ASA.11
A todo paciente con leucemia que se encuentra en un régimen terapéutico que incluya L-ASA, se le deben realizar historias clínicas y exámenes físicos así como de laboratorio seriados, para diagnosticar oportunamente cualquier complicación de la enfermedad o efecto adverso del tratamiento. Todo dolor abdominal en estos pacientes debe alertar acerca de una posible pancreatitis aguda y así obtener los valores de amilasa (o lipasa) sérica de forma oportuna. Cabe destacar que el valor de amilasa sérica no refleja el grado de severidad; sin embargo, es un parámetro esencial para obtener un diagnóstico preciso, un manejo adecuado y un seguimiento oportuno.12
Se ha intentado identificar factores de riesgo que alerten al personal de salud en cuanto a probables casos de pancreatitis secundaria a quimioterapia con L-ASA, con el fin de obtener un diagnóstico temprano y manejo oportuno. Anteriormente se creía que el único factor de riesgo predecible era que el paciente estuviera en un régimen de quimioterapia de alto riesgo, otorgando a los pacientes un riesgo cuatro veces mayor en comparación con los que se encuentran en régimen de bajo riesgo.8 Sin embargo, un estudio reciente del Hospital Sainte-Justine en Montreal, Canadá, demostró que tener algún polimorfismo genético de un solo nucleótido en MYBBP1A, IL- 16 o SPEF2, o ser homocigoto par la repetición de trinucleótidos de ASNS (el gen que codifica para aspargina sintetasa), otorga un riesgo estadísticamente significativo de desarrollar pancreatitis.2,9 Si bien estas pruebas genéticas son estudios más bien nuevos que permiten predecir (con cierta limitación) la enfermedad, todavía no se realizan en nuestro país, a diferencia de Canadá y los Estados Unidos. Estos polimorfismos genéticos también se han estudiado en pacientes con complicaciones frecuentes como la dermatitis y la trombosis.2,9
Los pacientes que presentan pancreatitis aguda secundaria al tratamiento con L-ASA, tienen una tasa de mortalidad significativamente superior a quienes no presentan esta complicación, así como una sobrevida dos años menor.8 Entre las complicaciones se encuentra la necesidad de ventilación mecánica asistida, necrosis pancreática, shock, cetoacidosis, pseudoquistes pancreáticos y la muerte. Si bien la pancreatitis aguda no es prevenible, sus complicaciones lo son. El único riesgo asociado a una mayor comorbilidad es la edad del paciente (a mayor edad, más riesgo de complicación).6,8,13
En este caso clínico, la evolución del paciente se presentó sin complicaciones, en parte gracias al rápido y acertado diagnóstico, y al manejo adecuado que se brindó.
El paciente se encontraba en un régimen de quimioterapia de alto riesgo, debido al cromosoma Filadelfia al diagnóstico, lo cual le confiere un mayor riesgo de una pancreatitis como complicación, aunque solo el 7% de los pacientes con LLA que utilizan L-ASA, presentan un cuadro de pancreatitis aguda.10
Es primordial el manejo interdisciplinario en pacientes oncológicos, ya que la enfermedad de fondo confiere una dificultad aún mayor en el diagnóstico y abordaje de la PA. En el caso clínico propuesto, el paciente recibió atención por parte de los servicios de hematología, gastroenterología, radiología, emergencias, soporte nutricional, entre otros, y el diagnóstico se efectuó en forma temprana, lo que evitó complicaciones o mortalidad.
Los estudios intentan apoyar una nueva tendencia por utilizar octreótido profilácticamente, en pacientes que requieren reiniciar L-ASA posterior a una pancreatitis aguda secundaria a L-ASA. Si bien el octreótido ha sido parte del tratamiento de la pancreatitis aguda desde el siglo pasado y con resultados positivos, aún se requiere más observaciones y estudios para determinar si disminuye el riesgo. Los datos apoyan el uso de octreótido en pacientes que requieran continuar con L-ASA, ya que podrían beneficiarse.14,15 En el caso presentado no se utilizó octreótido en el paciente, y recibió L-ASA posteriormente como parte del protocolo, sin llegar a manifestar complicaciones.
La pancreatitis es una complicación que justifica suspender la quimioterapia en pacientes con leucemia, lo que confiere un riesgo de recaída apreciable. Por lo tanto, estudios demuestran que reiniciar terapia con L-ASA posterior a un cuadro de pancreatitis, debe ser una decisión basada en la necesidad del tratamiento para combatir la leucemia, y no en el cuadro de pancreatitis previo. Esto obedece a que no se ha visto una relación estadísticamente significativa entre el riesgo de una segunda pancreatitis y la severidad de la primera, así como el hecho de que una segunda pancreatitis no tiene mayor riesgo de complicación que una primera.13
En el caso clínico, la buena evolución del paciente y el hecho de no haber presentado complicaciones a pesar de reiniciar el protocolo de quimioterapia, el cual incluyó L-ASA, se debe en buena parte a un rápido diagnóstico e intervención oportuna y multidisciplinaria. Complicaciones propias de una PA como pancreatitis crónica, necrosis pancreática y pseudoquístes, se ven de la mano de un diagnóstico tardío, lo que empeora el pronóstico de estos pacientes oncológicos, debido a que dificulta el reinicio del protocolo de quimioterapia.8,13
Por lo tanto, conviene sospechar la presencia de pancreatitis aguda cuando hay un paciente con LLA y dolor abdominal, y así realizar los estudios indicados. El diagnóstico temprano y de forma adecuada, así como el manejo correcto y la retirada rápida del fármaco, son fundamentales en la disminución de morbimortalidad de estos pacientes.
Trabajo realizado en Departamento de Hemato-oncología. Hospital Nacional de Niños “Dr. Carlos Sáenz Herrera”
Conflictos de interés: los autores no tienen potenciales conflictos de interés en relación con este trabajo.
Fuentes de apoyo: No aplica.
Abreviaturas: LLA, leucemia linfocítica aguda; AHOPCA, Asociación de Hemato-oncólogos para Centroamérica; L-ASA, L-asparginasa.